2. 西安北方惠安化学有限公司, 陕西 西安 710302
2. Xi′an North Huian Chemical Industries Co. Ltd., Xi′an 710302, China
呋咱环是构建高能量密度化合物重要的结构单元,在分子中引入呋咱环可以显著提高化合物的密度,改善氧平衡[1-2]。二呋咱基醚由于其固有的稳定性和柔韧性受到人们的广泛关注,俄罗斯科学院捷林斯基有机化学所的Sheremetev等[3]在这方面做出了卓越的贡献,利用硝基间的醚化反应成功合成了二呋咱基醚类化学物。3, 3′-二硝基呋咱基醚(FOF-1)[4-5]、3, 3′-二氰基呋咱基醚(FOF-2)[6-7]和3, 3′-二(1-氟代-1, 1-硝基甲基)二呋咱基醚(FOF-13)[8]由于性能优异,特别是熔点较低,有望在熔铸炸药、含能增塑剂等领域得到应用。
四唑类衍生物由于其氮含量高、热稳定性好、生成焓高成为富氮化合物的典型代表[9-11]。本研究设计并合成了未见文献报道的含能化合物3, 3′-二(四唑-5-基)二呋咱基醚,探讨了锌盐催化下四唑成环反应机理与目标化合物的质谱裂解途径,考察了影响环化反应结果的影响因素,确定了较佳的反应条件。
2 实验部分3, 3′-二(四唑-5-基)二呋咱基醚的合成路线如Scheme 1所示。

|
Scheme 1 |
NEXUS870型傅里叶变换红外光谱仪,瑞士BRUKER公司AV500型(500 MHz)超导核磁共振仪,GCMS-QP2010质谱仪,PE-2400型元素分析仪,LC-2010A ht液相色谱仪。
3-氨基-4-氰基呋咱(CNAF)自制,双氧水(50%)、浓硫酸工业品,二水合钨酸钠、碳酸钠、乙腈、叠氮钠、二水合溴化锌、二水合氯化锌、七水合硫酸锌等均为分析纯。
2.2 实验过程 2.2.1 3-氰基-4-硝基呋咱(CNNF)合成冰盐浴降温至-15 ℃,将600.0 g(8.8 mol)H2O2(50%)加入反应瓶中,搅拌下加入66.0 g(0.22 mol) Na2WO4·2H2O,后缓慢滴加浓硫酸880.0 g(8.8 mol),滴加时温度控制在5 ℃以下,约50 min加完。滴加完毕后升温至12 ℃,开始分批加入22.0 g(0.2 mol)CNAF,加毕保持15 ℃反应2 h后停止反应。CH2Cl2萃取(300 mL×4),合并萃取液,经碱洗、水洗后,无水MgSO4干燥,浓缩得淡黄色液体18.1 g,收率64.6%,纯度99.2%。
13C NMR(DMSO-d6), δ: 161.17(C—NO2), 130.76(C—CN), 105.78(C≡N);IR(KBr, cm-1), υ: 1542, 1350(NO2), 2268(C≡N), 1580, 1460, 1033(呋咱环); 元素分析(%): C3H2N4O, 理论值(实测值): C 25.71(25.63), N 40.00(39.59), H 0.00(0.02)。
2.2.2 3, 3′-二氰基二呋咱基醚(FOF-2)合成将14.0 g (0.1 mol)CNNF,8.5 g(0.08 mol)无水碳酸钠和980 mL无水乙腈加入反应瓶中,缓慢升温至78 ℃,有黄色硝烟生成,反应6 h后中止反应。待降至室温后过滤浓缩得10.5 g淡黄色固体,加入20 mL乙醇完全溶解后倒入140 mL水中析出产品,过滤干燥后得白色固体8.6 g,收率84.3%,纯度99.5%。
13C NMR(DMSO-d6), δ: 160.69(C—O), 128.54(C—CN), 106.11(C≡N);IR(KBr, cm-1), υ: 2270(C≡N), 1560(C=N), 1250(C—O—C), 1030(呋咱环);元素分析(%): C3H2N4O, 理论值(实测值): C 41.18(41.18), N 35.29(35.36), H 0.00(0.00)。
2.2.3 3, 3′-二(四唑-5-基)二呋咱基醚的合成将0.55 g(2.7 mmol)FOF-2,25 mL去离子水,0.50 g(7.7 mmol)NaN3,0.46 g ZnCl2·2H2O(2.7 mmol)分别加入反应瓶中,升温回流反应4 h后中止反应。降至室温后用10%的稀盐酸酸化至pH等于1,乙酸乙酯萃取(15 mL×4),合并萃取液,经无水MgSO4干燥,浓缩得淡黄色固体0.69 g,粗品收率88.5%,纯度88.0%(表 1和表 2中的收率及纯度为粗品收率及纯度),经水重结晶得白色固体0.41 g,纯度98.3%。
| 表 1 不同的锌盐对环化反应收率的影响 Tab.1 Effect of different zinc salts on yield of cyclizing reaction |
| 表 2 催化剂的用量对环化反应收率的影响 Tab.2 Effect of the ratio of zinc chloride dihydrate to FOF-2 on yield of cyclizing reaction |
13C NMR(DMSO-d6), δ: 160.96,148.02,139.22;IR(KBr, cm-1), υ: 3451(N—H),1592(C=N),1234(C—O—C),1048(呋咱环);元素分析(%): C6H2N4O3,理论值(实测值): C 24.84(25.19), N 57.93(57.43), H 0.69(0.97);MS(EI) m/z(%): 247 (0.55), 232 (1.93), 204 (8.49), 137 (11.07), 69 (18.07), 30(100.00)。
3 结果与讨论 3.1 反应条件优化 3.1.1 催化剂的选择料比n(NaN3):n(FOF-2)=3:1,n(Zn2+):n(FOF-2)= 1:1,考察了催化剂种类对反应收率的影响。结果见表 1,其中,收率与纯度为粗品收率与纯度。三种锌盐均对反应有着良好的催化效果,以ZnSO4·7H2O和ZnCl2·2H2O做催化剂反应收率稍高于ZnBr2·2H2O,由于价格低廉,选择ZnCl2·2H2O催化此反应。
3.1.2 反应时间的影响料比n(NaN3):n(FOF-2)=3:1,ZnCl2·2H2O催化,n(Zn2+):n(FOF-2)=1:1,水为溶剂回流反应,采用薄层色谱跟踪反应,发现反应4 h,原料基本反应完毕。由于原料与产物极性相差太大,先利用弱极性展开体系(V(石油醚):V(乙酸乙酯)=10:1)观察原料反应情况,后利用强极性展开体系(V(二氯甲烷):V(甲醇):V(氨水)=4:1:0.05)观察产物生成情况,氨水的加入有效弱化了产物与硅羟基的键合作用,从而抑制了产物点的拖尾。
3.1.3 催化剂用量的影响反应时间为4 h,料比n(NaN3):n(FOF-2)=3:1,催化剂为ZnCl2·2H2O,考察了催化剂用量对反应收率的影响。结果见表 2,其中,纯度与收率均为粗品的纯度与收率。ZnCl2·2H2O的加入,对反应有着明显的催化效果,随着ZnCl2·2H2O量的增加,收率也随之增加,n(ZnCl2·2H2O):n(FOF-2)=1.0时,收率最大。再增加ZnCl2·2H2O,收率反而有所下降。此外,无ZnCl2·2H2O的加入也可以得到产物,这是因为呋咱环具有较强的吸电子效应,活化了氰基,但收率偏低,仅为44.8%。
3.2 Zn2+催化下四唑成环反应机理锌盐催化的四唑环合成过程可以分为如下几个阶段(Scheme 2)。(1) Zn2+作为配位中心与氰基形成配合物A,从而使氰基活化[10, 13],使其更有利于叠氮基的进攻;(2)叠氮基进攻经活化了的氰基,形成过渡态叠氮酰亚胺B;(3)叠氮酰亚胺B关环形成四唑钠盐,同时生成Zn2+;(4)四唑钠盐经酸化后生成四唑类化合物。

|
Scheme 2 |
Himo F[10-12]等运用密度泛函理论方法深入研究了此反应机理,认为配合物A的形成是此催化反应的关键,降低了叠氮基进攻的能垒,经计算可使反应能垒降低20.9~ 25.1 kJ·mol-1。
3.3 3, 3′-二(四唑-5-基)二呋咱基醚的质谱裂解途径分析目标化合物的分子离子峰由于太弱而观测不到,特征碎片为m/z=247,204,137,110,69等,m/z=247和204的碎片推测为分子离子发生环开裂分别丢失一个和两个小分子HN3所得;m/z=247的离子碎片的σC—O发生异裂丢失[O—C2N2O—CN]的中性碎片得到m/z=110的离子碎片;分子离子的σC—O发生异裂丢失[O—C2N2O—CN]的中性碎片得到m/z=137分子离子,其进一步丢失中性碎片[C2N2O]得到m/z=69。可能的裂解途径见图 1所示。
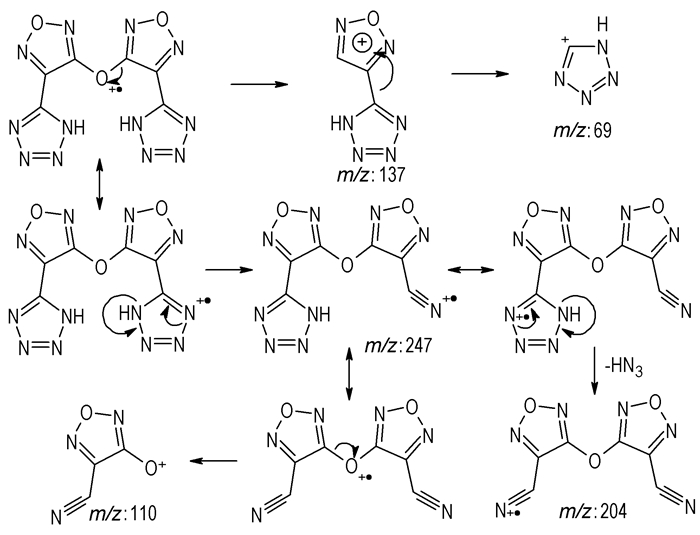
|
图 1 目标化合物可能的质谱裂解途径 Fig.1 Possible cleavage ways of target compound |
(1) 设计并合成了未见文献报道的含能化合物3, 3′-二(四唑-5-基)二呋咱基醚,总收率46.7%,并利用13C NMR、IR、MS、元素分析表征了结构。
(2) 确定了较佳的环化反应条件:ZnCl2·2H2O为催化剂,反应时间4 h,n(ZnCl2·2H2O):n(FOF-2)=1:1。
(3) 探讨了锌盐催化的四唑成环反应机理,Zn2+作为配位中心与氰基形成配合物是此催化反应的关键步骤,能有效降低反应能垒,促进反应进行。
| [1] |
范艳杰, 王伯周, 周彦水, 等. 3, 3'-二氰基-4, 4'-偶氮呋咱(DCAF)合成及晶体结构[J].
含能材料, 2009, 17(4): 385-388. FAN Yan-jie, WANG Bo-zhou, ZHOU Yan-shui, et al. Synthesis and crystal structure of 3, 3'-dicyano-4, 4'-azofurazan (DCAF)[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2009, 17(4): 385-388. |
| [2] |
李战雄, 唐松青, 欧育湘, 等. 呋咱含能衍生物合成研究进展[J].
含能材料, 2002, 10(2): 59-65. LI Zhan-xiong, TANG Song-qing, OU Yu-xiang, et al. Review on the synthesis of the furoxan derivatives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2002, 10(2): 59-65. |
| [3] |
Sheremetev A B, Kharitonova O V, Mel'nikova T M, et al. Synthesis of symmetrical difurazanyl ethers[J].
Mendeleev Commun, 1996, 6(4): 141-143. DOI:10.1070/MC1996v006n04ABEH000618 |
| [4] |
Sheremetev A B, Kharitonova O V, Aleksandrova N S, et al. Dinitro trifurazans with oxy, azo and azoxy bridges[J].
Propellants, Explosives, Pyrotechnics, 1998, 23: 142-149. DOI:10.1002/(ISSN)1521-4087 |
| [5] |
王锡杰, 廉鹏, 葛忠学, 等. 3, 3'-二硝基双呋咱醚(FOF-1)合成、晶体结构及理论研究[J].
化学学报, 2010, 68(6): 557-563. WANG Xi-jie, LIAN Peng, GE Zhong-xue, et al. Synthesis, crystal structure and theoretical research of 3, 3'-dinitrodifurazanyl ether (FOF-1)[J]. Acta Chim Sinica, 2010, 68(6): 557-563. |
| [6] |
Novikova T S, Melnikova T M, Kharitonova O V, et al. Novel synthesis of 3, 4-dicyanofuroxan[J].
Mendeleev Commun, 2001, 11(1): 30-31. DOI:10.1070/MC2001v011n01ABEH001369 |
| [7] |
范艳杰, 王伯周, 来蔚鹏, 等. 3, 3'-二氰基二呋咱基醚(FOF-2)的合成、表征及量子化学研究[J].
有机化学, 2009, 29(4): 614-620. FAN Yan-jie, WANG Bo-zhou, LAI Wei-peng, et al. Synthesis, characterization and quantum chemistry study on 3, 3'-dicyanodifurazanyl ether (FOF-2)[J]. Chinese Journal of Organic Chemistry, 2009, 29(4): 614-620. |
| [8] |
Sheremetev A B. 3, 3-Bis(1-fluoro-1, 1-dinitromethyl)difurazanyl ether[C]//Proc. 29th International ICT Conference, Karlsruhe, June 30-July 3, 1998: 58/1-6.
|
| [9] |
WANG Rui-hu, GUO Rong, ZENG Zhuo, et al. Furazan-functionalized tetrazolate-based salts: A new family of insensitive energetic materials[J].
Chem Eur J, 2009, 15: 2625-2634. DOI:10.1002/chem.v15:11 |
| [10] |
Himo F, Demko Z P, Noodleman Louis, et al. Why is tetrazole formation by addition of azide to organicnitriles catalyzed by zinc(Ⅱ) salts[J].
J Am Chem Soc, 2003, 125: 9983-9987. DOI:10.1021/ja030204q |
| [11] |
Himo F, Demko Z P, Noodleman Louis, et al. Mechanisms of tetrazole formation by addition of azide to nitriles[J].
J Am Chem Soc, 2002, 124: 12210-12216. DOI:10.1021/ja0206644 |
| [12] |
Demko Z P, Sharpless K B. Preparation of 5-substituted 1H-tetrazoles from nitriles in water[J].
J Org Chem, 2001, 66: 7945-7950. DOI:10.1021/jo010635w |
| [13] |
刘雄伟, 姜恒, 官红. 室温无溶剂条件下醋酸锌催化的Knoevenagel缩合反应[J].
有机化学, 2007, 27(1): 131-133. LIU Xiong-wei, JIANG Heng, GUAN Hong. Knoevenagel condensation catalyzed by Zinc acetate under solvent free condition at room temperature[J]. Chinese Journal of Organic Chemistry, 2007, 27(1): 131-133. |

3, 3′-Bis (tetrazol-5-yl)difurazanyl ether was synthesized by a three-step reaction, and the aim compound and all the intermediates were characterized by IR, 13C NMR, MS and elemental analysis.



