烟火剂具有独特的声、光、色等造型效果, 因而被广泛应用于渲染节日和庆典气氛。然而, 在生产、储存和运输中经常由于不当操作, 导致火灾爆炸事故接连发生。据不完全统计, 每年春节期间, 全国因燃放烟花爆竹引发的火灾事故数量约占同期火灾总数的40%以上[1]。2010年2月9日晚20时27分, 北京京广桥附近的央视新大楼北配楼也因从业人员违规燃放礼花发生火灾[2]。2010年2月26日晚, 广东普宁市军埠镇石桥头村某村民违规燃放烟花, 发生爆炸事故, 造成20人死亡、49人受伤[3]。
作为烟火剂的一种, 硝酸钡系白光剂同样具有热不稳定性, 目前国内研究物质热稳定性最常用的热分析方法有热重法(thermogravimetry, TG), 差热分析法(differential thermal analysis, DTA), DSC差示扫描量热法(differential scanning calorimetry, DSC)[4], 这几种方法的优点是所需样品量小、测试时间短。但热探测敏感性较低, 所测得的物质放热反应温度会因温升速率的不同而发生变化。绝热量热分析法是近年来逐步推广使用的能够提供较高质量数据的方法[4-14], 钱新明[6-7]、臧娜[8]、张凤[9]等人运用绝热量热仪(accelerating rate calorimeter, ARC)对烟火剂的安定性进行了系列研究。
ARC能够使测试样品由于自加热作用发生的放热反应, 并同时记录反应过程中的时间、温度和压力关系。可用于评估化工生产过程反应性物质的放热反应危险, 其应用主要涉及反应性物质的热稳定性研究、放热过程危险性的评估、放热反应过程的安全操作条件(温度、压力上限以及泄压措施等)的确定、自加速分解温度的确定、各种放热反应引起的火灾爆炸事故原因分析、研究反应性物质的宏观放热反应动力学参数等方面[4]。因此, 运用ARC评价反应性物质的热危险性具有一定优越性。
为了更好地评价硝酸钡系白光剂的危险性, 避免由此引发的火灾爆炸事故, 本工作采用ARC对硝酸钡系白光剂的干燥药粉和潮湿药粉的反应过程进行了研究。
2 实验部分 2.1 仪器与试剂ARC是由英国热危险技术公司(thermal hazard technology, THT)生产, 操作温度为0~500 ℃, 压力为0~20 MPa, 测试样品质量为0.01~10.00 g; 测试敏感度为0.02 ℃·min-1, 实验为加热-搜索-等待模式, 加热幅度为5 ℃, 搜索时间为15 min, 等待时间为25 min。样品室为钛合金材料, 不参与化学反应过程。
干燥的硝酸钡系白光剂直接从烟花厂取得, 将干燥样品喷入少量水蒸汽静置后制得潮湿样品。干燥样品中, 硝酸钡50%, 硫磺15%, 铝镁合金20%, 酚醛树脂5%, 三味粉10.12%。潮湿样品中, 硝酸钡40.02%, 硫磺12.04%, 铝镁合金15.94%, 酚醛树脂4.07%, 三味粉8.14%;水19.9%。样品球的比热容由THT公司提供, 测试样品的比热容由各组分的比热容按质量比例混合计算得出。干燥样品和潮湿样品的具体测试条件见表 1。
| 表 1 样品1和样品2的测试条件 Tab.1 Measuring conditions of sample 1 and sample 2 |
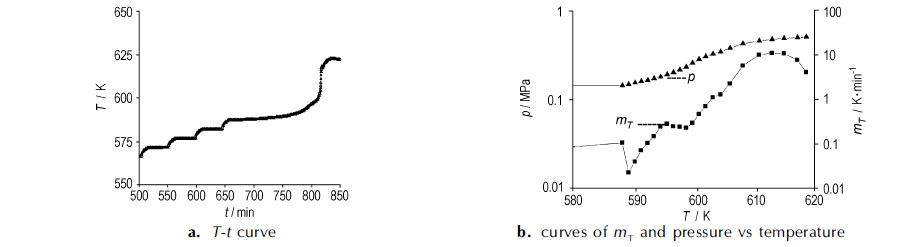
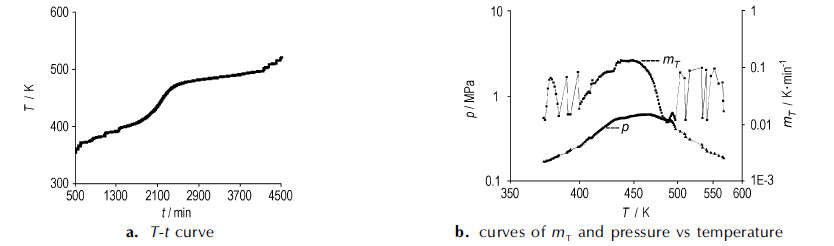
通过对两种不同样品进行ARC实验, 分别得出干燥和潮湿样品绝热放热反应曲线如图 1和图 2, 其中, 图 1b和图 2b的图形分别用温升速率、压力的对数值与温度倒数值绘制, 其坐标轴数据对应的是物理量的原始数据(实验获得的放热特征参数见表 2)。
|
图 1 干燥样品的绝热反应曲线 Fig.1 Adiabatic reaction curves of dry sample |
|
图 2 潮湿样品的绝热反应曲线 Fig.2 Adiabatic reaction curves of wet sample |
| 表 2 样品1和样品2的反应特性参数 Tab.2 Reaction characteristic data of sample 1 and sample 2 |
由图 1a和表 2可以看出, 干燥样品在设定温度550 K时样品没有发生放热反应, 经过数次加热-等待-搜索循环后(数个台阶)在温度587.5 K处, 观测到发生放热反应(温度上升, ARC不再进行加热-等待-搜索)。此后反应体系温度开始缓慢上升, 在实验进行767.96 min后体系温度开始加速上升。由图 1b可以看出, 温升速率对数与温度倒数之间呈线性增长关系, 但是在595~600 K之间有一定幅度的降低, 随后, 温升速率随温度继续上升。系统在发生放热反应151.43 min后, 于温度612.5 K处出现最大温升速率11.013 K·min-1, 在短时间内达到最高温度为618.43 K。同时在干燥烟火剂放热反应过程中, 系统反应最高压力达到0.512 MPa, 单位样品质量的最高压力为0.89 MPa。
由图 2和表 2可以看出, 潮湿样品在372.58 K温度处观测到放热, 此后, 温度随时间缓慢上升, 放热过程较慢, 时间较长。从开始放热到达到最高温升速率, 经历了1555 min, 最大温升速率温度为449.32 K。最终潮湿样品在507.3 K温度结束反应, 系统达到最高压力0.614 MPa, 单位样品质量的最高压力为1.02 MPa。
对比两次测试结果看出, 受潮以后的烟火剂更容易发生放热反应, 初始放热温度大大降低, 反应过程中受潮后的样品反应过程剧烈程度降低, 反应时间更长。
3 结果分析与讨论 3.1 测试数据的校正由于样品反应放出的热量除用来加热自身以外, 还有一部分热量用来加热盛装样品的样品室。所以测试结果是样品和样品室所组成的整个反应系统的温度变化。为了准确地分析样品发生爆炸的原因, 首先需要分析计算其反应动力学参数, 然后用热惰性因子φ[4]进行校正以确定发生火灾爆炸的最危险条件。
| $ \varphi = \frac{{M{{\bar C}_v} + {M_b}{{\bar C}_{v, b}}}}{{M{{\bar C}_v}}} $ | (1) |
式中, M和Mb分别为样品和样品室的质量, kg; Cv和Cv, b分别为样品室的比热容, kJ·kg-1·K-1。
本文计算反应动力学参数处理的方法为伪逆矩阵法[15]。该方法是将实验所得温升速率-温度曲线数据点(m>10, m为数据点数)代入微分机理函数, 建立超定方程组, 通过矩阵法求解最小二乘解得3个未知量E、A和n。通过计算机相关软件模拟, 求得干燥样品反应级数、活化能及指前因子:n=0.91, E=241.69 kJ·mol-1, A=1.96×1024 s-1; 潮湿样品的反应活化能及指前因子:n=0.76, E=217.56 kJ·mol-1, A=2.56×1022 s-1。
最后, 根据热惰性因子进行绝热温升、初始放热温度、最高放热温度以及最大温升速率时间的校正。对于样品放热反应而言, 其初始放热温度、任何时刻的温度及温升速率在绝热状态下可由以下公式进行修正[4], 修正结果如表 3所示。
| $ \Delta {T_{{\rm{ad}}}} = \varphi \Delta {T_{{\rm{ad, s}}}} $ | (2) |
| $ {T_0} = {\left[{\frac{1}{{{T_{0, {\rm{s}}}}}} + \frac{R}{E}{\rm{ln}}\varphi } \right]^{ -1}} $ | (3) |
| $ {T_{{\rm{Ax}}}} = {T_{{\rm{A0}}}} + \varphi ({T_{\rm{x}}}-{T_0}) $ | (4) |
| $ {T_{\rm{f}}} = \varphi \Delta {T_{{\rm{ad, s}}}} + {\left[{\frac{1}{{{T_{0{\rm{, s}}}}}} + \frac{R}{E}{\rm{ln}}\varphi } \right]^{ -1}} $ | (5) |
| $ {M_{\rm{T}}} = \varphi {m_{{{\rm{T}}_{\rm{S}}}}} $ | (6) |
| $ {\theta _{\rm{m}}} = \frac{{{T_0}^2}}{{{T_{{\rm{0, s}}}}^2}}{\theta _{{\rm{m, s}}}} $ | (7) |
| 表 3 热惰性因子修正的样品的绝热反应特性参数 Tab.3 Adiabatic reaction characteristic data of samples modified by thermal inertia factor |
式中, E为反应活化能, kJ·mol-1; R为气体常数, J·mol-1·K-1; T为温度, K; ΔTad为绝热温升, ℃; θm为最大温升速率时间, min。下标A表示绝热条件下的值, x表示某时刻的值, s表示包括样品和样品室的实验值, 0表示初始值, f为最大值。
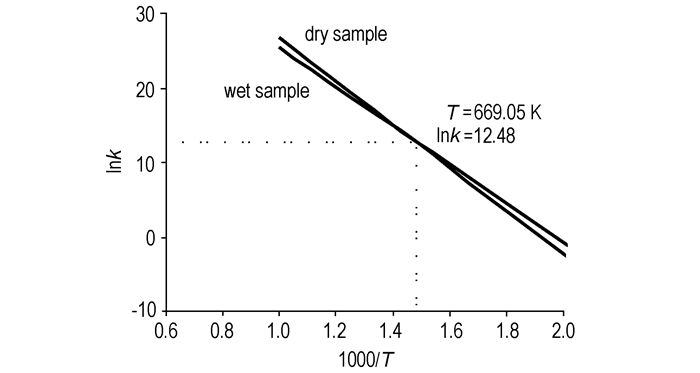
又根据阿累尼乌斯方程的计算结果, 绘制两种样品的反应速率常数对数lnk与温度倒数1000/T的线性关系如图 3所示。
|
图 3 lnk与1000/T的线性关系 Fig.3 lnk vs 1000/T relationship of two samples |
从图 3可以看出, 两种样品在温度为669.05 K(395.9 ℃)处具有等动力学点, 当温度低于395.9 ℃时, 潮湿样品的反应速率常数k大于干燥样品的反应速率常数, 当温度高于395.9 ℃时, 潮湿样品的反应速率常数k小于干燥样品的反应速率常数。
3.2 分析与讨论从表 3可以看出, 在绝热条件下, 硝酸钡系白光剂的干燥样品在567.75 K(294.5 ℃)开始发生放热反应, 145.93 min后, 温度达到707.5 K(434.35 ℃)时反应最剧烈, 反应系统最高温度可达740.48 K(467.33℃)。潮湿样品363.59 K(90.44 ℃)开始发生放热反应, 1480.86 min后, 温度达到799.47 K(526.32℃)时反应最剧烈, 反应系统最高温度可达1128.8 K(855.65℃)。对比两种样品的修正结果看出, 受潮以后的白光剂初始放热温度大大降低, 更容易发生放热反应。这是因为烟火剂中含有由镁、铝质量分数各50%左右组成的铝镁合金, 该物质能与水结合发生反应, 生成氢气、氢氧化铝和氢氧化镁, 放出热量使药剂发热、升温, 药剂变得更敏感[16]。此外, 烟火剂中的硫磺遇水在空气中容易生成亚硫酸, 这种酸性物质能与氢氧化铝和氢氧化镁发生中和反应, 生成水。这种反应破坏了烟火剂致密氧化膜保护层, 使反应加速[16]。并且经计算潮湿样品反应活化能E更低, 也有利于放热反应的发生。因而受潮后的烟火剂更容易发生自燃自爆, 从而引起火灾爆炸危险。
但是, 潮湿白光剂反应最大温升速率(0.77 K·min-1)远远低于干燥样品的最大温升速率(61.56 K·min-1), 反应剧烈程度大大降低, 反应时间长。这是因为如图 3所示, 二者反应活化能不同, 存在等动力学点, 当反应温度低于等动力学点时, 具有较低活化能的潮湿样品的反应速率常数大于干燥样品, 因此引发反应的温度低, 反之, 温度高于等动力学点时, 潮湿者的反应速率将小于干燥样品, 因而潮湿者的后续反应较干燥者慢。从而验证了受潮以后的烟火剂更容易发生放热反应, 但反应时间长, 后续反应的剧烈程度有所降低。
从该样品测试结果分析, 硝酸钡系烟火剂的初始放热温度远远高于以氯酸钾为原料的干燥鞭炮样品120 ℃的初始放热温度[5], 反应没有鞭炮剧烈, 最高温升速率远远低于鞭炮[5]。这是因为, 该样品中使用的主要原料为硝酸钡, 该物质熔点为592 ℃, 加热时先分解为亚硝酸钡, 再分解为氧化钡。硝酸钡的热敏感性低于氯酸钾[17-18], 氯酸钾在400 ℃以上则分解, 是一种敏感度很高的炸响剂, 有时候甚至会在日光照射下自爆。
从表 2与表 3的对比分析来看, 在绝热条件下, 样品所放出的热量完全用于加热自身, 样品的绝热温升、最大温升速率以及最高放热温度都要比实验条件下的测量值高, 而初始放热温度与达到最大温升速率的时间分别要比实验条件下的初始放热温度小。因此, 绝热条件下烟火剂的热危险性比实验条件下的危险性大, 修正后的结果对于评价热稳定性更具重要性。
4 结论(1) 以硝酸钡作为主要原料的白光剂热危险性较小, 初始放热温度较高, 反应较为缓慢。但是, 同样具有一定的热爆炸危险性, 一旦发生失控放热反应, 会形成较大的爆炸破坏。
(2) 受潮以后的白光剂初始放热温度大大降低, 反应更容易进行, 因而在干燥过程中, 更容易发生火灾爆炸危险。因此, 潮湿样品不宜在阳光下曝晒, 并且干燥过程中控制烟火剂温度不宜超过90 ℃, 以免发生危险。
(3) 根据实验分析可知, 潮湿烟火剂的反应过程有两类, 一是铝镁合金与水的反应。二是强氧化剂与强还原剂反应。系统从开始反应到剧烈反应经历的热蓄积时间长, 如果发现及时, 能有足够的时间有效控制火灾爆炸事故的发生。
(4) 测试数据在经过绝热修正后更能反映样品的热危险性, 因而烟火剂在越密闭或越绝热的环境中越具有火灾爆炸危险。
(5) 由于受潮后烟火剂更容易发生反应, 热危险性较大, 因此, 在贮藏、运输、使用中要防止遇水或受潮。
| [1] |
张香萍. 烟花爆竹存放使用中的消防安全问题研究[J].
武警学院学报, 2010, 26(6): 49-52. ZHANG Xiang-ping. A study of fire prevention for storage and use of firecrackers[J]. Journal of Chinese People's Armed Police Force Academy, 2010, 26(6): 49-52. |
| [2] | |
| [3] | |
| [4] |
傅智敏. 绝热加速量热法在反应性物质热稳定性评价中的应用[D]. 北京: 北京理工大学机电工程学院, 2002.
FU Zhi-min. Evaluating thermal stability for reactive chemical by accelerating rate calorimeter[D]. Beijing: Beijing Institute of Technology, 2002. |
| [5] |
蒋慧灵, 傅智敏, 王志朋, 等. 鞭炮干燥过程热危险性分析[J].
火工品, 2005(1): 50-53. JIANG Hui-ling, FU Zhi-min, WANG Zhi-peng, et al. Analysis of the thermal explosion dangerous during the firecracker's drying process[J]. Initiators & Pyrotechnics, 2005(1): 50-53. |
| [6] |
钱新明, 王鹏飞. 含改性氯酸钾烟火药剂的安全性研究[J].
含能材料, 2008, 16(3): 298-300. QIAN Xin-ming, WANG Peng-fei. Safety of pyrotechnics with modified potassium chlorate[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2008, 16(3): 298-300. |
| [7] |
钱新明, 邓楠, 魏思凡, 等. 碳纳米管对烟火药剂的催化作用[J].
含能材料, 2009, 17(5): 603-607. QIAN Xin-ming, DENG Nan, WEI Si-fan, et al. Catalytic effect of carbon nanotubes on pyrotechnics[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(5): 603-607. |
| [8] |
臧娜, 钱新明. 三种爆竹类药剂的热安全性研究[J].
含能材料, 2007, 15(2): 172-174. ZANG Na, QIAN Xin-ming. Thermal safety of three kinds of firework[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2007, 15(2): 172-174. |
| [9] |
张凤, 汪佩兰. 氯酸钾/铝粉/硫磺超细配方烟火药剂的特性[J].
化工学报, 2011, 63(1): 10-14. ZHANG Feng, WANG Pei-lan. Properties of ultra-fine formula pyrotechnics containing potassium chlorate, aluminum and sulfur[J]. CIESC Journal, 2011, 63(1): 10-14. |
| [10] |
钱新明, 魏思凡, 邓楠. CNTs/TMO复合催化剂对含高氯酸钾烟火药剂分解反应速率的影响[J].
火炸药学报, 2009, 32(3): 87-90. QIAN Xin-ming, WEI Si-fan, DENG Nan. Effect of carbon nanotubes supporting transition metal oxides on reaction rate of firework of potassium perchlorate[J]. Chinese Journal of Explosives & Propellants, 2009, 32(3): 87-90. |
| [11] |
钱新明, 邓楠. 烟花爆竹用氯酸钾的安全化研究[J].
中国安全生产科学技术, 2008, 3(4): 63-66. QIAN Xin-ming, DENG Nan. Evolvement of potassium chlorate safety in fireworks and firecrackers[J]. Journal of Safety Science and Technology, 2008, 3(4): 63-66. |
| [12] |
蒋慧灵, 臧娜, 钱新明. 过硫酸钠和过硫酸钾的热稳定性分析[J].
化工学报, 2006, 57(12): 2798-2800. JIANG Hui-ling, ZANG Na, QIAN Xin-ming, et al. Thermal stability of potassium supersulphate and sodium supersulphate[J]. Journal of Chemical Industry and Engineering, 2006, 57(12): 2798-2800. DOI:10.3321/j.issn:0438-1157.2006.12.002 |
| [13] |
蒋慧灵, 卢文清, 孙斌, 等. 苯甲酰肼与对硝基苯肼的热稳定性分析[J].
化学研究与应用, 2006, 18(12): 1424-1427. JIANG Hui-ling, LU Wen-qing, SUN Bin, et al. Adiabatic stability analysis of benzoyl hydrazine and p-nitro phenyl hydrazine[J]. Chemic Research and Application, 2006, 18(12): 1424-1427. DOI:10.3969/j.issn.1004-1656.2006.12.013 |
| [14] |
FU Zhi-min, FENG Chang-gen, QIAN Xin-ming. A mathematical model for evaluating thermal stability of solid energetic materials[C]//Theory and Practice of Energetic Materials, Vol. 4, Beijing: China Science and Technology Press, 2001: 606-617.
|
| [15] |
朱华桥, 钱新明, 傅智敏. 伪逆矩阵法处理绝热测试数据[J].
火炸药学报, 2003, 26(1): 78-80. ZHU Hua-qiao, QIAN Xin-ming, FU Zhi-min. Pseudo-inverse matrix method-A new method to deal with the adiabatic test data[J]. Journal of Explosives & Propellants, 2003, 26(1): 78-80. |
| [16] |
黎俐. 铝镁合金粉化学放热效应探讨[J].
山西化工, 2008, 28(3): 35-37. LI Li. A study on chemical exothermic effect of dusty aluminum magnesium alloy[J]. Shangxi Chemical Industry, 2008, 28(3): 35-37. |
| [17] |
郭祥熙, 王百姓, 樊彩霞, 等. 关于烟花爆竹爆音剂中代替氯酸钾用复合氧化剂的研究与应用[J].
花炮科技与市场, 2007(2): 32-34. |
| [18] |
范小花, 蔡治勇, 易俊, 等. 烟花爆竹用氧化剂的研究进展[J].
中国安全科学学报, 2008, 18(6): 80-83. FAN Xiao-hua, CAI Zhi-yong, YI Jun, et al. Research and progress of oxidants used in fireworks and firecrackers[J]. China Safety Science Journal, 2008, 18(6): 80-83. |
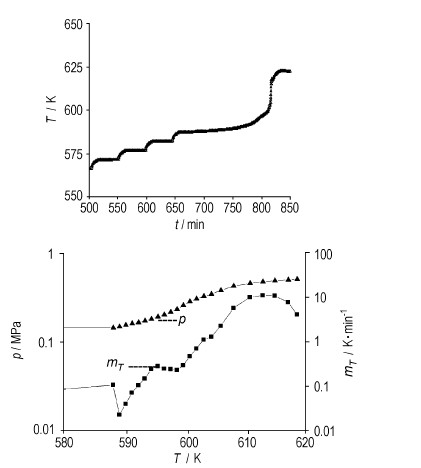
The adiabatic reaction processes of dry and wet white-light fireworks mainly composed of barium nitrate were studied by an accelerating rate calorimeter(ARC).The curves of change in adiabatic reaction temperature with time and in temperature rise rate with temperature were obtained.



