2. 北京理工大学生命学院, 北京 100081
2. School of Life Science and Technology, Beijing Institute of Technology, Beijing 100081, China
唑类、三嗪类等富氮化合物具有高密度、高正生成焓、热稳定性好等优点,可作为气体发生剂、固体推进剂燃料以及烟火剂,近年来备受关注[1-5]。
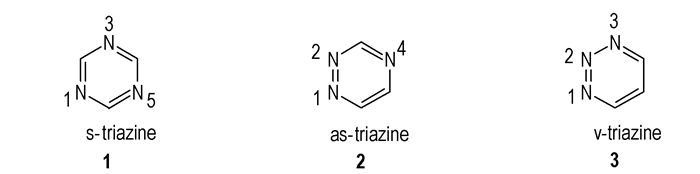
三嗪环张力较小,稳定性很好,氮含量极高(51.83%),具有较高的生成焓。三嗪有三种同分异构体(Scheme 1),其中研究最多的是1, 3, 5-三嗪(均三嗪,s-三嗪)。三嗪环有三个可修饰的位点,可以与亲核试剂反应得到一系列的衍生物,研究者将叠氮基[6]、硝基[7]、硝胺基[8-9]、偶氮键和联氨键[10]、氮杂环丙烷[11]、氮杂环丁烷[11]、三唑[12]、四唑[13]等结构引入三嗪环,从而得到了多种新型富氮含能化合物。近年来,三嗪类含能离子衍生物[14-15]也日益成为含能离子盐的重要成员。
|
Scheme 1 Various types of triazines |
理论研究方面也取得很大进展,梁晓琴等[16]在B3LYP/aug-cc-pvDZ理论水平上研究了均三嗪取代衍生物的分子构型、解离能及含能性质。Huynh等[17]总结了以偶氮键和联氨键相连的三嗪双环含能衍生物,但关于三嗪单环、双环乃至多环方面的研究状况,目前尚无较全面的综述。为了更好的研究三嗪类含能化合物的发展历程,得到高能顿感的含能化合物,本文从三嗪环的单环衍生物到多环衍生物介绍了三嗪类含能化合物的研究进展。
2 单环早期三嗪类含能化合物的研究主要集中在对三嗪单环进行化学修饰,引入氨基、叠氮基、硝胺基等取代基合成各种单环衍生物,利用取代基来控制和改变富氮化合物的性能。引入其他的杂环化合物构成多核的结构,利用三嗪环的稳定性连接一些含氮量高或张力大的杂环构成新的母体。其中部分单环三嗪含能化合物可作为安全气囊气体发生剂的候选者,氧含量高的含能化合物可作为固体推进剂的氧化剂。
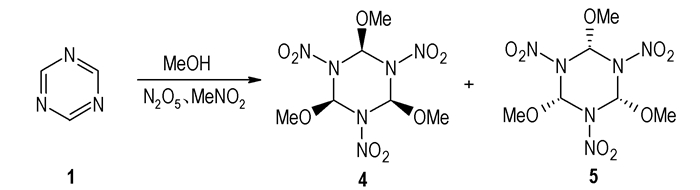
2.1 1, 3, 5-三嗪(1,Scheme 1)1可以与3, 3-二甲氧基环丙烯进行[3+2]环加成反应[18],可以经开环再成环被Cl、NH3等基团取代生成各种含能物质的前体。1还可以在MeNO2条件下直接用N2O5硝化[19-20],生成顺反两种三甲氧基三硝基三嗪(4,5,Scheme 2)。
|
Scheme 2 Nitration of triazines |
计算预测4,5的密度为1.67 g·cm-3,蒸发焓94.2 kJ·mol-1[19]。但这两种物质均不稳定且无法分离,其在0 ℃下相对稳定,在20 ℃时具有相同的分解速率。
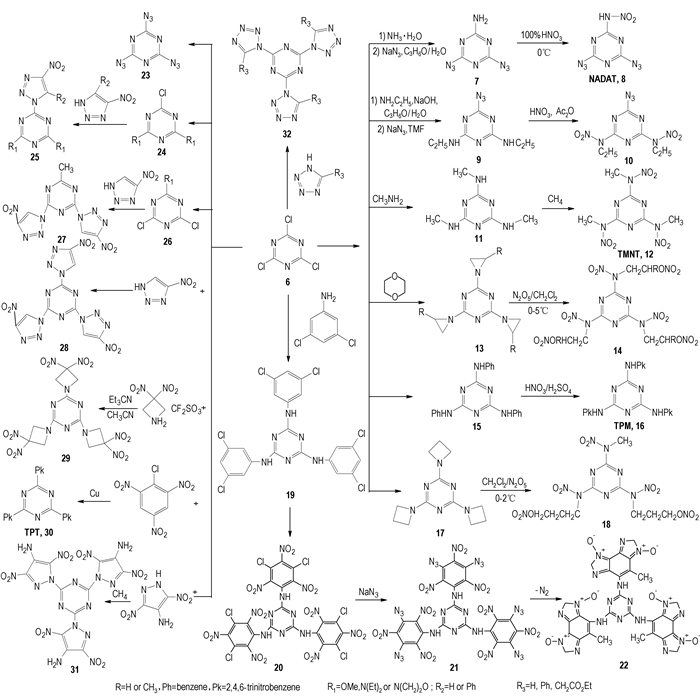
2.2 以2, 4, 6-三氯-1, 3, 5-三嗪(TCT,6,Scheme 3)为前体的三嗪类含能化合物6是重要的三嗪类含能化合物的前体,很容易与亲核试剂发生反应,三个氯分子可分别被叠氮基,以及其他含N杂环取代,形成新的含能材料[6, 13]。
以6为原料制备含能化合物主要是通过两种途径,一种是先用其他基团取代氯原子,再进行硝化。另一种途径是直接用已经硝化的化合物取代氯原子。
2.2.1 2, 4, 6-三叠氮基-1, 3, 5-三嗪(TAT,23,Scheme 3)
|
Scheme 3 Triazine derivatives that take 6 as precursor |
23是早在1921年就已经被研究的一个富氮化合物,可以由6与叠氮化钠(SDA)反应制得[6]。每个叠氮基团可以释放335 kJ的能量,爆炸威力相当于雷酸汞的两倍,但其挥发性和对火花、摩擦、撞击等极其敏感而限制了实际应用。近年来,以其为前体制备C/N纳米材料的努力也未获成功[1, 21]。
2.2.2 含叠氮基的硝胺化合物为了改善TAT的爆轰性能,既保留叠氮基高的生成热,又可以通过引入其他基团降低感度。Reed和Dolah首先开展了对含叠氮基的硝胺化合物的研究[22]。Rosher, Morton和Fimslic合成了一系列叠氮硝胺化合物,将其用作推进剂组分,可显著增加燃烧速度而不影响压力指数,并提高比冲,之后又发现了其能量与HMX相当,而且爆轰感度较低,因此试图应用于无烟低感度推进剂以代替HMX[22]。
氨基替代叠氮基可以降低其感度,6-氨基-2, 4-二叠氮-1, 3, 5-三嗪(7,Scheme 3)可以由6为原料经过6-氨基-2, 4-二氯-1, 3, 5-三嗪两步得到。但是氨基密度低,氧平衡低,7与100%的硝酸可以得到6-硝胺基-2, 4-二叠氮-1, 3, 5-三嗪(NADAT,8,Scheme 3)[14],可以弥补氨基带来的缺点。8中硝胺基有部分转变为—NNO2可增强它的稳定性,并且其硝酸盐可以作为含能离子盐的有机阴性离子与其他离子或盐在水中形成相应的盐如碳酸胍,碳酸氨基胍,中性的4-氨基-1, 2, 4-三唑,3, 5-二氨基-1, 2, 4-三唑和3, 4, 5-三氨基-1, 2, 4-三唑的胍盐等;8在碳酸钾溶液中也可以很容易地去质子化然后与有机硫酸或卤盐反应[14]。胍基中的三个氨基形成很丰富的氢键网可以提高离子盐的密度和热稳定性,所以这些盐类都有相对高的密度(1.63~1.78 g·cm-3),热稳定性适中(Td=130~196 ℃)[14],而且理论计算的爆速和爆压与常见的含能化合物TAT或TATB相似或更高。
2, 4-二乙胺基-6-叠氮-1, 3, 5-三嗪(9,Scheme 3)[19]硝化后得到2, 4-二(N-硝基)-乙胺基-6-叠氮基-1, 3, 5-三嗪(10,Scheme 3),撞击感度较低,落锤10 kg,25 cm落高时爆炸百分数为20%[22]。分解后生成的氮烯与芳香环之间的共轭作用使自由基本身稳定,分解过程较容易进行,其热稳定性比一般脂肪族叠氮化物差。前者存在分子内氢键,表现出较高的熔点和密度,经硝化氢键消失,熔点和密度都有所下降。硝胺甲基和硝基相比使化合物的密度降低,限制了其在含能爆炸物中的应用。硝胺甲基属于二级硝胺,比硝胺基稳定,如2, 4, 6-三硝胺甲基-1, 3, 5-三嗪(TMNT)[8](12,Scheme 3)。
2.2.3 与高张力氮杂环及苯环相连后硝化氮杂环都具有很大的环张力,而且三嗪环易发生亲核取代,环的结构比较稳定,将高张力的氮杂环与三嗪环相连,增加了三嗪环的能量也提高了氮杂环的稳定性。早在1950年,Bestian H.等人[23]在研究氮杂环丙烷的反应时就发现其可和三嗪环发生反应,还可将杂环丁烷与三嗪环相连[11]。这类化合物共同的缺点是只含有氮原子和氢原子,虽然符合环境友好但不含氧原子,导致氧平衡和密度都偏低,硝化后,氮杂环开环得到相应的硝胺-硝酸化合物[11],如三氮杂环丙烷三嗪(13,Scheme 3)硝化后得到的硝胺-硝酸化合物(14,Scheme 3)氧平衡和RDX相同,但是感度低于RDX。
苯环和氮杂环相比非常稳定,引进氨基及加大共轭体系均是提高熔点、增加热安定性的有效措施。将三氯三嗪与苯胺反应之后经硝化可以很容易制备三苦胺基三嗪[24](TPM,16,Scheme 3),其热稳定性适中,性能略优于TNT,是一种性能较为优良的耐热炸药。美国LANL从1966年开始制备16,1968年获得专利权,1976年完善化,目前已中型生产,成本相当于黑索今。16还可以进一步用硝酸和乙酸酐硝化,仲胺基被硝化成N—NO2。
在2, 4, 6-三亚胺基-N-N-N-三-2-硝基苯并氧化呋咱-1, 3, 5-三嗪分子[25](22,Scheme 3)中,一个氧化呋咱代替一个硝基, 使密度提高0.06~0.08 g·cm-3, 爆速增加0.3 km·s-1左右。杂环体系引入后,由于分子内微扰作用,使原子轨道的组合大大优于碳环体系,因为额外的电荷密度带来的稳定化能,使含能材料的耐热性提高,冲击感度下降。分子中引入亚氨基,可因分子间氢键形成而增大晶格能。它仅有三个仲氨氢原子,具有较好的负氧平衡,少氢钝感,是一种性能优异的高能量密度材料。
2.2.4 与含硝基的氮杂化及苯环反应将三嗪的氮杂环衍生物直接硝化虽然提高了氧平衡,但导致环的破裂,氮杂环的张力消失,Hiskey M. A.等人[26]开始研究用含有硝基的氮杂环与三嗪环直接反应,这样既保证了氧平衡和密度,又保留了氮杂环的环张力,使化合物的含能性能提高。3, 3-二硝基氮杂环丁烷是强的亲核试剂,可以与三嗪环反应得到三取代的二硝基氮杂环丁烷三嗪[26](29,Scheme 3)。Kizhnyaev V.K.等人[12]也利用亲核取代合成出一系列的硝基三唑取代物(Scheme 3)。6和三硝基氯苯,使之在铜粉作用下发生乌尔曼反应三苦基均三嗪(TPT,30,Scheme 3),产率为72%,用30制成的导爆索在315 ℃加热1 h后仍能可靠地爆轰,即使加热2 h分解量也不大。
美国Livemore国家实验室于2001年首次合成了4-氨基-3, 5-二硝基吡唑(LLM-116)。LLM-116是一种性能优异的新型含能材料, 其感度较低, 能量是TATB的1.38倍, 在不敏感弹药中具有潜在的应用前景。它可以作为重要的含能中间体, 与卤代硝基化合物进行缩合反应,如与6反应生成2, 4, 6-三(4-氨基-3, 5-二硝基吡唑-1-基)-1, 3, 5-三嗪[27](31,Scheme 3)。
2.2.5 2, 4, 6-三四唑基-1, 3, 5-三嗪四唑是含有四个氮原子的五元杂环化合物,四唑环氮含量超过80.0%,是目前能够稳定存在的含氮量最高的一种环结构单元,含有大量高能的N—N键、C—N键以及大的环张力,并且具有高密度、高生成焓、高气体生成量、低感度、热稳定性好以及爆轰产物多为洁净的N2等一系列优良性质,而成为有效、安全和环境友好型候选高能量密度材料(HEDMs)。6和四唑,在15~25 ℃条件下,在三乙胺或NaHCO3存在的水-丙酮体系中反应,可得到三四唑基取代的三嗪(32,Scheme 3)[13]。此反应中,第一个氯原子很容易被取代,但是第二个第三个的取代需要更高的反应温度因此产率很低(18%)。6中的氯原子可以用OMe,NEt2,N(CH2)4O等基团取代保护,从而可以得到三嗪环四唑的一取代和二取代化合物。
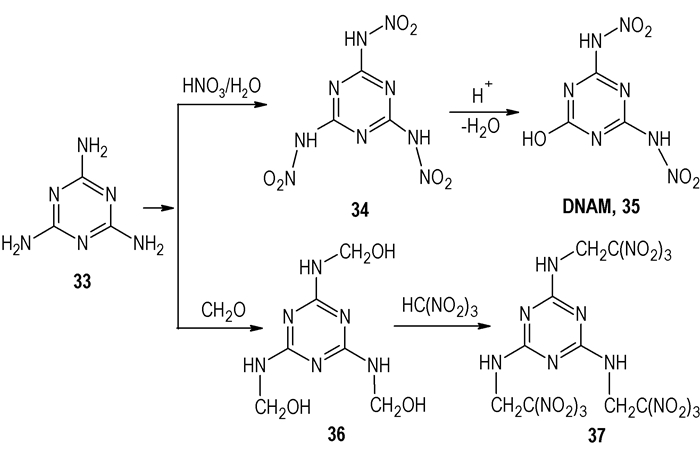
2.3 以2, 4, 6-三氨基-1, 3, 5-三嗪(33,Scheme 4)为前体
|
Scheme 4 Triazine derivatives that take 33 as precursor |
33是惰性化合物可以作为阻燃剂,生成焓低,没有氧原子,氧平衡低,通过硝化成硝胺基[8-9]可以提高氧平衡和生成热,因此它也是一个重要的含能化合物的前体。
2, 4, 6-三硝胺基-1, 3, 5-三嗪(34,Scheme 4)理论上应该具有较高的密度和生成热,可由硝酸在乙酸酐的条件下直接硝化33产生(Scheme 4),但由于其中的一个硝胺基极易水解,其很快被水解为2, 4-二硝胺基-6-羟基-1, 3, 5-三嗪(DNAM,35,Scheme 4)[8-9]。35加热到228 ℃没有经过熔解就直接分解,易爆。
引入硝仿乙基[28](Scheme 4)不仅能改善氧平衡,而且其分子间的氢键作用和硝基的偶极作用能够提高化合物的密度,计算表明每增加一个硝仿乙基密度增加约0.06 g·cm-3。
2.4 硝仿基三嗪硝仿基团含有三个硝基,可以在一定程度上弥补三嗪环的不足。1994年Alexey V.S.等人[29]合成出2, 4, 6-三硝仿基-1, 3, 5-三嗪(39,Scheme 5),熔点90~91 ℃,易爆炸在空气中不稳定,只能保存在5~10 ℃的CCl4溶液中。三嗪环硝仿取代物,在既保证含能化合物氧平衡生成热的基础上降低其感度,一取代物和二取代物大多数是利用三硝仿三嗪的亲核取代,用硝胺基[30],叠氮基[31],氨基[32],烷氧基[33]等取代其中的一个或两个硝仿基团。硝胺基有很高的反应活性;一叠氮的取代物分离出来是油状粘性物有水解的倾向,二叠氮取代物是固体不易水解,熔点96~97 ℃,但这两种物质都对摩擦和撞击敏感。
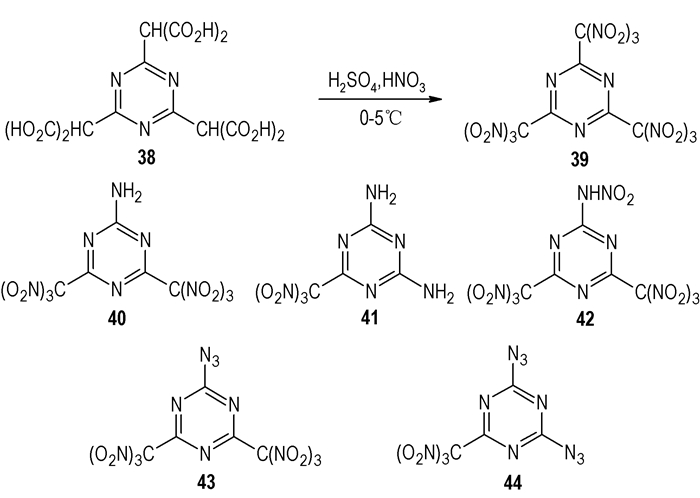
|
Scheme 5 Synthesis of 2, 4, 6-Tris(trinitromethyl)-1, 3, 5-triazine and triazine derivatives of trinitromethyl |
6的化学性质和酰基氯相似,可以和多硝基盐类化合物反应生成不稳定的硝酸酐,有爆炸的危险,Gidaspov A.A.等[34]研究表明其直接与硝仿盐反应生成硝酸酐二硝仿三嗪时加入水可以消除危险生成羟基。
2.5 三嗪并四唑环叠氮基的生成焓很高,但是含有叠氮基的化合物感度很低,合成时需要特别小心,也限制了其应用,研究者根据叠氮和四唑环的异构,构想叠氮基异构形成四唑环并在三嗪环上。并四唑环合成一般是通过叠氮甲亚胺叠氮四唑异构三嗪环的增环形成,但是叠氮三嗪必须有供电子基团取代。实验已经证明2-二甲氨基-4, 6-二硝仿基-1, 3, 5-三嗪和2-二乙胺基-4, 6-二硝仿基-1, 3, 5-三嗪不能形成叠氮-四唑互变异构的转变[35]。2-羟基-4, 6-二硝仿基-1, 3, 5-三嗪的四甲胺盐(46,Scheme 6),叠氮钠在丙酮溶液中反应,一个硝仿基被取代成叠氮基但是它可以继续反应生成的5-硝仿四唑[1, 5-a-]-1, 3, 5-三嗪-7-酮(47,Scheme 6),在甲醇溶液中用碘化钾脱硝酸形成5-二硝甲基四唑[1, 5-a]-1, 3, 5-三嗪-7-酮的钾盐(50,Scheme 6),通过X-衍射分析已确定结构,同样也得到并四唑环的钠盐(48,Scheme 6)[15]。
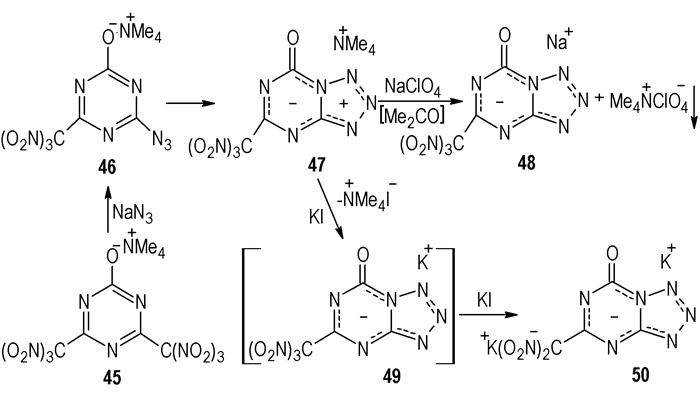
|
Scheme 6 Synthesis tetrazolo-1, 3, 5-triazines |
虽然还不知道叠氮和它的异构体四唑环感度的准确数值,但是具有芳香性的四唑环对撞击和摩擦的敏感度都小于共价的叠氮化物。
2.6 2, 4, 6-三硝基-1, 3, 5-三嗪(TNTA)和TAT氮氧化物1907年Finger最早提出通过硝化6合成2, 4, 6-三硝基-1, 3, 5-三嗪(TNTA)的可能性,Korkin和Bartlett从理论上最早建议TNTA可以作为HEDM[36]。据估计TNTA的爆炸性能优于HMX或至少与RDX相近,通过原子体积估算它有更高的密度2.1 g·cm-3[7]。但至今TNTA仍未合成出来。Michael D.Coburn等[37]试图通过将氨基转变成硫亚胺,再氧化成硝基,但是只得到硫亚胺的三氟盐(51,Scheme 7)。
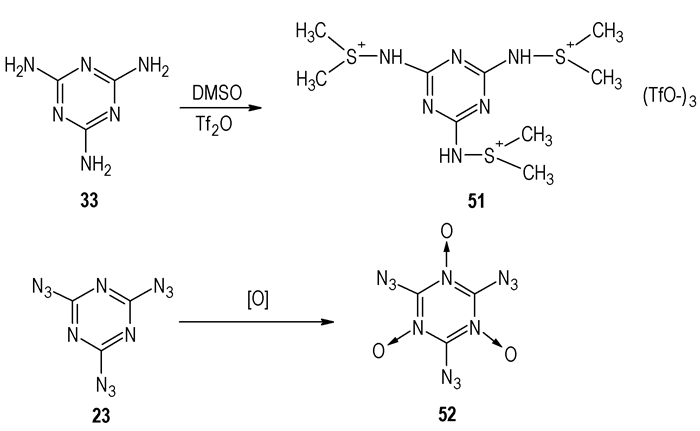
|
Scheme 7 Preparation of sulfilimines and N-oxides of TAT |
含氮杂环化合物经N-氧化反应生成的N-氧化物具有独特的性能,在含能材料领域,采用N-氧化反应来改进性能是一种重要的方法,可以有效地提高含能材料的氧平衡、密度、生成焓, 改善高能炸药的性能[10]。含有多个氮原子的杂环化合物结构更为复杂,N-氧化反应的发生也更为不易,不仅存在各个氮原子氧化位置的选择,而且合适的氧化剂亦不易寻找,氧化能力过弱不足以发生N-氧化反应, 氧化能力过强则会损坏化合物的原有结构[38],因此寻找合适的氧化剂对含有叠氮基的三嗪氧化也是未来含能材料发展方向之一。高氮含能材料23生成热高达1050 kJ·mol-1[6],但不含氧,导致密度偏低,如把其氧化成为单氮、二氮、或者三氮氧化物则能解决这个问题。采用常见的的氧化剂过氧乙酸、过氧三氟乙酸、水合过硫酸盐、臭氧等对其进行N-氧化反应效果不甚理想,无论常温下还是升高温度反应收率都很低[38]。
Keshavarz M. H.等[39]构建了一系列的二硝三唑基三嗪的衍生物(Scheme 8)。用硝基取代了1 上的氢比用相对体积较大的二硝基三唑取代氢密度大,但是对生成热影响不大,而且感度增加,安全性降低。
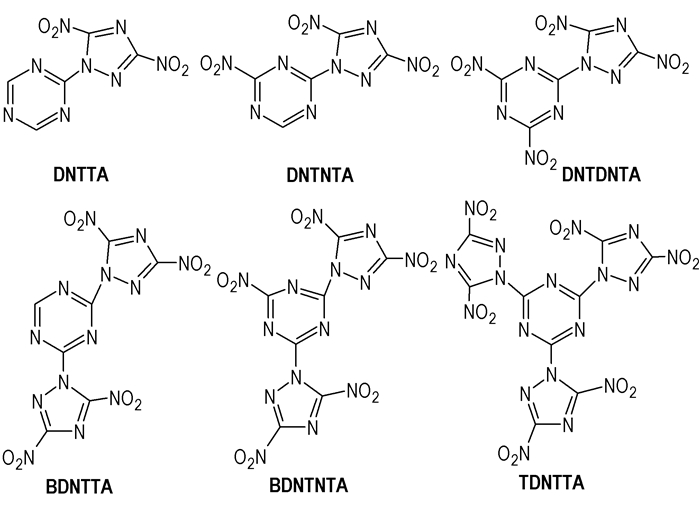
|
Scheme 8 Triazine derivatives of dinitro-triazole |
经理论计算构建的二硝三唑基三嗪衍生物都是重要的含能物质,含两个二硝三唑基的三嗪衍生物的感度比HMX和TNTA低得多。这些衍生物硝基含量多,正氧平衡好,其中氧可以在分解时把所有的C氧化成CO2或CO,可以用作固体推进剂。
2.7 1, 2, 4-三嗪(2,Scheme 1)和1, 2, 3三嗪(3,Scheme 1)的含能衍生物由于2和3没有1稳定,前两者的环容易破裂,在含能化合物方面不能形成共轭稳定,所以关于前两者的含能衍生物研究很少。2用于木材染料较多,3自1874年首次合成报道之后至今,有关的化合物很少[40]。
3-叠氮-5-氨基-6-硝基-1, 2, 4-三嗪[41]是氨基四唑与硝基乙腈反应经过扩环生成,化合物中有叠氮基团高的生成热,硝基提高氧平衡,氨基可以形成分子间氢键降低感度,但其在酸性条件下容易水解。3-叠氮-1, 2, 4-三嗪的N-氧化[42]都是通过用N-氧化物前体来进行重氮化或叠氮化形成叠氮基团来实现的。
由三嗪单环含能化合物的发展可以看出,对于三嗪主要是通过引入硝基提高其爆轰性能。由表 1可以看出,引入硝基杂环可以得到较高密度的化合物,而由于杂化硝化易于开环,其发展方向应是先硝化后引入,Keshavarz, M. H.等[39]构建的二硝三唑基三嗪的衍生物是非常有前途的含能化合物,此外引入硝基四唑应该也能得到爆轰性能较好的化合物。
| 表 1 部分三嗪单环含能化合物的性质 Tab.1 Properties of some single triazine ring energetic compounds |
由于三嗪环可修饰位点数目较少,使得其衍生物合成的种类和性能都受到一定的限制。研究发现,偶氮键可以有效提高富氮杂环化合物的密度和生成热,含能基团通过偶氮(—N=N—)连接形成的一类化合物(以下简称为偶氮类含能化合物)极为引人瞩目[10, 43]。大多数偶氮类含能化合物具有很高的正生成焓, 表现出明显的高能量密度、低感度的特点, 在无烟炸药、气体发生器, 火箭推进剂等方面具有很大的应用潜力。
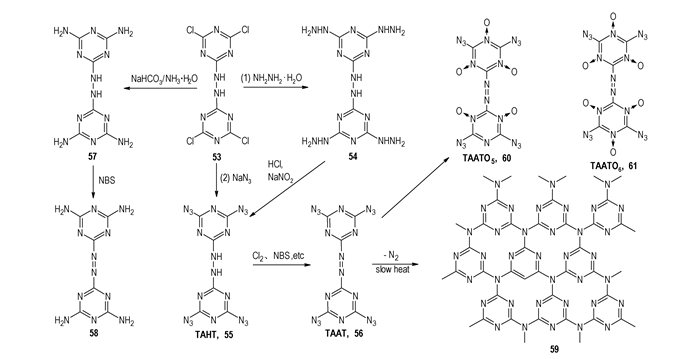
3.1 联氨三嗪衍生物--4, 4′, 6, 6′-四叠氮联氨-1, 3, 5-三嗪、4, 4′, 6, 6′-四肼基联氨-1, 3, 5-三嗪4, 4′, 6, 6′-四叠氮联氨-1, 3, 5-三嗪(TAHT,55,Scheme 9),联氨键的联接导致了生成热变大(1753 kJ·mol-1),和23相比密度降低(1.65 g·cm-3),感度也明显降低。本课题组李玉川博士等[44]改进了其合成方法,NaN3亲核取代直接上叠氮基和重氮化方法相比危险性降低(Scheme 9)。
|
Scheme 9 Synthesis of 4, 4′, 6, 6′-tetraamino-azo-triazine, TAAT and The possible pyrolysis mechanism of TAAT |
4, 4′, 6, 6′-四肼基联氨-1, 3, 5-三嗪[17](54,Scheme 9)可以通过四氯联氨三嗪(53,Scheme 9)和肼在乙腈回流的条件下很容易得到(Scheme 9),反应产率高达97%。肼需在0 ℃条件下滴加,以弥补肼放出的热量。DSC分析54在293 ℃时迅速分解,生成焓为(406±5) kJ·mol-1[17]。54可以和HNO3、HClO4反应生成相应的离子盐。但是关于离子盐详细的爆轰性能还没有报道。
3.2 偶氮三嗪衍生物-4, 4′, 6, 6′-四氨基偶氮-1, 3, 5-三嗪、4, 4′, 6, 6′-四叠氮偶氮-1, 3, 5-三嗪及其N-氧化偶氮键的联接在大大增加生成热的同时也使密度略有提高。4, 4′, 6, 6′-四叠氮基偶氮-1, 3, 5-三嗪(TAAT,56,Scheme 9)和23相比分解温度升高、摩擦感度降低,稳定性显著增强,并且具有高达2171 kJ·mol-1的生成热[17],在已知的多硝基化合物、高氮化合物和多叠氮基化合物中具有最高的生成热。
氨基取代的杂环高氮化合物一般都具有良好的稳定性,对热、撞击和摩擦耐受能力较强。4, 4′, 6, 6′-四氨基偶氮-1, 3, 5-三嗪[47](58,Scheme 9)是一个钝感化合物,氨基硝化成硝胺基后可成为含能化合物,但是由于其偶氮键易断和硝胺基容易被水解成羟基所以还没有合成出来。
Pagoria等[45]人提出通过将三级胺转变成相应的N-氧化物来提高杂环化合物的氧平衡和密度。TAAT由于其分子中不含氧原子,密度相对较低,因此其爆轰性能不如RDX、HMX。N-氧化反应之后其氧平衡和化合物得密度都得到提高。据计算预测TAAT的N-氧化物密度提高,由于N→O键,TAAT的N-氧化物的爆轰性能都比TAAT好,TAATO5(60,Scheme 9)和TAATO6(61,Scheme 9)的密度都高于2.0 g·cm-3。TAATO6的密度最大,但是密度的增加不是简单的线性关系。当其中N→O键的数量多于6时,密度变小。虽然TAATO5和TAATO6的密度小于CL-20但是由于生成热大所以其爆轰性能更好[46]。
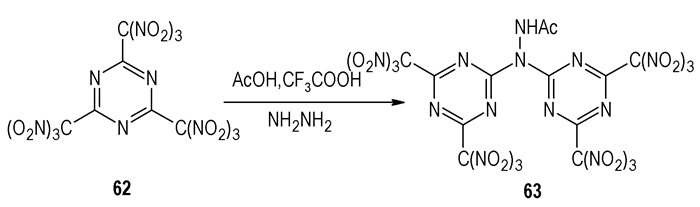
3.3 1-乙酰基-2, 2-[4, 6-二硝仿基-1, 3, 5三嗪-2-]肼基三嗪的三硝仿基衍生物感度高,在空气中有爆炸的危险,限制了其应用,通过一个乙酰基[28](Scheme 10)相连后,熔点为151~152 ℃,经计算密度为2.192 g·cm-3,与38 (2.241 g·cm-3)相比有所下降,但氨基可以形成分子间氢键,使感度降低。
|
Scheme 10 Linking by Acetyl |
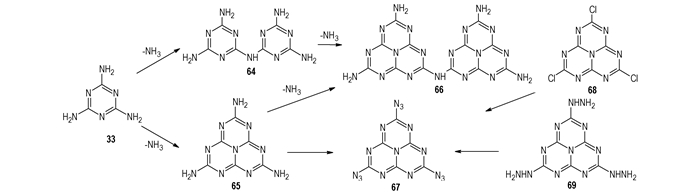
33加热高于熔点热缩合,失去了氨形成蜜白胺(64,Scheme 11)和蜜勒胺(65,Scheme 11)。64形成只需要消除一些取代,而更多的浓缩形成65则需要打破芳香环[47]。
|
Scheme 11 Thermal aminolysis of melamine to form condensed structures |
以s-庚嗪为前体的化合物被认为是有希望的,热稳定的高氮,sp2连接的碳化氮材料的前体物。2, 5, 8-三叠氮-s-庚嗪(67,Scheme 11)是完全结合的多环只由碳原子和氮原子组成,由于含叠氮基团多,所以是不稳定的含能材料。它具有可见光光致发光的特性,在185 ℃下迅速分解成CNx材料。23在光滑的玛瑙研钵中用力研磨就就会发生剧烈爆炸,而67在不光滑的陶瓷研钵中才可以看见其温和地分解成棕褐色的物质[48]。大量N原子的孤电子对也使它成为超分子金属配位化合物的骨架。
3.5 氮化碳材料(59,Scheme 9)[49]56受热速率较快时(如>20 ℃·min-1),直接剧烈完全分解,生成以氮气为主的气体;而受热速率较慢时,56则很可能是缓慢释放氮气然后交联形成的新的网状结构(Scheme 9)。对56进行X-射线单晶衍射,可知其分子中两个三嗪环是共面的,且分子中每个三嗪环和与之相连的叠氮基也是基本共面的。56结构中含有四个叠氮基,在热分解的过程中可以通过释放氮气相互交联,形成氮化碳纳米材料,但是依然保持三嗪环的骨架结构。
双环的三嗪较单环相比修饰位点增多,但由于偶氮键及联氨键本身的缺点如联氨键易被氧化,偶氮键在酸性的条件下易发生断裂,从而也限制了三嗪双环化合物的进一步修饰(硝化,氧化等)。双环化合物的种类较单环少,可以参照单环的发展,在双环化合物引入含硝基的取代基,而且56是迄今生成热最高的化合物,寻找合适的氧化剂对其进行N—O化得到的化合物具有更好的应用前景。
三嗪多环化合物主要是通过单环双环化合物热聚合形成,其形成需要高温高压,在含能性能上优势较小,主要应用于氮化碳纳米材料。
4 结论含能化合物爆轰性能的提高主要是通过化合物的氧平衡,生成热,密度的提高来实现的,但前两者增加的同时通常也增加了化合物的感度,只有密度的增加既能提高性能又不增加感度。偶氮键、联氨键的相连增加了杂环的共轭性,也有助于降低化合物的感度。从近年来三嗪类多氮化合物的最新研究进展可见,引入硝基,或直接氮氧化,在提高密度的同时也改善了高氮杂环化合物的氧平衡。其中最理想的是在叠氮类三嗪衍生物上直接氧化既提高密度又能保留叠氮基高的生成热。三嗪类衍生物的发展是逐步引入氧原子在含能性能和密度、感度之间找到更好的平衡点。三嗪环的高氮稳定性决定其在未来含能化合物发展中占有一席之位。三嗪类含能衍生物进一步发展的方向一是改善合成方法,提高部分含能衍生物的产率,如四唑环,硝基四唑环取代;二是寻找新的合成方法和新的氧化剂,合成已通过计算得到的性质优良的衍生物如二硝基三唑的一系列衍生物和实现叠氮类三嗪衍生物的氮氧化;三是通过计算优化结构寻找爆轰性能更好的三嗪衍生物;四是充分发挥含能离子盐的优势,将部分不稳定的含能化合物作为有机阴离子合成相应的含能离子盐。
| [1] |
YE Cheng-feng, GAO Hai-xiang, Boatz J A, et al. Polyazidopyrimidines: high-energy compounds and precursors to carbon nanotubes[J].
Angew Chem Int Ed, 2006, 45(43): 7262-7265. DOI:10.1002/(ISSN)1521-3773 |
| [2] |
Hammerl A, Klapotke T M, Rocha R. Azide-tetrazole ring-chain isomerism in polyazido-1, 3, 5-triazines, triazido-s-heptazine, and diazidotetrazines[J].
Eur J Inor Chem, 2006, 16(11): 2210-2228. |
| [3] |
Fischer A, Antonietti M, Thomas A. Growth confined by the nitrogen source: Synthesis of pure methal nitride nanoparticles in mesoporous graphitic carbon nitride[J].
Adv Mater, 2007, 19(2): 264-267. DOI:10.1002/(ISSN)1521-4095 |
| [4] |
Goettmann F, Thomas A, Antonietti M. Metal-free activation of CO2 by mesoporous graphic carbon nitride[J].
Angew Chem Int Ed, 2007, 46(15): 2717-2720. DOI:10.1002/(ISSN)1521-3773 |
| [5] |
Banert K, Joo Y, Ruffer T, et al. The exciting chemistry of tetraziomethane[J].
Angew Chem Int Ed, 2007, 46(7): 1168-1171. DOI:10.1002/(ISSN)1521-3773 |
| [6] |
Pepekin V I. Limiting detonation velocities and limiting propelling powers of organic explosives[J].
Doklady Physical Chemistry, 2007, 414(2): 159-161. DOI:10.1134/S0012501607060103 |
| [7] |
Yang K, Park Y H, Cho S G, et al. Theoretical studies on the formation mechanism and explosive performance of nitro-substituted 1, 3, 5-triazines[J].
Journal of Computational Chemistry, 2010, 31(13): 2483-2492. |
| [8] |
Ritter H, Licht H H. Synthesis and characterization of methylnitramino-substituted pyridines and triazines[J].
Propellants, Explosives, Pyrotechnics, 1993, 18(2): 81-88. DOI:10.1002/(ISSN)1521-4087 |
| [9] |
Atkinson E R. The Nitration of Melamine and of Triacetylmelaminel[J].
Journal of the American Chemical Society, 1951, 73(9): 4443-4444. DOI:10.1021/ja01153a121 |
| [10] |
Huynh M H V, Hiskey M A, Hartline E L, et al. Polyazido high-nitrogen compounds: Hydrazo-and azo-1, 3, 5-triazine[J].
Angewandte Chemie-International Edition, 2004, 43(37): 4924-4928. DOI:10.1002/(ISSN)1521-3773 |
| [11] |
Golding P, Millar R W, Paul N C, et al. Preparation of nitramine-nitrates by ring-opening nitration of azetidines by dinitrogen pentoxide (N2O5)[J].
Tetrahedron, 1995, 51(17): 5073-5082. DOI:10.1016/0040-4020(95)98704-L |
| [12] |
Kizhnyaev V, Pokatilov F, Vereshchagin L, et al. Synthesis of energetic polynuclear and polymeric nitroazole systems[J].
Russian Journal of Applied Chemistry, 2009, 82(10): 1769-1775. DOI:10.1134/S1070427209100048 |
| [13] |
Vereshchagin L I, Verkhozina O N, Pokatilov F A, et al. Synthesis of polynuclear heterocyclic polynitrogen systems based on cyanuric chloride and its derivatives[J].
Chemistry of Heterocyclic Compounds, 2010, 46(2): 206-211. DOI:10.1007/s10593-010-0493-2 |
| [14] |
Huang Y G, Zhang Y Q, Shreeve J M. Nitrogen-rich salts based on energetic nitroaminodiazido[1, 3, 5]triazine and guanazine[J].
Chemistry-a European Journal, 2011, 17(5): 1538-1546. DOI:10.1002/chem.v17.5 |
| [15] |
Fedorov B S, Utienyshev A N, Ghidaspov A A, et al. Condensed tetrazolo-1, 3, 5-triazines. 2. alkylation and nucleophilic substitution of 5-trinitromethyltetrazolo[1, 5-a]-1, 3, 5-triazin-7-ones[J].
Chemistry of Heterocyclic Compounds, 2005, 41(4): 496-502. DOI:10.1007/s10593-005-0178-4 |
| [16] |
梁晓琴, 蒲雪梅, 田安民. 均三嗪含氮取代基衍生物的结构和性质[J].
物理化学学报, 2008, 24(4): 639-645. LIANG Xiao-qin, PU Xue-mei, TIAN An-min. Structures and properties of s-triazine derivations substituted by substitutent groups containing nitrogen[J]. Acta Phys-Chim Sin, 2008, 24(4): 639-645. |
| [17] |
Huynh M H V, Hiskey M A, Pollard C J, et al. 4, 4′, 6, 6′-tetra-substituted hydrazo-and azo-1, 3, 5-triazines[J].
Journal of Energetic Materials, 2004, 22(4): 217-229. DOI:10.1080/07370650490893054 |
| [18] |
Gerlinde F, Monika R, Gunther S. Thermally induced formal[3+2] cycloadditions of 3, 3-dimethoxycyclopropene to triazines, a novel synthesis of pyrrolo [1, 2-d] [1, 2, 4] triazines[J].
Chemische Berichte, 1993, 126(10): 2317-2323. DOI:10.1002/(ISSN)1099-0682 |
| [19] |
Andrew C, Lawrence M. The nitration of 1, 3, 5-triazine with dinitrogen pentoxide[J].
Journal of Organic Chemistry, 2000, 65(15): 4743-4744. DOI:10.1021/jo000064s |
| [20] |
Shastin A V, Godovikova T I, Korsunskii B L. Nitro derivatives of 1, 3, 5-triazine: Synthesis and properties[J].
Russian Chemical Reviews, 2003, 72(3): 279-287. DOI:10.1070/RC2003v072n03ABEH000803 |
| [21] |
Gillan E G. Synthesis of nitrogen-rich carbon nitride networks from an energetic molecular azide precursor[J].
Chem Mater, 2000, 12(12): 3906-3912. DOI:10.1021/cm000570y |
| [22] |
周智明, 陈博仁. 几种有机叠氮化合物的合成及性能研究[J].
含能材料, 1996, 4(2): 49-56. ZHOU Zhi-ming, CHEN Bo-ren. Synthesis and properties of some organic azido compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 1996, 4(2): 49-56. |
| [23] |
Bestian H, Heyna J, Bauer A, et al. Reactions of ethylenimine[J].
Justus Liebigs Annalen der Chemie, 1950, 566: 210-244. DOI:10.1002/(ISSN)1099-0690 |
| [24] |
吕春绪. 耐热炸药分子结构分析与合成研究[J].
含能材料, 1993, 1(4): 13-18. Lü Chun-xu. Structure analysis of heat-resistant explosive molecule and its synthesis research[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 1993, 1(4): 13-18. |
| [25] |
王乃兴, 陈博仁, 欧育湘. 2, 4, 6-三亚胺基-N, N′, N″-三(2-硝基苯并氧化呋咱)-1, 3, 5-三嗪的合成[J].
应用化学, 1993, 10(1): 98-100. WANG Nai-xing, CHEN Bo-ren, OU Yu-xiang. Synthesis of 2, 4, 6-triimido-n, n′, n"-tri(2-nitro-benzofuroxan)-1, 3, 5-triazine[J]. Chinese Journal of Applied Chemistry, 1993, 10(1): 98-100. |
| [26] |
Hiskey M A, Johnson M C, Chavez D E. Preparation of 1-substituted-3, 3-dinitroazetidines[J].
Journal of Energetic Materials, 1999, 17(2): 233-252. |
| [27] |
王伯周, 汪营磊, 张志忠, 等. 4-氨基-3, 5-二硝基吡唑(LLM-116)缩合物的合成与表征[J].
含能材料, 2009, 17(3): 293-295. WANG Bo-zhou, WANG Ying-lei, ZHANG Zhi-zhong, et al. Synthesis and characterization of 4-Amino-3, 5-dinitropyrazole(LLM-116) condensation products[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(3): 293-295. |
| [28] |
Ovchinnikov I V, Kulikov A S, Epishina M A, et al. Synthesis of N-trinitroethyl derivatives of linear and heterocyclic nitrogen-containing compounds[J].
Russian Chemical Bulletin, 2005, 54(5): 1346-1349. DOI:10.1007/s11172-005-0408-z |
| [29] |
Shastin A V, Godovikova T I, Golova S P, et al. Synthesis of 2, 4, 6-Tris(trinitromethyl)-1, 3, 5-triazine[J].
Mendeleev Communications, 1995, 5(1): 17-18. DOI:10.1070/MC1995v005n01ABEH000440 |
| [30] |
Shastin A V, Godovikova T I, Korsunskii B L. Trisubstituted 1, 3, 5-triazines. 4. Synthesis of 2-nitroamino-4, 6-bis(trinitromethyl)-1, 3, 5-triazine. 4. Synthesis of 2-nitroamino-4, 6-bis(trinitromethyl)-1, 3, 5-triazine[J].
Chemistry of Heterocyclic Compounds, 1999, 35(1): 75-77. DOI:10.1007/BF02251666 |
| [31] |
Shastin A V, Godovikova T I, Korsunskii B L. Nucleophilic substitution reactions of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine. 3. reaction of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine with azides and hydrazine[J].
Chemistry of Heterocyclic Compounds, 2003, 39(3): 354-356. DOI:10.1023/A:1023970928207 |
| [32] |
Shastin A V, Godovikova T I, Golova S P, et al. Nucleophilic substitution reactions of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine. 2. interaction of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine with primary amines and hexamethyldisilazane[J].
Chemistry of Heterocyclic Compounds, 1995, 31(5): 601-609. DOI:10.1007/BF01166338 |
| [33] |
Shastin A V, Godovikova T I, Golova S P, et al. Nucleophilic substitution reactions of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine. 1. Interaction of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine with alcohols, diols, ammonia, and secondary amines[J].
Chemistry of Heterocyclic Compounds, 1995, 31(5): 596-600. DOI:10.1007/BF01166337 |
| [34] |
Gidaspov A A, Bakharev V V, Kukushkin I K. Trinitromethylation reactions of chloro-1, 3, 5-triazines[J].
Russian Chemical Bulletin, 2009, 58(10): 2154-2163. DOI:10.1007/s11172-009-0294-x |
| [35] |
Fedorov B S, Fadeev M A, Gidaspov A A, et al. Condensed tetrazolo-1, 3, 5-triazines. 1. synthesis of 5-polynitromethyltetrazolo[1, 5-a]-1, 3, 5-triazin-7-one salts[J].
Chemistry of Heterocyclic Compounds, 2005, 41(2): 228-234. DOI:10.1007/s10593-005-0132-5 |
| [36] |
Korkin A A, Bartlett R G. Theoretical prediction of 2, 4, 6-trinitro-1, 3, 5-triazine (TNTA). A new, powerful, high-energy density material[J].
Journal of the American Chemical Society, 1996, 118(48): 12244-12245. DOI:10.1021/ja962744b |
| [37] |
Coburn M D, Harris B W, Lee K Y, et al. Explosives synthesis at los alamos[J].
Industrial & Engineering Chemistry Product Research and Development, 1986, 25(1): 68-72. |
| [38] |
李小童, 庞思平, 于永忠, 等. 杂环化合物氮氧化反应研究的新进展[J].
有机化学, 2007, 27(9): 1050-1059. LI Xiao-tong, PANG Si-ping, YU Yong-zhong, et al. New advances in n-oxidation of nitrogen-containing heterocyclic compounds[J]. Chinese Journal of Organic Chemistry, 2007, 27(9): 1050-1059. |
| [39] |
Keshavarz M H, Esmailpoor K, Tehrani. M K. Theoretical prediction of physicochemical properties, performances and sensitivities of some new derivatives of dinitro triazolyl triazine[J].
Propellants Explosives Pyrotechnics, 2010, 35(5): 482-486. DOI:10.1002/prep.200900003 |
| [40] |
Lemi T, Taner A, Selcuk G, et al. A DFT study on nitrotriazines[J].
Journal of Hazardous Materials, 2009, 167: 440-448. DOI:10.1016/j.jhazmat.2008.12.134 |
| [41] |
Rusinov V L, Dragunova T V, Zyryanov V A, et al. Synthesis and conversions of 3-azido-5-amino-1, 2, 4-triazines[J].
Khimiya Geterotsiklicheskikh Soedinenii, 1984(4): 557-561. |
| [42] |
Mark M G, William W P. 3-Azido-1, 2, 4-triazine N-Oxides[J].
J. Heterocyclic Chem., 1977, 14: 1221-1223. DOI:10.1002/jhet.v14:7 |
| [43] |
Hiskey M A, Chavez D E, Bishop R L, et al. Use of 3′-diamino-4, 4′-azoxyfurazan and 3, 3′-diamino-4, 4′-azofurazan as insensitive high explosive: US, 6358339[P]. 2002.
|
| [44] |
李玉川. 富氮含能化合物的合成研究[D]. 北京: 北京理工大学, 2009.
|
| [45] |
Pagoria P F, Lee G S, Mitchell A R, et al. Synthesis of amino-and nitro-substituted heterocycles as insensitive energetic materials[J].
Insensitive Munitions&Energetic Materials Technology, 2001, 2: 655-661. |
| [46] |
QI Cai, ZHANG Ru-bo, ZHANG Xue-jiao, et al. Theoretical investigation of 4, 4′, 6, 6′-Tetra(azido)azo-1, 3, 5-triazine-N-oxides and the effects of N→O bond on organic azides[J].
Chemistry-An Asian Journal, 2011, 6(6): 1456-1462. DOI:10.1002/asia.v6.6 |
| [47] |
Oxley J C, Smith J L, Moran J S. Decomposition of azo-and hydrazo-linked bis triazines[J].
Journal of Energetic Materials, 2009, 27(2): 63-93. DOI:10.1080/07370650802405174 |
| [48] |
Miller D R, Swenson D C, Gillan E G. Synthesis and structure of 2, 5, 8-triazido-s-heptazine: An energetic and luminescent precursor to nitrogen-rich carbon nitrides[J].
Journal of the American Chemical Society, 2004, 126(17): 5372-5373. DOI:10.1021/ja048939y |
| [49] |
李玉川, 张雪娇, 付耿, 等. 4, 4′, 6, 6′-四叠氮基偶氮-1, 3, 5-三嗪(TAAT)的合成、表征与热分解研究[J].
有机化学, 2011, 31(9): 1484-1489. LI Yu-chuan, ZHANG Xue-jiao, FU Geng, et al. Synthesis, Characterization and thermal decomposition mechanism of 4, 4′, 6, 6′-tetra(azido)azo-1, 3, 5-triazine(TAAT)[J]. Chinese Journal of Organic Chemistry, 2011, 31(9): 1484-1489. |
The progesses in the synthesis, energetic properties and development of the triazines′ energetic materials were reviewed with 48 references.



