2. 中国工程物理研究院化工材料研究所, 四川 绵阳 621900
2. Institute of Chemical Materials, CAEP, Mianyang 621900, China
1, 3, 5, 7-四硝基-1, 3, 5, 7-四氮杂环辛烷(HMX)是目前实际应用中综合性能优越的高能炸药[1],近年来其应用研究仍然是火炸药领域的一个热点。目前世界各国制造HMX的方法是在制备RDX的贝克曼法的基础上发展而来的。迄今为止,贝克曼法仍是世界上工业化生产HMX的基本方法。但是,由于其收率低、成本高、污染大等问题,严重制约了其今后的发展[2],仍须进一步改进。
为了降低HMX的制造成本,研究者对制造HMX工艺的新途径进行了许多探索和研究[2-13],其中TAT法较贝克曼法更有发展前途,其优点主要是:原料易得;醋酐用量减少;收率较高;制造经济,便于生产;制造过程中污染物减少;纯度高达99%。20世纪70年代以来,针对TAT法制备HMX的硝化剂问题进行了较详细的研究[14],主要体系有:① HNO3/发烟H2SO4;② HNO3/H2SO4;③ HNO3/SO3-硝基甲烷;④硝酸盐/HNO3;⑤ HNO3/CF3SO3H;⑥ HNO3/P2O5;⑦ HNO3/(CF3CO)2O;⑧ N2O5/硝基甲烷;⑨ N2O5/HNO3;⑩ HNO3/多聚磷酸。经初步试验,用前两种硝化体系硝化TAT未得到HMX;用③-⑧的硝化体系收率低、成本较高;最后两种收率较高,以N2O5/HNO3和HNO3/多磷酸为硝化剂收率均大于80%。虽然对TAT的硝解工艺已有较多的专利和文献研究,但是对其硝解副产物和机理研究较少。因此,我们对N2O5/HNO3硝解TAT的副产物进行了柱分离,同时对其机理进行了分析。
2 实验部分 2.1 试剂与仪器HNO3、P2O5为化学纯,其它试剂为分析纯,N2O5自制。
WRS-1B数字熔点测定仪(上海精密科学仪器有限公司);高效液相色谱仪(Waters Alliance HPLC系统),C18柱,流动相乙腈和水(70: 30),流速为0.7 mL·min-1,波长230 nm;MB154S型红外光谱仪(加拿大Boman公司),KBr压片;500 MHz核磁共振仪(德国Bruker-Daltonik公司),内标为四甲基硅烷;Finnigan Trace TSQ高分辨质谱仪(美国ThemoElectron公司);VARIO EL Ⅲ元素分析仪(德国Elementar公司)。
2.2 实验过程 2.2.1 TAT的合成将14.0 g(0.1 mol)乌洛托品(HA)和6.2 g醋酸铵(0.081 mol)加到盛有7.0 mL水的50 mL烧瓶中,搅拌,保持温度为5~10 ℃。然后于60 min内向上述浆液中加入30.6 g醋酸酐(0.3 mol),保持温度在5~10 ℃,然后保温反应30 min,最后减压蒸馏除去大部分溶剂,冷冻析晶,过滤。晶体经沸腾丙酮重结晶,得到的3, 7-二乙酰基-1, 3, 5, 7-四氮杂双环[3.3.1]壬烷(DAPT)10.4 g,产率98.5%,熔点为190~192 ℃。
将200.0 mL的冰醋酸与58.0 g的醋酸酐(0.56 mol)加入到500 mL的反应器中,在搅拌下加入31.0 g的乙酸钠(0.38 mol)和20.0 g的DAPT(0.094 mol),保持反应温度为5~10 ℃。在30 min中内滴加15.0 g乙酰氯(0.19 mol),在5~10 ℃下反应1 h后,加入100.0 mL水,继续反应80 min,反应完之后用碳酸钠中和,然后用2.0 L的二氯甲烷萃取,无水硫酸钠干燥,之后减压蒸馏,得到的固体用丙酮重结晶,得到的1, 3, 5, 7-四乙酰基-1, 3, 5, 7-四氮杂环辛烷(TAT)为22.3 g,熔点155~157 ℃,产率为80%。
2.2.2 N2O5硝解TAT制备HMX工艺及副产物的分离 2.2.2.1 HMX的制备将一定浓度N2O5/HNO3溶液(2.3 g N2O5和21.9 g HNO3)倒入四口烧瓶中,剧烈搅拌,保持体系温度0 ℃,将2.0 g TAT分批加入上述体系中,控制温度0~5 ℃,加料结束升温到50 ℃反应一段时间。向反应液中滴加几滴水后升温到65 ℃氧化结晶15 min,再降温至40 ℃加入7.0 mL的水,搅拌,过滤,水洗得产品HMX,产率90%。
2.2.2.2 副产物的分离将2.2.2.1中50 ℃反应一段时间后的物料倒入含有33.0 g NaHCO3的冰水溶液中,搅拌中和后,用乙酸乙酯450.0 mL分3次萃取,合并有机层,用20.0 g无水Na2SO4干燥,于40 ℃减压蒸除溶剂(-0.095 MPa)得到白色固体样品。以二氯甲烷和乙腈混合液为洗脱剂,柱层析分离出副产物。
3 结果与讨论TAT硝解过程中硝解产物复杂,除了形成一硝基取代、二硝基取代、三硝基取代和四硝基取代(HMX)化合物外,二硝基取代还会有邻位和对位不同位置的取代,同时还会有开环反应形成直链化合物。硝解反应中的很多中间体和副产物是不稳定的,它们难以从反应体系中离析出来,有些没有紫外吸收,这直接影响柱层析分离时洗脱剂比例的选择以及分离的效果。最后,通过柱分离获得了两个组分,两组分的高效液相色谱(HPLC)谱图如图 1所示。采用元素分析、红外光谱、核磁共振对两个组分进行了表征,最后分别为1-乙酰基-3, 5, 7-三硝基-1, 3, 5, 7-四氮杂环辛烷(SEX)和1, 5-二乙酰基-3, 7-二硝基-1, 3, 5, 7-四氮杂环辛烷(DADN)。没有分离到一硝基化合物1, 3, 5-三乙酰基-7-硝基-1, 3, 5, 7-四氮杂环辛烷。
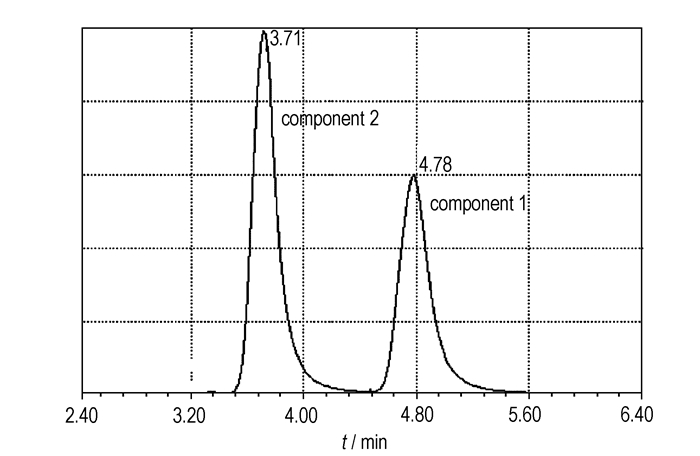
|
图 1 分离组分的HPLC谱图 Fig.1 HPLC spectrum of by-products achieved |
柱分离所得的组分1为白色固体,其1H NMR化学位移(见图 2)与文献[15]报道的1-乙酰基-3, 5, 7-三硝基-1, 3, 5, 7-四氮杂环辛烷(SEX)的1H NMR的化学位移(δ=5.98,δ=5.56,δ=2.24))相同,其中3.347是水的化学位移,2.505是氘代DMSO的化学位移(下同)。组分1熔点:237 ℃(文献[14]报道熔程:237~237.5 ℃)。FTIR(KBr, cm-1)(见图 3):3033,517,1255,937,759。元素分析(%),C6H11N7O7,计算值(实测值):C 24.57(24.60),H 3.78(3.73),N 33.44(33.43)。可以确定组分1是1-乙酰基-3, 5, 7-三硝基-1, 3, 5, 7-四氮杂环辛烷(SEX)。
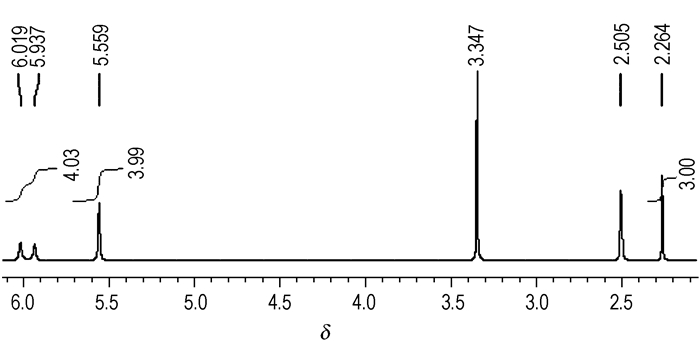
|
图 2 组分1的1H NMR谱图 Fig.2 1H NMR spectra of component 1 |
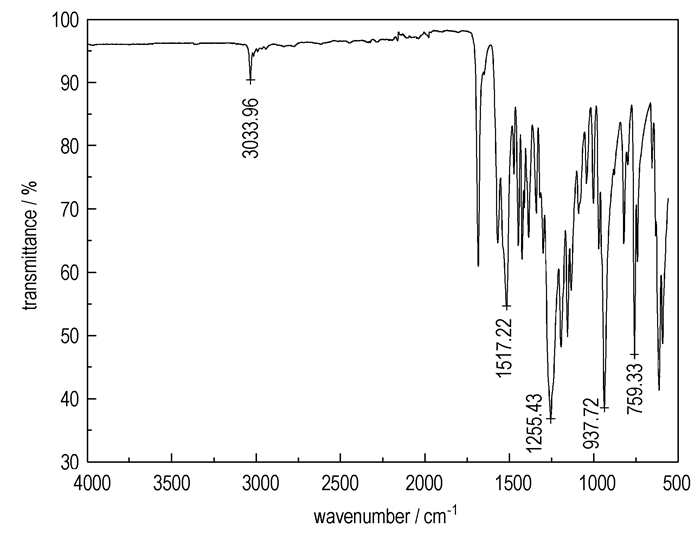
|
图 3 组分1的红外光谱图 Fig.3 FTIR spectra of component 1 |
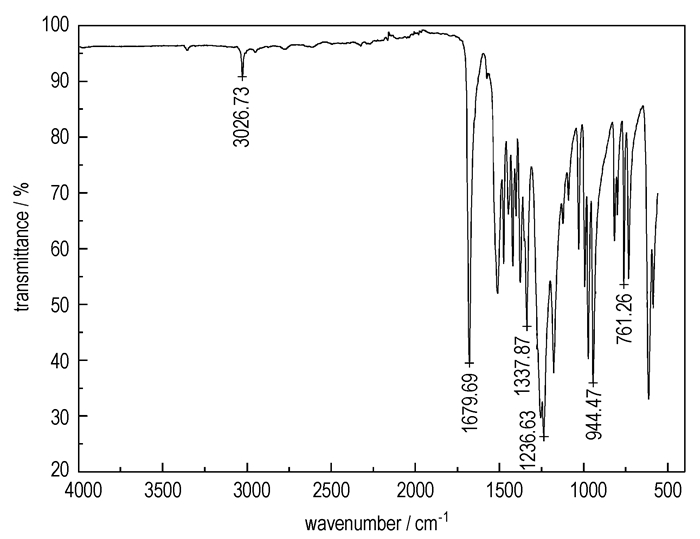
柱分离所得组分2的1H NMR化学位移(见图 4)与文献[11]报道的1, 5-二乙酰基-3, 7-二硝基-1, 3, 5, 7-四氮杂环辛烷(DADN)的1H NMR化学位移(δ=5.56,δ=2.3)相同。组分2熔点:264 ℃(文献[11]报道熔点:265 ℃)。FTIR(KBr, cm-1)(见图 5):3026,1679,1337,1236,944。元素分析(%),C8H14N6O6,计算值(实测值):C 23.10(23.18),H 4.86(4.90),N 28.96(28.93)。为了确认组分2为DADN而非其异构体1, 3-二乙酰基-5, 7-二硝基-1, 3, 5, 7-四氮杂环辛烷,同时按照文献[11]方法制得DADN标准品进行核磁检测,与组分2的图谱完全吻合,可以确定组分2为1, 5-二乙酰基-3, 7-二硝基-1, 3, 5, 7-四氮杂环辛烷(DADN)。
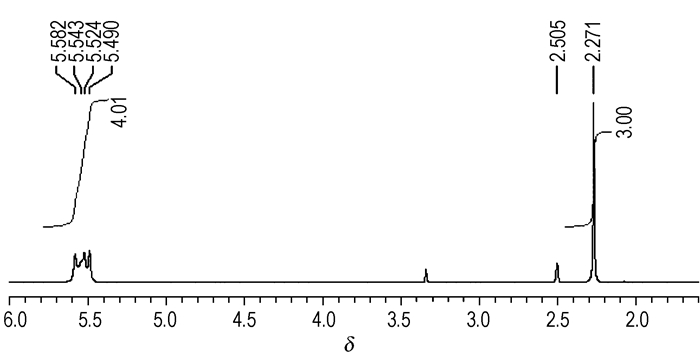
|
图 4 组分2的1HNMR谱图 Fig.4 1H NMR spectra of component 2 |
|
图 5 组分2的红外光谱图 Fig.5 FTIR spectra of component 2 |
传统硝化理论认为[16-17]胺(包括酰胺)的硝化条件取决于胺的碱性。胺的碱性越强,硝化所需要的酸的强度越低;胺的碱性越弱,硝化需要的酸的强度越高。通过酰胺制备炸药时需要在同一分子内硝化多个酰基,随着分子内硝基数目的增加,胺的碱性下降,需要酸性更强的酸。在很多情况下,最后一个酰基的硝解十分困难,不完全硝解的产物成为产品杂质的主要组成。在有些情况下,酰胺的硝解由于找不到酸性足够强的酸而得不到相应的硝胺。
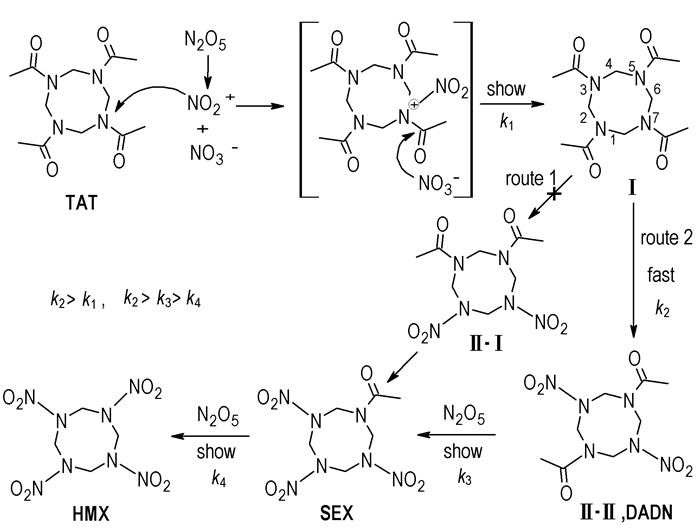
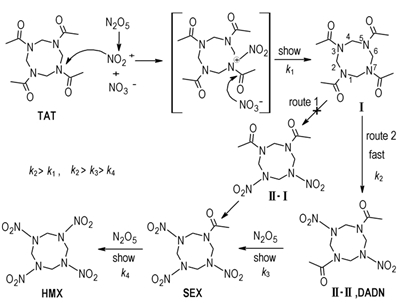
TAT的硝解就是一个例子,用硝酸直接硝解TAT得不到目标产物HMX。当使用强硝化剂N2O5硝解TAT时反应顺利进行,但是随着八元环上硝基逐渐增多,八元环上氮的碱性逐渐降低,向八元环上引入硝基变得困难,所以反应中N2O5必须过量,同时反应时间不能太短。反应开始时(见Scheme 1),硝酰阳离子进攻TAT上与乙酰基相连的N原子,乙酰基被取代后形成1, 3, 5-三乙酰基-7-硝基-1, 3, 5, 7-四氮杂环辛烷(化合物Ⅰ),化合物Ⅰ进一步硝化,这时会有两种不同的产物出现,当硝酰阳离子进攻化合物Ⅰ中1位或5位上的N原子时,形成化合物Ⅱ-Ⅰ(路线1);而当硝酰阳离子进攻化合物Ⅰ中3位上的N原子时,形成化合物Ⅱ-Ⅱ(DADN,路线2)。这两条路线都有可能,相比较而言,按照路线2的方式进行的可能性更大些,由于硝酰阳离子进攻中间体Ⅰ时,其中1, 5位的N原子的位置相同,该位置上的N原子距离7位上的硝基较近,硝基是强的吸电子基团,其对1, 5位上的N原子的影响较之对3位上的N原子的影响要大,1, 5位上氮原子上孤对电子云密度相应降低,而3位上的孤对电子云密度较高,3位上N原子有利于硝酰阳离子的亲电取代反应,所以,硝酰阳离子首先进攻化合物Ⅰ中3位上的氮原子形成对称结构的DADN,产物更稳定。不管是形成化合物Ⅱ-Ⅰ还是化合物DADN,进一步硝化后形成化合物Ⅲ(SEX),最后再硝化形成HMX。
|
Scheme1 Main nitrolysis mechanism of TAT |
实验中过柱分离得到的副产物只有DADN和SEX,而没有得到化合物Ⅱ-Ⅰ,进一步证实硝化反应是按照推测的路线2进行反应的。
在实验过程中还发现了一个有趣的现象,无论怎样调整反应条件(如缩短反应时间至5min或延长反应的时间至10 h)分离反应副产物,始终没有分离得到副产物Ⅰ。出现这种现象的原因可能是TAT非常对称,因此稳定性较高,第一步硝解反应不易进行,反应速率较慢,而一旦完成反应形成中间产物Ⅰ,对称性被破坏,第二步硝化从碱性相对更大的N-NO2键对位的N原子开始,生成较稳定的对称性DADN,反应速率较第一步硝解反应更大,即反应速率常数k2>k1;而DADN中引入了两个硝基后酰胺的碱性变弱了,DADN硝化形成SEX的反应较慢,形成SEX后引入了三个硝基后氮原子的碱性变得更弱了,因此,SEX硝解形成HMX的速率更慢,即反应速率常数k2>k3>k4,所以整体硝化TAT制备HMX的时间较长。控制反应速率的是第三步和第四步硝化。第二步反应速率太快,所以反应中无法分离得到一硝基化合物Ⅰ。
4 结论(1) N2O5硝解TAT过程中通过柱分离得到了的两个组分,通过红外、核磁、元素分析等检测手段确定两组分分别为1-乙酰基-3, 5, 7-三硝基-1, 3, 5, 7-四氮杂环辛烷和1, 5-二乙酰基-3, 7-二硝基-1, 3, 5, 7-四氮杂辛烷。
(2) N2O5硝解TAT制备HMX是一个选择性逐步降解的过程。反应分四步,TAT先迅速硝解形成一硝基化合物,再快速硝化形成DADN,DADN中酰胺碱性降低,反应慢慢硝化形成SEX,SEX再以更慢的速度硝化形成HMX,其中k2>k1,k2>k3>k4。
| [1] |
何志勇, 罗军, 吕春绪, 等. N2O5硝解DPT制备HMX[J].
火炸药学报, 2010, 33(2): 1-4. HE Zhi-yong, LUO Jun, Lü Chun-xu, et al. Synthesis of HMX from DPT by green nitrolysis with dinitrogen pentoxide[J]. Chinese Journal of Explosives & Propellants, 2010, 33(2): 1-4. |
| [2] |
HE Zhi-yong, LUO Jun, Lü Chun-xu, et al. Synthesis of HMX via nitrolysis of DPT catalyzed by acidic ionic liquids[J].
Central European Journal of Energetic Materials, 2011, 8(2): 83-91. |
| [3] |
Siele V I, Warman M, Leccacorvi J, Hutchinson R W, et al. Alternative Procedures for Preparing HMX[J].
Propellants, Explosives, Pyrotechnics, 1981, 6(3): 67-73. DOI:10.1002/(ISSN)1521-4087 |
| [4] |
Siele V I, Gilbet E E. Process for preparing 1, 3, 5, 7-tetranitro-1, 3, 5, 7-tetraazacyclooctane: US 3939 148[P]. 1976.
|
| [5] |
Succasunna W L, Saddlebrook S N, FairLawn J A. Improved process of producing HMX in 100% yield and purity: US 5124493[P]. 1992.
|
| [6] |
葛忠学, 李高明, 洪峰, 等. 绿色硝化技术合成HMX的小试工艺研究[J].
火炸药学报, 2002(1): 45-47. GE Zhong-xue, LI Gao-ming, HONG Feng, et al. Study on the Lab Synthesis of HMX using dinitrogen pentoxide as the Nitrating Agent[J]. Chinese Journal of Explosives & Propellants, 2002(1): 45-47. |
| [7] |
李全良, 陈军, 王建龙. DPT制备HMX工艺研究[J].
含能材料, 2007, 15(5): 509-510. LI Quan-liang, CHEN Jun, WANG Jian-long. Synthesis Craft of HMX from 1, 5-Methylene-3, 7-dintrio-1, 3, 5, 7-tetraazacyclooctane[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2007, 15(5): 509-510. |
| [8] |
李全良. 奥克托今的合成工艺研究[D]. 太原: 中北大学, 2007.
LI Quan-liang. Study on the technology of synthesis of HMX[D]. Taiyuan: North University of China, 2007. |
| [9] |
QIAN Hua, YE Zhi-wen, LU Chun-xu. Ultrasonially promoted nitrolysis of DAPT to HMX in ionic liquid[J].
Ultrasonics Sonochemistry, 2008, 15: 326-329. DOI:10.1016/j.ultsonch.2007.06.002 |
| [10] |
邱少君, 刘庆, 葛忠学, 等. DPT的硝化反应研究[C]//高性能含能材料合成机理研究论文集. 2008: 113-121.
QI Shao-jun, LIU Qing, GE Zhong-xue, et al. Nitration of DPT[C]//Study on the synthesis mechanism of high performance energetic materials. 2008: 113-121. |
| [11] |
钱华. 五氧化二氮在硝化反应中的应用[D]. 南京: 南京理工大学, 2008.
QIAN Hua. Researon the nitration by dinitrogen pentoxide[D]. Nanjing: Nanjing University of Science and Technology, 2008. |
| [12] |
ZHI Hui-zhen, LUO Jun, ZHANG Qiang, et al. An efficient method to synthesize HMX by nitrolysis of DPT with N2O5 and a novel ionic liquid[J].
Chinese Chemical Letters, 2009, 20(4): 379-381. DOI:10.1016/j.cclet.2008.12.040 |
| [13] |
钱华, 刘大斌, 吕春绪. 超声波促进DAPT一步法制备HMX[J].
火炸药学报, 2010, 33(6): 16-18. QIAN Hua, LIU Da-bin, Lü Chun-xu. Ultrasonically promoted one-step synthesis of HMX from DAPT[J]. Chinese Journal of Explosives & Propellants, 2010, 33(6): 16-18. |
| [14] |
曹欣茂, 李福平.
奥克托今高性能炸药及其应用[M]. 北京: 兵器工业出版社, 1993: 175-187.
CAO Xin-mao, LI Fu-ping. HMX high explosive and its application[M]. Beijing: Weapon Industry Press, 1993: 175-187. |
| [15] |
Irvine J S, Robert K M, Frank H J, et al. Proton Magnetic Resonance Data for Some Intermediates and Products of Nitrolysis of Hexamethylenetetramine[J].
Journal of Chemical and Engineering Data, 1973, 18(3): 335-337. DOI:10.1021/je60058a020 |
| [16] |
周发歧.
炸药合成化学[M]. 北京: 国防工业出版社, 1984: 256-257.
ZHOU Fa-qi. Explosives synthesis chemical[M]. Beijing: National Defence Industry Press, 1984: 256-257. |
| [17] |
吕春绪.
硝酰阳离子理论[M]. 北京: 兵器工业出版社, 2006: 3-5.
Lü Chun-xu. Nitronium Theory[M]. Beijng: Weapon Industry Press, 2006: 3-5. |
Two byproducts 1, 5-diacetyl-3, 7-dinitro-1, 3, 5, 7-tetrazacyclooctane(DADN) and 1-acetyl-3, 5, 7-trinitro-1, 3, 5, 7-tetrazacyclooctane(SEX) were obtained from the nitrolysis mixture of TAT in N2O5/HNO3 system to prepare HMX. The results indicate that TAT is nitrolyzed in succession to form HMX, and the order of the reaction rate is k2>k1, k2>k3>k4.




