二硝酰胺铵(ADN)是第三代含能材料的典型代表,作为高能氧化剂应用于固体推进剂时具有能量高、成气量大、无氯、特征信号低等特点,在常规武器装备中具有广泛的应用前景[1]。
ADN的合成路线较多[2-4],其中氨基磺酸法[5]是具有工业化前景的方法之一,该法首先采用氨基磺酸与氢氧化钾中和制备氨基磺酸钾,然后用硝酸/硫酸低温硝化、氨气中和、活性炭分离、浓缩得到ADN,目前该方法已达到公斤级规模。氨基磺酸法制备ADN工艺涉及到酸碱中和、硝化、胺化等三种不同类型的反应,且均为放热反应,尤其是在氨基磺酸钾低温硝化过程产生大量的热,如果热量无法及时移除,会使得硝化温度过高或氨基磺酸钾加料时间过长,由于硝化中间体二硝基氨基磺酸极不稳定,在较高温度下分解速度非常快,会导致收率大幅降低,继续放大存在较大难度。因此,ADN合成中的热效应已成为限制其由实验室制备向工业化制造发展的“瓶颈”。
热流法具有精度高、适应范围广等优点,已成为化学合成过程反应热测定的主流方法。Osato等[6]利用该方法测定了化学过程的反应热数据并用以指导工艺优化,吕家育等[7]通过测定反应热对工艺过程的热失控成因进行了理论分析。
本研究采用热流法首次测定了ADN合成过程中酸碱中和、硝硫混酸配制、低温硝化、胺化等4个工艺阶段的反应热释放速率及传热系数、比热容等热力学数据,初步分析了ADN合成过程的热危险性,为工程化设计提供理论依据。
2 实验部分 2.1 试剂与仪器反应热测定装置为瑞士METTLER-TOLEDO公司的全自动反应量热器RC1e,配有德国Julabo公司的FP52型低温循环器。
氨基磺酸,工业级;氢氧化钾,分析纯,成都科龙化工试剂厂;无水乙醇,分析纯,西安化学试剂厂;浓硫酸,分析纯,西安福晨化学试剂厂;浓硝酸,市售工业级;氨水,分析纯,四川西陇化工有限公司;冰块,自制。
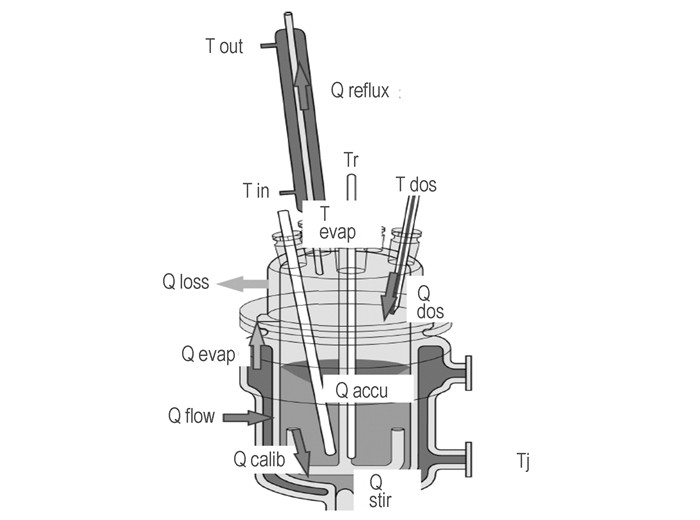
2.2 测定原理图 1表示反应釜的热量流动状况,依据能量衡算,反应釜遵循热流平衡:流入=累积+流出的热量
|
图 1 反应釜热流状况 Fig.1 The heat flow status of reactor |
| $ 即:{Q_{\rm{r}}} + {Q_{\rm{c}}} + {Q_{{\rm{stir}}}} = ({Q_{\rm{a}}} + {Q_{\rm{i}}}) + ({Q_{\rm{f}}} + {Q_{{\rm{dos}}}} + {Q_{{\rm{loss}}}} + \cdots ) $ | (1) |
式中,Qr为化学或物理反应热量产生的速率;Qc为校准功率(插入物料内的量热器在反应前后校准时放出的热量);Qstir为由搅拌桨带进的能量(在反应物质中产生的热);Qa为反应物质的储存热量(累积);Qi为通过插入件(温度传感器、pH传感器等)储存的热量;Qf为通过反应釜壁的热流;Qdos为加料带入的热量;Qloss为通过反应釜盖的热流(辐射或传导);Qreflux为在回流冷凝器中散发的热量;Qevap为蒸发的热量。
通过热流法测定上述各种类型的热量,可计算出反应放热速率Qr,通过下式积分,即可获得反应过程的总放热量。
| $ \Delta {H_{\rm{r}}} = \smallint {Q_r}{\rm{d}}t $ | (2) |
实验过程、物料配比按文献[5]的步骤进行,反应路线如下:
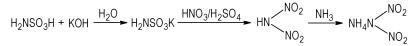
|
向2 L玻璃釜中加入500 mL水,温度控制为20 ℃,量热校准后加入500 g氨基磺酸,分批计量加入310 g氢氧化钾,将温度升高至60 ℃,保温1 h,再降温至20 ℃,量热校准后出料。
2.3.2 硝硫混酸配制过程热量测定向2 L玻璃釜中加入500 mL硝酸,温度控制为-20 ℃,量热校准后采用自动计量加料装置以10 g·min-1的速率加入312 g浓硫酸,量热校准。
2.3.3 二硝酰胺溶液制备过程热量测定将硝硫混酸温度控制为-35 ℃,量热校准后分批计量加入190 g氨基磺酸钾,再次量热校准后出料,料液放至2 kg碎冰中。
2.3.4 氨水中和过程热量测定向2 L玻璃釜中加入600 mL二硝酰胺溶液,控制温度在-10 ℃,量热校准,以10 g·min-1的速率加入氨水至反应液pH值≥8(由在线pH传感器连锁控制),量热校准后出料。
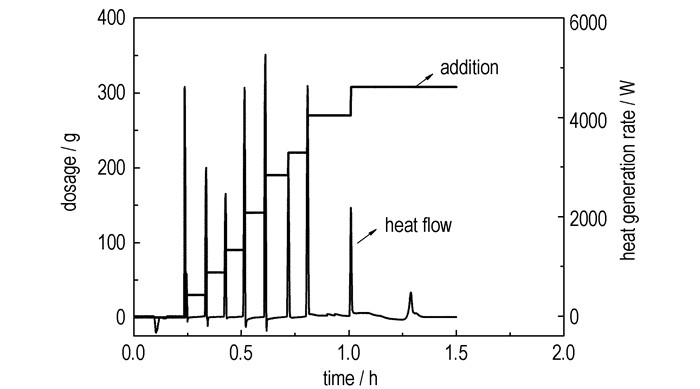
3 结果与讨论 3.1 氨基磺酸钾合成过程热效应分析氨基磺酸钾的合成是典型的酸碱中和反应,由图 2可以看出,该反应的热量释放完全受加料控制,即每批氢氧化钾加入后,热量瞬间释放,基本没有热量的累积效应。对于工业反应器来说,夹套、盘管的综合冷却能力必须能够满足出现最大放热速率Qrmax时的换热要求,本实验中,氨基磺酸共分8次加入,其中第五次加入量为50 g,此时出现最大放热速率为5199.7 W。
|
图 2 氨基磺酸钾合成过程反应热释放速率曲线 Fig.2 Heat flow curves of synthesis process of potassium amidosulfate |
表 1列出氨基磺酸钾合成过程的量热数据,传热系数代表着反应体系与外界热交换速率的大小,反应体系的传热系数为212.72 W/(K·m2),这是由物料流动状况、物性、外界条件共同决定的。
| 表 1 反应传热数据 Tab.1 Calorimetric data of synthesis process |
由表 1可知,反应总放热量为580 kJ,由图 2知该反应放热仅受加料控制,因此,在中试或以上规模试验中,若采取固体连续、自动进料方式,则放热速率恒定为1.17 kJ/g(即加入每克氨基磺酸放出的热量)。
绝热温升(ΔTad)表示冷却失效状况下反应理论上能够升高的温度,是反应过程安全评估必不可少的因素,ΔTad依据下式计算[7]:
| $ \Delta {T_{{\rm{ad}}}} = \frac{{\smallint {Q_{\rm{r}}}(t){\rm{d}}t}}{{{M_{\rm{r}}}{C_{{\rm{pr}}}}}} $ | (3) |
式中,Qr为放热速率,t为反应时间,Mr为反应物料总质量。由此计算得到加料完毕后反应体系的绝热温升为123.25 K。
氨基磺酸钾合成过程中放热速率极大,但反应的热危险性并不突出,原因是:①热量释放可由加料速率控制,且加料时间基本不对收率、纯度造成影响;②氨基磺酸钾相当稳定,不会出现分解等急剧放热的现象。
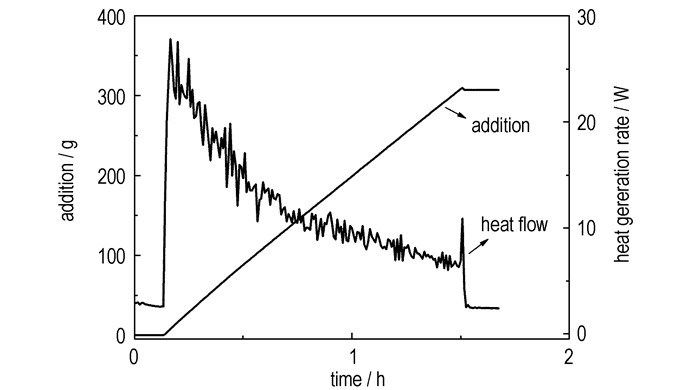
3.2 硝硫混酸配制过程热效应分析硝硫混酸是含能化合物合成中常见的硝化剂,硝酸与硫酸的混合过程中可产生NO2+,硝化介质中NO2+浓度的大小是硝化能力强弱的重要标志。由图 3可以看出随着硫酸的加入,体系放热速率曲线的斜率缓慢降低。硫酸初始滴加时,体系放热速率瞬间达到最大值27.77 W,平均放热速率为12.22 W。表 2为反应传热数据,由表 2可见,体系总放热量为43.07 kJ,单位质量反应体系放热量为0.04 kJ。
|
图 3 硝硫混酸配制过程热量释放速率曲线 Fig.3 Heat flow curve of process of nitric acid and sulfuric acid mixing |
| 表 2 硝硫混酸配制过程中反应传热数据 Tab.2 Calorimetric data of acid mixing process |
由(1)式计算,加料完毕后反应体系的绝热温升为19.40 K,即MSTR为0 ℃。由于硝硫混酸配制后硝化剂酸度降低,硝化能力逐渐减弱,原则上配制时间应尽量缩短。在本次热量测定中,硫酸滴加时间约为1.5 h,放热速率较低,如硫酸滴加时间控制在10 min,则总放热量不变,但最大放热速率将升高至250 W,此时平均放热速率为110 W,单位质量反应体系放热量将增大至0.36 kJ,因此,硝硫混酸的配制仍具有相当的热危险性,对系统冷却能力有较高要求。
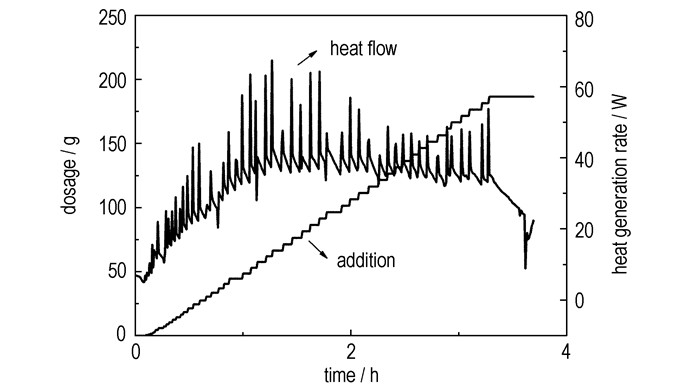
3.3 硝化过程热效应分析硝化反应是含能化合物合成中最常见的反应,也是放热量最为强烈的反应类型之一。在小试研究中发现,ADN合成中氨基磺酸钾的低温硝化放热量极大,如果热量无法及时移除,会使得硝化温度过高或氨基磺酸钾加料时间过长,由于硝化中间体二硝基氨基磺酸极不稳定,在较高温度下分解速度非常快,会导致收率大幅降低。图 4是硝化过程反应热释放速率曲线,由于固体加料方式为手动间歇加料,与硫酸滴加(自动连续计量加料)相比,加料曲线呈锯齿状。
|
图 4 硝化过程反应热释放速率曲线 Fig.4 Heat flow curve of nitration process |
由图 4可以看出,反应热释放属典型的加料控制型,原料氨基磺酸钾加入后,热量迅速释放完毕,加料操作开始1 h后,反应放热速率基线基本保持在40 W左右,硝化过程平均放热速率为33 W。
表 3为硝化反应传热数据。由于反应总放热量为207.11 kJ,根据(1)式,硝化反应体系的绝热温升为126.53 ℃,由于加料完毕后体系温度一般在-20~-10 ℃,故MSTR为106.53~116.53 ℃,由于中间体二硝酰胺在常温或高温时极不稳定,因此,反应放大后如冷却能力设计不足,很容易造成喷料等安全事故。
| 表 3 硝化过程中反应传热数据 Tab.3 Calorimetric data of nitration process |
由于该硝化过程热量释放受加料控制,对于此类反应,在规模化试验中一般采用如下措施防止热量的累积: ①减缓加料速度;②延长加料时间;③加限料阀。
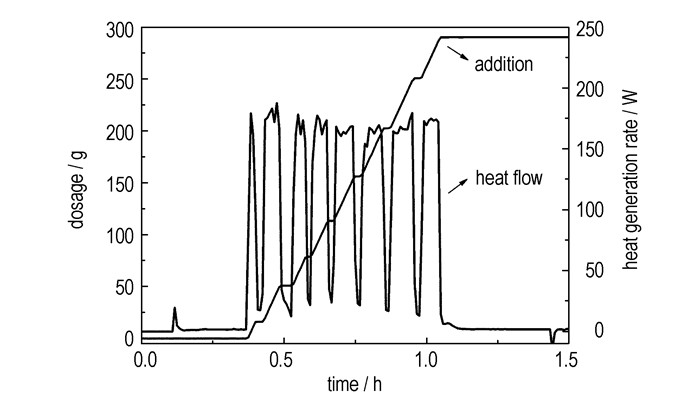
3.4 胺化过程热效应分析二硝基脲溶液的胺化过程属于酸碱中和类型,放热量极大。由图 5可以看出,氨水加入后,热量迅速释放,放热速率Qr呈直线上升,停止加入后,Qr很快趋近于零,最大放热速率基本保持在180 W左右,平均放热速率为125.41 W。由表 4可见,胺化体系总放热量为302.99 kJ,由(1)式计算,加料完毕后反应体系的绝热温升为91.48 K,即MSTR为81.48 ℃。
|
图 5 胺化过程反应热释放速率曲线 Fig.5 Heat flow curve of amination process |
| 表 4 反应传热数据 Tab.4 Calorimetric data of amination process |
胺化反应的目的是将溶液中和至碱性,反应体系的pH值是影响产品收率、纯度的重要指标,因此,加料速率可适当放缓,以降低可能存在的热危险性。
4 结论(1) 利用反应量热仪测定了ADN合成中酸碱中和、硝硫混酸配制、低温硝化、胺化等工艺阶段的反应热释放速率曲线及热传递系数、比热容等热力学数据,四个工艺阶段的放热量分别为580, 43.07, 207.11, 302.99 kJ,平均放热速率分别为188.44, 12.22, 33, 125.41 W。
(2) 对ADN合成中四个工艺阶段初步进行了热危险性分析,相应绝热温升分别为123.25, 19.40, 126.53, 91.48 K。
| [1] |
张志忠, 姬月萍, 王伯周, 等. 二硝酰胺铵在火炸药中的应用[J].
火炸药学报, 2004, 27(3): 36-41. ZHANG Zhi-zhong, JI Yue-ping, WANG Bo-zhou, et al. Application of ammunium dinitramide in propellants and explosives[J]. Chinese Journal of Explosives & Propellants, 2004, 27(3): 36-41. |
| [2] |
王伯周, 张志忠, 朱春华, 等. ADN的合成及性能研究(Ⅰ)[J].
含能材料, 1999, 7(4): 145-148. WANG Bo-zhou, ZHANG Zhi-zhong, ZHU Chun-hua, et al. Studies on synthesis and properties of ADN(Ⅰ)[J]. Chinese Journal of energetic Materials (Hanneng Cailiao), 1999, 7(4): 145-148. |
| [3] |
张志忠, 王伯周, 朱春华, 等. ADN的合成研究(Ⅱ)[J].
含能材料, 2001, 9(3): 97-99. ZHANG Zhi-zhong, WANG Bo-zhou, ZHU Chun-hua, et al. Studies on synthesis and properties of ADN(Ⅱ)[J]. Chinese Journal of energetic Materials(Hanneng Cailiao), 2001, 9(3): 97-99. |
| [4] |
王伯周, 刘愆, 张志忠, 等. 氨基甲酸乙酯法合成ADN[J].
火炸药学报, 2005, 28(3): 49-51. WANG Bo-zhou, LIU Qian, ZHANG Zhi-zhong, et al. Synthesis of ammonium dinitramide from ethyl carbamate[J]. Chinese Journal of Explosive & Propellants, 2005, 28(3): 49-51. |
| [5] |
刘愆, 王伯周, 张海昊, 等. ADN无机法合成及分离纯化研究[J].
含能材料, 2006, 14(5): 358-360. LIU Qian, WANG Bo-zhou, ZHANG Hai-hao, et al. Inorganic synthesis of ADN and its separation and purification[J]. Chinese Journal of energetic Materials(Hanneng Cailiao), 2006, 14(5): 358-360. |
| [6] |
Osato H, Kabaki M, Shimizu S. Development of safe, scalable nitric acid oxidation using a catalytic amount of NaNO2 for 3-Bromo-2, 2-bis(bromomethyl)propanoic acid : an intermediate of s-013420[J].
Organic Process Research and Development, 2011, 15(3): 581-584. DOI:10.1021/op1003133 |
| [7] |
吕家育, 陈网桦, 陈利平. 某恒温间歇反应的热失控研究[J].
中国安全科学学报, 2011, 21(4): 121-127. LV Jia-yu, CHEN Wang-hua, CHEN Li-ping. Research on thermal runaway of certain isoperibolic reaction in batch reactor[J]. China Safety Science Journal, 2011, 21(4): 121-127. |
The heat release law of the synthesis process of ADN was determined by using reaction calorimeter RC1e. The technical process comprises four stages: neutralization, mixing of nitric acid and sulfuric acid, nitration under lower temperature, amination.



