2. 安徽理工大学化工学院, 安徽 淮南 232001
2. School of Chemical Engineering, Anhui University of Science and Technology, Huainan 232001, China
黑火药是军工和民用爆破领域常用的一种点火药剂,即使是在21世纪的今天,黑火药也以其特有的性能在民用爆破和军用枪械点火方面有着广泛的应用。但是,黑火药燃烧后残渣中可溶性硫酸盐对武器系统造成的腐蚀以及气相产物中硫氧化物对周围环境的污染,越来越引起人们的重视。在对药剂密度要求不高的点火系统中,使用C/KNO3型无硫点火药,可以避免使用黑火药点火带来的腐蚀污染等问题。一直以来,国内外研究学者都非常注重有关黑火药燃烧、爆炸性能的理论探讨,无硫点火药的探索也是黑火药替代物研究的一个重要方向[1-3]。
一些资料中对颇具代表性的含能材料如RDX做了很多研究[4-6],但是,对混合含能材料的研究还很不全面。本研究用石墨取代木炭与硝酸钾组成二元黑火药,结合同步TG-DSC联用技术,以及多元非线性拟合技术,对石墨-硝酸钾在不同条件下的热分解及热分析动力学过程进行研究,确定其遵循的机理函数f(α),并求出活化能E和指前因子A,为二元黑火药的研究提供一些科学依据。
2 实验 2.1 样品与试剂实验中采用德国耐驰公司STA449CTG-DSC同步分析仪。石墨/硝酸钾取质量比见表 1。石墨(Graphite powder)灰黑色带有金属光泽的粉剂,化学纯(CP),含量≥99.85%,灼烧残渣≤0.15%,颗粒度≤30 μm,熔点在300 ℃以上。硝酸钾为无色透明结晶,分析纯(AR),熔点334 ℃。配制药剂时把所使用的KNO3用陶瓷球磨机研磨,过220目筛,取筛下物与石墨充分混合,混合均匀后把药剂在一定压力下压制成药柱切割成片状待用。
| 表 1 C/KNO3配比 Tab.1 C/KNO3 Sample with different proportions |
TG-DSC实验时,环境气体为N2气,进气速率为20 mL/min,试样容器为三氧化二铝坩埚,参比物为三氧化二铝,升温速率为20 K·min-1。实验时样品1#温度范围控制在30~1200 ℃,其它样品温度范围都控制在30~1000 ℃。
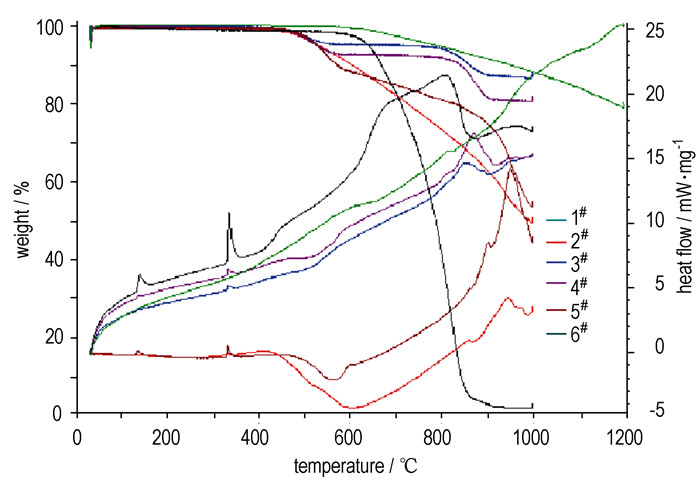
3 结果与讨论 3.1 不同配方对DSC特征量的影响图 1为C/KNO3各样品在升温速率为20 K·min-1时TG-DSC曲线。
|
图 1 在20 K·min-1时C/KNO3的TG-DSC曲线 Fig.1 TG-DSC curves of C/KNO3 at 20 K·min-1 |
由图 1可见,1#为纯石墨样品,温度升至1200 ℃一直处于吸热过程,失重很少,质量没有大的变化;6#为纯硝酸钾样品,在30~1000 ℃的升温过程中完全分解,在132.11 ℃的吸热峰是硝酸钾的相变峰,333.406 ℃开始的吸热峰是硝酸钾的熔化峰;2#~5#样品除了有上述的共同特征峰外,在600~1000 ℃的范围内还存在一个反应峰。可以判断在未达到石墨的熔化温度时反应开始,二者发生的是固相反应。反应条件不同,生成物和效应不同。
一般认为, 硝酸钾与石墨反应主要存在以下几种反应类型[7]:
Ⅰ: 2KNO3=K2O+2.5O2↑+N2↑
Ⅱ: 2KNO3+C=2KNO2+CO2↑
Ⅲ: 2KNO3+2.5C=K2O+N2↑+CO2↑
Ⅳ: 2KNO3 +1.75C =KNO2 +0.5K2O +0.5N2↑ +1.75CO2↑
这些反应都是基于热化学反应的角度,反应复杂。对石墨硝酸钾反应各阶段产物进行测定,发现在反应过程中以上几种情况都存在[8],没有很严格的区分界限,只是在特定条件下有主反应和副反应之分。
表 2是升温速率为20 K·min-1时不同C/KNO3样品在400~1000 ℃时的DSC特征量。从中看出,反应的起始温度和终止温度在发生波动,反应的峰值温度逐渐升高,随着硝酸钾含量的增加,反应的放热有增加的趋势。这是由于硝酸钾含量增加,使得石墨周围硝酸钾密度加大,反应时石墨与硝酸钾的接触面积增加,硝酸钾的介入,使石墨特殊的结构出现晶格松弛,导致了更多的晶体缺陷,打破了石墨固有的平衡和结构力学模式,使其参加反应的条件降低。
| 表 2 C/KNO3药剂20 K·min-1时DSC特征量 Tab.2 DSC data of C/KNO3 at 20 K·min-1 |
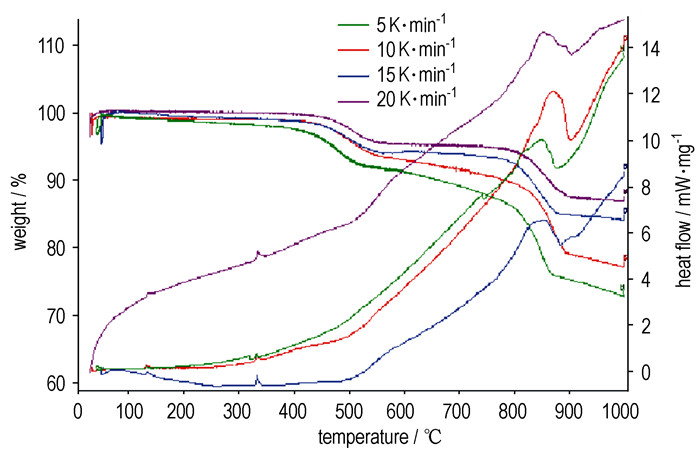
取3#样品做不同升温速率时的TG-DSC实验,结果如图 2所示。表 3为3#样品不同升温速率下的DSC特征量。从图 2可以看出,随着升温速率的增加,谱线上的特征峰仍然相对应。同一种药剂升温速率不同TG-DSC曲线存在着很大差异,尽管起始温度、峰温、终止温度都较接近,但是反应热区别很大。在升温速率为10 K·min-1时反应热最大。
|
图 2 3#号样品在不同升温速率下的TG-DSC曲线 Fig.2 TG-DSC curves of 3# sample at different heating rates |
| 表 3 3#号样品在不同升温速率下的DSC特征量 Tab.3 DSC data of sample 3# at different heating rates |
在以上实验基础上,采用无模式Friedman法对3#样品反应的活化能进行求算[9]。Friedman方程为:
| $ \ln \left[{\frac{{\beta {\rm{d}}\alpha }}{{{\rm{d}}T}}} \right] = \ln Af\left( \alpha \right) -\frac{E}{{RT}} $ |
式中, α为转化率,A为指前因子,β为升温速率,T为温度,f(α)为反应机理函数,R为气体常数。
在DSC曲线中纵坐标为dQ/dt,即反应的吸热或放热率。对一恒定加热速率的DSC曲线,某一温度时的反应转化率α可由反应开始的温度到结束温度的DSC曲线下面的面积和反应峰的总面积之商求得(基线延长线以上面积),而dα/dt可以由dQ/dt除以反应峰总面积获得。以
|
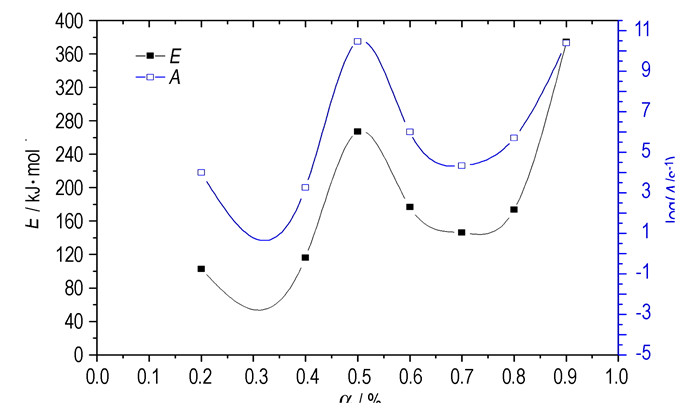
图 3 3#样品的E和A与α的关系曲线 Fig.3 E and A values vs extent of conversion (α) curves for sample 3# |
| 表 4 为不同转化率时3#样品的活化能和指前因子 Tab.4 The apparent activation energy (E) and pre-exponential factor (A) of sample 3# at different extents of conversion (α) |
从图 3可以看出,硝酸钾与石墨的反应不同于一般材料反应的规律,图线出现了几次起伏。在转化率不断升高的过程中,反应的活化能E和指前因子A发生了几次大的变化,在温度不断升高的过程中受到了多个反应的控制,可以断定在整个过程中至少存在三个以上的反应,这与实际反应结果相符。
4 结论硝酸钾与石墨反应的TG-DSC测试发现,在同一升温速率下药剂配方不同,热分解特性也表现出了很大的不同。通过C/KNO3=90/10样品考察同一配比不同升温速率的热分解反应发现,升温速率为10 K·min-1时反应热最大,采用无模式Friedman法对C/KNO3=90/10样品的热分解过程进行动力学参数的计算,从谱图中E、A与的关系曲线看出硝酸钾与石墨的分解过程非常复杂。谱图所表现的复杂性与实际硝酸钾与石墨化学反应的复杂性对应,研究表明硝酸钾与石墨至少存在三个以上的反应,其中主反应的活化能在102.84~374.27 kJ·mol-1之间,指前因子大约在3.25~10.39 s-1之间。
| [1] |
Hussain G, Rees G J. Combustion of black powder[J].
Propellant, Explosives, Pyrotechnics, 1992, 17: 1-4. DOI:10.1002/(ISSN)1521-4087 |
| [2] |
崔庆忠, 焦清介. 二元无硫黑火药研究[J].
北京理工大学学报, 2004, 11. 24(11): 12-15. CUI Qing-zhong, JIAO Qing-jie. Study on Sulfur-Free black power of two ingredients compositions[J]. Transaction of Beijing Institute of Technology, 2004, 11. 24(11): 12-15. |
| [3] |
崔庆忠. 硝酸钾/类木炭体系烟火药若干问题研究[D]. 博士学位论文. 北京: 北京理工大学, 2006.
CUI Qing-zhong. Study on Potassium Nitrate/analogous Charcoal Type Pyrotechnic[D]. Doctoral Dissertation. Beijing: Beijing Institute of Technology, 2006. |
| [4] |
汤崭, 任雁, 杨利, 等. 一种判定RDX热分解机理函数与热安定性的方法[J].
火炸药学报, 2011, 34(1): 19-24. TANG Zhan, REN Yan, YANG Li, et al. A new way to estimate the thermal decomposition mechanism function and thermal safety RDX[J]. Chinese Journal of Explosive & Propellants., 2011, 34(1): 19-24. |
| [5] |
杨威, 姬月萍, 汪伟, 等. 1-甲基-2, 4-二硝基咪唑的合成及反应动力学[J].
火炸药学报, 2010, 6. 33(3): 63-68. YANG Wei, JI Yue-ping, WANG Wei, et al. Synthesis and kinetics of 1-methyI-2, 4-dinitroimidazole[J]. Chinese Journal of Explosive & Propellants., 2010, 6. 33(3): 63-68. |
| [6] |
PCT/US98/03810. Method for manufacture of black powder and black powder substitute[S].
|
| [7] |
无机化学[M]. 北京: 高等教育出版社, 2001: 396-400.
Inorganic Chemistry[M]. Beijing: Higher Education Press, 2001: 396-400. |
| [8] |
高东升. 激光与含能材料作用机理研究[D]. 南京: 南京理工大学. 2006.
GAO Dong-sheng. The Research of Interaction Mechanism between Laser and Energetic Materials[D]. Nanjing: Nanjing University of Science and Technology, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10288-2004108609.htm |
| [9] |
Friedman Henry L. Kinetics of thermal degradation of char-forming plastics from thermogravimetry. Application to a phenolic plastic[J].
Journal of Polymer Science Part C: Polymer Symposia, 1954, 6(1): 183-195. |
C/KNO3 decomposition process is complex with three or more reaction.




