N, N-二甲基-2-叠氮乙胺(DMAZ)是一种新型液体火箭燃料,其许多物理性质与一甲肼(MMH)接近[1],但毒性比肼类燃料低,且无致癌性,因此被认为是一种可替代肼类燃料的绿色推进剂[1-6]。
文献[7]总结了六种合成DMAZ的工艺路线,分别为氯乙胺盐酸盐工艺、氯乙胺工艺、叠氮氯乙胺工艺、对甲基苯磺酰叠氮乙基酯工艺、1, 2-二叠氮乙烷工艺和叠氮乙基邻苯二甲酰胺工艺等。美军用的DMAZ由位于明尼苏达州圣保罗的3M公司生产,但合成工艺尚未公开。近年来,黎明化工研究院对DMAZ的合成开展了较多的研究工作[7-8],但迄今为止有关DMAZ合成反应动力学方面的工作尚未见文献报道。
研究DMAZ合成反应动力学,有助于把握影响反应速率的各种因素,从而有助于优化反应条件,提高DMAZ的合成效率。相对于其它合成工艺而言,氯乙胺盐酸盐工艺由于采用水为反应介质,因此具有绿色、环保、产物纯度高等优点。本研究采用紫外吸收光谱技术,测定了水介质中N, N-二甲基-2-氯乙胺盐酸盐(DMCH)与叠氮化钠(NaN3)反应的动力学参数,该反应是氯乙胺盐酸盐工艺合成DMAZ的关键步骤(Scheme 1)。
|
Scheme 1 Synthesis route of DMAZ |
仪器:Shimadzu UV-2450紫外可见分光光度计,DF-101S智能集热式恒温加热磁力搅拌器。
试剂:N, N-二甲基-2-氯乙胺盐酸盐(DMCH,99%,自制); 叠氮化钠(工业级,浙江省东阳市天宇化工有限公司); 去离子水。
2.2 实验过程在配有温度计、磁力搅拌器的250 mL三口玻璃烧瓶中,加入4 mol·L-1 DMCH水溶液50 mL,升温至反应温度(337.15 K、347.15 K和357.15 K),快速加入已恒温的4 mol·L-1叠氮化钠水溶液50 mL后开始计时,每隔一定时间(0.5~1 h),用移液管准确移取1 mL反应液置于50 mL容量瓶中,用去离子水定容,然后用紫外可见分光光度计在250~350 nm波长范围内进行扫描(去离子水做参比),从紫外吸收谱图上求得最大吸收所对应的吸光度。
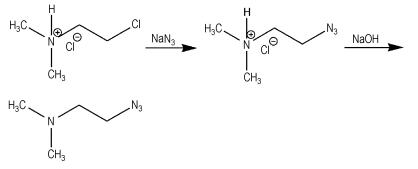
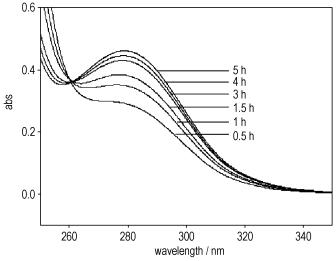
3 结果与讨论 3.1 分析方法的建立为了研究N, N-二甲基-2-氯乙胺盐酸盐(DMCH)与叠氮化钠(NaN3)反应的动力学,需知道不同反应时刻各组分的浓度。实验发现,产物N, N-二甲基-2-叠氮乙胺盐酸盐(DMAZ·HCl)在λ=280 nm处有最大吸收,而DMCH和NaN3均无吸收(图 1),因此通过测量反应体系在λ=280 nm处的吸光度,再根据工作曲线(DMAZ·HCl浓度与吸光度之间的关系曲线),即可得到不同反应时刻DMAZ·HCl的浓度,从而可以获得反应动力学参数。
|
图 1 反应物和产物的紫外吸收谱图 Fig.1 UV absorbance spectra for reactants and products |
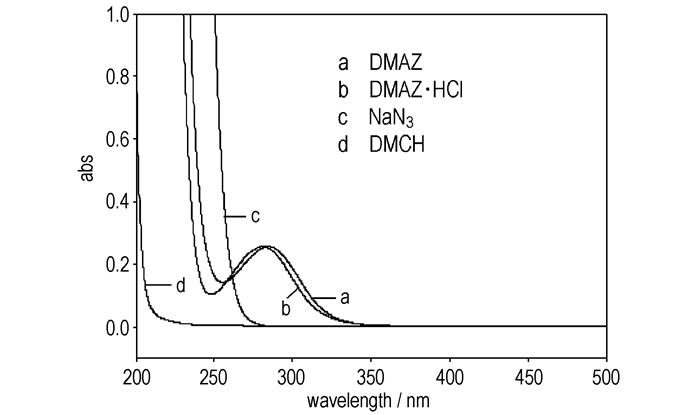
配制一系列已知浓度的DMAZ·HCl水溶液,用紫外可见分光光度计测得各溶液在λ=280 nm处的吸光度,得浓度-吸光度工作曲线(图 2):A=0.1831c,式中,A为吸光度,c为DMAZ·HCl水溶液的浓度,相关系数R2=0.9999,可见DMAZ·HCl浓度与吸光度之间存在很好的线性关系。
|
图 2 水介质中DMAZ·HCl浓度与吸光度的关系 Fig.2 UV absorbance-concentration curve for DMAZ·HCl aqueous solution |
假设DMCH与NaN3反应为二级反应,则
| $ \frac{{{\rm{d}}x}}{{{\rm{d}}t}} = {k_2}\left( {{c_{A, 0}}-x} \right)\left( {{c_{B, 0}}-x} \right) $ | (1) |
其中,cA, 0和cB, 0分别为DMCH和NaN3的初始浓度,x为反应t时间后产物的浓度,k2为反应速率常数。
(1) 当cA, 0=cB, 0时,
| $ \frac{{{\rm{d}}x}}{{{\rm{d}}t}} = {k_2}{\left( {{c_{A, 0}}-x} \right)^2} $ | (2) |
作不定积分,得
| $ \frac{1}{{{c_{A, 0}}-x}} = {k_2}t + C $ | (3) |
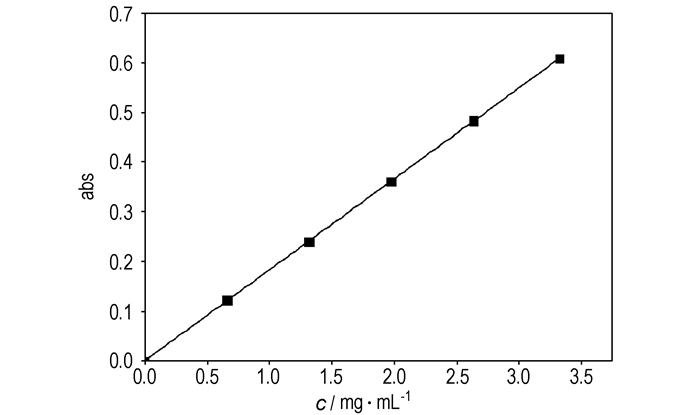
由图 3可知,
|
图 3 337.15 K时(cA, 0-x)-1-t曲线(cA, 0=cB, 0) Fig.3 (cA, 0-x)-1-t curve at 337.15 K(cA, 0=cB, 0) |
(2) 当cA, 0≠cB, 0时,
| $ \frac{{{\rm{d}}x}}{{{\rm{d}}t}} = {k_2}\left( {{c_{A, 0}}-x} \right)\left( {{c_{B, 0}}-x} \right) $ | (4) |
作不定积分,得
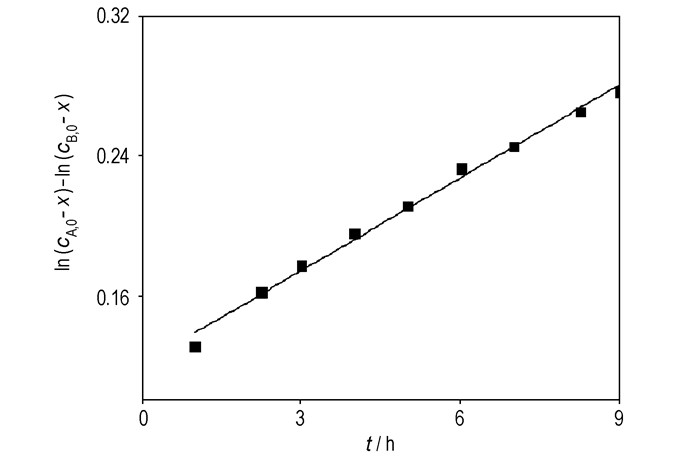
| $ \frac{1}{{{c_{A, 0}}-{c_{B, 0}}}}\ln \left( {\frac{{{c_{A, 0}}-x}}{{{c_{B, 0}}-x}}} \right) = {k_2}t + C $ | (5) |
由图 4可知,
|
图 4 337.15 K时ln{(cA, 0-x)/(cB, 0-x)}-t曲线(cA, 0≠cB, 0) Fig.4 ln{(cA, 0-x)/(cB, 0-x)}-t curve at 337.15 K(cA, 0≠cB, 0) |
根据Arrhenius方程可知:
| $ k = {k_0}\exp \left( {-\frac{{{E_{\rm{a}}}}}{{RT}}} \right) $ | (6) |
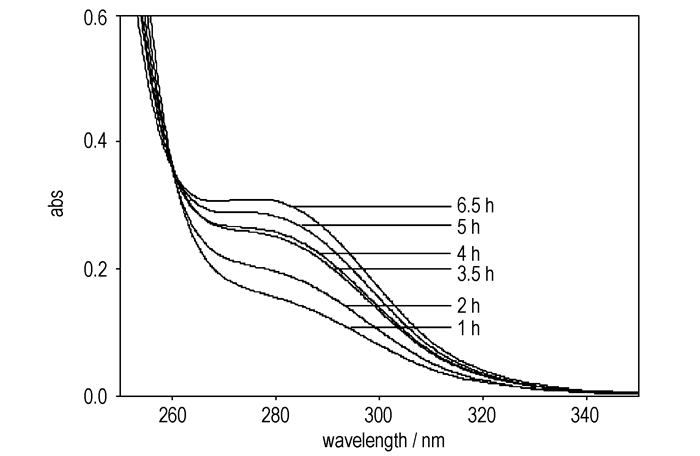
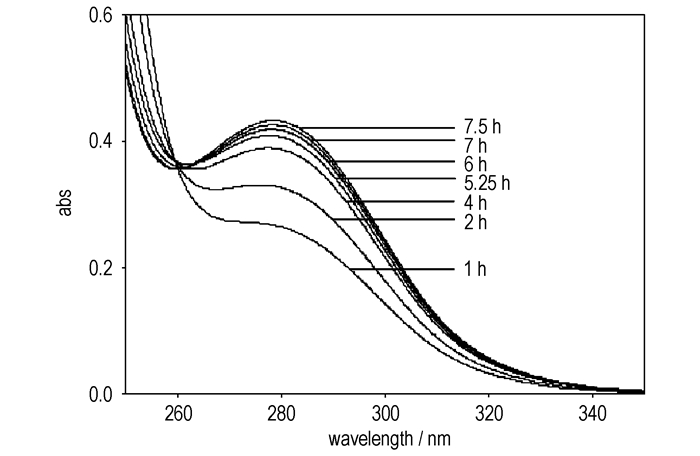
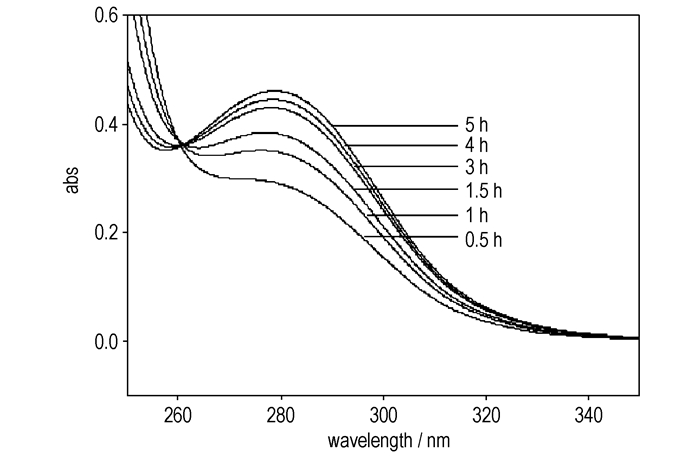
为了求反应表观活化能Ea,需知道若干温度下的反应速率常数。图 5~图 7给出了337.15, 347.15, 357.15 K时反应体系在不同时刻的紫外吸收谱图。
|
图 5 337.15 K时反应体系在不同时刻的紫外吸收谱图(cA, 0=cB, 0=2 mol·L-1) Fig.5 UV absorbance spectra as a function of reaction time at 337.15 K (cA, 0=cB, 0=2 mol·L-1) |
|
图 6 347.15 K时反应体系在不同时刻的紫外吸收谱图(cA, 0=cB, 0=2 mol·L-1) Fig.6 UV absorbance spectra as a function of reaction time at 347.15 K (cA, 0=cB, 0=2 mol·L-1) |
|
图 7 357.15 K时反应体系在不同时刻的紫外吸收谱图(cA, 0=cB, 0=2 mol·L-1) Fig.7 UV absorbance spectra as a function of reaction time at 357.15 K (cA, 0=cB, 0=2 mol·L-1) |
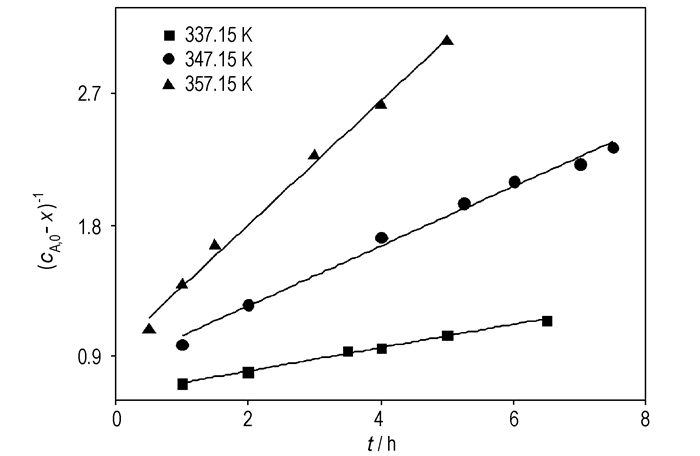
根据图 5~图 7所示结果,得到三个温度下
|
图 8 不同温度下的(cA, 0-x)-1-t曲线(cA, 0=cB, 0=2 mol·L-1) Fig.8 (cA, 0-x)-1-t curves at different temperatures(cA, 0=cB, 0=2 mol·L-1) |
| 表 1 不同温度下的表观反应速率常数 Tab.1 Apparent rate constants at different temperatures |
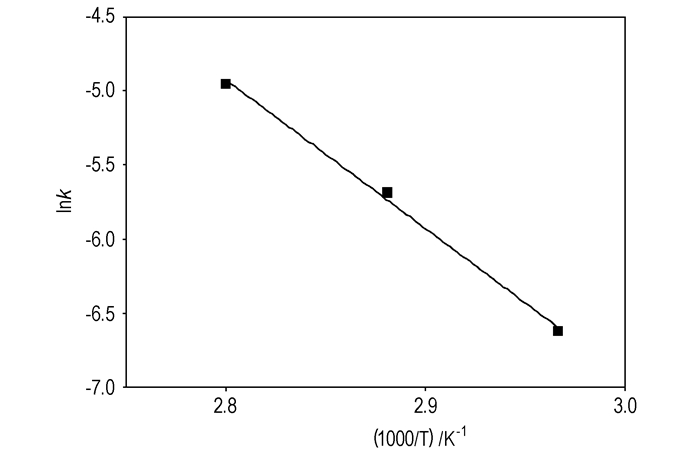
以lnk对1/T作图(图 9),得一直线,相关系数R2=0.9944。根据直线斜率和截距分别求得表观活化能(Ea)和指前因子(k0):Ea=83.5 kJ·mol-1,k0=1.19×1010 L ·mol-1·min-1。
|
图 9 lnk与1/T的关系 Fig.9 Relationship between lnk and 1/T |
采用紫外吸收光谱技术测定了水介质中N, N-二甲基-2-氯乙胺盐酸盐与叠氮化钠反应的动力学参数。结果表明,该反应为二级反应,337.15, 347.15, 357.15 K时的表观反应速率常数分别为1.337×10-3, 3.403×10-3, 7.082×10-3 L·mol-1·min-1,表观活化能Ea为83.5 kJ·mol-1,指前因子k0为1.19×1010 L·mol-1·min-1。
| [1] |
Mellor B. A preliminary technical review of DMAZ: A low-toxicity hypergolic fuel[C]//Proc. 2nd Int. Conference on Green Propellants for Space Propulsion. Cagliari, Sardinia, ESA SP-557, 2004.
http://adsabs.harvard.edu/abs/2004ESASP.557E..22M |
| [2] |
Thompson D M. Tertiary amine azides in hypergolic liquid or gel fuels propellant system: US 6013143[P], 2000.
|
| [3] |
Thompson D M. Amine azides used as monopropellants: US 6210504[P], 2001.
|
| [4] |
Thompson D M. Tertiary amine azides in liquid or gel fuels in gas generator system: US 6299654[P], 2001.
|
| [5] |
Mellor B, Ford M. Investigation of ignition delay with DMAZ fuel and MON oxidizer[R]. AIAA 2006-5215, 2006.
|
| [6] |
王建伟, 王文浩, 常伟林, 等. 液体叠氮燃料应用研究进展[J].
化学推进剂与高分子材料, 2010, 8(4): 1-7. WANG Jian-wei, WANG Wen-hao, CHANG Wei-lin, et al. Research progress on application of liquid azido fuel[J]. Chemical Propellants & Polymeric Materials, 2010, 8(4): 1-7. |
| [7] |
王建伟, 常伟林, 池俊杰, 等. 叠氮胺类燃料合成研究进展[J].
化学推进剂与高分子材料, 2011, 9(3): 1-4. WANG Jian-wei, CHANG Wei-lin, CHI Jun-jie, et al. Research progress on synthesis of liquid azido fuel[J]. Chemical Propellants & Polymeric Materials, 2011, 9(3): 1-4. |
| [8] |
池俊杰, 王建伟, 王文浩, 等. N, N-二甲基叠氮乙基胺合成研究[J].
化学推进剂与高分子材料, 2010, 8(4): 39-41. CHI Jun-jie, WANG Jian-wei, WANG Wen-hao, et al. Study on synthesis of 2-azido-N, N-dimethylethanamine[J]. Chemical Propellants & Polymeric Materials, 2010, 8(4): 39-41. |
The reaction kinetics of 2-azido-N, N-dimethylethylamine hydrochloride with sodium azide in aqueous solution was studied using ultraviolet absorption spectrometry.




