含三嗪环结构的化合物已经在工农业、医学、国防等领域应用广泛,可用作抗癌药物[1]、除草剂[2-4]、阻燃剂[5]、固化剂、多功能润滑剂、有机光电功能材料、紫外线吸收剂[6],也可用作含能材料[7-8],如1, 3, 5-三取代六氢均三嗪类化合物是合成RDX的重要中间体,在火炸药领域具有重要的应用前景。
在碳、氢、氮、氧类炸药体系中,氮元素不仅是可燃元素与氧元素的惰性隔板,且氮含量高的炸药爆容大、爆速高,有利于炸药作功[7]。三嗪类化合物分子中含有较多的氮原子,因此将三嗪环结构引入含能化合物中,可以增大化合物的氮含量,同时使分子中含有较多N—N,C—N,C=N,N=N等具有较高生成焓的化学键[9],进一步提升含能化合物的能量。
本课题组以2-氰基-4-硝基苯胺、3-氨基-4-氰基吡唑为原料,合成了两种连三嗪化合物——6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟和吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟,初步探讨了反应机理,结合实验结果及理论分析,阐述了重氮化、消除等反应发生在化合物结构中不同位置的原因,为此类化合物的进一步设计、合成提供了借鉴。
2 实验部分 2.1 合成路线分别以2-氰基-4-硝基苯胺、3-氨基-4-氰基吡唑为初始原料,在碱性条件下与盐酸羟胺发生肟化反应生成2-偕氨肟基-4-硝基苯胺、3-氨基-4-偕氨肟基吡唑,进一步与亚硝酸钠和稀盐酸发生重氮化、消除等反应得到两种新的稠环化合物-6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟和吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟,合成路线如Scheme 1所示。
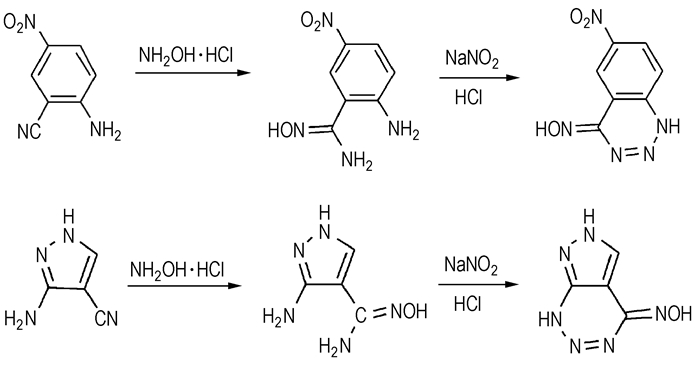
|
Scheme 1 |
2-氰基-4-硝基苯胺、3-氨基-4-氰基吡唑:化学纯,济南伟都化工试剂有限公司;盐酸羟胺:分析纯,成都市科龙化工试剂厂;亚硝酸钠:分析纯,天津市纵横兴工贸有限公司; NaOH和HCl:分析纯,成都市科龙化工试剂厂。
ZF-Ⅱ型三用紫外仪,上海市安亭电子仪器厂;NEXUS870型傅立叶变换红外光谱仪,美国热电尼高力公司;AV500型(500 MHz)超导核磁共振仪,瑞士BRUKER公司;GCMS-QP 2010型质谱仪,日本岛津公司;VARIO-EL-3型元素分析仪,德国EXEMENTAR公司;LC-2010A型高效液相色谱仪(归一化法),日本岛津公司;Q-200型差示扫描量热仪,美国TA公司;TA 2950热重仪,美国Nicolet公司;X-6型显微熔点测定仪,北京泰克仪器有限公司;S4 Pioneer X-荧光分析仪,德国BRUKER公司。
2.3 实验过程 2.3.1 6-硝基苯并-1, 2, 3-三嗪-4(1H)-肟的合成 2.3.1.1 2-偕氨肟基-4-硝基苯胺的合成室温搅拌下,将10.0 g(0.061 mol) 2-氰基-4-硝基苯胺加入120.0 mL去离子水中,然后缓慢加入8.5 g(0.122 mol)盐酸羟胺,并用30%的氢氧化钠溶液将反应液的pH值调节至10,室温反应1 h,升温至80 ℃反应2 h,冷却、过滤、水洗至中性,干燥得黄色粉状固体12.6 g,收率为95.6%,纯度为99.1%(HPLC),m.p.:212.3~212.9 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:6.035(s, 2H, NH2), 6.763~6.781(d, J=9.0 Hz, 1H, 6—CH), 7.753(s, 2H, 1—NH2), 7.933~7.952(d, J=9.0 Hz, 1H, 5—CH), 8.363~8.368(s, 1H, 3—CH), 9.913(s, 1H, OH);13C NMR(DMSO-d6, 500 MHz), δ:112.60(s, C=N), 114.76(s, C—NH2), 124.63(s, 2—C), 125.28(s, 6—C), 135.36(s, 5—C), 151.80(s, 3—C), 153.08(s, 4—C);IR(KBr, cm-1), υ:3485, 3460, 3372(—NH2), 3348(NO—H), 3081(苯环—H), 1657(C=N), 949(N—O), 752, 693(苯环);元素分析C7H8N4O3(%),理论值(实测值):C 42.86(43.24),H 4.110(4.019),N 28.56(28.23)。
2.3.1.2 6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟的合成室温搅拌下,将4.0 g(0.0204 mol)2-偕氨肟基-4-硝基苯胺溶解于31.9 mL 15%的稀盐酸中,将反应液冷却到5 ℃以下,滴加1.4 g(0.0204 mol)亚硝酸钠水溶液,随即产生砖红色固体,然后在5 ℃以下保持反应3 h,升温到30~35 ℃反应1.5 h,冷却、过滤、水洗至中性,干燥得砖红色固体3.8 g,收率为90.0%,纯度为99.6%(HPLC),m.p.:176.5~177.3 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:8.309~8.327(d, J=9.0 Hz, 1H, CH), 8.441~8.446(d, J=2.5 Hz, 1H, CH), 8.752(s, 1H, —NH), 9.397~9.406(d, J=4.5 Hz, 1H, CH), 9.647(s, 1H, OH);13C NMR(DMSO-d6, 500 MHz), δ:109.67(s), 120.06(s), 124.66(s), 130.29(s), 139.48(s), 142.79(s), 147.41(s);IR(KBr, cm-1), υ:3372(NO—H), 3295, 3196(N—H), 1648(C=N), 912(N—O), 1511, 1347(—NO2);元素分析C7H5N5O3(%),理论值(实测值):C 40.58(40.79),H 2.415(2.428),N 33.82(32.97);MS(m/z):207(M+)。
2.3.2 吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟的合成 2.3.2.1 3-氨基-4-偕氨肟基吡唑的合成室温搅拌下,将20.0 g(0.185 mol) 3-氨基-4-氰基吡唑加入200.0 mL去离子水中,缓慢加入25.8 g(0.371 mol)盐酸羟胺,并用30%的氢氧化钠溶液将反应液的pH值调节至10,在30~35 ℃反应1 h,加热至80 ℃反应2 h,冷却、过滤、水洗至中性,干燥得白色粉状晶体20.7 g,收率为79.3%,纯度为98.4%(HPLC),m.p.:189.6~190.9 ℃。
1H NMR(DMSO-d6, 500MHz), δ:5.536(s, 4H, 2NH2), 7.759(s, 1H, CH), 9.049(s, 1H, —NH), 11.573(s, 1H, OH);13CNMR(DMSO-d6, 500 MHz), δ:99.48(s), 127.37(s), 149.15(s), 152.98(s);IR(KBr, cm-1), υ:3425, 3329(—NH2), 3180(N—OH), 1655, 1642(C=N), 935(N—O), 1425, 1378, 1230(吡唑环);元素分析C4H7N5O(%),理论值(实测值):C 34.03(34.13),H 4.999(4.966),N 49.62(48.09);MS(m/z):141(M+)。
2.3.2.2 吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟的合成室温搅拌下,将2.0 g(0.014 mol) 3-氨基-4-偕氨肟基吡唑溶解于23.0 mL 15%的稀盐酸中,将反应液冷却到5 ℃以下,滴加1.0 g(0.014 mol)亚硝酸钠水溶液,随即产生黄色固体,然后在5 ℃以下保持反应3 h,升温到30~35 ℃反应1.5 h,冷却、过滤、水洗至中性,干燥得黄色固体2.0 g,收率为92.6%,纯度为99.3%(HPLC),m.p.:232.1~233.5 ℃。
1H NMR(DMSO-d6, 500MHz), δ:8.255(s, 2H, 2NH), 9.167(s, 1H, CH), 14.414(s, 1H, OH);13C NMR(DMSO-d6, 500 MHz), δ:99.27(s), 132.07(s), 141.50(s), 145.92(s);IR(KBr, cm-1), υ:3353(N—OH), 3237, 3130(—NH), 1677(C=N), 918(N—O), 1417, 1358, 1239, 1155(吡唑环);元素分析C4H4N6O(%), 理论值(实测值):C 31.58(31.33), H 2.632(2.696), N 55.22(53.45);荧光分析C4H4N6O(%), 理论值(实测值):CHN 89.5(89.2),O 10.5(10.5),Cl 0.000(0.332);MS(m/z):152(M+)。
3 结果与讨论 3.1 肟化反应氢氧化钠首先和盐酸羟胺反应生成羟胺,然后羟胺与2-氰基-4-硝基苯胺、3-氨基-4-氰基吡唑反应生成2-偕氨肟基-4-硝基苯胺、3-氨基-4-偕氨肟基吡唑。在这个过程中,羟胺制备是放热反应,控制氢氧化钠的滴加速度,以免反应体系温度瞬间过高,副产物增多,收率降低。实验中考察了2-氰基-4-硝基苯胺、3-氨基-4-氰基吡唑与盐酸羟胺的不同料比、pH值、反应温度和反应时间对肟化反应的影响。确定了合成2-偕氨肟基-4-硝基苯胺的最适宜条件为:2-氰基-4-硝基苯胺/盐酸羟胺的料比为1: 1.20,反应温度为80 ℃,pH值为10,反应时间为2 h,收率为95.6%;合成3-氨基-4-偕氨肟基吡唑的最适宜条件为:3-氨基-4-氰基吡唑/盐酸羟胺的料比为1: 1.25,反应温度为80 ℃,pH值为10,反应时间为2 h,收率为79.3%。
3.2 重氮化、消除反应2-偕氨肟基-4-硝基苯胺、3-氨基-4-偕氨肟基吡唑在稀酸条件下,与亚硝酸钠经过重氮化、消除反应生成6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟(1)、吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟(2),反应是“一锅法”完成的。实验过程中主要考察了盐酸浓度、温度等因素对反应收率的影响,结果见表 1、表 2。
| 表 1 盐酸浓度对收率的影响 Tab.1 Effect of HCl concentration on yield |
| 表 2 温度对收率的影响 Tab.2 Effect of temperature on yield |
表 1的结果表明,重氮化、消除反应过程中,随着盐酸浓度(百分含量)从7%~23%逐渐增大,产物的收率和纯度都基本不变,这是因为在保证足够盐酸用量的前提下,重氮化反应几乎是定量进行的。
从表 2可以看出,即使将重氮化反应的温度由0~5 ℃降低至-10~-5 ℃,反应还是向生成6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟和吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟的方向进行,且随着温度的改变,生成化合物的收率和纯度几乎没有变化。
3.3 重氮化及消除反应机理在2-偕氨肟基-4-硝基苯胺、3-氨基-4-偕氨肟基吡唑分子中,由于偕氨肟基的邻位存在一个氨基,相当于二元芳胺结构。二元芳胺的重氮化,根据两个氨基的所处相对位置不同而发生不同的反应,如对位二元芳胺重氮化反应生成对位二元重氮盐、间位二元芳胺重氮化反应生成偶氮化合物、邻位二元芳胺则是生成苯并氮杂环化合物。2-偕氨肟基-4-硝基苯胺、3-氨基-4-偕氨肟基吡唑首先发生重氮化反应,生成中间体-4-硝基-2-重氮肟基苯胺、3-氨基-4-重氮肟基吡唑,接着邻位的氨基进攻重氮基正离子,同时消除一分子HCl,生成6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟、吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟,反应机理如Scheme 2所示。
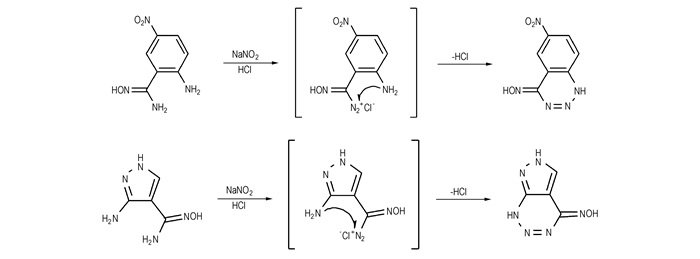
|
Scheme 2 |
此反应首先是由氢氧化钠和盐酸羟胺生成羟胺,接着羟胺与含氰基的化合物发生肟化反应生成偕氨肟基化合物,反应过程如Scheme 3所示。

|
Scheme 3 |
肟化加成反应是羟胺中的N原子与氰基中的C原子发生亲核加成反应,氰基中C原子的电子密度越低,越有利于此反应的进行。因此,氰基所连取代基R的吸电子能力越强,氰基中C原子的正电性越高,肟化加成反应越容易发生。
3.4.2 重氮化、消除反应在氨基邻位不存在强亲电基团时,用亚硝酸钠与盐酸生成的亚硝酸在低温下与偕氨肟基化合物发生重氮化反应,进而升温脱氮生成偕氯肟基化合物,反应过程如Scheme 4所示。
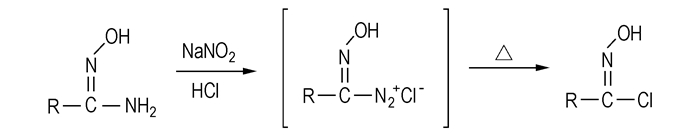
|
Scheme 4 |
芳胺在低温下与亚硝酸发生重氮化反应,生成重氮盐。在保证足够酸量和足够亚硝酸量的前提下,其反应的难易程度与氨基的碱性强弱有较大的关系,碱性越强,重氮化反应越容易进行。同时,生成的目标产物与氨基邻位的取代基类型有很大的关系,在氨基的邻位有强供电子基团,有可能重氮化反应后生成环状化合物。Scheme 5比较了3-氨基-4-偕氨肟基呋咱、2-偕氨肟基-4-硝基苯胺和3-氨基-4-偕氨肟基吡唑三种物质在重氮化反应后生成的不同类型产物。

|
Scheme 5 |
实验结果表明,三种物质重氮化反应首先都发生在与肟基相连的氨基上,这点通过化合物结构中不同氨基氮原子的电子云密度计算结果也得到了证明(表 3)。3-氨基-4-偕氨肟基呋咱经重氮化、脱氮反应生成了3-氨基-4-偕氯肟基呋咱[10],而2-偕氨肟基-4-硝基苯胺和3-氨基-4-偕氨肟基吡唑经重氮化反应后生成了两种稠环化合物-6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟和吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟,原因可能是呋咱环的吸电子能力较苯环和吡唑环强,因此降低了偕氨肟基邻位氨基上的电子密度,从而在反应过程中不会进攻邻位的重氮盐生成稠环化合物;而苯环和吡唑环的吸电子能力较弱,在反应过程中邻位氨基的电子云密度较大,反应过程中邻位氨基进攻生成的重氮基正离子,从而生成了苯环并三嗪环、吡唑并三嗪环两种稠环化合物。
| 表 3 氨基氮原子的电荷 Tab.3 The charge of amine nitrogen atom |
分别采用Gaussian 09程序[11]中的AM1[12]、B3LYP[13-14]、MP2[15]等算法,对3-偕氨肟基-4-硝基苯胺、3-氨基-4-偕氨肟基吡唑和3-氨基-4-偕氨肟基呋咱三种物质中氨基氮原子的电荷进行了量化研究,结果见表 3。
从表 3的计算结果可以看出,无论采用哪种算法,三种物质中偕氨肟基的氨基(表 3中的氨基1)氮原子电子密度总是大于邻位氨基(表 3中的氨基2)中的氮原子。因此,重氮化反应首先较容易发生在各个物质中与偕氨肟基相连的胺基上,这与实验所得结果相吻合。
4 结论(1) 分别以2-氰基-4-硝基苯胺、3-氨基-4-氰基吡唑为原料,经肟化、重氮化、消除等反应合成了两种新的连三嗪化合物-6-硝基苯并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟和吡唑并[3, 4-e]-1, 2, 3-三嗪-4(1H)-肟。
(2) 考察了各步反应的影响因素,2-偕氨肟基-4-硝基苯胺的最佳合成条件:2-氰基-4-硝基苯胺/盐酸羟胺的料比为1: 1.20,反应温度为80 ℃,pH值为10,反应时间为2 h,收率为95.6%;3-氨基-4-偕氨肟基吡唑的最佳合成条件:3-氨基-4-氰基吡唑/盐酸羟胺的料比为1: 1.25,反应温度为80 ℃,pH值为10,反应时间为2 h,收率为79.3%。
(3) 初步探讨了反应机理,结合实验结果和理论分析,阐述了重氮化、消除等反应发生在不同分子结构中不同位置氨基上的原因。当氨基的邻位存在强供电子基团时,发生重氮化、消除反应容易生成稠环化合物。
| [1] |
陈柳青, 黄淑萍, 魏学红, 等. 2, 4, 6-哌啶基-1, 3, 5-均三嗪新的合成方法及结构分析[J].
山西大学学报(自然科学版), 2004, 27(4): 377-380. CHEN Liu-qing, HUANG Shu-ping, WEI Xue-hong, et al. Synthesis and crystal structure of 2, 4, 6-(tri)1-piperidinyl-1, 3, 5-triazine[J]. Journal of Shanxi University (Natural Science Edition), 2004, 27(4): 377-380. |
| [2] |
Menicagli R, Samaritani S, Signore G, et al. In vitro eytotoxic activities of 2-alkyl-4, 6-diheteroalkyl-1, 3, 5-triazine: Flew molecules in anticanccr research[J].
J Med Chem, 2004, 47(19): 4649-4652. DOI:10.1021/jm0495374 |
| [3] |
Nishi K, Ishiuchi M, Morimune K, et al. Molecular and immunochemical characteristics of monoclonal and recombinant antibodies selective for the triazine herbicide simetryn and application to environmental analysis[J].
J Agric Food Chem, 2005, 53(13): 5096-5104. DOI:10.1021/jf050246t |
| [4] |
Kuo G H, DeAngelis A, Emanuel S, et al. Synthesis and identification off[1, 3, 5] riazine-pyridine biheteroaryl as a novel series of potent cyclindependent kinase inhibitors[J].
J Med Chem, 2005, 48(14): 4535-4546. DOI:10.1021/jm040214h |
| [5] |
田奋娥, 任洪燕, 张世均, 等. 新型含氮反应型阻燃剂的合成与表征[J].
塑料工业, 2010, 8(1): 8-10. TIAN Fen-e, REN Hong-yan, ZHANG Shi-jun, et al. Study on synthesis and characterization of novel nitrogen-containing reactive flame retardant[J]. China Plastics Industry, 2010, 8(1): 8-10. |
| [6] |
宋光伟, 倪建华, 孙大川, 等. 一种均三嗪类紫外线吸收剂UV-1577的合成及表征[J].
浙江化工, 2009, 40(3): 1-4. SONG Guang-wei, NI Jian-hua, SUN Da-chuan, et al. Synthesis and characterization of s-triazine UV-1577 ultraviolet absorber[J]. Zhejiang Chemical Industry, 2009, 40(3): 1-4. |
| [7] |
余秦伟, 杨建明, 赵锋伟, 等. 1, 3, 5-三取代六氢均三嗪类化合物的合成[J].
火炸药学报, 2008, 31(3): 50-52. YU Qin-wei, YANG Jian-ming, ZHAO Feng-wei, et al. Synthesis of 1, 3, 5-tri-substituted perhydro-s-triazine[J]. Chinese Journal of Explosives & Propellants, 2008, 31(3): 50-52. |
| [8] |
徐若千, 姬月萍, 丁峰, 等. 1, 3, 5-三羟乙基三嗪酮的富能化合成与表征[J].
火炸药学报, 2009, 32(4): 38-41. XU Ruo-qian, JI Yue-ping, DING Feng, et al. Energized synthesis and characterization of 1, 3, 5-tris(2-hydroxy ethyl)-1, 3, 5-triazinane-2, 4, 6-trione[J]. Chinese Journal of Explosives & Propellants, 2009, 32(4): 38-41. |
| [9] |
阳世清, 徐松林, 雷永鹏. 氮杂环含能化合物的研究进展[J].
含能材料, 2006, 14(6): 475-480. YANG Shi-qing, XU Song-lin, LEI Yong-peng. Development on nitrogen heterocyclic energetic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 475-480. |
| [10] |
周彦水, 王伯周, 李健康, 等. 3, 4-双(4'-硝基呋咱-3'-基)氧化呋咱合成、表征与性能研究[J].
化学学报, 2011, 69(1): 1-8. ZHOU Yan-shui, WANG Bo-zhou, LI Jian-kang, et al. Study on synthesis, characterization and properties of 3, 4-bis(4'-nitrofurazano-3'-yl)furoxan[J]. Acta Chimica Sinica, 2011, 69(1): 1-8. |
| [11] |
Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Gaussian, Inc.[J].
Wallingford CT, 2009 |
| [12] |
Dewar M J S, Zoebisch E G, Healy E F. AM1: A new general purpose quantum mechanical molecular model[J].
J Am Chem Soc, 1985, 107: 3902-3909. DOI:10.1021/ja00299a024 |
| [13] |
Becke A D. Density-functional thermochemistry Ⅲ. the role of exact exchange[J].
J Chem Phys, 1993, 98: 5648-5652. DOI:10.1063/1.464913 |
| [14] |
Lee C, Yang W, Parr R G. Development of the colle-salvetti correlation-energe formula into a functional of the electron density[J].
Phys Rev B, 1988, 37: 785-789. DOI:10.1103/PhysRevB.37.785 |
| [15] |
Head-Gordon M, Pople J A, Frisch M J. MP2 energy evaluation by direct methods[J].
Chem Phys Lett, 1988, 153: 503-506. DOI:10.1016/0009-2614(88)85250-3 |

Two novel 1, 2, 3-triazine compounds-6-nitrobenzene[3, 4-e]-1, 2, 3-triazine-4(1H)-oxime and pyrazole[3, 4-e]-1, 2, 3-triazine-4(1H)-oxime were prepared.



