现代武器和工业爆破技术的发展,对含能材料的安全性能要求越来越高。常规的TNT、RDX等单质炸药曾多次发生意外爆炸事故[1],因此,钝感含能材料是重要的研究方向。
据文献[2-3]报道,与六硝基茋(HNS)和太安(PETN)相比,2, 2', 4, 4', 6, 6'-六硝基偶氮苯(HNAB)是一种相对钝感的含能材料。HNAB的H50=27 cm[4]、PETN的H50=13 cm[5]、HNS的H50=54 cm[6]。就性能[7]上看,HNAB的密度为1.77 g·cm-3,爆速高达7250 m·s-1,特劳茨尔试验表明,其威力为TNT的1.23倍;HNS的密度为1.70 g·cm-3,爆速为7000 m·s-1,其威力为TNT的1.2倍;PETN的密度为1.45 g·cm-3,爆速为7275 m·s-1,其威力为TNT的1.2倍。因此,HNAB具有一定的应用前景, 国外也开展了对其性能、合成工艺的研究[8]。
现有的HNAB的合成方法[9]以2, 4, 6-三硝基氯苯为原料,经无水肼亲核取代后由发烟硝酸或以冰醋酸为溶剂,氮氧化物氧化制得。实验使用高纯度肼,不仅成本高,而且具有一定的危险性,同时氧化条件比较苛刻。本文是在文献[10]基础上对合成工艺进行了改进,以硫酸肼代替无水肼,避免了由于使用高纯度肼引起的危险,同时降低了反应成本;以九水合硝酸铁做氧化剂研磨制得HNAB,反应条件简单,能耗低,无污染;考察了亲核取代以及氧化反应的影响因素,确定了较优的工艺条件;利用DSC和TG热分析方法研究了HNAB的热分解机理,为HNAB的生产、储存和运输安全提供参考[11]。
2 实验部分 2.1 试剂及仪器2, 4, 6-三硝基氯苯,自制;硫酸肼,化学纯,国药集团化学试剂有限公司;甲醇,分析纯,国药集团化学试剂有限公司;九水合硝酸铁,分析纯,西陇化工股份有限公司;三乙胺,分析纯,国药集团化学试剂有限公司;吡啶、碳酸钾和丙酮均为分析纯,国药集团化学试剂有限公司。
Finnigan Tsq Quantum Ultra Am液-质联用光谱仪,美国Thermo Finnigan公司;红外光谱仪,日本SHIMADZU公司;500 MHz核磁共振波谱仪,瑞士Bruker公司;DSC823e差示扫描量热仪,瑞士METTLER TOLED公司;TGA/SDTA851e热分析仪,瑞士METTLER TOLED公司。
2.2 合成路线以2, 4, 6-三硝基氯苯为原料,与硫酸肼发生亲核取代反应,生成1, 2-二(2, 4, 6-三硝基苯基)肼,然后经九水合硝酸铁固相氧化制得HNAB,合成路线见Scheme 1。
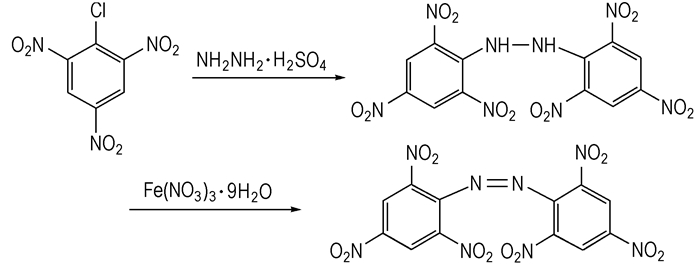
|
Scheme 1 |
以15 mL甲醇为溶剂,称取硫酸肼2.0 g(0.015 mol)和2, 4, 6-三硝基氯苯7.6 g(0.03 mol)于50 mL三口烧瓶中,水浴缓慢升温至45 ℃,分6次加入干燥的三乙胺6 mL(0.042 mol),反应24 h,抽滤,甲醇洗涤,甲醇重结晶,干燥后得黑色固体11.2 g,收率80.2%,m.p. 233~236 ℃(文献[10]值:235~237 ℃)。
MS(m/z):453(M+),407(M+—NO2),361(M+—2NO2);1H NMR(DMSO,500 MHz),δ:8.5883(d,2H,N—H),9.1717(s,4H,Ar—H)。
2.3.2 HNAB的合成与表征称取1, 2-二(2, 4, 6-三硝基苯基)肼2.0 g(0.004 mol)和九水合硝酸铁7.1 g(0.02 mol)于研钵中,累计研磨8 h至混合物呈黄色(采用间歇式研磨,过程缓慢并且跟踪体系温度,跟踪表明研磨过程无明显放热),用丙酮洗出产物,将混合液倒入碎冰中,抽滤,冰水洗涤,干燥,冰醋酸重结晶,干燥得橙黄色固体1.7 g,收率为85.4%,m.p.220.0~222.3 ℃(文献[12]值:221~223 ℃)。
IR(KBr,cm-1),υ:3091.89(C=C—H),1600.96(C=C),1539.2,1348.24(—NO2),1409.96(N=N);MS(m/z):452(M);1H NMR(DMSO,500 MHz),δ:9.3370(s,4H,Ar—H)。
3 结果与讨论 3.1 1, 2-二(2, 4, 6-三硝基苯基)肼的合成条件优化 3.1.1 三乙胺与硫酸肼的物料比对反应收率的影响硫酸肼2.0 g(0.015 mol),2, 4, 6-三硝基氯苯7.6 g(0.03 mol),甲醇15 mL,45 ℃条件下反应24 h,三乙胺与硫酸肼的物料比对收率影响的试验结果见表 1。
| 表 1 硫酸肼与三乙胺的物料比对反应收率的影响 Tab.1 Effect of mole ratio of hydrazine sulfate(n1) to triethylamine(n2) on the yield |
由表 1可知,三乙胺的用量对反应收率影响显著,收率随着三乙胺用量的增加显著增大。当硫酸肼和三乙胺的比例为1: 2.8时,反应收率高达80.2%,继续添加三乙胺,收率呈下降趋势。从反应机理上看,该反应是以肼作为亲核试剂,需要在碱性条件下进行。而三乙胺不仅可以调节混合液的pH至碱性,同时还能保证反应在均相条件下进行,若三乙胺加入量过少,体系中的肼没有完全释放出来,亲核取代不完全,但加入量过多时,产物会有部分溶于其中,难提纯,从而影响收率。由此可知,本实验硫酸肼和三乙胺的比例选用1: 2.8,收率较高。
3.1.2 反应时间对反应收率的影响硫酸肼2.0 g(0.015 mol),2, 4, 6-三硝基氯苯7.6 g(0.03 mol),甲醇15 mL,分批加入三乙胺6 mL,45 ℃条件下反应,反应时间对收率影响的试验结果见表 2。
| 表 2 反应时间对反应收率的影响 Tab.2 Effect of reaction time on the yield |
由表 2可知,随着反应时间的延长反应收率呈增长趋势。当反应时间为24 h时,收率为80.2%,继续延长反应时间,增长趋于平缓,说明亲核取代已进行得较为完全。该反应为双分子亲核取代反应,2, 4, 6-三硝基氯苯上的三个硝基的位阻比较大,给亲核试剂的进攻带来一定的困难,所以,反应收率可以通过延长反应时间提高。当反应时间为24 h时,薄层色谱(TLC)分析产物转化已基本完全,继续延长反应时间对增大收率收效甚微。综合考虑,反应时间选择24 h为宜。
3.1.3 反应温度对反应收率的影响硫酸肼2.0 g(0.015 mol),2, 4, 6-三硝基氯苯7.6 g(0.03 mol),甲醇15 mL,分批加入三乙胺6 mL,反应24 h,反应温度对收率影响的试验结果见表 3。
| 表 3 反应温度对反应收率的影响 Tab.3 Effect of reaction temperature on the yield |
由表 3可知,反应温度对收率的影响较为明显,反应温度由35 ℃升至45 ℃,产率由71.3%增至80.2%,达到了最大值。取代反应的反应速率随着反应温度的升高而增大,但当温度过高时,肼受热分解生成有毒的氧化氮烟气,不仅给实验带来危险性,而且参加反应的亲核试剂的量减少,收率也随之降低,所以该反应的最佳反应温度应控制在45 ℃左右。
3.1.4 碱对反应收率的影响硫酸肼2.0 g(0.015 mol),2, 4, 6-三硝基氯苯7.6 g(0.03 mol),甲醇15 mL,反应24 h,不同碱对收率影响的试验结果见表 4。
| 表 4 碱对反应收率的影响 Tab.4 Effect of different alkali on the yield |
由表 4可以看出,以三乙胺调节反应体系的酸碱性效果最佳,反应收率最高,为80.2%。碳酸钾加入体系,反应过程为非均相体系,不仅给反应带来一定的困难,而且不利于后处理;以吡啶为碱释放肼发生亲核取代反应,虽然反应可在均相条件下进行,但是,吡啶的碱性较弱,加入量不足则无法产生足量的肼,加入量过多会溶解一定量的产物,在后处理过程中增加产物的损失,而三乙胺的碱性比吡啶大,调节酸碱性效果好,降低了产物的损失。综上所述,该调节反应体系的酸碱性选用三乙胺效果最佳。
3.2 HNAB的合成条件优化 3.2.1 1, 2-二(2, 4, 6-三硝基苯基)肼和九水合硝酸铁的物料比对反应收率的影响1, 2-二(2, 4, 6-三硝基苯基)肼和九水合硝酸铁于研钵中研磨,反应物料比对收率影响的试验结果见表 5。
| 表 5 1, 2-二(2, 4, 6-三硝基苯基)肼和九水合硝酸铁的物料比对反应收率的影响 Tab.5 Effect of mole ratio of 1, 2-bis(2, 4, 6-trinitrophenyl)hydrazine(n1) to Fe(NO3)3·9H2O(n2) on the yield |
由表 5可知,九水合硝酸铁作为氧化剂参加反应,反应收率随氧化剂用量的增加而增大,当1, 2-二(2, 4, 6-三硝基苯基)肼和九水合硝酸铁的摩尔比为1: 5时,反应收率为82.9%;继续提高九水合硝酸铁用量,反应收率增加不明显,说明1, 2-二(2, 4, 6-三硝基苯基)肼已基本被氧化完全。从反应成本方面考虑,1, 2-二(2, 4, 6-三硝基苯基)肼和九水合硝酸铁的最佳摩尔比为1: 5。
3.2.2 研磨时间对反应收率的影响1, 2-二(2, 4, 6-三硝基苯基)肼2.0 g(0.004 mol)和九水合硝酸铁7.1 g(0.020 mol)于研钵中研磨,研磨时间对收率影响的试验结果见表 6。
| 表 6 研磨时间对反应收率的影响 Tab.6 Effect of grinding time on the yield |
由表 6可知,研磨时间是影响反应收率的重要因素之一,反应收率随着反应时间的延长先增大后趋于平缓,当研磨时间为8 h时,收率达到82.9%,继续延长时间对增大收率收效甚微。该反应为固相与固相之间的反应,由于固体质点间键力大,所以,反应速度较慢,延长反应时间有益于原料的氧化,研磨8 h后,原料已基本反应完全,继续延长反应时间对提高收率无益。综上所述,最佳累计研磨时间为8 h。
3.3 HNAB的热分解动力学 3.3.1 DSC分析样品质量为0.5200 mg,升温区间为50~500 ℃,升温速率为10 K·min-1,气氛为流动N2,流速为20.0 mL·min-1。DSC曲线如图 1所示。
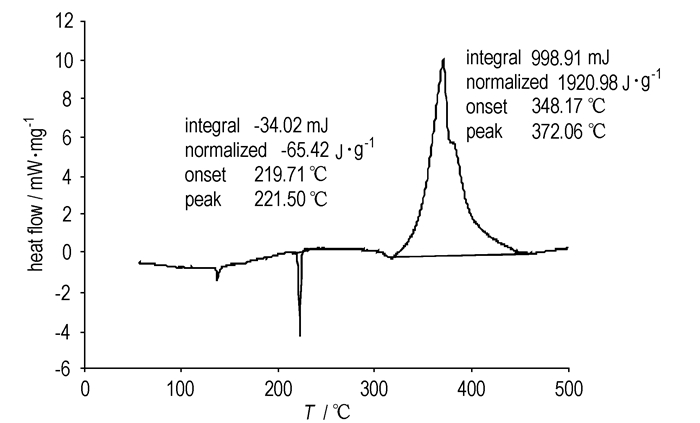
|
图 1 HNAB的DSC曲线 Fig.1 DSC cruve of HNAB |
由图 1可知,HNAB先吸热熔化后分解放热,其熔点为219.71~221.50 ℃,与文献值(221.95~222.95 ℃[12])相近;从348.17 ℃开始放热分解,峰温为372.06 ℃,分解热焓为1920.98 J·g-1。这表明,HNAB具有较高的熔点和分解温度,耐热性能良好。分析原因认为,HNAB分子中具有大共轭体系、对称结构,而且基团配置均匀,这对分子的热稳定性和耐热性能非常有利[13]。
3.3.2 HNAB的热分解动力学样品质量为(0.5000±0.02) mg,升温区间为50~500 ℃,升温速率为10、15、20、25 K·min-1,气氛为流动N2,流速为30.0 mL·min-1,TG曲线如图 2所示。
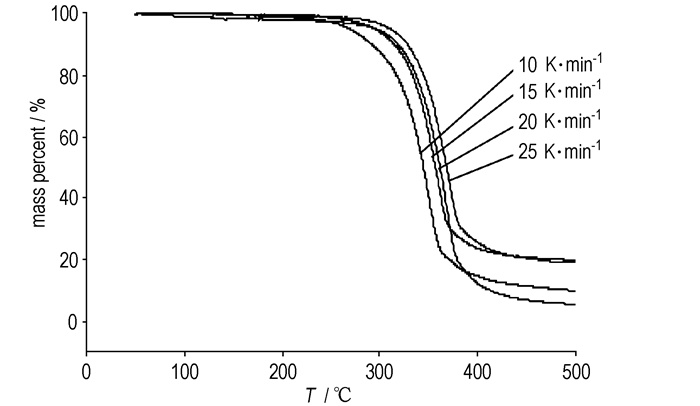
|
图 2 HNAB在不同升温速率的热重曲线 Fig.2 TG curves of HNAB at different heating rates |
对于炸药的热分解,通过不同升温速率的TG曲线进行非等温动力学分析时,常用Ozawa公式[14]:
| $ \lg \beta = \lg \left[{\frac{{AE}}{{RF\left( \alpha \right)}}} \right] - 2.315 - 0.4576\frac{E}{{RT}} $ | (1) |
式中,β为升温速率,K·min-1;A为指前因子,s-1;α为炸药反应深度;R为理想气体常数,J·mol-1·K-1;E为表观活化能,J·mol-1;T为温度,K;F(α)为机理函数的积分形式。
本实验的升温速率分别为10、15、20、25 K·min-1,根据HNAB的热重分析曲线求出反应深度α分别为0.2、0.3、0.4、0.5、0.6、0.7、0.8时所对应的分解温度T。根据公式(1)和试验数据对lgβ与1/T进行线性拟合,由直线斜率获得表观活化能E,计算结果见表 7。
| 表 7 Ozawa法计算的HNAB的热分解活化能 Tab.7 Thermal decomposition activation energy for HNAB by Ozawa's method |
根据Doyle法[15],公式(1)可变换成:
| $ \lg F\left( \alpha \right) = \lg \left[{\frac{{AE}}{{R\beta }}} \right] - 2.315 - 0.4576\frac{E}{{RT}} $ | (2) |
对于任何热分解反应机理函数[15],lgF(α)与1/T均呈线性关系,线性拟合分析表明,当n=1时,通过Doyle法与Ozawa法求得的表观活化能接近,且线性拟合所得的相关系数好,计算结果见表 8。
| 表 8 lgF(α)~1/T线性拟合的结果 Tab.8 Result of linear fitting lgF(α)~1/T |
线性拟合分析结果表明,HNAB的热分解属于n=1的成核和核生长机理,反应机理函数的微分形式为:f(α)=(1-α),热分解动力学方程为:
| $ \begin{array}{l} \frac{{{\rm{d}}\alpha }}{{{\rm{d}}t}} = kf\left( \alpha \right) = A \cdot {{\rm{e}}^{ - \frac{E}{{RT}}}} \cdot f\left( \alpha \right)\\ \;\;\;\; = 3.965 \times {10^{11}} \times \left( {1 - \alpha } \right)\exp \left[{-\frac{{1.485 \times {{10}^4}}}{T}} \right] \end{array} $ |
(1) 1, 2-二(2, 4, 6-三硝基苯基)肼制备的较优工艺为:硫酸肼2.0 g,2, 4, 6-三硝基氯苯7.6 g,甲醇15 mL,三乙胺6 mL,反应温度45 ℃,反应时间24 h。
(2) 根据HNAB的TG曲线,用Ozawa法求得其分解属于n=1的成核和核生长机理,反应机理函数微分形式是f(α)=(1-α),其热分解动力学方程为:
| $ \begin{array}{l} \frac{{{\rm{d}}\alpha }}{{{\rm{d}}t}} = kf\left( \alpha \right) = A \cdot {{\rm{e}}^{ - \frac{E}{{RT}}}} \cdot f\left( \alpha \right)\\ \;\;\;\; = 3.965 \times {10^{11}} \times \left( {1 - \alpha } \right)\exp \left[{-\frac{{1.485 \times {{10}^4}}}{T}} \right] \end{array} $ |
| [1] |
王振宇. 国外近年研制的新型不敏感单质炸药[J].
含能材料, 2003, 11(4): 227-240. WANG Zhen-yu. Development on some new insensitive individual explosives abroad[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2003, 11(4): 227-240. |
| [2] |
Agrawal J P. Recent trends in high-energy materials[J].
Prog Engergy Combust Sci, 1998, 24: 1-30. DOI:10.1016/S0360-1285(97)00015-4 |
| [3] |
Hasman E, Gvishi M, Carmel Y. Measurement of shock initiation threshold of HNAB by flyer plate impact[J].
Propell Explos Pyrotech, 1986, 11(5): 144-149. DOI:10.1002/(ISSN)1521-4087 |
| [4] |
Leopold Howard S. Initiation of explosive by exploding wires. 8. Survey to determine explosives capable of initiation at moderate voltage levels[R]. AD0476199, 1965.
|
| [5] |
Bulusu S N.
Chemistry and Physics of Energetic Materials[M]. Dordrecht, The Netherlands: Kluwer Academic Publishers, 1990: 605-639. |
| [6] |
李洪珍, 黄明, 黄奕刚, 等. 3, 3'-二氨基-4, 4'-偶氮呋咱及其氧化偶氮呋咱的研究进展[J].
含能材料, 2005, 13(3): 192-195. LI Hong-zhen, HUANG Ming, HUANG Yi-gang, et al. Progress in diaminoazofurazan and diaminoazoxyfurazan[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2005, 13(3): 192-195. |
| [7] |
Wickham A, John J R, Dilworth R L.
Military Explosives[M]. Washington: Department of the Army, 1984: 8-60. |
| [8] |
Zeman S. Possibilities of applying the piloyan method of determination of decomposition activation energies[J].
Journal of Thermal Analysis, 1980, 19: 107-115. DOI:10.1007/BF01928436 |
| [9] |
Buzykin B I, Sharin G P, Trutneva L A. Aromaticcompounds containing hydrazo or azo groups[J].
Russ Chem B, 1970, 19(10): 2184-2188. DOI:10.1007/BF00861493 |
| [10] |
Badgujara D M, Talawar M B, Harlapur Sujata F, et al. Synthesis, characterization and evaluation of 1, 2-bis(2, 4, 6-trinitrophenyl) hydrazine: A key precursor for the synthesis of high performance energetic materials[J].
Journal of Hazardous Materials, 2009, 172: 276-279. DOI:10.1016/j.jhazmat.2009.07.005 |
| [11] |
高大元, 董海山, 李波涛, 等. 炸药热分解动力学及其应用[J].
含能材料, 2004, 12(增刊): 307-310. GAO Da-yuan, DONG Hai-shan, LI Hai-bo, et al. Research and application of thermal decomposition kinetics for explosives[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(Supplement): 307-310. |
| [12] |
Hayes D V, Honea F I. Technical report on the synthesis of HNAB: United States: EY-76-C-04-0487[P], 1971-08-01.
|
| [13] |
吕春绪.
耐热硝基芳烃化学[M]. 北京: 兵器工业出版社, 2000.
|
| [14] |
马晓明, 李斌栋, 吕春绪, 等. 无氯TATB的合成及其热分解动力学[J].
火炸药学报, 2009, 32(6): 24-27. MA Xiao-ming, LI Bin-dong, Lü Chun-xu, et al. Synthesis and thermal decomposition kinetics of TATB without chloride[J]. Chinese Journal of Explosives & Propellants(HuoZhayao Xuebao), 2009, 32(6): 24-27. |
| [15] |
何志伟, 高大元, 刘祖亮. 2, 6-二氨基-3, 5-二硝基吡啶-1-氧化物及其黏结炸药的热分解动力学[J].
火炸药学报, 2009, 32(2): 32-35. HE Zhi-wei, GAO Da-yuan, LIU Zu-liang. Thermal decomposition kinetics of 2, 6-diamino-3, 5-dinitropyridine-1-oxide and its formulation explosives[J]. Chinese Journal of Explosives & Propellants(HuoZhayao Xuebao), 2009, 32(2): 32-35. |
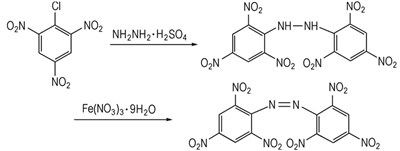
Hexanitroazobenzene(HNAB) was prepared via nucleophilic substitution reaction and oxidation reaction using picryl chloride as raw materials. The reaction conditions were optimized.



