2. 中国药科大学药学院,江苏 南京 210009
2. School of Pharmacy, China Pharmaceutical University, Nanjing 210009, China
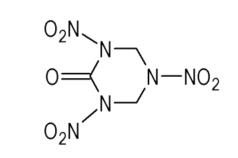
现今,寻找新的高能钝感炸药是炸药设计和合成的重要方向,其目标是:比1, 3, 5-三氨基-2, 4, 6-三硝基苯(TATB)钝感;拥有比1, 3, 5, 7-四硝基-1, 3, 5, 7-四硝基氮杂环辛烷(HMX)更高的能量[1];即希望这些含能化合物除了比TATB钝感外,其密度接近2.0 g·
|
Scheme 1 |
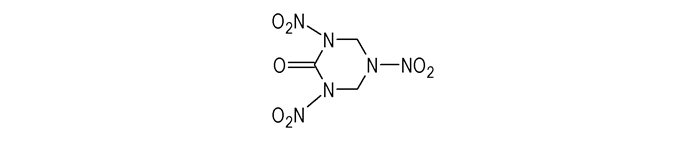
国内外对RDX酮的合成路线和制备工艺进行了广泛而深入的研究,主要有两种合成方法:一是直接法,即以脲和乌洛托品(六亚甲基四胺,HA)为原料,在硝化(解)液中直接制得RDX酮与RDX的混合物,然后分离。我国科研工作者在1966年便用此法经硝解合成出RDX酮,之后有人在直接硝解法制备黑索今(RDX)的废酸中加入尿素,也可获得该化合物。二是多步法,首先用小分子缩合环化成1, 3, 5-三嗪烷类中间体,然后再硝化制得RDX酮。该法是以后逐步发展起来的,常分两步进行,先用小分子缩合环化(一般借助Mannich反应)成RDX酮的前身-1, 3, 5-三氮杂环己烷-2-酮(又称:1, 3, 5-三嗪烷-2-酮,1, 3, 5-triazinan-2-one)等衍生物,再经硝化(解)制得RDX酮。根据起始用于缩合的小分子种类或结构的不同,现已形成多种合成RDX酮的小分子缩合多步法。然而,直接法分离提纯产物比较困难,多步法步骤多、成本高。本文即从直接法和多步法角度对RDX酮的合成方法及反应特点进行综述、分析。
2 以脲和乌洛托品为原料合成RDX酮 2.1 硝酸、硝硫混酸体系张跃军[5]以乌洛托品、脲或者硝基脲为原料,在99%硝酸和硝硫混酸中合成RDX酮。实验发现使用硝硫混酸硝化剂,RDX酮的产率在90%以上,产物为RDX酮与RDX的混合物;使用纯硝酸硝化剂,RDX酮的产率仅在50%左右。
为了探索RDX酮的形成机理,张跃军[6]分别以1, 5-甲撑基-3, 7-二硝基-1, 3, 5, 7-四氮杂环辛烷(DPT),1-乙酰氧甲基-3, 7-甲撑基-3, 5, 7-三硝基-1, 3, 5, 7-四氮杂环辛烷(PHX),1, 7-二乙酰氧基-2, 4, 6-三硝基-2, 4, 6-三氮杂庚烷(BSX)为原料,研究了在硝硫混酸中与脲或硝基脲反应合成RDX酮。由于HA、DPT、PHX和BSX分子中具有的叔胺基氮原子数量不同,它们在硝解剂中生成非硝基取代的
在硝硫混酸中,用乌洛托品或/和硝基脲的硝酸盐作原料对RDX酮产率有影响。Shokrollahi等[8]用HA二硝酸盐或HA分别和脲反应,合成RDX酮的产率依次为37%和34%;而Boniuk等[9]分别用二硝基脲和二硝基脲的盐与HA反应,合成RDX酮的产率可依次提高到45%和55%,伴随产生的RDX产率分别为30%和15%。
综合以上结果表明:(1)以脲和乌洛托品为原料,硝酸或硝硫混酸合成RDX酮的直接法:原料易得,方法简单,但仅得到RDX酮与RDX的混合物,单一产品需分离。(2)硝基脲及其硝酸盐对提高RDX酮产率至关重要,可能是这些脲的衍生物更易和HA碎片(如
张跃军[5]在多磷酸混酸体系中以HA和脲来合成RDX酮,产率超过100%(按HA单分子计。理论上,1分子HA可分解为3分子的
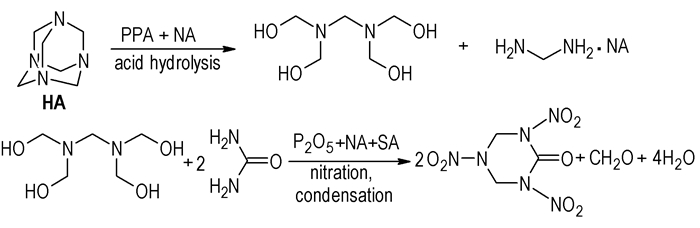
在多磷酸混酸合成RDX酮的研究中,奚美玒等[12]除了运用常规一步法合成RDX酮外,还设计出二步法,如Scheme 2所示,首先将HA在PPA和少量硝酸的混合酸中低温酸解成相关小分子碎片,然后将此混合物加到含有脲的PPA-硝硫混酸中,进行缩合和硝化,制得RDX酮等。二步法的RDX酮产率高达130%以上(按HA单分子计),为以HA为原料合成RDX酮方法中的最高者。二步法解决了两个问题:一是避免了脲对HA酸解的影响,二是产生较多的HA酸解碎片有利RDX酮的形成,揭示出一分子HA能制得多分子RDX酮的本质。多磷酸混酸二步法中同时伴随产生产率在20%以上的RDX,故该法显著地提高了原料HA的利用率。
|
Scheme 2 |
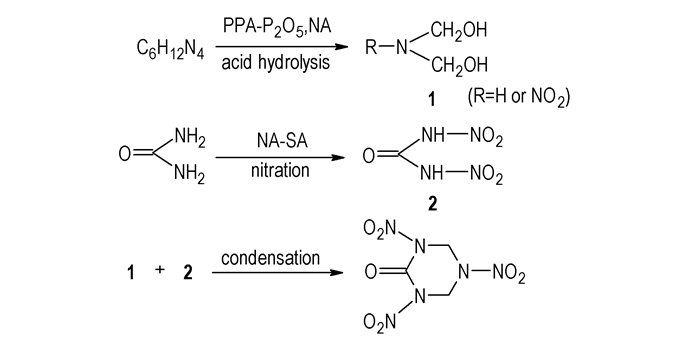
Sikder等[13]在磷酸酐
|
Scheme 3 |
多磷酸法合成RDX酮的原料价廉易得,多磷酸可降低硝酸的氧化性,使体系的酸性适合HA酸解成所需的碎片,RDX酮产率较高。但是,此法缺陷在于:废酸成分较复杂,废酸处理有一定困难。
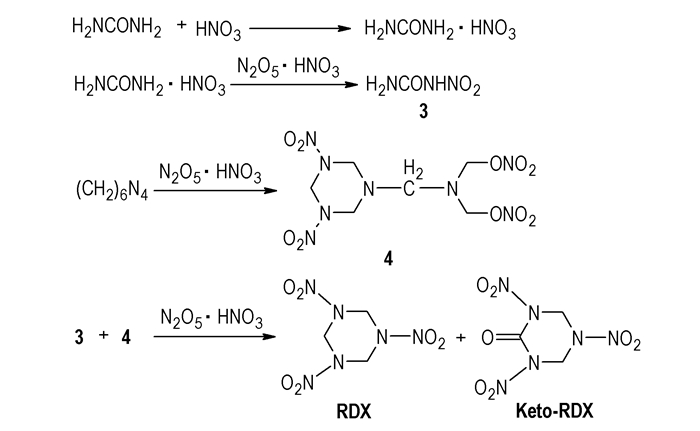
2.3 硝酸-五氧化二氮体系曹端林等[14]设计了以硝酸-五氧化二氮作为硝化剂合成RDX酮的新方法,其合成过程如Scheme 4所示。Hale[15]研究发现HA在发生硝解反应的同时,也发生脱硝基和水解等副反应,这主要取决于硝化酸中活化剂
|
Scheme 4 |
该方法提高了反应过程中的安全程度,RDX酮产率高,可达到120%;同时因硝化剂中无其它杂酸,废酸方便回收利用,反应过程基本能做到无污染,是一种环保型的合成方法。
3 小分子缩合多步法合成RDX酮 3.1 以2-氧-5-叔丁基-1, 3, 5-三氮杂环己烷(TBT)为前体合成RDX酮Adolph等[17]曾使用硝硫混酸或乙酸酐-
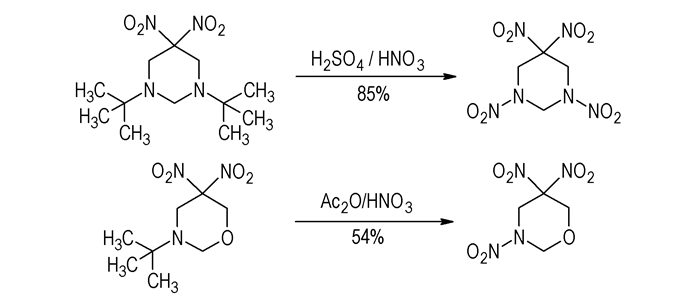
|
Scheme 5 |
直至1994年,Mitchell等[1]借鉴上述方法,设计以2-氧-5-叔丁基-1, 3, 5-三氮杂环己烷(TBT)为前体,利用直接就位置换的方法合成出RDX酮,其合成路线如Scheme 6所示。作者采用
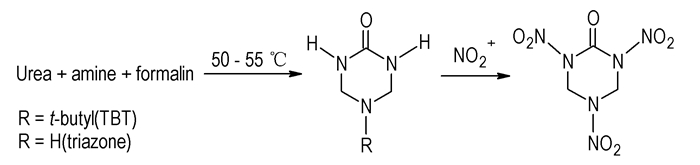
|
Scheme 6 |
此法首先用小分子脲、甲醛和叔丁胺经Mannich反应缩合环化,制得中间体-1, 3, 5-三氮杂环己烷-2-酮衍生物,起始原料易得、价廉,反应操作安全、简单。然而,由于前体缩合物TBT的产率仅60%左右,反应总产率较低,第二步的硝化反应还发生一些副反应,产物不纯。近来,周诚等[19]对该方法合成RDX酮的工艺进行了优化研究,使RDX酮的总产率提高到48%,纯度达98.8%。
3.2 以氨基磺酸钾、甲醛和脲为原料合成RDX酮从“绿色化学的原子经济性”角度看,“3.1”中以TBT为前体合成RDX酮的方法不经济,没有充分地应用原料,浪费了占TBT中较多质量份额的叔丁基,所以对上法改进是必然的。Ermakov等[20]提出用氨基磺酸钾替代上法中的叔丁胺,和甲醛、脲缩合制备相应的中间体:4-氧-1, 3, 5-三嗪烷-1-磺酸钾(
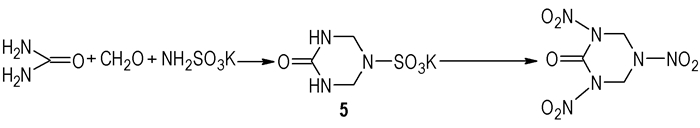
|
Scheme 7 |
相对TBT法,Ermakov等人的方法优势十分明显,他们所用的氨基磺酸钾与叔丁胺比较,具有来源广、价格低,不影响后续反应中硝硫混酸的成份,以及废酸易于回收利用等特点。但该法的难点是:脲和甲醛的缩合对反应条件的要求非常苛刻,许多情况下会生成各种产物(包括一些聚合物),产品分离比较困难,从而使得前体化合物没有固定的熔点,质量难以控制,影响到后续反应的硝化和RDX酮的总产率。
3.3 以2-硝亚氨基-六氢-1, 3, 5-三嗪及其类似物为前体合成RDX酮前面所述的两种多步法都涉及到脲和甲醛之间的缩合,这种缩合产物复杂,要获得较纯的RDX酮的前体TBT或化合物
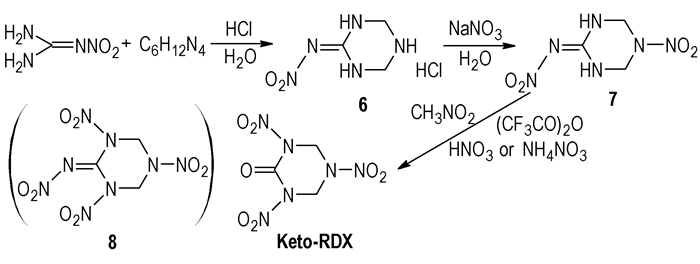
|
Scheme 8 |
该方法的优点是每一步的反应产率都较高(
RDX酮是一种高密度含能化合物,其衍生物在新单质炸药的研制中占据较重要的地位。多年来,关于RDX酮的合成方法研究和报道较多,其中由我国科技人员创立和发展起来的直接法是以脲和乌洛托品为原料经硝化剂硝解(化)而制得RDX酮的,分析已采用的各种不同的硝化剂对RDX酮产率的影响,可看到酸性适宜而绝对无水的硝化剂能显著地提高RDX酮的产率,并能使RDX酮产率超过100%,如多磷酸混酸体系与
在直接法中,对于
小分子缩合多步法中总结了三种有代表性的RDX酮前体1, 3, 5-三氮杂环己烷衍生物的合成思路和相关方法。其中前体4-氧-1, 3, 5-三嗪烷-1-磺酸钾(
| [1] |
Mitchell A R, Pagoria P F, Coon C L, et al. Nitroureas 1. Synthesis, scale-up and characterization of K-6[J].
Propell Explos Pyrot, 1994, 19: 232-239. DOI:10.1002/(ISSN)1521-4087 |
| [2] |
Fedoroff B T, Sheffield O E, Kaye S M.
Encyclopedia of explosives and related items[M]. Dover, N.J: Picatinny Arsenal, 1974: 117-118. |
| [3] |
Gilardi R, Flippen-Anderson J L, George C. Structures of 1, 3, 5-trinitro-2-oxo-1, 3, 5-triazacyclohexane (Ⅰ) and 1, 4-dinitro-2, 5-dioxo-1, 4-diazacyclohexane (Ⅱ)[J].
Acta Cryst, C46, 1990: 706-708. |
| [4] |
Pagoria P F, Lee G S, Mitchell A R, et al. A review of energetic materials synthesis[J].
Thermochim Acta, 2002, 384: 187-204. DOI:10.1016/S0040-6031(01)00805-X |
| [5] |
张跃军. 2, 4, 6-三硝基-2, 4, 6-三氮杂环己酮的合成Ⅰ以乌洛托品为原料的合成[J].
火炸药学报, 1999, 22(4): 1-4. ZHANG Yue-jun. Synthesis of 2, 4, 6-trinitro-2, 4, 6-triazacyclo-hexanone (keto-RDX)[J]. Chinese Journal of Explosives and Propellants, 1999, 22(4): 1-4. |
| [6] |
张跃军. 2, 4, 6-三硝基-2, 4, 6-三氮杂环己酮的合成Ⅱ以DPT或PHX为原料的合成[J].
火炸药学报, 2001, 24(1): 1-3, 6. ZHANG Yue-jun. Synthesis of 2, 4, 6-trinitro-2, 4, 6-triazacyclo-hexanone (keto-RDX)[J]. Chinese Journal of Explosives and Propellants, 2001, 24(1): 1-3, 6. |
| [7] |
张跃军. 几种硝化剂中脲和硝基脲的反应形式(Ⅰ)加料方式的研究[J].
火炸药学报, 2001, 24(2): 6-8. ZHANG Yue-jun. Study on the reaction form of urea and nitrourea in nitrating agents[J]. Chinese Journal of Explosives and Propellants, 2001, 24(2): 6-8. |
| [8] |
Shokrollahi A, Zali A, Pouretedal H R, et al. Synthesis of Keto-RDX and its characterizations calculation[J].
Chinese Journal of Energetic Materials(Hanneng Cailiao), 2008, 16(1): 44-48. |
| [9] |
Bonuik H, Pilecki W, Stawinski T, et al. New method of synthesizing K-RDX using dinitrourea(DNU)[C]∥International Annual Conference of ICT 31st(Energrtic Materials), 2000, 46/1-46/8. CAN 133: 283738.
|
| [10] |
Siele V I, Gilbert E E. Process for preparing 1, 3, 5, 7-tetranitro-1, 3, 5, 7-tetracyclooctane: US 3939148[P], 1976-02-17.
|
| [11] |
Henryka B, Witold P, Tomasz S, et al. New method of synthesizing K-RDX using dinitrourea (DNU)[C]∥Energetic materials-Analysis, diagnostics and testing; Proceedings of the 31st ICT International Conference. Germany: Karlsruhe, 2000: 1-8.
|
| [12] |
奚美玒, 姚其正. 多磷酸法合成2, 4, 6-三硝基-2, 4, 6-三氮杂环己酮[J].
南京理工大学学报, 1999, 23(6): 550-553. XI Mei-hong, YAO Qi-zheng. The synthesis of 2, 4, 6-trinitro-2, 4, 6-triazacyclo hexanone using polyphosphoric acid[J]. Journal of Nanjing University of Science and Technology, 1999, 23(6): 550-553. |
| [13] |
Sikder N, Bulakh N R, Sikder A K, et al. Synthesis, characterization and thermal studies of 2-oxo-1, 3, 5-trinitro-1, 3, 5-triazacyclohexane (Keto-RDX or K-6)[J].
J Hazard Mater, 2003, 96: 109-119. DOI:10.1016/S0304-3894(02)00169-3 |
| [14] |
曹端林, 曹明保, 李永祥. 绿色硝解技术合成RDX酮[J].
火炸药学报, 2004, 27(1): 12-15. CAO Duan-lin, CAO Ming-bao, LI Yong-xiang. Synthesis of Keto-RDX using dinitrogen pentoxide as the nitrating agent[J]. Chinese Journal of Explosives and Propellants, 2004, 27(1): 12-15. |
| [15] |
Hale G C. Nitration of urotropine using nitric acid[J].
J Am Chem Soc, 1925, 47: 2754-2757. DOI:10.1021/ja01688a017 |
| [16] |
鲁鸣久, 刘鸿, 丁黎. 氮杂环胺类的硝化剂及硝化反应的研究[J].
火炸药学报, 1999, 22(3): 1-5. LU Ming-jiu, LIU Hong, DING Li. Research on the nitrating agents and nitration of the azacycloamins[J]. Chinese Journal of Explosives and Propellants, 1999, 22(3): 1-5. |
| [17] |
Cichra D A, Adolph H G. Nitrolysis of dialkyl tert-butylamines[J].
J Org Chem, 1982, 47: 2474-2476. DOI:10.1021/jo00133a047 |
| [18] |
Ritter H, Braun S, Cshafer M, et al. Relationship between crystal shape and explosive properties of K-6[C]∥International Annual Conference of ICT 32nd(Energrtic Materials), 2001, 91/1-91/14. CAN 135: 333014.
|
| [19] |
周诚, 周彦水, 霍欢, 等. 1, 3, 5-三硝基-六氢化-1, 3, 5-三嗪-2-酮的合成与表征[J].
火炸药学报, 2011, 34(4): 17-20. ZHOU Cheng, ZHOU Yan-shui, HUO Huan, et al. Synthesis and characterization of 1, 3, 5-trinitro-hexahydro-1, 3, 5-triazin-2(1H-one)[J]. Chinese Journal of Explosives and Propellants, 2011, 34(4): 17-20. |
| [20] |
Ermakov A S, Serkov S A, Tartakovskii V A, et al. Use of potassium sulfamate in the synthesis of heterocyclic nitramines[J].
Chemistry of Heterocyclic Compounds, 1994, 30(8): 976-978. DOI:10.1007/BF01165039 |
| [21] |
Huang D S, Rindone R R. High-energy insensitive cyclic nitramines: US 4983734[P], 1991-01-08.
|
| [22] |
Hunag D S. Preparation of 2, 4, 6-trinitro-2, 4, 6-triazacyclohexanone: US 5391736[P], 1995-02-21.
|
The research situations and progress on the synthesis of Keto-RDX were summarized,analysized and reviewed with 22 references.




