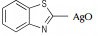
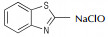
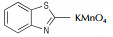
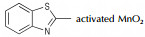
氮杂环化合物是非常典型的多氮化合物,具有高氮含量、高生成焓、易于实现氧平衡等特点,可作为高能钝感炸药、火箭推进剂、气体发生剂以及焰火剂等[1-5],已成为新型高能量密度材料研究的一个热点。通过偶氮键将氮杂环连接起来不但可以提高氮含量,极大地增加其生成焓,而且还可以大幅度提高其密度,如3, 3′-偶氮(6-氨基-S-四嗪)和4, 4′, 6, 6′-四叠氮基偶氮-1, 3, 5-三嗪[6-8],是实现氮杂环化合物高能量、高密度化的重要技术途径。
目前,在氮杂环之间进行偶氮键连接的方法较多,但主要是经氮杂环化合物上联亚氨基-偶氮基和氨基-偶氮基的氧化偶联反应来实现的[9-11]。本文分类综述了通过联亚氨基-偶氮基和氨基-偶氮基的氧化偶联反应向氮杂环化合物上引入偶氮键的方法和途径,为相关研究提供借鉴。
2 联亚氨基-偶氮基氧化偶联此类反应可由Scheme 1概括。
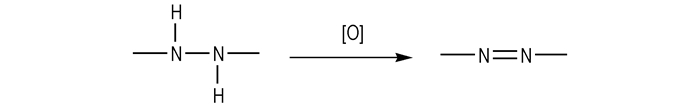
|
Scheme 1 |
常用氧化剂主要包括:活性MnO2,H2O2/H2SO4,Cl2,Br2,O2,KMnO4/H+,NaOC l (次氯酸钠),TCI (三氯异氰尿酸),DCI (二氯异氰尿酸),SDCI (二氯异氰尿酸钠),DBI (二溴异氰尿酸),SDBI (二溴异氰尿酸钠),NCS(N-氯代丁二酰亚胺),NBS(N-溴代丁二酰亚胺)[12]等。
Huynh M.H.V.等[6]以三氯三嗪与水合肼为原料,经两步反应得到4, 4′, 6, 6′-四肼基联亚氨基-1, 3, 5-三嗪,然后在亚硝酸钠/盐酸体系中生成4, 4′, 6, 6′-四叠氮基联亚氨基-1, 3, 5-三嗪(1),最后以Cl2作为氧化剂将1结构中的联亚氨基氧化为偶氮基,合成出了偶氮化产物4, 4′, 6, 6′-四叠氮基偶氮基-1, 3, 5-三嗪(2)。化学反应方程式如Scheme 2所示。
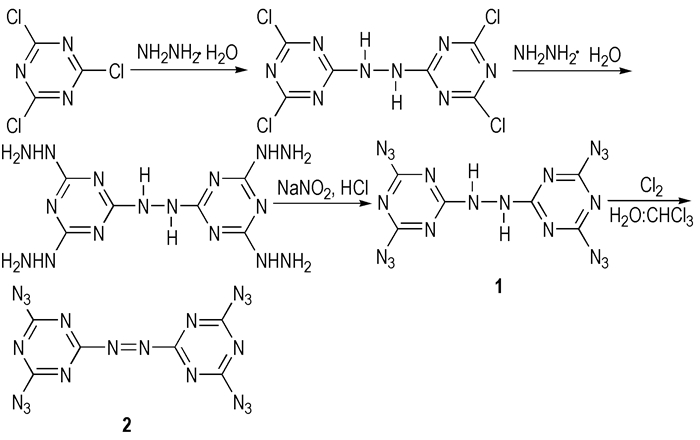
|
Scheme 2 |
北京理工大学的李玉川等[13]对2的合成进行了更深入的研究。通过选择不同的氧化剂,研究了氧化剂类型对反应的影响,结果见表 1。
| 表 1 氧化剂对4, 4′, 6, 6′-四叠氮基联亚氨基-1, 3, 5-三嗪氧化偶联反应的影响 Tab.1 Effects of different oxidants on oxidation-coupling reaction of 4, 4′, 6, 6′-tetraazidohydrazo-1, 3, 5-triazine |
由表 1可知,采用不同氧化剂对2的产率影响较大。能产生较大活性自由基的氧化剂如Cl2,SDCI等对应目标产物的收率较高,而且纯度较好;使用固体氧化剂反应时间稍长,原因在于固体氧化剂自由基的释放速率相对液态氧化剂的释放速率要稍缓一些。而选择H2O2,KMnO4(H+ or OH-)和活性MnO2为氧化剂,无论如何变化反应条件,均得不到目标化合物。对比表 1中的各种氧化剂可知,除H2O2,KMnO4和活性MnO2以外,其余9种氧化剂均可产生自由基。这就说明联亚氨基的氧化偶联反应为自由基反应机理,见Scheme 3(以Cl2为例)。
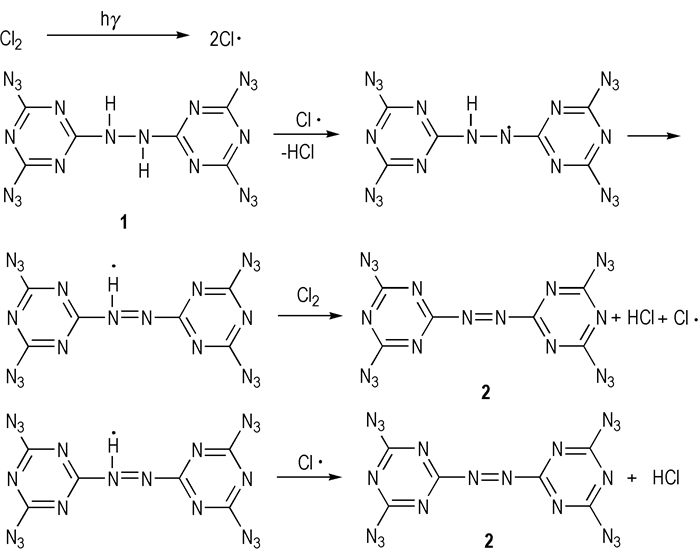
|
Scheme 3 |
在所使用的可产生自由基的氧化剂中,Cl2和Br2对设备和操作条件要求较为苛刻,存在潜在的安全问题;TCI,SDBI,NCS,NBS等氧化剂较为昂贵;SDCI和NaCl O低毒安全、易于运输、价格低廉,作为氧化剂时反应条件温和。此外,SDCI的溶解度比TCI等含氯氧化剂要高得多,实际使用效果最好,应用范围更广,是此类反应较合适的氧化剂。
David E.C.等[14]首先将3, 5-双(3, 5-二甲基吡唑-1-基)-1, 2, 4, 5-四嗪与肼反应,得到偶联中间体3, 3′-[3, 6-二(3, 5-二甲基吡唑)基]联亚氨基-1, 2, 4, 5-四嗪(3),然后以Br2,MnO2,HgO和HONO为氧化剂试图氧化3中的联亚氨基,但均未取得成功;而选用NBS为氧化剂时,可以将3中的联亚氨基氧化为偶氮基,得到结构明确的目标化合物3, 3′-[3, 6-二(3, 5-二甲基吡唑)基]偶氮基-1, 2, 4, 5-四嗪(4),产率高达98%,反应方程式见Scheme 4。
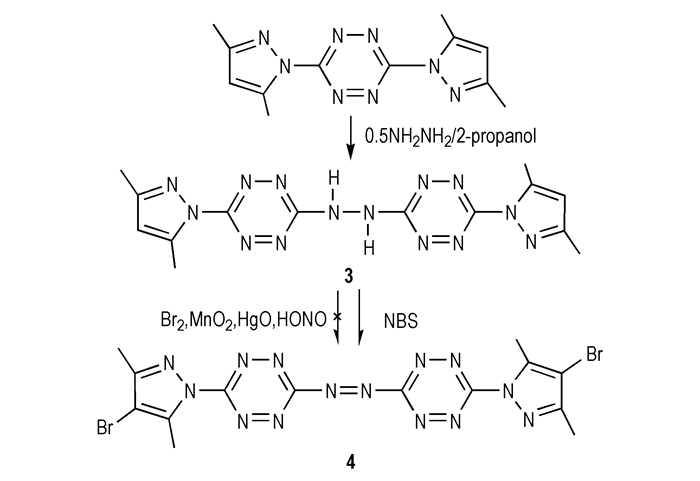
|
Scheme 4 |
4的合成进一步验证了该类反应遵循自由基氧化反应机理。值得注意的是,同样是选择可产生自由基的Br2作为氧化剂,却不能得到目标化合物。从推测的反应机理来看,卤素自由基在进行提取氢原子的反应时,NBS(即溴自由基)的提取能力要高于Br2,前者具有更大的反应活性。通常情况下,自由基活性越大则选择性越差,会导致副反应增多。但是3中由于仅有两个氢原子且相互对称,无论卤素自由基提取哪一个氢原子均得到相同的产物,不存在选择性问题。因此,从反应活性和选择性两方面综合考虑,此类反应须选择自由基活性较大的氧化剂[15]。
3 氨基-偶氮基氧化偶联向氮杂环间引入偶氮键的方法除了利用联亚氨基的氧化反应外,还可通过杂环上氨基(C—NH2和N—NH2)的氧化偶联来实现。此类反应可由Scheme 5概括。

|
Scheme 5 |
此类反应不仅可以选择NaOC l,TCI,DC I,SDCI,DB I,SDBI,NCS,NBS等能够产生活性自由基的氧化剂,H2O2,KMnO4,AgO,Pb(OAc)4及活性MnO2等非自由基氧化剂也可用于此类氧化偶联反应。对于后者,王伯周等[16-18]以3, 3′-偶氮双(6-氨基-1, 2, 4, 5-四嗪)和3, 3′-二氰基-4, 4′-偶氮氧化呋咱的合成为研究对象,提出了脱水氧化机理,见Scheme 6。
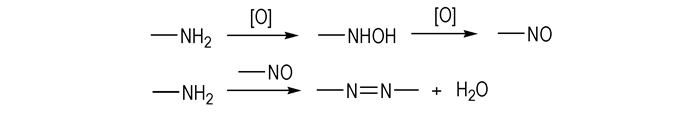
|
Scheme 6 |
然而,对于氨基(C—NH2和N—NH2)的自由基氧化机理,尚需进一步研究。
3.1 C—NH2氧化偶联通常,C—NH2的氧化偶联可以选择电化学氧化[19-20]和氧化剂氧化两种方法。电化学氧化偶联时产率较低,目前文献报道较少。因此,研究热点仍集中于化学氧化剂方面。
Batog L.V.等[21]以DBI为氧化剂,4-氨基-5-(4-R1-5-R2-1, 2, 3-三唑-1-基)呋咱(5)发生分子间的C—NH2氧化偶联反应,得到偶氮化合物4, 4′-偶氮基-5-(4-R1-5-R2-1, 2, 3-三唑-1-基)呋咱(6)。如果用KMnO4/H+为氧化体系,则会同时发生氨基的氧化偶联和三唑基的氧化分解,得到偶氮化合物7,见Scheme 7。
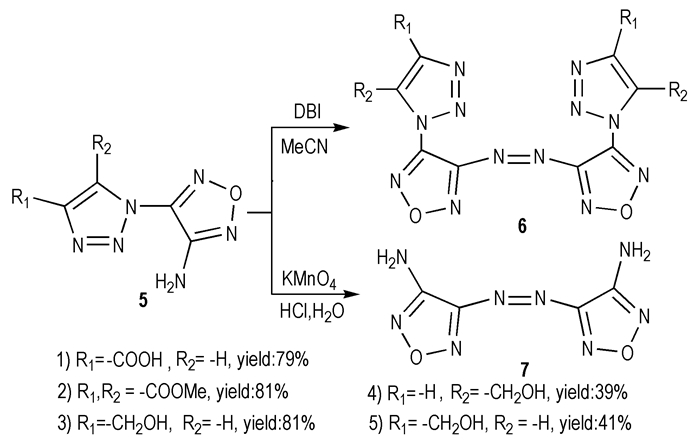
|
Scheme 7 |
Batog L.V.等[22]尝试了H2O2/H2SO4体系进行4-氨基-5-(4-羟甲基-5H-1, 2, 3-三唑-1-基)呋咱的氨基氧化偶联反应,但未取得成功。David C.和Larry H.等[23]试图利用H2O2/H2SO4体系氧化3, 4-二氨基呋咱(8)来制备3, 3′-二氨基-4, 4′-偶氮呋咱(9)(见Scheme 8)。但实验结果表明,该氧化体系中不仅发生了目标偶联反应,还生成了3, 3′-二氨基-4, 4′-氧化偶氮呋咱、3-氨基-4-硝基呋咱和双[1,2,5]-噁二唑并[3, 4-c:3′, 4′-g][1,2,5,6]四氮杂环辛四烯(10)三种副产物,反应方程式见Scheme 8。Talawar等[24]采用单电子氧化剂KMnO4氧化8,则所得产物以9为主,收率可达89%。
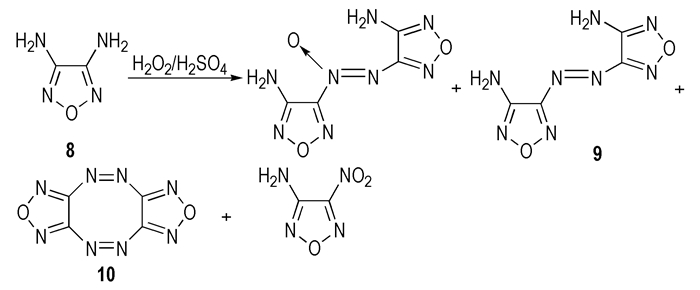
|
Scheme 8 |
此外,为了得到高产率的10,他们又针对8进行了多种氧化体系实验,并最终从H2O2,TCI,DC I,SDCI,DB I,SDBI,NCS,NBS中选择出TCI作为最佳氧化剂,产率可达48%。
Darren L.N.等[25]研究了5-氨基-3-硝基-1-氢-1, 2, 4-三唑(11)的氧化偶联行为,选择KMnO4/H+为氧化剂,见Scheme 9。实验结果发现,产物中含有少量的副产物(13)。该反应对实验条件的变化比较敏感,主产率随着KMnO4加入速率的减慢、浓盐酸用量的增大而逐渐降低,主产物产率变化范围为38%~70.6%。遗憾的是,导致产率变化的根本原因至今尚不清楚,这与氧化反应自身的复杂性密切相关。
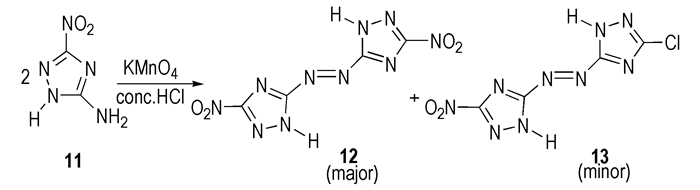
|
Scheme 9 |
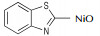
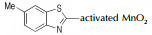
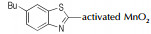
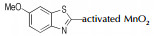
Wang等[26]系统地研究了AgO,Pb(OAc)4,NaOCl,KMnO4,NiO及活性MnO2对噻唑类杂环氧化偶联反应的影响,涉及的反应通式如Scheme 10所示,结果详见表 2。由表 2可以看出:(1)对于同一种氧化偶联单体(如2-氨基苯并噻唑),偶联反应收率会依氧化剂类型不同而改变;(2)对于同一种氧化剂(如活性MnO2),偶联单体的取代基对反应产率影响较大[23, 27]。
|
Scheme 10 |
| 表 2 氧化剂对偶氮苯并噻唑合成的影响 Tab.2 Effects of different oxidants on the synthesis of azo-benzothiazole |
氮杂环上的N—NH2氧化偶联的方法文献报道较少,可选择的氧化剂包括:HgO,NH2Cl/H+,次氯酸叔丁酯,SDCI,二氮烯(HN=NH)等[28, 29]。
Bernd P.等[30]以HgO作为氧化剂研究了1-氨基-2-羟甲基吡咯烷(14)的氧化偶联反应。实验发现,直接氧化14虽能得到目标产物15,但收率很低。原因在于15在后处理(减压蒸馏)过程中会直接分解。如果首先将14中的羟基用三甲基氯硅烷保护起来,氧化反应生成的中间体16不易发生分解,将16进一步水解可得目标产物15,产率可达46%。
Delalu H.等[31]首先通过氯胺对3-氮杂双环[3,3,0]辛烷(17)进行氨基化反应得到中间体18,进一步酸化处理可以得到四氮烯化合物即N, N ′-偶氮基-3-氮杂双环[3,3,0]辛烷(19)。此反应主要是利用氯胺的氧化性得到了离子型的中间结构,然后通过二聚化作用形成偶氮基团。
Jeffrey C.B.等[32]报道使用次氯酸叔丁酯能够氧化高氮杂环氮原子上的氨基形成一系列偶氮键相连接的多氮化合物(如化合物20 ~ 23),但没有任何相关的结构表征以及物理性质的报道。

|
Scheme 11 |
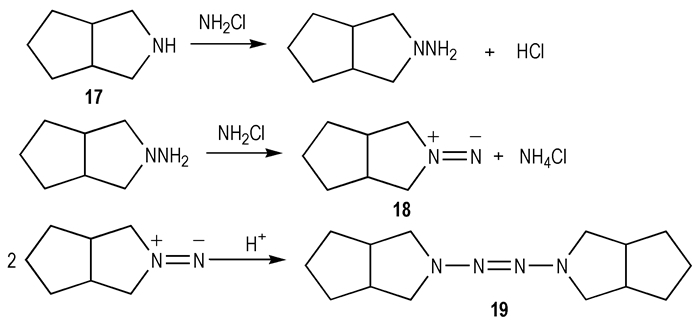
|
Scheme 12 |
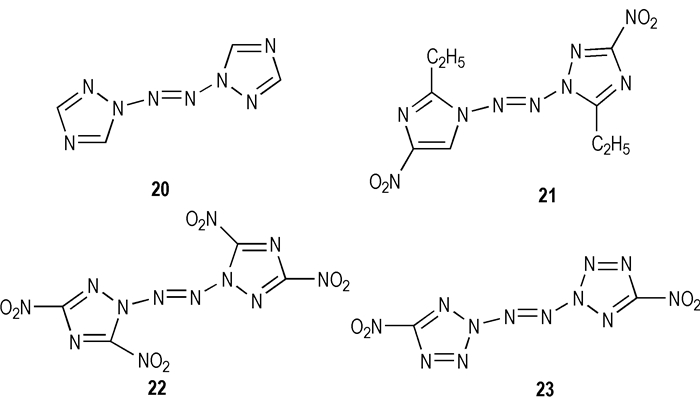
|
Scheme 13 |
北京理工大学李玉川课题组[33-36]多年致力于探索在高氮杂环的氮原子上引入偶氮键高产率得到多氮化合物的合成方法以及对相关多氮化合物的结构表征和性能的研究。他们在SDCI/CH3COOH体系中氧化4-氨基-1, 2, 4-三唑(24)、1-氨基-1, 2, 3-三唑(26)发生氨基偶联反应,分别合成出了四个氮原子(N4)和八个氮原子(N8)直接相连的4, 4′-偶氮基-1, 2, 4-三唑[37](25)和1, 1′-偶氮基-1, 2, 3-三唑[8](27),并对两种目标产物进行了结构表征和相关性能研究。晶体结构表明,两种化合物的芳香性并不局限于三唑环内,而是两个三唑环和偶氮键一起构成一个大的π电子共轭体系。此外,他们还证实,不仅偶氮键的引入能够增加多氮化合物的密度和生成焓,而且偶氮键联于杂环氮原子比联于杂环碳原子更有利于提高多氮化合物的密度和生成焓(见Scheme 15)
|
Scheme 14 |
|
Scheme 15 |
2011年,Klapötke T. M.等[38]借鉴李玉川课题组的研究思路,用SDCI氧化偶联1-氨基-1, 2, 3, 4-四唑(28)合成了十个氮原子直接相连的1, 1′-偶氮基-1, 2, 3, 4-四唑(29)(见Scheme 16)。作者还尝试了用次氯酸叔丁酯作为氧化剂,始终无法得到目标产物。原因在于次氯酸叔丁酯氧化体系中目标产物不稳定,极易发生分解。由于29感度极高(摩擦感度小于1 J),作者对其只进行了拉曼光谱和核磁共振的测试,进一步的研究尚未见文献报道。此外,计算结果表明,该N10型化合物的生成焓高达+1030 kJ·mol-1,密度为1.774 g·cm-3,而上述N8型偶氮化合物的生成焓+962 kJ·mol-1,密度为1.640 g·cm-3。由此可见,化合物中直接相连的氮原子数目越多则该化合物的含能性质越突出,但化合物的稳定性将会有所降低。
|
Scheme 16 |
目前,超过八个氮原子直接相连接的多氮化合物的合成报道很少,大都还在理论设计和计算阶段[39-41],例如Mikhail N.G.等[42]提出了通过氨基五唑(30)的氧化偶联反应合成1, 1′-偶氮基-1, 2, 3, 4, 5-五唑(31)的设计思路(Scheme 17)。计算结果表明,该N12型全氮化合物的生成焓高达+1343 kJ·mol-1,能量水平相当可观。但由于前体化合物30的合成存在诸多困难,该设计思路尚无法具体实施。
|
Scheme 17 |
随着新型高能量密度材料的不断发展,合成具有多个氮原子直接相连的多氮乃至全氮化合物对科研工作者来讲具有很大的挑战性。N—NH2的氧化偶联反应丰富了由—N—N=N—N—连接的双环化学,其独特的多氮原子相连的稳定结构增强了学者们对合成一系列新型多氮化合物的希望和信心,对于合成多氮甚至全氮化合物提供了基础和参考。
4 结论联亚氨基和氨基的氧化偶联反应是合成氮杂环-偶氮化合物的主要方法,其关键技术在于氧化剂的选择。尤其是多氮唑类杂环上N—NH2的氧化偶联反应,如果采用常规的氧化剂如KMnO4、活性MnO2、H2O2等,产率会很低甚至无法反应。因此,应该以增强氧化剂的反应活性和选择性为主要发展方向,以氧化反应机理研究为基础,不断开发新型、高效的氧化体系,以期提高反应收率。
| [1] |
Huynh M H V, Hiskey M A, Chavez D E, et al. Synthesis, characterization, and energetic properties of diazido heteroaromatic high-nitrogen C—N compound[J].
J Am Chem Soc, 2005, 127(36): 12537-12543. DOI:10.1021/ja0509735 |
| [2] |
Abe T, Tao G H, Joo Y H, et al. Activation of the C—F bond: transformation of CF3N=N— into 5-azidotetrazoles[J].
Angew Chem, 2008, 120(37): 7195-7198. DOI:10.1002/ange.v120:37 |
| [3] |
Klapötke T M, Mayer P, Schulz A, et al. 1, 5-Diamino-4-methyltetrazolium dinitramide[J].
J Am Chem Soc, 2005, 127(7): 2032-2033. DOI:10.1021/ja042596m |
| [4] |
Sato T, Narazaki A, Kawaguchi Y, et al. Dicyanocarbodiimide and trinitreno-s-triazine generated by consecutive photolysis of triazido-s-triazine in a low-temperature nitrogen matrix[J].
Angew Chem Int Ed, 2003, 42(42): 5206-5209. DOI:10.1002/(ISSN)1521-3773 |
| [5] |
李小童, 庞思平, 于永忠, 等. [3, 6-二叠氮基-1, 2, 4, 5-四嗪]的合成及理论研究[J].
化学学报, 2007, 65(10): 971-976. LI Xiao-tong, PANG Si-ping, YU Yong-zhong, et al. Synthesis and theoretic studies of 3, 6-diazido-1, 2, 4, 5-tetrazine[J]. Acta Chim Sinica, 2007, 65(10): 971-976. DOI:10.3321/j.issn:0567-7351.2007.10.016 |
| [6] |
Huynh M H V, Hiskey M A, Hartline E L, et al. Polyazido high-nitrogen compounds: hydrazo-and azo-1, 3, 5-triazine[J].
Angew Chem Int Ed, 2004, 43(37): 4924-4928. DOI:10.1002/(ISSN)1521-3773 |
| [7] |
Chavez D E, Hiskey M A, Gilardi R D. 3, 3′-Azobis(6-amino-1, 2, 4, 5-tetrazine): a novel high-nitrogen energetic material[J].
Angew Chem Int Ed, 2000, 39(10): 1791-1793. DOI:10.1002/(SICI)1521-3773(20000515)39:10<1791::AID-ANIE1791>3.0.CO;2-9 |
| [8] |
李玉川, 李生华, 祁才, 等. 新型多氮化合物1, 1′-偶氮-1, 2, 3-三唑的合成与性能研究[J].
化学学报, 2011, 69(19): 2159-2165. LI Yu-chuan, LI Sheng-hua, QI Cai, et al. Synthesis and performance of a novel poly-nitrogen compound 1, 1′-azobis-1, 2, 3-triazole[J]. Acta Chim Sinica, 2011, 69(19): 2159-2165. |
| [9] |
LI Yu-chuan, QI Cai, LI Sheng-hua, et al. 1, 1′-Azobis-1, 2, 3-triazole: a high-nitrogen compound with stable N8 structure and photochromism[J].
J Am Chem Soc, 2010, 132(35): 12172-12173. DOI:10.1021/ja103525v |
| [10] |
Klapötke T M, Mayer P, Schulz A. 1, 4-Bis-[1-methyltetrazol-5-yl]-1, 4-dimethyl-2-tetrazene: a stable, highly energetic hexamer of diazomethane (CH2N2)6[J].
Propellant, Explos Pyrotech, 2004, 29(6): 325-332. DOI:10.1002/prep.v29:6 |
| [11] |
Herve G, Jacob G, Gallo R. Preparation and structure of novel hexaazaisowurtzitane cages[J].
Chem Eur J, 2006, 12(12): 3339-3344. DOI:10.1002/(ISSN)1521-3765 |
| [12] |
Balachandran K S, George M V. Oxidation with metal oxides-Ⅵ: oxidation of benzoylhydrazones of aldehydes, ketones and 1, 2-diketones with nickel peroxide[J].
Int J Chem, 1973, 11: 1267-1271. |
| [13] |
李玉川, 张雪娇, 付耿, 等. 4, 4′, 6, 6′-四叠氮基偶氮-1, 3, 5-三嗪(TAAT)的合成、表征与热分解研究[J].
有机化学, 2011, 31(9): 1484-1489. LI Yu-chuan, ZHANG Xue-jiao, FU Di, et al. Synthesis, characterization and thermal decomposition mechanism of 4, 4′, 6, 6′-tetra(azido)azo-1, 3, 5-triazine(TAAT)[J]. Chinese Journal of Organic Chemistry, 2011, 31(9): 1484-1489. |
| [14] |
David E C, Michael A H, Richard D G. 3, 3′-Azobis(6-amino-1, 2, 4, 5-tertrazine):a novel high-nitrogen energetic material[J].
Angew Chem Int Ed, 2000, 39(10): 1791-1793. DOI:10.1002/(SICI)1521-3773(20000515)39:10<1791::AID-ANIE1791>3.0.CO;2-9 |
| [15] |
李小童, 庞思平, 于永忠, 等. 高氮化合物4, 4′, 6, 6′-四叠氮基偶氮-1, 3, 5-三嗪的合成研究[J].
含能材料, 2007, 15(5): 485-489. LI Xiao-tong, PANG Si-ping, YU Yong-zhong, et al. Synthesis of high-nitrogen compound of 4, 4′, 6, 6′-tetra(azido)azo-1, 3, 5-triazine[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2007, 15(5): 485-489. |
| [16] |
王伯周, 来蔚鹏, 廉鹏, 等. 3, 3′-偶氮双(6-氨基-1, 2, 4, 5-四嗪)新法合成、表征与量子化学研究[J].
有机化学, 2009, 29(8): 1243-1248. WANG Bo-zhou, LAI Wei-peng, LIAN Peng, et al. Novel synthesis, characterization and quantum chemistry study on 3, 3′-azobis(6-amino-1, 2, 4, 5-tetrazine)[J]. Chinese Journal of Organic Chemistry, 2009, 29(8): 1243-1248. |
| [17] |
范艳洁, 王伯周, 周彦水, 等. 3, 3′-二氰基-4, 4′-偶氮氧化呋咱(DCAF)合成及晶体结构[J].
含能材料, 2009, 17(4): 385-388. FAN Yan-jie, WANG Bo-zhou, ZHOU Yan-shui, et al. Synthesis and crystal structure of 3, 3′-dicyano-4, 4′-azofuroxan(DCAF)[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2009, 17(4): 385-388. |
| [18] |
罗义芬, 马玲, 王伯周, 等. 3, 3′-二氰基-4, 4′-偶氮氧化呋咱合成与表征[J].
含能材料, 2010, 18(5): 538-540. LUO Yi-fen, MA Ling, WANG Bo-zhou., et al. Synthesis and characterization of 3, 3′-dicyano-4, 4′-azofuroxan[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2010, 18(5): 538-540. |
| [19] |
Oturan M A, Pinson J, Traikia M, et al. The electrochemical oxidation of riluzole, a neuroprotective drug: comparison with the reaction with oxygen derived radicals[J].
J Chem Soc Perkin Trans 2, 1999: 619-622. |
| [20] |
Goyal R N, Srivastava K A, Ahmad S S, et al. Annelated[1, 2, 4, 5]tetrazines[J].
Bull Soc Chim Fr, 2001, 38(3): 541-559. |
| [21] |
Batog L V, Konstantinova L S, Rozhkov V Y, et al. Synthesis of nitro, nitroso, azo, and azido derivatives of (4-R1-5-R2-1, 2, 3-triazol-1-yl)-1, 2, 5-oxadiazoles by oxidation and diazotization of the corresponding amines[J].
Russ Chem Bull, 2005, 54(8): 1915-1922. DOI:10.1007/s11172-006-0058-9 |
| [22] |
Batog L V, Rozhkov V Y, Shatunova E V, et al. Synthesis and transformations of 4-amino-4′-(4-nitro-1H-1, 2, 3-triazole-1-yl)-and 4-amino-4′-(1, 2, 3-triazole[4, 5-c]-1, 2, 5-oxadiazol-5-yl)-3, 3′-(NNO)-azoxy-1, 2, 5-oxadiazoles[J].
Russian Chemical Bulletin International Edition, 2008, 57(1): 165-169. DOI:10.1007/s11172-008-0024-9 |
| [23] |
David C, Larry H, Michael A H, et al. Preparation and explosive properties of azo-and azoxy-furazans[J].
Journal of energetic materials, 2000, 18(2-3): 219-236. DOI:10.1080/07370650008216121 |
| [24] |
Talawar B L, Vedso P, Morel S, et al. Synthesis of 2-substituted 1-hydroxyimidazoles through directed lithiation[J].
J Org Chem, 1998, 63(1): 12-16. DOI:10.1021/jo970355+ |
| [25] |
Darren L N, Michael A H, Herbert H H. Synthesis and explosive properties of 5, 5′-dinitro-3, 3′-azo-1-H-1, 2, -4-triazole(DNAT)[J].
Journal of Energetic Materials, 2003, 21(1): 57-62. DOI:10.1080/07370650305584 |
| [26] |
Wang X M, Kazumasa F, Masaki M. Synthesis and properties of bis(hetaryl)azo dyes[J].
Dyes and Pigm, 2003, 57: 77-86. DOI:10.1016/S0143-7208(03)00011-1 |
| [27] |
Loew P, Weis C D. Azo-1, 3, 5-triazines[J].
J Heterocycl Chem, 1976, 13(4): 829-833. DOI:10.1002/jhet.v13:4 |
| [28] |
Wang M X, Funabiki K, Matsui M. Synthesis and properties of bis(hetaryl)azo dyes[J].
Dyes Pigm, 2003, 57: 77-86. DOI:10.1016/S0143-7208(03)00011-1 |
| [29] |
Najim A A, Yaseen A A, Ashmehan A. N-and C-acyclic thionuleoside analogues of 1, 2, 3-triazole[J].
Heteroat Chem, 2003, 15(5): 380-387. |
| [30] |
Bernd P, Ralf M, Peter H, et al. First synthesis and investigation of two hydroxyalk-yl-substituted 2-tetrazenes[J].
Eur J Org Chem, 1998: 1431-1440. |
| [31] |
Delalu H, Elkhatib M, Peyrot L. Synthesis and NMR investigation of 3, 4-diazabicyclo[4.3.0]non-2-ene and N, N′-azo-3-azabicycl-o[3, 3, 0]octane. X-ray crystal structure analysis of a new tetrazene derivative[J].
J Heterocyclic Chem, 1999, 36: 681-686. DOI:10.1002/jhet.v36:3 |
| [32] |
Jeffrey C B, Robert J S, Paul E P. N, N ′-azobis-nitroazoles and analogs thereof as igniter compounds for use in energetic composition [P]. US, 5889161, 1999.
|
| [33] |
LI Sheng-hua, PANG Si-ping, LI Xiao-tong, et al. Synthesis of new tetrazene(N—N=N—N)-linked bi(1, 2, 4-triazole)[J].
Chin Chem Lett, 2007, 18(10): 1176-1178. DOI:10.1016/j.cclet.2007.08.018 |
| [34] |
李生华, 庞思平, 李小童, 等. 多叠氮基三唑类高氮化合物的合成与晶体结构[J].
有机化学, 2008, 28(4): 727-731. LI Sheng-hua, PANG Si-ping, LI Xiao-tong, et al. Synthesis and crystal structure of novel highly nitrogen-containing compound of polyazidotriazole[J]. Chin J Org Chem, 2008, 28(4): 727-731. |
| [35] |
LI Sheng-hua. Synthesis and crystal structure of nitrogen-rich compound: 2, 5, 2′-triazido-1, 1′-azo-1, 3, 4-triazole[J].
J Chem Crystallogr, 2009, 39: 13-16. DOI:10.1007/s10870-008-9411-1 |
| [36] |
QI Cai, LI Sheng-hua, LI Yu-chuan, et al. A novel stable high-nitrogen energetic material: 4, 4′-azobis(1, 2, 4-triazole)[J].
J Mater Chem, 2011, 21(9): 3221-3225. DOI:10.1039/c0jm02970j |
| [37] |
LI Sheng-hua. Synthesis and crystal structure of 2, 2′, 5, 5′-tetrachloro-1, 1′-azo-1, 3, 4-triazole[J].
Chinese Journal of Energetic Materials, 2009, 17(1): 7-10. |
| [38] |
Klapötke T M, Piercey D G. 1, 1′-Azobis(tetrazole): a highly energetic nitrogen-rich compound with a N10 chain[J].
Inorganic Chemistry, 2011, 50(7): 2732-2734. DOI:10.1021/ic200071q |
| [39] |
Cowley R E, Elhaik J, Ecker N A, et al. A bridging hexazene (RNNNNNNR) ligand from reductive coupling of azides[J].
J Am Chem Soc, 2008, 130(19): 6074-6075. DOI:10.1021/ja801375g |
| [40] |
Jones D W. Preparation and reactions of cis-1, 4-diphthaloyltetra-az-2-ene[J].
J Chem Soc Perkin Trans I, 1976(10): 1150-1155. DOI:10.1039/p19760001150 |
| [41] |
Simkin B Y, Minkin V I, Glukhovtsev M N. The concept of aromaticity in heterocyclic chemistry[J].
Adv Heterocycl Chem, 1993, 56: 303-428. DOI:10.1016/S0065-2725(08)60196-8 |
| [42] |
Mikhail N G, Jiao H J, Paul R S, et al. Besides N2, what is the most stable molecule composed only of nitrogen atoms?[J].
Inorg Chem, 1996, 35(24): 7124-7133. DOI:10.1021/ic9606237 |
Advances in oxidation-coupling reaction of hydrazo-azo and amino-azo in nitrogen-containing heterocyclic compounds were reviewed. The effects of different oxidants on oxidation-coupling reaction were discussed and the trends in the development of oxidation-coupling reaction of nitrogen-containing heterocyclic compounds were pointed out.