2. 国防科学技术大学航天科学与工程学院,湖南 长沙 410073
2. College of Aerospace Science and Engineering, National University of Defense Technology, Changsha 410073, China
随着固体火箭冲压发动机技术的发展及其对高能量推进剂的需求,在推进剂中添加镁、铝和硼等高能添加剂成为其发展方向之一。在飞行马赫数2.0,工作高度为海平面,进入冲压燃烧室的空气温度540 K,冲压燃烧室的工作压强0.57 MPa,喷管出口压强0.101 MPa,贫氧推进剂的初温298 K的计算条件下,高氯酸铵(AP)含量40%、端羟基聚丁二烯(HTPB)含量20%、镁粉/铝粉/硼粉含量分别为40%的贫氧推进剂比冲分别可达7381.5、7887.5和8365.7 N·s·kg-1[1]。含镁推进剂虽然能量密度低于含铝和含硼推进剂,但镁金属较低的熔点和沸点使其点火特性和燃烧效率更优,因而同样成为研究热点[2-3]。20世纪70年代,前苏联将镁基水反应金属燃料成功应用于超高速鱼雷巡航推进系统[4],我国近年来在中高镁含量(镁含量60%和73%等)的水反应金属燃料燃烧机理研究上也取得了进展[5-8]。另外,直接采用镁粉作为发动机燃料也处于应用研究阶段,镁粉燃料粉末冲压发动机已得到了试验验证[9-11],燃烧室压力0.5 MPa,喷管出口压力为环境压力时,其理论比冲高达12000 N·s·kg-1[12];美国国家航空和航天管理局在21世纪初提出了以镁粉作为火星探测器燃料[13-14],利用镁粉与火星大气中的CO2反应提供推力,燃烧室压力1 MPa,喷管出口压力10-3 MPa时,其比冲可达2200 N·s·kg-1[15]。
发动机工作过程中,镁基金属燃料的能量主要通过镁颗粒与氧化剂燃烧释放出来,生成的高温燃气经喷管膨胀产生推力。作为发动机中主要燃料,镁颗粒的快速着火和充分燃烧,是提高发动机燃烧性能的关键。20世纪90年代中期,曹泰岳[16]指出,金属颗粒对推进剂性能的影响在很大程度上取决于金属颗粒燃烧的细节,包括金属颗粒的结团、着火、燃烧及燃烧产物的弥散等过程。因此,研究镁颗粒的着火与燃烧过程,对采用镁基贫氧推进剂发动机的燃烧组织与性能预示具有重要意义。本文将从镁颗粒在O2、CO、CO2和H2O(g)等氧化性环境中镁颗粒着火前表面变化特征、燃烧特征、燃烧产物几个方面的实验现象进行归纳总结,并对镁颗粒燃烧过程中表面氧化层形成机理进行讨论,最后分别介绍了镁颗粒在空气或O2、CO2和H2O(g)环境中燃烧的理论模型。
2 镁颗粒在不同氧化性气氛中的燃烧特性 2.1 镁颗粒在空气和O2中的燃烧特性常规冲压发动机的动力主要是靠冲压进入补燃室的空气作为氧化剂与高温燃气和金属颗粒进一步反应释放热量转化而来,因此最初对镁颗粒燃烧的研究主要集中于空气或O2环境中的燃烧。
20世纪60年代,Cassel H M[17]等对镁颗粒在空气或O2中的燃烧开展了实验研究。利用火炉对高硅玻璃管加热,高硅玻璃管内分别充满了空气或O2,将直径20~120 μ m的镁颗粒喷射进玻璃管,实现了镁颗粒的燃烧,观察到反应区与颗粒表面相距一定距离,在假设燃烧过程是由O2扩散速率控制基础上,结合实验结果获得了燃烧时间。镁颗粒在纯O2中的燃烧时间约为在空气中的十分之一,由此认为镁颗粒在空气中的燃烧由O2的扩散速率控制,而在O2中的燃烧主要受镁的蒸发速率控制。根据热力学和热化学分析,认为反应过程中MgO的核晶速率和沉积过程决定了反应区的厚度。在Van′t Hoff-Le Chatelier点火理论基础上,假设燃烧速率可由Arrhenius定律描述,分析得到颗粒着火温度是环境气体介质热传导系数的函数[18]。
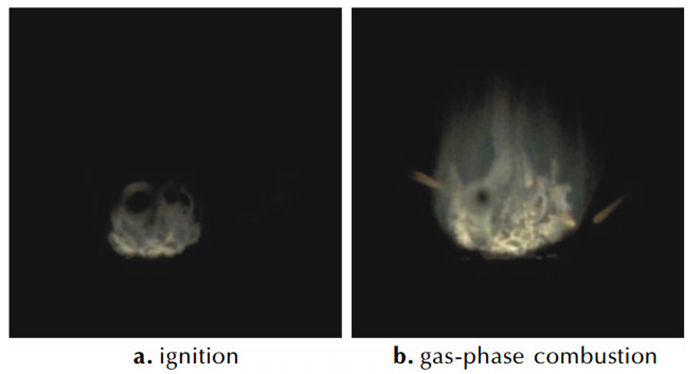
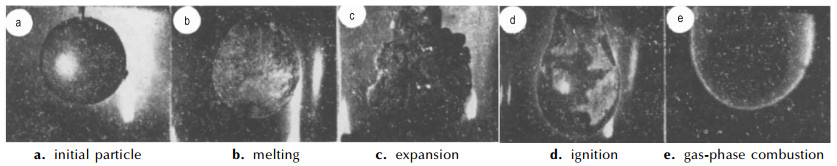
Derevyaga M E[19]将纯度为99.9%,直径分别为3,4,6 mm的球形镁颗粒固定在钨铼热电偶上,利用高温氧化性气体对颗粒进行加热至燃烧,研究了镁颗粒在高温O2中的燃烧机理,整个燃烧过程如图 1。图 1a是颗粒初始状态,当颗粒到达热平衡时,表面覆盖一层氧化层(图 1b);随着温度升高,颗粒膨胀,表面开始出现粒状鼓包(图 1c);颗粒膨胀导致表面氧化层破裂,液态镁暴露出来,颗粒着火(图 1d)并迅速过渡到气相燃烧状态(图 1e);燃烧剩余物呈多孔状,明显大于颗粒初始大小。黄利亚[20]也观测到相似燃烧过程,如图 2。图 2b、图 2c和图 2d分别与图 1c、图 1d和图 1e对应。Derevyaga M E将镁在O2中的燃烧分为四个阶段:泡沫段(foam formation)、气相氧化段(oxidation occurs in gas phase)、过渡段(transition)、溅射燃烧段(combustion occurs with spattering)。在燃烧阶段,镁液滴温度逐渐达到液态镁沸点温度(1363 K)。
|
图 1 镁颗粒(直径6 mm)表面随时间变化[19] Fig.1 The changes of magnesium particle with diameter of 6 mm surface with time |

|
图 2 镁颗粒在空气中的燃烧过程[20] Fig.2 Combustion process of a magnesium particle in air |
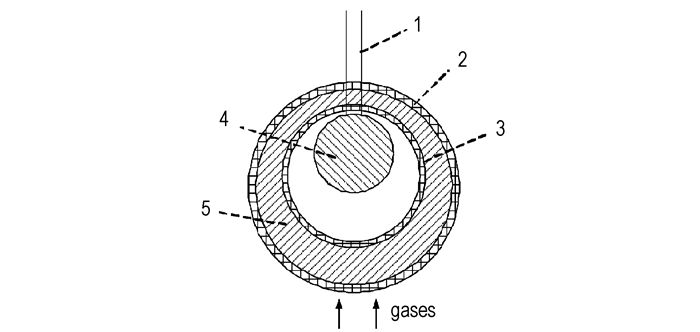
此外,Derevyaga M E在研究压力对镁颗粒燃烧的影响时[21]发现,高压下镁液滴的燃烧过程分为两个阶段。在第一阶段,镁颗粒发生气相燃烧,此时镁滴的温度保持恒定,接近其沸点;在火焰最明亮的区域形成外层氧化层,推断是由分散的氧化产物烧结形成的;同时,镁滴表面也会形成另外一层氧化层,称为内层氧化层,它是微小的燃烧产物在镁滴表面沉积形成的,内外氧化层之间是多孔的氧化物,氧化层结构如图 3所示。当外层氧化层完全将镁滴包裹后,气相燃烧停止,燃烧过程进入第二阶段。在第二阶段,内外氧化层之间的多孔氧化物中会发生剧烈的化学反应,氧化层会变得较为明亮(第一阶段比第二阶段亮几倍),颗粒温度下降,燃烧速率逐渐降低。燃烧剩余物是一个空心壳,内壳直径小于原镁颗粒的初始直径,外壳直径大于初始直径,约是初始直径的1.4倍。
|
图 3 镁颗粒在高压下燃烧表面的氧化层示意图[21] 1—热电偶, 2—外层氧化层, 3—内层氧化层, 4—镁液滴, 5—多孔氧化物 Fig.3 Diagram of oxide layer of a Mg particle combustion surface at high pressure[21] 1—thermocouple, 2—external oxide shell, 3—internal oxide shell, 4—liquid metal droplet, 5—porous residue |
从以上镁在O2中燃烧的研究来看,镁颗粒着火阶段是表面多相氧化过程,颗粒吸热熔化后膨胀将颗粒表面氧化层撑破,液态镁暴露出来并伴随着一定量的镁蒸气,此时发生着火,其燃烧过程均属于气相燃烧,并且随着环境O2浓度的增加燃烧速率加快,气相燃烧逐步由O2扩散速率控制向镁蒸发速率控制转变。此外,镁颗粒的燃烧产物为空心球壳状也能说明其燃烧过程是气相燃烧。表面氧化层的多孔性质在燃烧阶段对颗粒表面的传热传质均有不同程度的影响,使其燃烧过程有别于简单的液滴蒸发燃烧。
Kashireninov O E[22]采用化学动力学分析方法进一步对燃烧过程的气相反应区进行了分析,并提出气相燃烧中颗粒表面也可能存在多相氧化反应,这与表面氧化层的性质息息相关。Florko A V等[23]利用直径2~6 mm颗粒的气相燃烧区的发射光谱,获得了气相反应区的温度和厚度,并计算出了镁与O2反应的活化能和指前因子分别为(168±21) kJ·mol-1和106 m3·(mol·s)-1。
2.2 镁颗粒在CO2和CO中的燃烧特性20世纪末火星探测逐渐兴起,根据火星大气层的特性提出了以镁与CO2反应为探测器提供能源的概念,同时也开展了镁在CO2和CO中燃烧的研究。
Legrand B等[24]利用电磁悬浮装置将直径为50~100 μ m的单个镁颗粒悬浮在压力为0.1~2 MPa的高压燃烧器内,用CO2激光器进行点火,实现了镁颗粒在CO2中的燃烧。研究中发现,只有当环境压力、CO2浓度升高到一定程度时,镁颗粒才会着火,据此认为镁颗粒着火临界条件由化学动力学控制;颗粒燃烧时间只与压力有关,火焰直径是颗粒初始直径的3~4倍,由此认为镁颗粒燃烧过程由气相扩散控制。Madrid A A等[25]采用1000 W的氙灯点火,开展了微重力条件下直径为2, 3, 4 mm的圆柱形镁团(高度与直径相等)在CO2中的燃烧实验,同样观察到了气相燃烧,热电偶测得着火温度在1100 K左右,另外,还观测到微重力条件下颗粒燃烧时间是正常重力下的2倍,是正常重力下O2燃烧中的5倍。
镁颗粒在CO2中的燃烧过程同样是气相燃烧,但是其燃烧过程中表面反应和空间反应并存,CO2与镁反应生成MgO和CO,CO还会进一步与镁反应生成MgO和C。另外,产物C也会附着在颗粒表面,进一步影响颗粒表面的传热传质,从而导致其燃烧速率与O2中的燃烧情况不同。
Gol′dshleger U I等[26-27]采用热重分析法分别研究了1.01 kPa下、温度为898~1323 K范围内粒径为1~3 mm的单个镁颗粒在CO2和CO介质中的详细反应过程。将镁颗粒悬挂在热电偶上,热电偶与测重装置相连,在密闭容器内充入设定温度的CO2或CO。在CO2中,当环境气体温度为898~923 K时,颗粒变化特征与在O2环境中的变化相似;环境气体温度为923~965 K时,观察到缓慢多相反应,颗粒的温度保持恒定,高于环境气体温度10~12 K,最终反应产物是一种疏松的球状空心物;当环境气体温度超过965 K时,颗粒由缓慢多相反应迅速过渡到稳定气相燃烧。在CO中,当环境气体温度低于923 K时,颗粒处于缓慢氧化阶段;环境气体温度为923~947 K时,属于缓慢多相反应阶段;环境气体温度为947~985 K时,颗粒进入气相燃烧阶段,与在CO2中不同的是火焰发生在颗粒表面,最高火焰温度为1600 K,颗粒尺寸持续增大,表面凝结产物质量是CO2中的1.5~2倍;环境气体温度为985~1230 K时,稳定的气相燃烧遭到破坏,火焰闪烁,进入脉冲燃烧(pulse combustion)阶段,颗粒温度迅速升高至镁的沸点,质量急剧减少,在火焰脉冲之间,颗粒的温度高于环境温度,随着环境气体温度继续增加,脉冲间隔减小,但随着环境气体的流速增加,脉冲间时间间隔增加;当环境气体温度为1230~1272 K时,又会出现一个高温缓慢多相反应区;当环境气体温度高于1272 K时,高温缓慢多相反应转变为气相燃烧,此时的燃烧特性与在CO2气体中的燃烧相似,火焰温度约1800 K(在CO2中约2800 K)。镁颗粒在CO2和CO中的燃烧阶段比较如图 4所示。
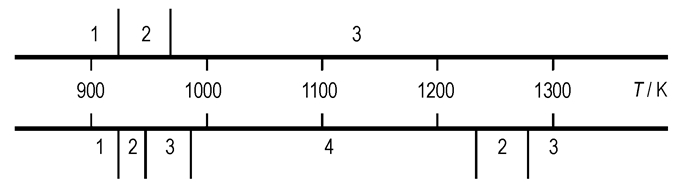
|
图 4 镁颗粒在CO和CO2中燃烧阶段[27] 1—缓慢氧化段, 2—缓慢多相燃烧, 3—气相燃烧, 4—脉冲燃烧 Fig.4 Regions of existence of the combustion of magnesium particle in the CO and CO2 media[27] 1—slow oxidation, 2—slow heterogeneous combustion, 3—vapor-phase combustion, 4—pulse combustion |
与镁颗粒在空气和O2中的燃烧特征相比,在碳氧化物中也表现出从表面多相反应过渡到气相燃烧,特别是在CO2中的燃烧特征与在空气和O2中的燃烧特征很相似,燃烧阶段均由气相扩散控制。但镁在空气和O2中燃烧产物只有MgO,不存在颗粒与产物的二次反应,而镁在CO2中燃烧会生成CO,CO扩散到颗粒表面会与镁发生二次反应,并生成固态的MgO和C附着在颗粒表面,形成致密的表面球壳。从镁在CO中的燃烧现象来看,固态燃烧产物在颗粒表面的沉积导致了在947~985 K之间的一个表面燃烧现象,此现象表明产物在颗粒表面的沉积对表面传热传质存在很大的影响,导致镁的蒸发量减小。但是随着颗粒温度的升高(985~1230 K),镁的蒸发量逐渐增大,将表面沉积物冲破,即出现了脉冲燃烧。
2.3 镁颗粒在H2O(g)中的燃烧特性自从提出利用含镁、铝等的水反应金属燃料与水反应作为水下推进系统能源的概念以来,镁颗粒在H2O(g)中燃烧的相关研究就得到了重视。1971年,Prachukho V P等[28]将单个镁颗粒喷射进由氢气和空气燃烧产生的高温H2O(g)中,实现了粒径为1~250 μ m的镁颗粒在不同压力H2O(g)中的燃烧,实验中观察到镁颗粒均是气相燃烧,部分颗粒燃烧产物呈中空球壳状,直径是初始直径的2~2.5倍。统计300~400个颗粒的燃烧时间,最后得到了燃烧时间tb与颗粒粒径d的经验式。在蒸气压力为1~6 kPa内,燃烧时间随压力增大而增加,满足tb=2.0×10-5d2.6;在6~11 kPa内,燃烧时间受压力影响较小,满足tb=4.8×10-5d1.6。另外,作者在H2O(g)中分别加入相同浓度的N2和H2进行对比实验, 验证了H2的存在能加快镁在H2O(g)中的燃烧速率。
Ozerov E S和Yurinov A A[29]采用Prachukho V P的实验装置对粒径为66~185 μ m的镁铝合金颗粒在H2O(g)中的燃烧进行了实验研究,实验中观测到镁颗粒均为气相燃烧,燃烧后的空心球壳直径是初始直径的1.5~2倍。结合扩散燃烧理论,并考虑对流对燃烧速率的影响,得到燃烧速率常数K=2δ2/Nu·τ,其中δ是颗粒的特征直径,τ是观测到的燃烧时间,Nu是Nusselt数, Nu=2+0.54Re0.5。
黄利亚[20]采用蒸气发生器将H2O(g)供应到高压燃烧器内,用电阻丝加热的方式研究了直径为1.5~5 mm镁颗粒在H2O(g)中的着火与燃烧,测得着火温度在1180 K左右,观察到了镁颗粒表面的着火过程和整个气相燃烧过程的火焰结构,如图 5所示。与空气或O2中镁颗粒燃烧剩余物相比,在H2O(g)中燃烧后剩余物更为疏松,呈向上发展的白色絮状的空心球壳,如图 6所示。根据镁与H2O(g)的反应特性推断是燃烧过程中产生的H2密度较小,会携带部分MgO向上运动,最终形成向上发展的趋势。
在水下推进系统发展的迫切需求下,近年来镁在H2O(g)中燃烧的研究蓬勃开展,从上述实验可以看出,镁颗粒在H2O(g)同样是气相燃烧,与在O2、CO2和CO中燃烧情况不同的是燃烧过程中会产生不会参与二次反应的H2,H2向环境扩散会对颗粒表面固相产物的沉积产生影响,其燃烧产物会表现出更为疏松的性质,这样颗粒表面的传热传质速率会加快,即能加快燃烧速率。另外,颗粒附近的H2会影响周围H2O(g)向反应区的扩散速率,如文献[28]所述,如果H2O(g)在H2中的扩散系数比H2O(g)在N2或Ar中的扩散系数大一个量级,就可以认为H2的存在能提高氧化剂的补充速率,从而加快燃烧速率。
3 镁颗粒燃烧过程中表面氧化层形成机理 3.1 着火前表面氧化层的形成镁颗粒在不同氧化性气体中燃烧研究结果表明,着火前颗粒表面会发生表面多相反应。2004年,Gol′dshleger U I和Amosov S D[30]在镁与高温O2反应的试验中发现,环境气体温度较低时(823~894 K),颗粒表面就开始发生缓慢的多相反应,若O2浓度较高,形成的氧化层就比较致密。Gol′dshleger U I等[26-27]对镁颗粒在CO2和CO中燃烧的研究认为,只有镁完成了多相反应阶段后才会着火。周俊虎等[31]研究水蒸气中镁颗粒着火前的高温氧化特性和机理时发现:低于673 K基本不发生反应;高于673 K后发生表面反应,反应受化学动力学控制;大约773 K才可能出现气相反应,继续加热可能出现着火和燃烧。因此,颗粒表面的多相反应是着火前表面氧化层形成的主要原因。
3.2 气相燃烧阶段表面氧化层的形成Derevyaga M E等[19, 21]认为氧化层的形成可能有两种机理:一是颗粒表面氧化物将金属蒸气吸附,并与扩散到表面的氧化剂发生反应形成氧化层;二是气相反应区的高温将产物烧结形成氧化层。Al′tman I S等[32]认为表面氧化层是由气相燃烧产物凝结形成的。
随着光学测量手段的发展,Florko A V[33]等采用UM-2单色仪记录下了直径为0.5~2 mm的镁颗粒在空气中燃烧的光谱,观察到了镁颗粒的气相燃烧过程,通过气相产物的光谱证明了镁颗粒燃烧时部分气相氧化物从反应区扩散到颗粒表面,并在表面凝结使表面氧化层增厚。
Dreizin E L[34]等采用HC120-01 Hamamatsu探测器和滤光片,观测了直径为180~250 μ m的镁颗粒燃烧中MgO的发射光谱,也证实了其燃烧过程是气相燃烧,并通过中止燃烧对熄火后的颗粒进行分析,发现未燃的镁中含有大量的O,并据此分析认为燃烧过程中O2扩散到颗粒表面,融入到液态的镁中形成Mg-O溶液,当该溶液达到饱和后就会发生放热相位分离:Mg+Osolution→Mg+MgO。由此认为:气相火焰中MgO向颗粒表面扩散凝结不是表面氧化层增长的主要因素,而颗粒表面形成的Mg-O溶液的相位分离生成的MgO才是表面氧化层增厚的主要原因。Derizin E L和Hoffmann V K测量了气相中MgO的发射光谱,证明镁的燃烧属于气相燃烧,同样认为Mg-O溶液的相位分离是形成颗粒表面氧化层的主要原因。
Gol′dshleger U I和Amosov S D[30]认为颗粒着火前表面的缓慢多相反应会在表面形成一层致密的氧化层,随着颗粒温度升高,表面氧化层被撑破出现裂缝,液态镁从裂缝中渗透出来,此时表面附近同时会有多相反应和气相反应发生,反应产物在致密的氧化层上方沉积形成一层疏松的多孔状氧化层,它对镁的气相燃烧影响较小,多孔氧化层中发生着气相反应使其增长。当镁蒸发量足够大时,进入气相燃烧阶段,此时氧化层的结构变化很小。
镁颗粒在O2、CO2、CO和H2O(g)中的燃烧过程属于气相燃烧, 这已被大量实验所证实,但气相燃烧过程中表面氧化层的形成机理目前还未获得明确结论。从上述研究中可以得出气相燃烧过程中表面氧化层的增长主要有3种因素:(1)部分气相燃烧产物扩散到颗粒表面发生凝结使表面氧化层增长;(2)表面多孔氧化层将镁蒸气吸附在表面并与扩散到表面的氧化剂反应促使氧化层增厚;(3)燃烧过程中氧化剂扩散到颗粒表面融入液态镁中形成Mg-O溶液,饱和Mg-O溶液的相位分离促使表面氧化层增长。
4 不同氧化环境中几种典型镁颗粒燃烧模型 4.1 空气和O2中蒸气相扩散燃烧模型在大量镁颗粒燃烧实验研究的基础上,研究人员通过借鉴碳氢化合物液滴燃烧模型建立镁颗粒准稳态燃烧模型。Cassel H M和Liebman I[17]假设镁颗粒的燃烧过程受O2的扩散控制,化学反应速率很快,基于液滴蒸发燃烧模型和实验测量的反应区与颗粒表面的距离,建立了如下的准稳态燃烧速率模型:
| $ \frac{\rho }{M}4{\rm{ \mathit{ π} }}{{\rm{r}}^2}\frac{{{\rm{d}}r}}{{{\rm{d}}t}} = \frac{{\varepsilon Dp}}{{RT}}4{\rm{ \mathit{ π} }}({r_0} + L){\rm{ln}}\frac{{p - {p_{\rm{L}}}}}{{p - {p_\infty }}} $ | (1) |
式中, D为O2的平均扩散系数, cm2·s-1;T为反应区附近的平均温度, K; ρ为镁液滴的密度, g·cm-3; M为镁的摩尔质量; ε为氧的化学当量; r0为未燃烧的镁液滴的半径, cm; p为总压, kPa; pL和p∞为O2在反应区附近和环境中的分压, kPa。对(1)式积分就可以得到燃烧时间:
| $ t = \frac{{{{\rm{ \mathit{ ρ} }}_0}}}{{M\varepsilon }}\frac{{R{T_{\rm{D}}}}}{{Dp}}\frac{{r_0^3}}{{3({r_0} + L)}}{\rm{ln}}\frac{{p - {p_{\rm{L}}}}}{{p - {p_\infty }}} $ | (2) |
式中,ρ0为金属颗粒沸点温度时的密度, g·cm-3; r0为金属颗粒沸点温度时的半径, cm; p∞为环境气体温度下氧的分压, kPa; D为反应前沿扩散区温度下的扩散系数, cm2·s-1。
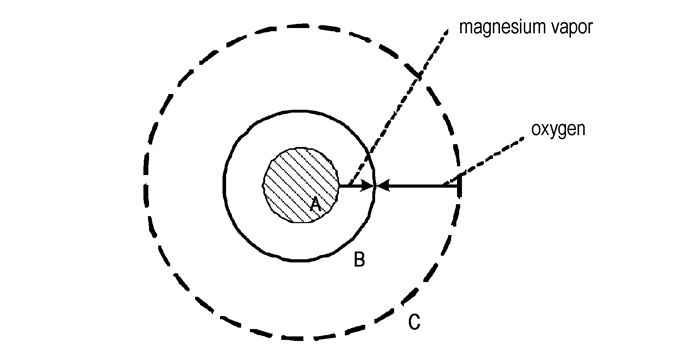
Brzustowski T A和Glassman I[36]将镁颗粒在O2中的燃烧过程描述为,液滴A被同心的火焰区包围,B是火焰面,AB之间的区域是镁蒸气的扩散区,BC之间是环境氧化性气体并且认为C是无穷远边界,如图 7。假设燃烧是准定常的且在均匀的压力下进行,镁蒸气和氧化性气体分别通过AB区域和BC区域,按当量比扩散到B发生反应,反应释放出来的热量传给镁液滴维持镁滴的蒸发,同时使反应区达到火焰温度,燃烧产物向环境输运。根据模型可以计算得到颗粒的消耗速率、颗粒表面温度、火焰面温度和位置等参数。
Kashireninov O E等[37]认为镁颗粒表面氧化性气体与固态镁的多相反应只在着火的初始阶段有比较明显的影响,氧化性气体与液态镁的反应在燃烧过程中不占主导地位,因此假设镁颗粒燃烧阶段气相反应占主导地位。另外,他们认为镁的气相燃烧不是主要的热量来源,而氧化物蒸气的凝结和O2、金属原子、氧化物基团的三分子再化合反应才是主要的热源。通过动力学原理分析,他们认为在燃烧温度时,过饱和的气相氧化物在扩散火焰中发生均相凝结,颗粒表面的发展由溶入金属的原子氧与金属原子发生的异相反应控制。由于气相反应速率相当快,MgO的生成速率与凝结速率的比值很可能决定了燃烧区与颗粒之间的热平衡。他们采用微观动力学方法来描述金属蒸气燃烧,并同时考虑化学动力学、扩散和热传导,最终建立了简化的球形一维扩散火焰数学模型。
4.2 CO2中镁颗粒燃烧模型由于简单蒸气相扩散燃烧模型不能准确描述镁颗粒在不同氧化性气氛中物理化学过程,近年来出现了镁颗粒在CO2和水蒸气中燃烧理论的相关研究。2002年,King M K[38]提出了镁颗粒在CO2中燃烧的两区模型,如图 8。他将镁的燃烧分为外反应区和表面反应区,在外反应区镁蒸气和环境中扩散进来的CO2瞬间完全反应生成CO和固态或液态的MgO,CO向颗粒表面和外界扩散,并在表面反应区与液态镁在有限速率控制下反应生成固态MgO和C。该模型的不足在于没有仔细考虑表面凝结产物对镁蒸发和表面反应的影响。
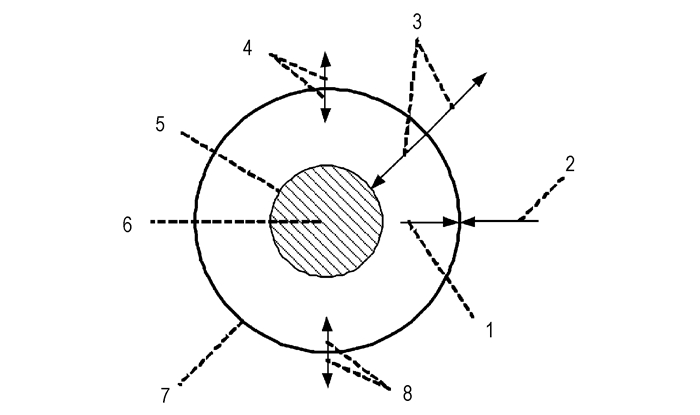
|
图 8 镁颗粒在CO2中燃烧两区火焰模型示意图[38] 1—镁蒸气, 2—CO2, 3—CO, 4—辐射换热, 5—表面反应区, 6—镁颗粒, 7—外反应区, 8—对流换热 Fig.8 Diagram of the two-reaction zone model of Mg particle combustion in CO2[38] 1—magnesium vapor, 2—CO2, 3—CO, 4—radiative heat fluxes, 5—surface reaction zone, 6—magnesium particle, 7—external reaction zone, 8—convective heat fluxes |
宾夕法尼亚州立大学Miller T F和Garza A B[39]在2006年采用有限速率动力学模型对镁在不同压力和速度的水蒸气环境中的燃烧进行了研究。基于Hertz-Langmuir方程和镁蒸气饱和蒸气压关系式得出了镁的蒸发速率为
| $ {m_{{\rm{eva}}}} = \frac{{7.296 \times {{10}^{14}}}}{{{T^{1.9}}}}{{\rm{e}}^{ - \frac{{17385}}{T}}} $ | (3) |
由于镁与H2O(g)的化学动力学参数缺乏,采用简化的硬球动力学模型来描述镁与H2O(g)的反应速率,并根据硬球假设得到了镁与水蒸气反应Arrhenius公式中指前因子为
| $ {A_{{\rm{Mg}}/{{\rm{H}}_{\rm{2}}}{\rm{O}}}} = 5 \times {10^{12}}{T^{1/2}}[{\rm{c}}{{\rm{m}}^3} \cdot {({\rm{mol}} \cdot {\rm{s}} \cdot {{\rm{K}}^{\frac{1}{2}}})^{-1}}] $ | (4) |
分析了镁表面温度、环境压力、气流速度等因素对气相最高温度及其位置的影响,并得出了镁颗粒在水蒸气中的燃烧是气相燃烧的结论。
黄利亚[20]在采用液滴蒸发燃烧模型来描述镁颗粒的燃烧过程的研究中发现,液滴蒸发燃烧模型并不能准确地预测镁颗粒的燃烧时间,考虑到氧化层对颗粒表面的覆盖,引入覆盖因子修正了D2定律,能较准确地预测镁颗粒在水蒸气中的燃烧时间。
上述镁颗粒燃烧模型基本都是从蒸气相扩散燃烧模型发展来的,虽然能在一定程度上反应燃烧过程的某些物理化学性质,但各个模型建立过程中简化了镁颗粒燃烧的物理过程,很少涉及到镁颗粒在各种氧化性气氛中燃烧的反应细节,对于准确描述整个燃烧过程还有一定差距。目前所欠缺的信息主要是镁与各种氧化性反应的机理、化学动力学特性和表面氧化层的形成机理及其对燃烧过程中传热传质的影响。
5 结束语对不同氧化性气氛中镁颗粒燃烧的研究现状进行了综述,分析了镁颗粒在空气和O2、CO2、CO和H2O(g)中的着火和燃烧特性,讨论了颗粒表面氧化层的形成机理。研究结果表明:(1)不同氧化性气氛中镁颗粒的燃烧均是从表面多相反应向气相燃烧过渡的过程;(2)着火阶段表面多相反应是表面氧化层形成的主要原因,气相燃烧阶段表面氧化层的增长可能是由于气相产物在表面的凝结或扩散到表面的氧化剂与颗粒反应造成的;(3)基于蒸气相扩散燃烧模型发展的镁颗粒在不同氧化性气氛中的燃烧模型可以在一定程度上反映燃烧过程中如燃烧速率、火焰温度、火焰半径等参数。
但是随着固体冲压发动机、火星探测器和水冲压发动机等技术的发展,需要对镁颗粒在各种氧化性气氛中的燃烧特性进一步研究,以更好地实现燃烧组织和提高能量利用率,对认识发动机内部镁颗粒的燃烧过程和提高发动机燃烧性能具有重要意义。因此,还有很多工作需要开展:(1)开发先进的光学观测和测量技术,为燃烧区的反应机理研究提供技术支持;(2)深入研究表面氧化层的形成机理,分析其对燃烧过程中颗粒表面传热传质的影响;(3)模型中需丰富燃烧过程的物理化学信息如反应的机理、化学动力学特性和表面氧化层的形成机理及其对燃烧过程中传热传质的影响等,逐步提高模型的准确性。
| [1] |
张炜, 方丁酉, 朱慧, 等. 镁铝贫氧推进剂的能量分析[J].
固体火箭技术, 1998, 21(4): 31-35. ZHANG Wei, FANG Ding-you, ZHU Hui, et al. Performance analysis of Mg-Al oxygen-poor propellants[J]. Journal of Solid Rocket Technology, 1998, 21(4): 31-35. |
| [2] |
张炜, 朱慧, 方丁酉. 固体贫氧推进剂研究[J].
火炸药学报, 2002(1): 25-28. ZHANG Wei, ZHU Hui, FANG Ding-you. Research in solid fuel-rich propellant[J]. Chinese Journal of Explosives & Propellants, 2002(1): 25-28. |
| [3] |
王克强, 莫红军. 贫氧推进剂的研究发展方向[J].
飞航导弹, 2005(11): 54-57. WANG Ke-qiang, MO Hong-jun. Research and development direction of fuel-rich propellant[J]. Winged Missiles Journal, 2005(11): 54-57. DOI:10.3969/j.issn.1009-1319.2005.11.017 |
| [4] |
赵卫兵, 史小锋, 伊寅, 等. 水反应金属燃料在超高速鱼雷推进系统中的应用[J].
火炸药学报, 2006, 29(5): 53-56. ZHAO Wei-bing, SHI Xiao-feng, YI Yin, et al. Application of hydroreactive metal fuel in super-cavitation torpedo propulsion system[J]. Chinese Journal of Explosives & Propellants, 2006, 29(5): 53-56. |
| [5] |
刘冠鹏, 郭效德, 段红珍, 等. 镁水反应的实验研究及机理初探[J].
固体火箭技术, 2008, 31(5): 497-500. LIU Guan-peng, GUO Xiao-de, DUAN Hong-zhen, et al. Experimental investigation and mechanism exploration on reaction between Mg and water[J]. Journal of Solid Rocket Technology, 2008, 31(5): 497-500. |
| [6] |
邹美帅, 郭晓燕, 杨荣杰, 等. 氧化剂对水冲压镁基富燃料推进剂燃烧特性影响[J].
推进技术, 2010, 31(6): 773-776. Z0U Mei-shuai, GUO Xiao-yan, YANG Rong-jie, et al. Effect of oxidizers in magnesium fuel-rich propellant for water-ramjet engine[J]. Journal of Propulsion Technology, 2010, 31(6): 773-776. |
| [7] |
韩超, 夏智勋, 胡建新, 等. 水反应金属燃料在水蒸气环境下的稳态燃烧特性[J].
固体火箭技术, 2011, 34(1): 75-78. HAN Chao, XIA Zhi-xun, HU Jian-xin, et al. Steady-state combustion characteristic of hydro-reactive metal-rich fuel in steam atmosphere[J]. Journal of Solid Rocket Technology, 2011, 34(1): 75-78. |
| [8] |
周星, 张炜, 柳先玮. 配方参数对镁基水反应金属燃料/水蒸汽反应特性的影响[J].
含能材料, 2011, 19(1): 37-41. ZHOU Xing, ZHANG Wei, LIU Xian-wei. Effects of formulation parameters on reaction characteristics of magnesium-based hydroreactive fuel with water vapor[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(1): 37-41. |
| [9] |
Goroshin S, Higgins A J, Kamel M. Powdered metals as fuel for hypersonic ramjets. AIAA-2001-3919[R], 2001.
|
| [10] |
申慧君, 夏智勋, 胡建新, 等. 金属粉末燃料冲压发动机初步试验研究[J].
固体火箭技术, 2008, 31(3): 225-231. SHEN Hui-jun, XIA Zhi-xun, HU Jian-xin, et al. Preliminary experimental investigation on metal-powder fuel ramjet[J]. Journal of Solid Rocket Technology, 2008, 31(3): 225-231. |
| [11] |
申惠君, 夏智勋, 胡建新, 等. 粉末燃料冲压发动机自维持稳定燃烧试验研究[J].
固体火箭技术, 2009, 32(2): 145-149. SHEN Hui-jun, XIA Zhi-xun, HU Jian-xin, et al. Experimental investigation on self-sustaining combustion of powdered metal fuel ramjet[J]. Journal of Solid Rocket Technology, 2009, 32(2): 145-149. |
| [12] |
申惠君. 粉末燃料冲压发动机关键技术探索与研究[D]. 长沙: 国防科学技术大学, 2010.
SHEN Hui-jun. Exploration and Research on the Key Technologies of Powdered Fuel Ramjet[D]. Changsha: National University of Defense Technology. |
| [13] |
Wickman J H. In-situ mars rocket and jet engines burning carbon dioxide. AIAA-99-2409[R], 1999.
|
| [14] |
Linnell J A, Miller T F. A preliminary design of a magnesium fueled martian ramjet engine. AIAA-2002-3788[R], 2002.
|
| [15] |
John P F, Ron J L. Powdered magnesium-carbon dioxide rocket combustion for mars propulsion. AIAA-2005-4469[R], 2005.
|
| [16] |
曹泰岳, 张为华, 王宁飞. 轻金属颗粒燃烧理论研究进展[J].
推进技术, 1996, 17(2): 82-87. CAO Tai-yue, ZHANG Wei-hua, WANG Ning-fei. Progress in research on combustion theory of light-metal particles[J]. Journal of Propulsion Technology, 1996, 17(2): 82-87. |
| [17] |
Cassel H M, Liebman I. Combustion of magnesium particles I[J].
Translated from Fizika Goreniya i Vzryva, 1962, 6: 153-156. |
| [18] |
Cassel H M, Liebman I. Combustion of magnesium particles Ⅱ. ignition temperatures and thermal conductivities of ambient atmospheres[J].
Translated from Fizika Goreniya i Vzryva, 1963, 7: 79-81. |
| [19] |
Derevyaga M E, Stesik L N, Fedorin E A. Magnesium combustion regimes[J].
Translated from Fizika Goreniya i Vzryva, 1978, 5: 3-10. |
| [20] |
黄利亚. 镁基水冲压发动机内部燃烧过程与燃烧组织方法研究[D]. 长沙: 国防科学技术大学, 2010.
HUANG Li-ya. Research on combustion processes and combustion optimization in magnesium-based water ramjet engines[D]. Changsha: National University of Defense Technology. |
| [21] |
Derevyaga M E. Effect of pressure on magnesium combustion[J].
Translated from Fizika Goreniya i Vzryva, 1983, 19(1): 34-39. |
| [22] |
Kashireninov O E. Metals vapor oxidation in diffusion flames[J].
Pure & Appl Chern, 1990, 62(5): 851-859. |
| [23] |
Florko A V, Golovko V V, Okhrimenko N A, et al. Structure of the magnesium particle combustion zone: optic-spectrum investigations[J].
Translated from Fizika Goreniya i Vzryva, 1991, 27(1): 37-42. |
| [24] |
Legrand B, Shafirovich E, Marion M, et al. Studies on the burning of levitated magnesium particles in CO2. AIAA 98-1026[R], 1998.
|
| [25] |
Madrid A A, Stroud C, Omaly P, et al. Combustion of bulk-magnesium in carbon dioxide under reduced-gravity conditions[R]. AIAA 99-0695, 1999.
|
| [26] |
Gol'dshleger U I, Shafirovich E Ya. Combustion regimes of magnesium in carbon oxides. 1. combustion in CO2[J].
Combustion, Explosion, and Shock Waves, 1999, 35(6): 637-644. DOI:10.1007/BF02674536 |
| [27] |
Gol'dshleger U I, Shafirovich E Ya. Combustion regimes of magnesium in carbon oxides. 2. combustion in CO[J].
Combustion, Explosion and Shock Waves, 2000, 36(2): 220-226. DOI:10.1007/BF02699364 |
| [28] |
Prachukho V P, Ozerov E S, Yurinov A A. Burning of magnesium particles in water vapor[J].
Translated from Fizika Goreniya i Vzryva, 1971, 7(2): 232-236. |
| [29] |
Ozerov E S, Yurinov A A. Combustion of particles of aluminum-magnesium alloys in water vapor[J].
Translated from Fizika Goreniya i Vzryva, 1977, 13(6): 913-915. |
| [30] |
Gol'dshleger U I, Amosov S D. Combustion modes and mechanisms of high-temperature oxidation of magnesium in oxygen[J].
Combustion, Explosion, and Shock Waves, 2004, 40(3): 275-284. DOI:10.1023/B:CESW.0000028940.02367.3a |
| [31] |
周俊虎, 周楷, 杨卫娟, 等. 镁在水蒸气中高温氧化的动力学特性[J].
燃烧科学与技术, 2010, 16(5): 383-387. ZHOU Jun-hu, ZHOU Kai, YANG Wei-juan, et al. Kinetics of high temperature oxidation of magnesium in steam[J]. Journal of Combustion Science and Technology, 2010, 16(5): 383-387. |
| [32] |
Al'tman I S, Vovchuk Ya I. Thermal regime of the vapor-state combustion of a magnesium particle[J].
Combustion, Explosion, and Shock Waves, 2000, 36(2): 227-229. DOI:10.1007/BF02699365 |
| [33] |
Florko A V, Zolotko A N, Kaminskaya N V, et al. Spectral investigation of the combustion of magnesium particles[J].
Translated from Fizika Goreniya i Vzryva, 1982, 18(1): 17-22. |
| [34] |
Dreizin E L, Hoffmann V K. Experiments on magnesium aerosol combustion in microgravity[J].
Combustion and Flame, 2000, 122: 20-29. DOI:10.1016/S0010-2180(00)00099-7 |
| [35] |
Dreizin E L, Berman C H. Condensed-phase modifications in magnesium particle combustion in air[J].
Combustion and Flame, 2000, 122: 30-42. DOI:10.1016/S0010-2180(00)00101-2 |
| [36] |
Brzustowski T A, Glassman I. Vapor-phase diffusion flames in the combustion on magnesium and aluminum. AIAA 63-0489[R], 1963.
|
| [37] |
Kashireninov O E. Metals vapor oxidation in diffusion flames[J].
Pure & Appl Chern, 1990, 62(5): 851-859. |
| [38] |
King M K. A simplified two-reaction zone model of magnesium combustion in carbon dioxide[J].
Proceedings of the Combustion Institute, 2002, 29: 2931-2938. DOI:10.1016/S1540-7489(02)80358-3 |
| [39] |
Miller T F, Garza A B. Finite rate calculations of magnesium combustion in vitiated oxygen and steam atmospheres. AIAA 2006-4066[R], 2006.
|

The combustion characteristics of magnesium particle at different atmospheres were summarized, introduced and reviewed with 39 references.