呋咱类化合物具有标准生成焓高、富含氮氧、能量高、密度高、分子热力学稳定性较好等特点,大量的研究表明,对于设计C、N、O原子的高能量密度化合物,呋咱基团是一种非常有效的结构单元[1-5],是一类具有重要开发应用价值的含能化合物。
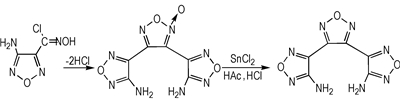
3, 4-二硝基呋咱基氧化呋咱(DNTF)是一种性能优异的呋咱类含能化合物,其特点是威力大,实测值为168.4%, TNT当量比HMX高20%;熔点较低(109~111 ℃),通过间接蒸汽加热熔化,长时间不分解,适于铸装,可作为熔铸混合炸药的液相载体炸药[6-9]。但是DNTF氧化呋咱环的配位氧化学性质较为活泼,具有较高的冲击波感度。为了降低DNTF的感度,设计了DNTF去配位氧的化合物,即3, 4-双(3′-硝基呋咱-4′-基)呋咱(BNTF)。经理论计算BNTF的感度较DNTF约降低10%。3, 4-双(3′-氨基呋咱-4′-基)呋咱(BATF)是合成BNTF的关键中间体,BATF呋咱环上的活性氨基,可采用Caro's acid氧化得化合物BNTF,中间体BATF上氨基还可以发生偶氮反应、取代反应等,从而得到一系列新型的呋咱化合物,丰富含能材料种类。本研究设计了BATF的合成路线,以3-氨基-4-酰氨肟基呋咱(AAOF)为原料,经缩合环化及还原反应得到新化合物BATF,并采用红外光谱、核磁共振光谱、元素分析、质谱对中间体及BATF进行了结构表征; 优化了还原反应的条件,确定了最佳条件; 同时探讨了BATF的质谱碎裂机理。
2 实验部分 2.1 实验仪器与试剂NEXUS870型傅里叶变换红外光谱仪、AV500型(500 MHz)超导核磁共振仪、GCMS-QP2010质谱仪、Vario EL-Ⅲ型元素分析仪、LC-2010A ht液相色谱仪、岛津DSC-60型差示扫描光谱仪、Bruker SMART APEX11X射线衍射仪。
乙醚、碳酸钠、二水氯化亚锡(SnCl2·2H2O)、醋酐、醋酸、二氯甲烷等主要试剂均为分析纯; 36%盐酸、3-氨基-4-酰氯肟基呋咱(AAOF)[10]、3, 4-双(3′-氨基呋咱-4′-基)氧化呋咱(DATF) [10]均为自制。
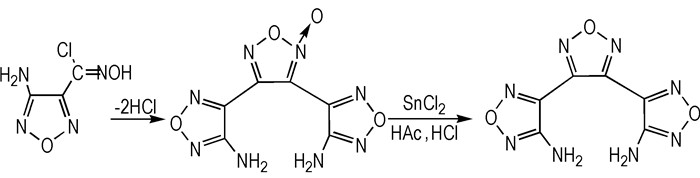
2.2 合成路线以3-氨基-4-酰氨肟基呋咱(AAOF)为原料,经合环生成DATF,DATF经SnCl2/HCl/AcOH体系还原反应得到BATF,具体合成路线见Scheme 1。
|
Scheme1 Synthetic route of BATF |
还原剂配制:向22.6 g(100 mmol)SnCl2·2H2O中加入20 mL醋酐、100 mL醋酸和20 mL盐酸,搅拌使溶液澄清; 其中10 mL上述溶液相当于还原剂7 mmol[11]。
在常温下向反应瓶中加入3, 4-二氨基呋咱基氧化呋咱7.5 g(0.029 mol)与30 mL醋酸,搅拌下滴加125 mL上述配制的还原剂,滴加完毕后升温至75℃,保温8 h。将反应液倒入150 mL水中,搅拌冷却有固体析出,过滤、水洗、干燥得乳白色固体4.1 g。收率为73.5%。用乙酸乙酯和石油醚混合溶剂重结晶后,m.p.:183~185 ℃,纯度为99.6%(HPLC)。
13C NMR (DMSO-d6, 500 MHz) δ: 155.752, 143.759, 135.802; 1H NMR (DMSO-d6, 500 MHz) δ: 6.645(s, 2H, —NH2); IR (KBr, υ/cm-1): 3459,3332(—NH2), 1635, 1560, 1415, 1360 (呋咱环); MS(EI)m/z(%):236(M+,47),206(75),149(100),179(38)176(30),96(52),69(31),58(74),43(50); Anal. calcd For C6H4N8O3(%): C 30.51, N 47.46, H 1.69 Found: C 30.41, N 47.58, H 1.61。
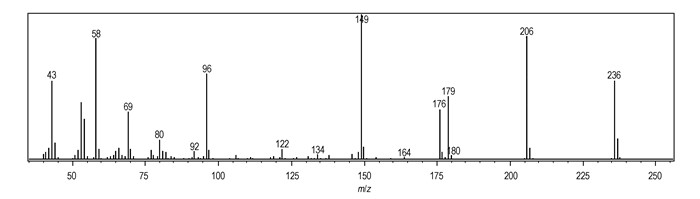
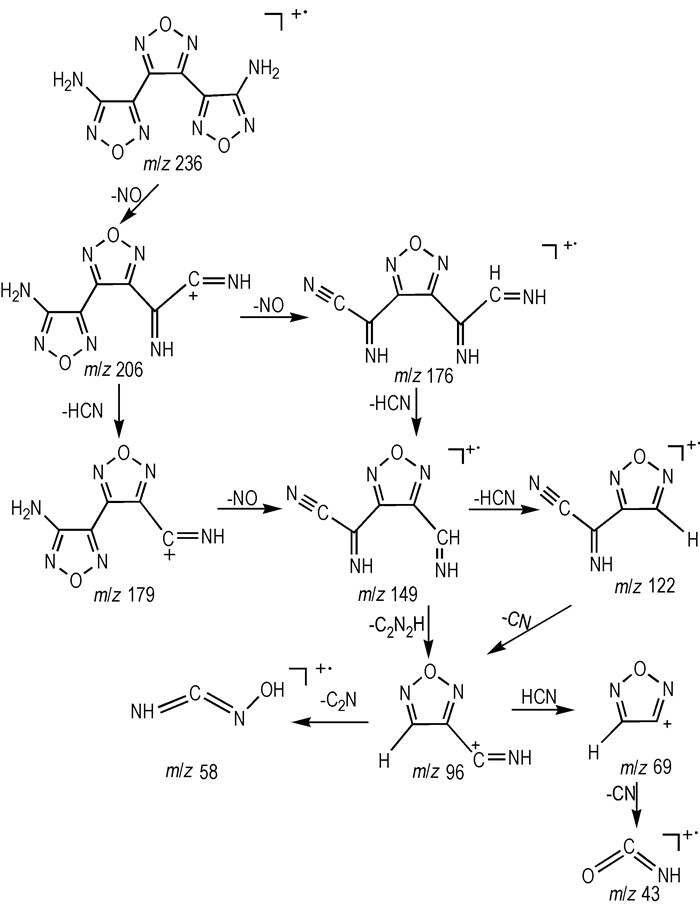
3 结果与讨论 3.1 BATF质谱及碎裂机理采用电子轰击的方法获得BATF的质谱图(见图 1)。其中分子离子峰为m/z 236,与该化合的分子量相符,化合物分子量为偶数,又含有偶数个氮原子, 根据N规则判断含有奇数个电子[12]。m/z 206的碎片离子峰为BATF分子碎裂失去自由基NO的碎片峰,碎片离子m/z 206进一步失去NO或HCN分别得到m/z 176,m/z 179,m/z 179的碎片离子进一步碎裂分别失去NO、HCN、C2N2H形成m/z=149、122、96碎片离子峰,m/z 96离子碎片分别失去C2N、HCN、CN得到更小的碎片m/z=58、69、43可能的碎裂途径见Scheme 2。
|
图 1 BATF的质谱图 Fig.1 MS spectra of BATF |
|
Scheme2 Fragmentation pathways of BATF |
氧化呋咱可以用各种还原剂进行还原,考察了不同还原剂对反应的影响,结果见表 1。
| 表 1 还原剂对BATF收率的影响 Tab.1 Effects of reducing agents on yield of BATF |
由表 1可以看出:采用五氯化磷、三苯基磷、盐酸肼、硼氢化钠和三乙氧基磷还原都没有得到产物,说明这些还原剂不适合还原DATF[13]; 采用锌与醋酸,锡与盐酸还原得到了产物,但纯度较差,收率较低,这是因为金属与酸形成的还原剂还原氧化呋咱时,氧化呋咱首先变成对式二肟,再重排成稳定的二肟或脱水变成呋咱[10],采用在线红外跟踪实验的方法,证实了这一观点,二肟产物的出现,使得BATF的产品纯度较低,后处理复杂; 采用SnCl2/HCl/AcOH为还原剂收率达到了73.5%,后处理较为简单。因此最适宜的还原剂为SnCl2/HCl/AcOH。
3.2.2 反应料比的影响在反应时间为7 h、反应温度为75 ℃,考察了还原剂的量对反应收率和纯度的影响。
由表 2,可以看出还原剂的量对反应收率影响较大,当还原剂与DATF料比为2:1时,发现DATF没有完全反应; 当还原剂与DATF料比为3:1~4:1。收率最高达到了73.5%,纯度到99.5%;继续增加还原剂的量,会有无机盐氯化亚锡析出导致反应收率和产品纯度降低,因此最适宜反应料比为3:1~4:1。
| 表 2 料比对BATF收率的影响 Tab.2 Effects of ratio of reducing agent on yield of BATF |
反应时间为7 h,还原剂与DATF料比为3:1~4:1,研究了不同反应温度对BATF收率的影响,结果见表 3。由表 3可看出,当温度为75 ℃时反应收率最高达到73.5%,纯度达到了99.5%,继续提高反应温度反收率无明显变化,最适宜反应温度应为75 ℃。
| 表 3 反应温度对BATF收率的影响 Tab.3 Effects of reaction temperature on yield of BATF |
反应温度为75 ℃,还原剂与DATF料比为3:1~ 4:1, 考察了不同反应时间对BATF收率的影响,结果见表 4。从表 4可以看出,当反应时间7 h时,DATF反应完全,收率达到最高(73.5 %),继续延长反应时间,发现收率无明显变化,所以最适宜反应时间应为7 h。
| 表 4 反应时间对BATF收率的影响 Tab.4 Effects of reaction time on yield of BATF |
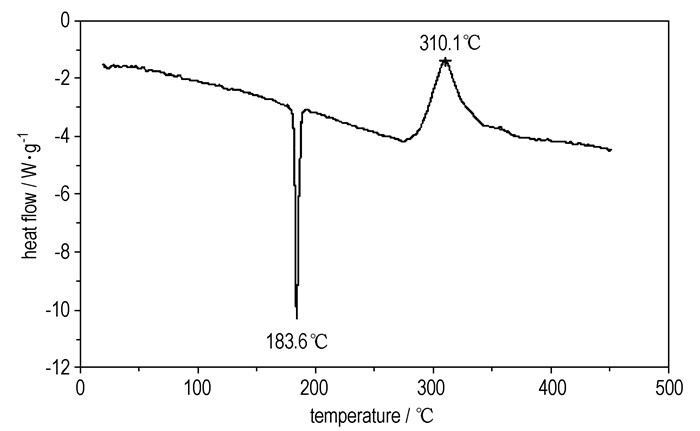
采用DSC对BATF的热性能进行了测试(升温速率β=10 ℃·min-1),图 2中呈现一个吸热峰和一个放热峰,在183.6 ℃处尖锐的吸热峰表明样品经历吸热熔融的相变过程,310.1 ℃为BATF放热分解峰, 且放热峰型不尖锐,温度跨度较大,说明样品熔融为液体以后气化分解。
|
图 2 BATF的DSC曲线 Fig.2 DSC curve of BATF |
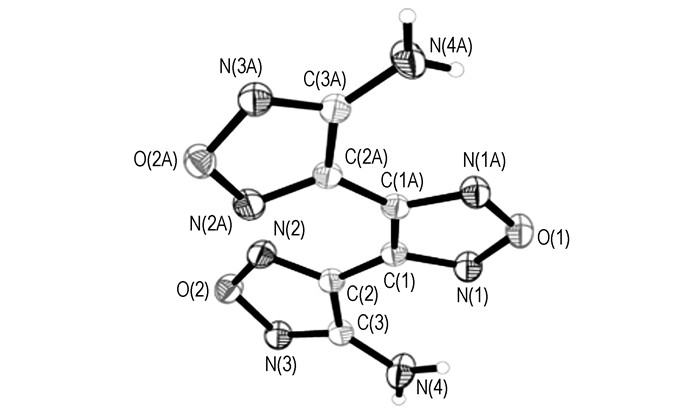
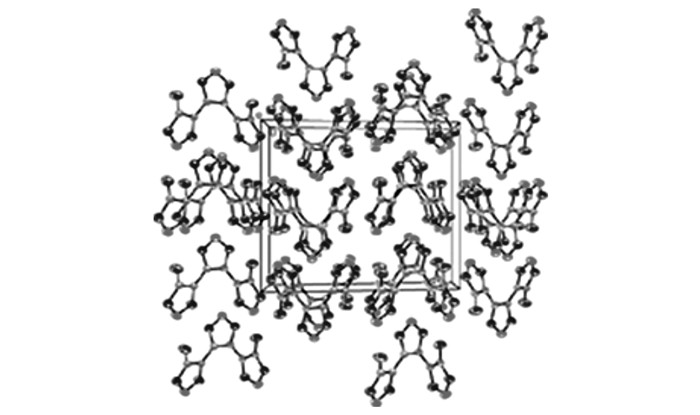
BATF溶于乙醇中,乙醇缓慢挥发得到了BATF的晶体。通过晶体结构分析得到了BATF的分子结构(见图 3),BATF分子在晶胞中的堆积图(见图 4)以及BATF的相关晶体参数见表 5。
|
图 3 BATF的分子结构图 Fig.3 Molecular structure of BATF |
|
图 4 BATF分子在晶胞中的堆积 Fig.4 Packing of the BATF molecule in crystal lattice |
| 表 5 BATF的晶体学数据 Tab.5 Crystallographic data for BATF |
(1) 设计了含能化合物3, 4-双(3′-氨基呋咱-4′-基)呋咱分子结构,以3-氨基-4-酰氨肟基呋咱为原料,缩合环化、还原合成了3, 4-双(3′-氨基呋咱-4′-基)呋咱(BATF),总收率为54%,并采用红外光谱、核磁共振光谱、质谱、元素分等确定了其结构。
(2) 探讨了还原反应的关键影响因素, 确定了最佳的反应条件为:SnCl2/HCl/AcOH为还原剂,还原剂与DNTF料比为3:1~4:1,反应时间为7 h,反应温度为75 ℃。
(3) 从理论上分析有机质谱形成的过程及对应的结构,并给出了BATF的碎裂机理。
| [1] |
李战雄, 唐松青, 欧育湘, 等. 呋咱含能衍生物合成研究进展[J].
含能材料, 2002, 10(2): 59-65. LI Zhan-xiong, TANG Song-qing, OU Yu-xiang, et al. Synthesis status of furazano energetic derivatives[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2002, 10(2): 59-65. |
| [2] |
Nivikova T S, Melnikova T M, Kharitonova O V, et al. An effective method for the oxidation of aminofurazansto nitrofurazans[J].
Mendeleev Communication, 1994, 4(4): 139-140. |
| [3] |
黄明, 李洪珍, 董海山, 等. 呋咱类含能材料合成进展[J].
含能材料(增刊), 2004(增刊): 93-78. HUANG Ming, LI Hong-zhen, DONG Hai-shan, et al. Development of furazan energtic materials[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004(suppl): 93-78. |
| [4] |
Shemereteev A B, Kulagina V O, Aleksandrova N S, et al. Synthesis of difurazanyl ethers from 4, 4'-dinitroazoxyfurazan[J].
Heterocyclic Chem, 2000, 11(1): 48-56. |
| [5] |
Christian S L, Chafin A P, Nielsen A T, et al. Synthesis of Aminonitrobenzodifuroxan: US 5149818[P], 1992.
|
| [6] |
王亲会. 一种新型熔铸炸药研究[J].
含能材料, 2004, 12(1): 46-48. WANG Qin-hui. A new melt -cast formulation[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(1): 46-48. |
| [7] |
郑付, 王江宁. 3, 4-二硝基呋咱基氧化呋咱(DNTF)的研究进展[J].
含能材料, 2006, 14(6): 463-466. ZHENG fu, WANG Jiang-ning. Review on 3, 4-bisnitrofurazanfuroxan(DNTF)[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 463-466. |
| [8] |
罗阳, 高红旭, 赵凤起, 等. 含3, 5-二硝基呋咱基氧化呋咱(DNTF)推进剂的能量特性[J].
含能材料, 2005, 13(4): 225-228. LUO Yang, GAO Hong-xu, ZHAO Feng-qi, et al. Energy characteristics of propellant containing 3, 4-dintrofurazanfuroxan(DNTF)[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2005, 13(4): 225-228. |
| [9] |
胡焕性, 张志忠, 赵凤起, 等. 高能量密度材料3, 4-二硝基呋咱基氧化呋咱性能及应用研究[J].
兵工学报, 2004, 25(2): 155-158. HU Huan-xing, ZHANG Zhi-zhong, ZHAO Feng-qi, et al. A study on the properties and application of high energy density material DNTF[J]. Acta Armamentarll, 2004, 25(2): 155-158. |
| [10] |
周彦水, 李建康, 黄新萍, 等. 3, 4-双(3'-氨基呋咱-4'-基)氧化呋咱(DATF)合成及性能研究[J].
火炸药学报, 2007, 30(1): 54-56. ZHOU Yan-shui, LI Jian-kang, HUANG Xin-ping, et al. Synthesis and properties 3, 4-bis(3'-aminofurazal-4'-yl)furoxan[J]. Chinese Journal of Explosive & Propellants, 2007, 30(1): 54-56. |
| [11] |
Sheremetev A B, Kulagina V O, Elena A, et al. Nucleophilic substitution in the furazan series:Reaction of nitrofurazans with ammonia[J].
Russian Chemical Bulletin Internation Edition, 2002, 51(8): 1533-1539. DOI:10.1023/A:1020931511013 |
| [12] |
Kulikov A S, Kakhova N N. Reduction of furoxan ring to the furazan ring insome carbonyl-substituted furoxans[J].
Russian Chemical Bulletin, 1994, 43(4): 630-632. DOI:10.1007/BF00699838 |
| [13] |
Sheremetev A B, Andrianov V G, Ivanova E A, et al. Synthesis of secondary and tertiary aminofurazans[J].
Russian Chemical Bulletin Internation Edition, 2004, 53(3): 596-614. DOI:10.1023/B:RUCB.0000035644.16331.f0 |