富氮含能化合物包括吡唑、三唑、四唑、三嗪以及四嗪类含能化合物,因其具有高生成焓、高密度、高氧平衡等特点,成为含能材料合成领域的热点[1]。这类化合物分子中含有大量的N—N和C—N键,分解时释放大量氮气,产生较高能量,可用于气体发生器、低特征信号推进剂、烟火药和高能低感炸药等,成为含能材料研究者普遍关注的领域[2-3]。3,6-二硝基吡唑[4,3-c]并吡唑(DNPP)是一种吡唑类富氮化合物,密度为1.865 g·cm-3,氮含量42.42%,生成焓273 kJ·mol-1,特性落高为68 cm,预测其能量为HMX的85%,DSC分解点为330.8 ℃,热稳定性好、感度低,是一种性能优良的新型含能材料[4]。以DNPP为前驱体,经N-氨化反应[5-6]可生成1, 4-二氨基-3,6-二硝基吡唑[4,3-c]并吡唑(LLM-119),其晶体密度为1.845 g·cm-3,氮含量达49.12%,预测其能量为HMX的104%,对摩擦、电火花刺激不敏感[7];DNPP经硝化反应可生成1, 3, 4, 6-四硝基吡唑[4,3-c]并吡唑(TNPP),采用Gaussian 09程序中的B3LYP方法[8]预测其密度为2.04 g·cm-3,爆速为9376 m·s-1,爆压为49.3 GPa,生成热为32.34 kJ·mol-1;同时,DNPP结构中含有亚氨基,分子带有一定的酸性,可与有机胺形成一系列胺盐,DNPP-胺盐具有较高的氮含量和生成热,可作为火焰配方抑制剂和燃速调节剂,用作枪支发射药和推进剂[9]。因此,开展DNPP的百克量合成工艺放大研究,将为其进一步应用研究奠定基础。
本文参考文献[10-13]的小试合成方法,以2, 4-戊二酮为原料,经肟化、环化、还原、重氮化、环化、硝化、氧化、脱羧硝化等反应进行了DNPP百克量合成研究,总收率从文献[4]的9.3%提高到17.9%;改进了关键中间体4-重氮-3,5-二甲基吡唑内盐的后处理方法:采用低温冷冻结晶工艺代替传统的萃取工艺;初步探讨了环化、还原“一锅法”反应机理,并结合实验现象分析了容易造成此反应喷料的原因;培养了DNPP·H2O单晶,经X射线单晶衍射仪测试了其晶体结构,并进行了单晶结构解析。
2 实验部分 2.1 合成路线以2, 4-戊二酮为原料,经肟化、环化、还原、重氮化、环化、硝化、氧化、脱羧硝化等反应合成了DNPP,合成路线如Scheme 1所示。
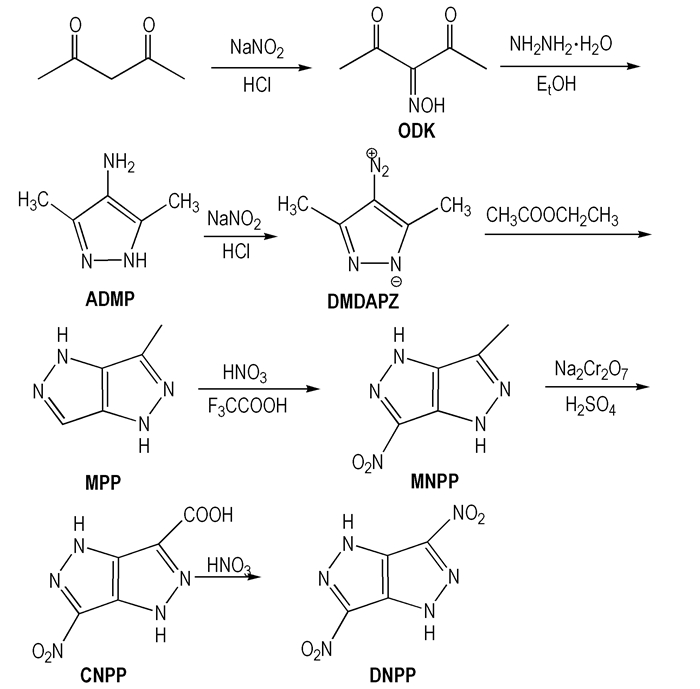
|
Scheme1 Synthetic route of DNPP |
2, 4-戊二酮、水合肼,分析纯,天津市化学试剂厂;三氟乙酸,分析纯,姜堰市环球化工厂;重铬酸钠,化学纯,天津市化学试剂三厂;乙酸乙酯、亚硝酸钠、冰醋酸,分析纯,成都市科龙化工试剂厂;浓盐酸(36%~38%)、浓硫酸(95%~98%)、浓硝酸(98%),工业级,西安福晨化学试剂有限公司。
ZF-Ⅱ型三用紫外仪,上海市安亭电子仪器厂;NEXUS 870型傅里叶变换红外光谱仪,美国热电尼高力公司;GCMS-QP2010型质谱仪, 日本岛津公司;AV 500型(500 MHz)超导核磁共振仪,瑞士BRUKER公司;VARIO-EL-3型元素分析仪,德国EXEMENTAR公司;LC-2010A型高效液相色谱仪(归一化法),日本岛津公司;X-6型显微熔点测定仪,北京泰克仪器有限公司;Smart APEXⅡCCD衍射仪,瑞士BRUKER公司。
2.3 合成过程 2.3.1 3-肟基戊二酮(ODK)的合成将300 mL 95% 2, 4-戊二酮(2.79 mol)加入反应瓶,在温度0~5 ℃下,依次滴加1161 mL 16.6%亚硝酸钠(2.79 mol)水溶液和283.2 mL 36%浓盐酸(3.00 mol),滴加完毕后反应20 min,过滤、水洗、干燥得白色粉晶3-肟基戊二酮348.1 g,收率92.6%,纯度99.3%,m.p:59~61 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:12.92(s,1H,OH),2.33(s,3H,CH3),2.25(s,3H,CH3);13C NMR(DMSO-d6, 500 MHz), δ:200.23, 194.98,156.48,30.41,25.47;IR(KBr, cm-1), ν:3025, 2861(—CH3), 1721, 1655(C=O). Anal. Calcd for C5H7NO3:C 46.51, H 5.426, N 10.85;found C 46.58, H 5.473, N 10.68。
2.3.2 4-氨基-3,5-二甲基吡唑(ADMP)的合成室温搅拌下,将373.3 mL 85%水合肼(6.15 mol)加入到1157.5 mL 95%的乙醇中,在0~5 ℃下加入280.0 g(2.17 mol) 3-肟基戊二酮,升温至回流反应2 h,过滤、水洗、干燥得白色固体4-氨基-3,5-二甲基吡唑186.7 g,收率77.5%,纯度98.7%,m.p.:191.1~192.6 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:11.42(s, 1H, NH), 3.21(s, 2H, NH2), 1.99(s, 6H, 2CH3);13C NMR(DMSO-d6, 500 MHz), δ:136.36, 125.57,123.80,9.78;IR(KBr, cm-1), ν:3347(—HN2), 3163(—NH—), 3058, 2822(—CH3), 1607(吡唑环骨架);Anal. Calcd for C5H9N3:C 54.05, H 8.108, N 37.84;found C 53.72, H 8.132, N 37.97。
2.3.3 4-重氮基-3,5-二甲基吡唑内盐(DMDAPZ)的合成室温搅拌下,将222.0 g (2.02 mo1) ADMP加入到630.0 mL蒸馏水,缓慢滴加352.0 mL冰醋酸,冰水浴降温至0~5 ℃下,再缓慢滴加140.2 g (2.03 mo1) NaNO2与630.0 mL蒸馏水的溶液(控制温度在0~5 ℃下滴加NaNO2溶液),滴加完毕后反应4.5 h,用氨水中和至pH=8后,反应液放入冰箱冷冻过夜,低温快速过滤,真空干燥得黄色固体209.9 g,收率86.1%,纯度98.4%,m.p.:63.1~65.2 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:2.376(s, 6H);13C NMR(DMSO-d6, 500 MHz), δ:12.51(d), 76.18(d), 154.70(s);IR(KBr, cm-1), ν:3457(—NH), 2168(—N2+), 1411, 1365, 1015(吡唑环骨架). Anal. Calcd for C5H6N4: C 48.78, H 5.691, N 45.53;found C 48.08, H 5.420, N 45.02。
2.3.4 3-甲基吡唑[4,3-c]并吡唑(MPP)的合成室温搅拌下,将140.0 g (1.12 mo1) DMDAPZ加入到7700.0 mL乙酸乙酯中,固体溶解后加入30.0 mL CH3COOH,加热至回流反应5.5 h,停止加热,搅拌冷却至室温,过滤除去不溶物,蒸出乙酸乙酯、水洗、干燥得黄色固体111.5 g,收率79.7%,纯度98.3%,m.p.:224.1~226.7 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:2.353(s, 3H), 7.429(s, 1H), 11.895(s, 1H), 12.309(s, 1H);13C NMR(DMSO-d6, 500 MHz), δ:12.09(s), 117.96(s), 126.15(s), 137.51(s), 138.89(s);IR(KBr, cm-1), ν:3150(—NH), 3083(—CH), 2989, 2915(—CH3), 1263, 1188, 1063(吡唑并吡唑环骨架). Anal. Calcd for C5H6N4(%):C 49.18, H 4.918, N 45.90; found C 48.94, H 4.921, N 45.22。
2.3.5 3-甲基-6-硝基吡唑[4,3-c]并吡唑(MNPP)的合成室温搅拌下,向1630.0 mL三氟乙酸中分批加入157.0 g (1.28 mo1) MPP,待溶解后,冰水浴控制体系温度约20 ℃,向体系中滴加285.0 mL浓硝酸,升温至30℃反应9 h,将反应液倒入冰水中,过滤、水洗、干燥得黄色固体138.6 g,收率67.4%,纯度98.5%,m.p.:264.0~265.9 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:2.413(s, 3H), 13.952(s, 1H);13C NMR(DMSO-d6, 500 MHz), δ:11.54(s), 128.73(s), 130.26(s), 136.73(s), 139.94(s);IR(KBr, cm-1), ν:3582(—NH), 2918, 2853(—CH3), 1504, 1374(—NO2), 1264, 1188, 1051(吡唑并吡唑环骨架)。Anal. Calcd for C5H5N5O2(%):C 35.93, H 2.994, N 41.92; found C 35.67, H 2.687, N 41.53。
2.3.6 6-硝基吡唑[4,3-c]并吡唑-3-羧酸(CNPP)的合成冰水浴搅拌下,将138.6 g (0.83 mol) MNPP加入到1538.5 mL浓硫酸中,控制加料温度约20 ℃,分批加入292.0 g (0.97 mol) Na2Cr2O7·2H2O,在25~30 ℃反应4 h,将反应液倒入冰水中,过滤、水洗、干燥得黄色固体122.0 g,收率74.6%,纯度98.1%,m.p.:262.1~263.9 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:14.271(s, 1H);13C NMR(DMSO-d6, 500 MHz), δ:1125.48(s), 131.07(s), 137.61(s), 139.28(s), 161.83(s);IR(KBr, cm-1), ν:3596(—OH), 3552, 3236(—NH), 1699(—C=O), 1506, 1378(—NO2), 1234, 1131, 1042(吡唑并吡唑环骨架). Anal. Calcd for C5H3N5O4(%): C 30.46, H 1.523, N 35.53; found C 30.83, H 1.452, N 35.13。
2.3.7 3,6-二硝基吡唑[4,3-c]并吡唑(DNPP)的合成冰水浴搅拌下,将190.0 g (0.96 mol) CNPP分批加入到1100.0 mL浓硝酸中,加完CNPP继续低温(冰水浴)搅拌20 min,撤去冰水浴,升温至45 ℃反应6 h,将反应液倒入冰水中,过滤、水洗、干燥得微黄色固体137.1 g,收率72.3%,纯度99.2%,m.p.:293.9~295.4 ℃。
1H NMR(DMSO-d6, 500 MHz), δ:15.058(s, 2H);13C NMR(DMSO-d6, 500 MHz), δ:131.58(d), 137.89(d);IR(KBr, cm-1), ν:3266(—NH), 1548, 1521, 1373, 1348(—NO2), 1244, 1145, 1038(吡唑并吡唑环骨架). Anal. Calcd for C4H2N6O4(%):C 24.24, H 1.010, N 42.42; found C 24.38, H 1.167, N 42.71;MS(E I): 198[M+]。
2.4 DNPP·H2O单晶培养称取1.0 g纯度为99.2%的DNPP自制样品,将其分散于适量的蒸馏水中,加热至60 ℃,使DNPP完全溶解,得到淡黄色澄清溶液,冷却至室温,过滤出不溶物,滤液置于干净的锥形瓶中,室温(25~30 ℃)下放置1周后,得到淡黄色柱状晶体。从中挑选适当大小的单晶颗粒进行晶体结构测试及分析。
2.5 DNPP·H2O晶体结构测定选取尺寸为0.20 mm×0.18 mm×0.25 mm的单晶,在Smart APEXⅡCCD衍射仪上,用MoKα射线(λ=0.071073 nm), 石墨单色器, 在296(2) K温度下,以ω扫描方式扫描,扫描范围:2.68°≤θ≤28.39°,-4≤h≤4,-18≤k≤9,-11≤ l ≤11,共收集衍射点2631个,其中独立衍射点1081个,选取l>2σ(l)的1081个点用于结构的测定和修正,全部数据均经Lp因子和半经验吸收校正,所有计算工作均用SHELXTL-97程序包完成。
3 结果与讨论 3.1 4-氨基-3,5-二甲基吡唑(ADMP)合成机理3-肟基戊二酮与水合肼环化、还原“一锅法”合成4-氨基-3,5-二甲基吡唑的反应机理为:3-肟基戊二酮与肼发生加成反应得到中间体1,中间体1不稳定,容易脱去两分子的水得到中间体2,中间体2发生分子内的重排得到4-亚硝基-3,5-二甲基吡唑溶液(蓝色);4-亚硝基-3,5-二甲基吡唑被肼还原为偶氮化合物3,在回流条件下脱去一分子的氮气得到目标化合物4-氨基-3,5-二甲基吡唑(ADMP),合成机理如Scheme 2。
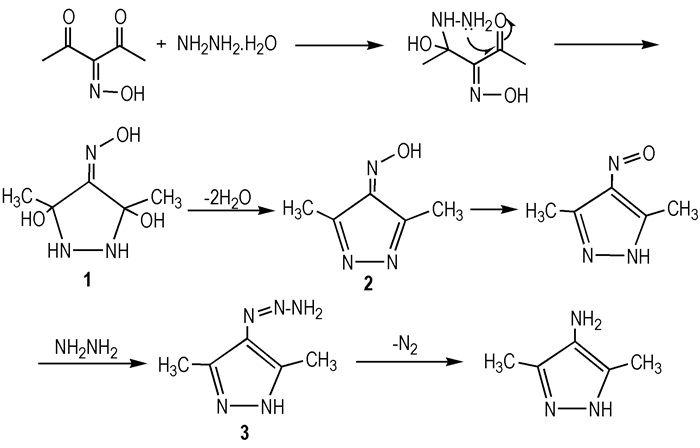
|
Scheme2 Synthetic mechanism of ADMP |
实验中发现,合成4-氨基-3,5-二甲基吡唑的反应开始时反应剧烈放热,在低温(0~5 ℃)状态下加完反应物料后,保持低温稳定搅拌约10 min,将反应体系转移到室温条件下,继续搅拌,反应体系经过剧烈放热升温至回流状态,回流约5 min后体系开始降温,温度下降约20 ℃再开启加热至回流。由以上推测的反应机理可以看出,实验开始时因剧烈放热过程产生氮气,且无法及时排出,容易发生喷料现象。
实验操作过程中发现,反应物料的加入总体积(V1)与反应容器体积(V2)的比例,对此反应的安全性(即是否发生喷料)影响较大。当加入反应物料的总体积(V1)与反应容器体积(V2)的比例(V1/V2)大于或等于2/3时,没有足够的空间缓冲释放出来的氮气,体系会发生喷料现象;当V1/V2小于或等于1/2时,反应体系发生剧烈回流,有足够空间缓冲释放出的氮气,不会发生喷料。因此,为了保证此反应平稳、安全的进行,V1/V2应保持小于或等于1/2。
3.3 重氮化反应的后处理方法探讨 3.3.1 萃取法4-重氮基-3,5-二甲基吡唑内盐(DMDAPZ)属于分子内盐,其极性大,在水中的溶解度较大,且因为分子中含有重氮基,使其不稳定,在室温条件下,存放时间越长,分解变质越严重,而制备过程要在水溶液中进行,提取产品存在较大难度,造成收率偏低,因此后处理方式对产物的收率影响很大,文献[4, 13, 14]采用低沸点溶剂萃取及低温减压蒸馏的方式,获取产物。因此,实验中考察了不同萃取次数对化合物收率的影响,结果见表 1。结果表明,随着萃取次数的增加,重氮盐的收率逐渐增大;当萃取次数大于9次时,再增加萃取次数,产物收率变化很小,纯度基本保持不变。因此,实验中选择萃取次数为9次。从上述实验结果可以看出,即使将萃取次数增大到9次,收率也仅仅从文献[14]的77.0%提高到81.9%,但增加了萃取试剂的使用量和延长了后处理时间。
| 表 1 萃取次数对收率的影响 Tab.1 Influence of extraction times on yield |
针对4-重氮基-3,5-二甲基吡唑内盐传统的后处理方法-萃取法,存在后处理时间长、萃取剂使用量大、操作过程繁杂等缺点。研究过程中采用新的后处理方法-冷冻结晶法,将重氮化反应后的反应液用氨水中和至pH=8,反应液放入冰箱中,冷冻过夜,析出大量黄色晶体,保持低温状态下快速过滤,真空干燥得黄色固体,收率86.1%,纯度98.4%,较工艺优化后的传统方法收率高。冷冻结晶法具有操作过程简单、后处理时间短、避免使用大量试剂、绿色环保等优点,适宜作为新的工艺方法放大推广应用。
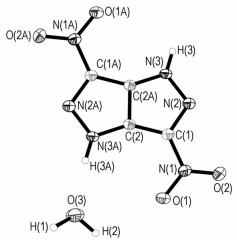
3.4 DNPP·H2O晶体结构分析DNPP·H2O晶体的分子结构和分子在晶胞中的堆积分别示于图 1和图 2,非氢原子坐标和等效温度因子、部分键长和键角、部分二面角、氢键及各向异性移动参数分别列于表 2~表 5。
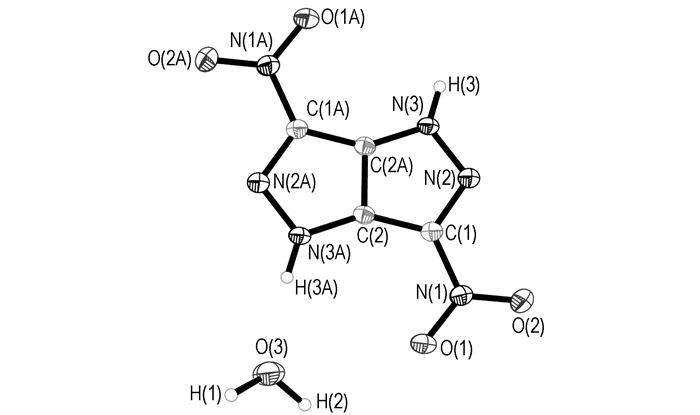
|
图 1 DNPP·H2O的分子结构 Fig.1 Molecular structure of DNPP·H2O |
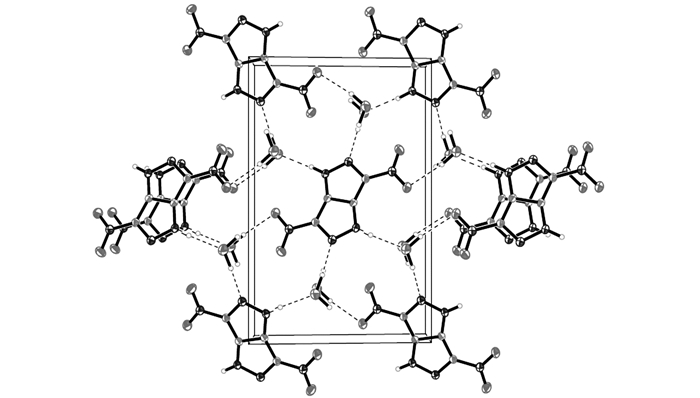
|
图 2 DNPP·H2O的晶胞堆积图 Fig.2 Packing diagram of the unit cell of DNPP·H2O |
| 表 2 非氢原子坐标(×104)和等效温度因子(nm2×103) Tab.2 Nonhydrogen atomic coordinates(×104)and equivalent temperature factor(nm2×103) |
| 表 3 部分键长和键角 Tab.3 Selected bond lengths and angles |
| 表 4 部分二面角 Tab.4 Selected dihedral angles |
| 表 5 氢键 Tab.5 Hydrogen bonds |
晶体分析结果表明,该晶体为单斜晶系,空间群为P2(1)/c。晶体学参数为:a=0.3480(4) nm,b=1.4134(16) nm,c=0.9027(11) nm,α=90°,β =94.327(16)°,γ=90°,V=0.4427(9) nm3,Z=4,Dc=1.756 g·cm-3,μ =0.164 mm-1,F(000)=240。该晶体结构由Patterrson直接法解出,原子位置均由差值Fourier合成法得到。分子结构用82个参数,由块矩阵最小二乘法进行优化(对于氢原子采用各向同性热参数,对于非氢原子采用各向异性热参数)。对于l>2σ(l)数据的最终偏差因子R1=0.0503,wR2=0.1391;对所有数据的偏差因子R1=0.0622,wR2=0.1534,最佳拟合度s=0.996,消光系数为0.060(16),最终差值电子云密度的最高峰为405 e·nm-3,最低峰为-355 e·nm-3。
分析结果可知,DNPP分子属于中心对称结构,在DNPP分子结构中,O(1)—N(1)—C(1)—C(2)的二面角为2.7°,O(2)—N(1)—C(1)—C(2)的二面角为-178.09°,N(2)—C(1)—C(2)—N(3)二面角为-179.6°,N(1)—C(1)—C(2)—N(3)二面角为2.5°,故吡唑并吡唑环和两个硝基的所有原子几乎处在同一平面上。吡唑并吡唑环本身形成了π810的大共轭体系,硝基自身形成了π34,从而使该化合物表现出良好的热稳定性。同时,DNPP的分子结构中亚氨基含有活泼氢,在以水为体系培养DNPP单晶时,由于DNPP和水分子之间存在分子间氢键,一分子DNPP结合了一分子水(从单晶结构和晶胞堆积图也可以看出),从而也使该物质的晶体密度小于实测密度。
4 结论(1) 进行了DNPP百克量合成研究,改进了重氮盐中间体的后处理方法:采用冷冻结晶法代替传统的萃取法,使操作工艺简单,避免使用大量的有机溶剂,绿色环保,收率从文献的77.0%提高到86.1%;全程收率从文献的9.3%[4]提高到17.9%。
(2) 探讨了环化、还原“一锅法”反应机理,结合实验,从原理上分析了造成此反应容易喷料的原因:反应中短时间产生大量的氮气,没有及时、有效的释放。
(3) 培养了DNPP·H2O单晶,晶体结构分析结果表明,DNPP·H2O为单斜晶系,空间群为P2(1)/c,DNPP分子结构中吡唑并吡唑环及两个硝基的所有非氢原子几乎处在同一平面上,彼此间形成一个稳定的共轭体系,从而使该化合物表现出良好的热稳定性。
| [1] |
敖国军, 刘振华, 张同来, 等. 三氨基胍系列含能化合物的研究进展[J].
含能材料, 2008, 16(4): 450-456. AO Guo-jun, LIU Zhen-hua, ZHANG Tong-la, et al. Progress in triaminoguanidine energetic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2008, 16(4): 450-456. |
| [2] |
LI Sheng-hua, SHI Hong-gang, SUN Cheng-hui, et al. Synthesis and crystal structure of 2, 2', 5, 5'-tetrachloro-1, 1'-azo-1, 3, 4-triazole[J].
Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(1): 7-9. |
| [3] |
阳世清, 徐松林, 雷永鹏. 氮杂环含能化合物的研究进展[J].
含能材料, 2006, 14(6): 475-484. YANG Shi-qing, XU Song-lin, LEI Yong-peng. Development on nitrogen heterocyclic energetic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 475-484. |
| [4] |
罗义芬, 葛忠学, 王伯周, 等. 二硝基吡唑并吡唑(DNPP)合成工艺研究[J].
含能材料, 2007, 15(3): 205-207. LUO Yi-fen, GE Zhong-xue, WANG BO-zhou, et al. Synthetic improvement of DNPP[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2007, 15(3): 205-207. |
| [5] |
Vasilii M V, Lgor L D, Svyatoslav A S. N-amination of pyrazoles: a general approach[J].
Mendeleev Commun, 1993: 111 |
| [6] |
Pagoria F, Gregory S, Alexander R. A review of energetic materials synthesis[J].
Thermo Chim Acta, 2002, 384(1): 187-204. |
| [7] |
李亚南, 唐婷, 廉鹏, 等. 1, 4-二氨基-3,6-二硝基吡唑[4,3-c]并吡唑(LLM-119)的合成、热性能及量子化学研究[J].
有机化学, 2012, 32(3): 580-588. LI Ya-Nan, TANG Ting, LIAN Peng, et al. Synthesis, yhermal performance and quantum chemistry study on 1, 4-diamino-3,6-dinitropyrazolo[4,3-c]pyrazole(LLM-119)[J]. Chinese Journal of Organic Chemistry, 2012, 32(3): 580-588. |
| [8] |
Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Gaussian, Inc., Wallingford CT, 2009.
|
| [9] |
Alfred G Stem, Jesse S Mooran, R Jason Jouet, et a1. Dinitropy-razolopyrazole-amine salts useful in gun propellants: USP 6706889Bl[P]. 2004.
|
| [10] |
罗义芬, 葛忠学, 王伯周, 等. 4-氨基-3,5-二甲基吡唑合成工艺改进[J].
精细化工中间体, 2007, 37(3): 47-49. LUO Yi-fen, GE Zhong-xue, WANG BO-zhou, et al. An improvement on synthesis of 4-amino-3,5-dimethylpyrazole[J]. Fine Chemical Intermediates, 2007, 37(3): 47-49. |
| [11] |
Infantes L, Foces-foces C, Claramunt R M, et al. Aminopyrazole and their conjugated acid:An X-ray study of 3, 5-dimethyl-4-aminopymzole and the picrate of 3(5)-aminopyrazole[J].
J Heterocycl Chem, 1999, 36(3): 595-600. DOI:10.1002/jhet.v36:3 |
| [12] |
Patel H P, Tedder J M. Heterocyclic diazo-compounds. Part Ⅲ. 4-diazopyrazoles prepared by the direct introduction of the diazonium group into the pyrazole nucleus[J].
J Chem Soc, 1963: 4589-4591. DOI:10.1039/jr9630004589 |
| [13] |
Gouki F, Yuichi K, Tanezo T. Reactivity of 4-diazo-3,5-dimethylpyrazole. I: Intramolecular cyclization reaction and the reaction mechanism[J].
Yakugeku Zasshi, 1974, 94(1): 17-22. DOI:10.1248/yakushi1947.94.1_17 |
| [14] |
张海昊, 王伯周, 罗义芬, 等. 3, 5-二甲基-4-重氮吡唑的合成[J].
化学试剂, 2007, 29(7): 437-438. ZHANG Hai-hao, WANG Bo-zhou, LUO Yi-fen, et al. The synthesis of 3, 5-dimethyl-4-diazopyrazole[J]. Chemical Reagents, 2007, 29(7): 437-438. |
The synthetic technical of 3,6-dinitropyrazolo[4,3-c]pyrazole(DNPP) was studied at 100 g level, and the structures of intermediates and DNPP were confirmed by IR, 1H NMR, 13C NMR, elemental analysis and MS. The single crystal of DNPP·H2O was obtained in the water system.




 ,
,