硝基胍可作为发射药、推进剂和炸药的组分, 广泛应用于火炸药制造中, 也可作为产气剂组分广泛应用于机动车辆或飞行器的气囊系统中。硝基胍(NQ)为白色针状结晶, 有
在硝基胍分子中, 由于硝基的吸电子作用, 使得其碳原子的电荷密度偏低, 很容易与富电子亲核试剂发生反应, 得到一系列硝基胍衍生物, 这些衍生物广泛可应用于医药、农药等领域[4-5]。硝基胍与含能亲核试剂反应够得到一系列新的含能硝基胍衍生物, 为寻找像硝基胍这种成本既低廉且又钝感的高能炸药。本文对这些含能硝基胍衍生物的研究状况进行了综述。
2
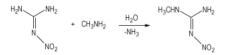
|
Scheme 1 |
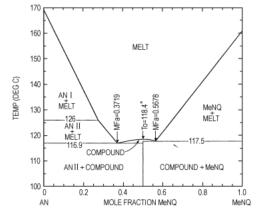
而MeNQ直接用作含能材料的文献报道较少, 只在20世纪90年代, Michael等人[6, 12]曾报道MeNQ可以与硝酸铵(AN)形成低共熔物制备分子间熔铸炸药。MeNQ与AN接触时, 会发生酸碱键合作用, 形成复合物, 降低了它们的熔点, 形成低共熔物。图 1为AN/MeNQ体系的温度—组成相图[12]。从图 1可知, 当AN的摩尔分数0.3719和0.5678时, 可形成低共熔物, 其熔点分别为116.9 ℃和117.5 ℃。
|
图 1 AN/MeNQ的相图 Fig.1 Phase diagram of AN/MeNQ |
AN/MeNQ体系可以用作熔铸炸药, 并可利用传统熔铸装药设备进行装药。由于对熔铸炸药配方的熔点基本要求是低于110 ℃, 最好低于100 ℃。通过添加熔点消降剂如硝基胍、胍的硝酸盐、氨基胍的硝酸盐、脲、硝酸钾、硝酸钠、硝酸锂、硝酸钙、高氯酸铵可降低AN/MeNQ体系的熔点。消降剂的质量分数可以在0.1%~25%间调整[12]。
用40份熔融介质(39.2份AN、45份MeNQ、11.3份NQ和4.5份硝酸钠)和60份
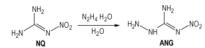
硝基胍与肼的水合物在水中于55 ℃反应15 min左右容易制得3-氨基-1-硝基胍(ANG)(Scheme 2)[13-16]。ANG密度1.767 g·
|
Scheme 2 |
ANG不溶于大多数有机溶剂, 微溶于水, 在20 ℃溶解度为0.34%(质量比), 70 ℃溶解度为3%(质量比)[15]。ANG具有酸碱性, 既能与碱反应, 又能与酸反应[18-19]。与硝酸反应, 生成3-氨基-1-硝基胍硝酸盐(ANGN)。ANGN密度1.905 g·
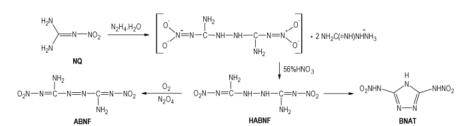
1-氨基-硝基胍与1-甲基-2-硝基-1-亚硝基胍在室温下反应可制得双(硝基甲脒)肼(HABNF), 但反应时间长, 得率低[20]。在Scheme 2中, 当硝基胍与肼的摩尔比为2:1、在醇中反应时能够制得HABNF, 但是得率只有4.5%[20-21]。考虑到硝基胍肼解反应的简单性, Metelkina[20]深入研究发现该反应的方向与肼水合物的初始浓度和反应温度有关, 跟溶剂无关, 因此他们采用水作溶剂控制肼水合物的浓度, 使其滴定加入, 控制温度45~50 ℃, 反应4 h, 或者在常温下反应12 d得到HABNF的氨基胍盐, 再用56%
|
Scheme 3 |
纯HABNF的颜色为纯白色, 熔点193~198 ℃(分解), 含有杂质的HABNF的熔点(分解)会降低[20-21]。HABNF可看作联硝基胍, 但它的热分解温度低于硝基胍(240 ℃左右), 其他性能未见报道。HABNF能被氧化得到偶氮硝基甲脒(ABNF)(Scheme 3), 其熔点和分解温度处于154~160 ℃, 作为炸药的可能性较小[20]。
2, 5-二硝基联胍还能环化, 得到3, 5-二硝氨基-1, 2, 4-三唑(BNAT)(Scheme 3) [22], 它具有酸性, 很容易形成钾盐, 进而制得其胍盐、氨基胍盐、肼盐和铵盐, 这些盐的热分解温度都低于190 ℃[23], 作为炸药的可能性较小。
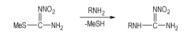
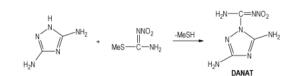
5 3, 5-二氨基-1-硝脒基-1, 2, 4-三唑(2-甲基-1-硝基-异硫脲与相应的有机胺反应[24-26](Scheme 4)是制备有脂肪族和芳香族取代硝基胍衍生物的常见方法, 相应3, 5-二氨基-1, 2, 4-三唑与2-甲基-1-硝基-异硫脲反应应该发生在氨基上, 但是Astakhov等[27]的试验却得到3, 5-二氨基-1-硝脒基-1, 2, 4-三唑(DANAT), 取代反应发生在三唑环上的氮原子上(Scheme 5)。作为钝感炸药5-氨基-3-硝基-1, 2, 4-三唑(ANTA)和4-氨基-5-硝基-1, 2, 3-三唑(ANTZ)能否发生类似于Scheme 4或Scheme 5反应, 得到能量更高的三唑类硝基胍衍生物, 尚未见有文献报道。
|
Scheme 4 |
|
Scheme 5 |
DANAT具有分子间氢键, 是一个十分稳定的化合物, 热分解温度达到270~275 ℃。DANAT呈碱性, 能与硝酸和高氯酸反应, 得到3, 5-二氨基-1-硝脒基-1, 2, 4-三唑硝酸盐和3, 5-二氨基-1-硝脒基-1, 2, 4-三唑高氯酸盐[27]; 前者在160 ℃开始失重, 270 ℃开始剧烈分解; 后者分解温度为240 ℃。
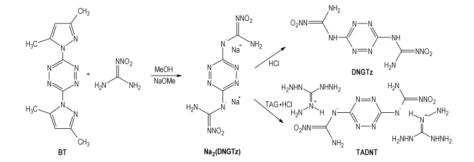
6 3, 6-二硝基胍-1, 2, 4, 5-四嗪(3, 6-双(二甲基吡唑-1-基)-1, 2, 4, 5-四嗪(BT)与硝基胍的钠盐在甲醇中反应得到3, 6-二硝基胍-1, 2, 4, 5-四嗪的钠盐
|
Scheme 6 Synthesis route of DNGTz and TADNT |
DNGTz为橙粉红色固体, 密度为1.76 g·
TADNT为棕红色固体, 密度为1.61 g·
DNGTz和TADNT都具有低的燃速压力指数(分别为0.163和0.366), 特别是DNGTz的燃速压力指数较低, 很适合应用于气体发生剂和推进剂[29]。
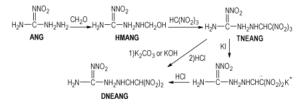
7 1-(2, 2, 2-三硝基乙氨基)-2-硝基胍(TNEANG和DNEANG爆轰性能未见文献报道, 熔点分别为95~96℃和93~94℃[31], 可作为熔铸炸药的熔融相应用。
|
Scheme 7 Synthesis route of TNEANG and DNEANG |
2-硝亚胺基-5-硝基-六氢化-1, 3, 5-三嗪(NNHT), 白色晶体, 熔点207 ℃; 分子结构中既含有硝基, 又含有氨基, 分子间和分子内皆可形成氢键, 具有较低的感度, 是近年来引起人们重视的一种新型不敏感炸药[32-35]。NNHT的密度为1.88 g·
NNHT的合成有两种方法。采用最多的是以硝基胍、甲醛和特丁胺为原料, 经过Mannich缩合反应得到2-硝亚胺基-5-特丁基-六氢化-1, 3, 5-三嗪(NBHTA), 然后经过氯离子催化硝解反应得到目标化合物NNHT(Scheme 8)[35, 40]。Mannich缩合反应温度一般在80 ℃左右, 得率低于90%;为了降低能耗, Miller添加了十二烷基硫酸铵等相催化剂, 在室温下反应48 h, 使NBHTA的得率提高到了97.5%[41]。
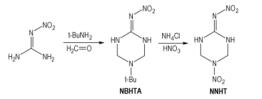
|
Scheme 8 |
为了降低成本, 研究者们[36, 42, 43]用乌洛托品替代特丁胺, 虽然NNHT的总得率(64.3%)降低了近20%, 但是该工艺的原料易得(乌洛托品成本只有特丁胺的三分之一左右)、粗品的纯度达到了96%(高于Scheme 8反应的82%), 更为经济, 利于规模化生产(Scheme 9)。
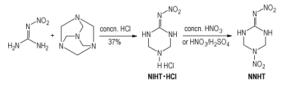
|
Scheme 9 |
用硝酸或硝硫混酸硝化胍盐能得到得率超过95%的NQ[44-46], 而NQ能被进一步硝化成DNG, Astrat′yev等[22]的研究发现硝化成DNG的反应速度大致随介质的硝化活性和酸性增强而增快(98%
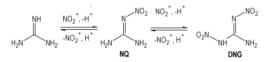
|
Scheme 10 |
DNG熔点为169 ℃, DSC分解温度超过了180 ℃, 对热较稳定[22, 47]。它在水和有机溶剂如乙酸乙酯、乙醇、丙酮、乙腈中有中等程度的溶解性, 并且随着温度的升高而增大, 例如20 ℃, DNG在水中的饱和溶解度为53 g·
DNG密度为1.884 g·
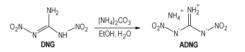
|
Scheme 11 |
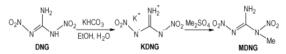
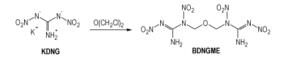
DNG阴离子能与亲电试剂反应得到在硝胺基氮原子上取代的衍生物。例如, DNG的钾盐与二甲基硫酸酯在冠醚存在下在丙酮溶剂中反应得到得率为85%的1-甲基-1, 2-二硝基胍(MDNG)(Scheme 12), MDNG熔点为82 ℃、可用于熔铸炸药[22]。1, 2-二硝基胍的钾盐与二氯二甲醚在冠醚和NaI存在下在丙酮溶剂中反应得到得率为75%双(1, 2-二硝基胍基)甲醚(BDNGME)(Scheme 13), 它的熔点为145 ℃[22], 从分子结构看, 也可能用作含能材料, 但是也未见文献对其性能表征。
|
Scheme 12 |
|
Scheme 13 |
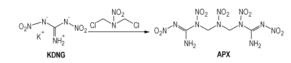
DNG的钾盐与2-硝基-1, 3-二氯-2-氮杂丙烷反应得到1, 7-二氨基-1, 7-二硝胺基-2, 4, 6-三硝基-2, 4, 6-三氮杂庚烷(APX)(Scheme 14), 正如与二氯二甲醚反应一样, 该反应在冠醚和NaI存在下在丙酮溶剂中来进行, APX的DSC分解温度为174 ℃, 计算的爆速和爆压分别为9540 m·
|
Scheme 14 |
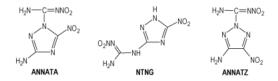
在硝基胍衍生物中, MeNQ和NNHT已分别应用于分子间熔铸炸药和发射药中。从能量方面来看, DNG、APX和ANGN的爆速都超过了9000 m·
|
Scheme 15 Molecular structures of ANNATA, NTNG and ANNATZ |
| [1] |
杜文霞, 刘亚杰, 吴琼, 等. 硝基胍的毒性研究[J].
工业卫生与职业病, 2003, 29(3): 171-173. DU Wen-xia, LIU Ya-jie, WU Qiong, et al. Toxicity study of nitroguanidine[J]. Ind Hlth & Occup Dis, 2003, 29(3): 171-173. |
| [2] |
段卫东, 黄凤雷. 低易损性硝基胍炸药的爆炸安全性能研究[J].
弹箭与制导学报, 2002, 23(4): 167-171. DUAN Wei-dong, HUANG Feng-lei. Investigation on the exploding security performance of low vulnerability explosive nitroguanidine[J]. Journal of Projectiles, Rockets, Missiles and Guidance, 2002, 23(4): 167-171. |
| [3] |
段卫东, 吕早生. 硝基胍炸药的机械感度和爆炸性能研究[J].
含能材料, 2003, 11(4): 209-212. DUAN We-dong, Lü Zao-sheng. Mechanical sensitivity and explosive performance of nitroguanidine(NQ)-based composite explosives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2003, 11(4): 209-212. |
| [4] |
丁建刚, 张振江. 硝基胍的量子化学研究[J].
苏州大学学报(自然科学版), 2003, 19(1): 80-82. DING Jian-gang, ZHANG Zhen-jiang. Quantum chemical study on nitroguanidine[J]. Journal of Suzhou University (Natural Science Edition), 2003, 19(1): 80-82. |
| [5] |
Bracuti A J. Structural features of 2-nitroguanidine. ADA415256[R], 2003.
|
| [6] |
张光全, 董海山. MeNQ的合成进展及其在熔铸炸药中的应用[J].
含能材料, 2008, 16(3): 353-355. ZHANG Guang-quan, DONG Hai-shan. Synthesis progress and application of N-methyl-N′-nitroguanidine in melt/cast explosives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2008, 16(3): 353-355. |
| [7] |
查志明. 一种甲基硝基胍及其制备方法:
CN, 101565392[P], 2008. |
| [8] |
Bernd Gallenkamp, Lothar Rohe. Process for preparing N-methyl-N′-nitroguanidine: USP, 5783734[P], 1998.
|
| [9] |
Bernd Gallenkamp, Lothar Rohe. Verfahren zur herstellung von N-methyl-N′-nitroguanidin: EPP, 0798293[P], 1997.
|
| [10] |
Winfried Pabst, Rainer Schirra. Method of producing N-methyl-N′-nitroguanidine: USP, 6384277[P], 2002.
|
| [11] |
Norbert Kern, Gary M. Nath. Method for producing N-methyl-N′-nitroguanidine:USP, 20020173675A1[P], 2002.
|
| [12] |
Michael A. Patrick, Stephen A. Aubert. Intermolecular complex explosives:USP, 4948438[P], 1990.
|
| [13] |
Castillo-Meléndez J A, Golding B T. Optimisation of the synthesis of Guanidines from amines via nitroguanidines using 3, 5-dimehtyl-N-nitro-1H-pyrazole-1-carboxamidine[J].
Synthesis, 2004, 10: 1655-1663. |
| [14] |
Phillips R, Williams J F. Nitro-aminoguanidine[J].
J Am Chem Soc, 1928, 50: 2465-2470. DOI:10.1021/ja01396a020 |
| [15] |
Whitmore W F, Revukas A J. Nitroguanylhydrazones of some common aldehydes and ketone[J].
J Am Chem Soc, 1935, 57: 706-708. |
| [16] |
Henry R A, Makosky R C, Smith G B I. Preparation of nitroaminoguanidine[J].
J Am Chem Soc, 1951, 73: 474-474. |
| [17] |
Thomas M. Klapötke, Joerg Stierstorfer. Current advances in RDX replacements[C] ∥Proceedings of the 27th Army Science Conference, Orlando, FL, USA, November 29-December 2, 2010.
|
| [18] |
Thomas M. Klapötke, Jörg Stierstorfer. Potential replacements of RDX with low sensitivities[C]∥ Insensitive Munitions & Energetic Materials Technology Symposium, 11-14 October, 2010, München Marriott Hotel Munich, Germany.
|
| [19] |
Kumler W D, SAH P T. The structure of nitroguanidine and nitroaminoguanidine[J].
The Journal of Organic Chemistry, 1953, 18(6): 669-675. DOI:10.1021/jo01134a010 |
| [20] |
Metelkina E L. 2-Nitroguanidine derivatives: Ⅵ. synthesis and chemical properties of hydrazo-and azobis(nitroformamidine)[J].
Russian Journal of Organic Chemistry, 2004, 40(7): 928-935. DOI:10.1023/B:RUJO.0000045193.49958.c4 |
| [21] |
Henry R A, Skolnik S, Smith G B I. The hydrazinolysis of nitroguanidine in alcoholic system: preparation and reactions of 1, 6-dinitrobiguanidine[J].
J Am Chem Soc, 1953, 75: 955-962. DOI:10.1021/ja01100a055 |
| [22] |
Astrat'yev A A, Dashko D V, Kuznetsov L L. Synthesis and some properties of 1, 2-dinitroguanidine[J].
Russian Journal of Organic Chemistry, 2003, 39(4): 501-512. DOI:10.1023/A:1026003700547 |
| [23] |
Metelkina E L. 2-Nitroguanidine Derivatives: V. Synthesis and structure of 3, 5-bis(nitroamino)-1, 2, 4-triazole salts. Acid-base propertiesof 3, 5-bis(nitroamino)-1, 2, 4-triazole[J].
Russian Journal of Organic Chemistry, 2004, 40(4): 543-550. DOI:10.1023/B:RUJO.0000036077.24894.51 |
| [24] |
Fishbein L, Gallaghan J A. The Preparation and reactions of 2-alkyl-1-(or 3)-nitro-2-thiopseudourea. part Ⅰ. reaction with amines[J].
J Am Chem Soc, 1954, 76(7): 1877-1879. DOI:10.1021/ja01636a042 |
| [25] |
Hafner L, Evans R. Preparation of 2-imino-and 2-nitrimine-1, 3-diazacycloalkanesJ][J].
J Org Chem, 1959, 24(8): 1157-1159. DOI:10.1021/jo01090a626 |
| [26] |
Kando Yasuyuki, Ishizuka Hitoshi, Uneme Hideki, et al. Preparation and reaction of mono-and di-acyl nitroisothiourea derivatives[J].
Nippon Kagakkai Koen Yokoshu, 1999, 77: 425-429. |
| [27] |
Astakhov A M, Vasil′ev A D, Gelemurzina V I, et al. N-Nitroimines: Ⅰ. synthesis, structure, and properties of 3, 5-diamino-1-nitroamidino-1, 2, 4-triazole[J].
Russian Journal of Organic Chemistry, 2003, 39(1): 120-124. DOI:10.1023/A:1023411100366 |
| [28] |
Chavez D E, Hiskey M A, Gilardi R D. Novel high-nitrogen materials based on nitroguanyl-substituted tetrazines[J].
Org Lett, 2004, 6: 2889 DOI:10.1021/ol049076g |
| [29] |
Chavez D E, Tappan B C, Hiskey M A, et al. New high-nitrogen materials based on nitroguanyl-tetrazines: explosives properties, thermal decomposition and combustion studies[J].
Propellants Explosives Pyrotechnics, 2005, 30(6): 412-417. DOI:10.1002/(ISSN)1521-4087 |
| [30] |
Metelkina E L, Novikova T A, Telenyuk S E. 2-Nitroguanidine derivatives: Ⅲ. study of reaction between 1-amino-2-nitroguanidine and formaldehyde[J].
Russian Journal of Organic Chemistry, 1999, 35(11): 1587-1589. |
| [31] |
Metelkina E L, Novikova T A. 2-Nitroguanidine derivatives. Synthesis and structureof 1-(2, 2, 2-trinitroethylamino)-and 1-(2, 2-dinitroethylamino)-2-nitroguanidines[J].
Russian Journal of Organic Chemistry, 2002, 38(9): 1378-1379. DOI:10.1023/A:1021632603222 |
| [32] |
Luis G L, Paz D, Ciller J. On the use of AM1 and PM3 methods on energetic compounds[J].
Propellants Explosives Pyrotechnics, 1993, 18: 33-40. DOI:10.1002/(ISSN)1521-4087 |
| [33] |
Kony M, Dagley I J, Leslie D R. 14N NMR Studies on cyclic nitramines correlations of chemical shifts with nitrogen partial atomic charge and π-orbital overlap[J].
J Org Chem, 1994, 59: 5623-5626. DOI:10.1021/jo00098a020 |
| [34] |
Cichra D A, Adolph H G. Nitrolysis of dialkyl tertbutylamines[J].
J Org Chem, 1982, 47: 2474-2476. DOI:10.1021/jo00133a047 |
| [35] |
张海昊, 王伯周, 刘愆, 等. 2-硝亚胺基-5-硝基-六氢化-1, 3, 5-三嗪(NNHT)的合成[J].
火炸药学报, 2007, 30(6): 48-50. ZHANG Hai-hao, WANG Bo-zhou, LIU Qian, et al. Synthesis of 2-nitroimino-5-nitrohexahydro-1, 3, 5-triazine (NNHT)[J]. Chinese Journal of Explosives & Propellants, 2007, 30(6): 48-50. |
| [36] |
Huang D S, Rindone R R. High energetic insensitivity cyclic nitramines: US, 4937340[P ], 1990.
|
| [37] |
Dagley I J, Kony M. Properties and impact sensitiveness of cyclic nitroamine explosives containing nitroguanidine groups[J].
J Energ Mater, 1995, 13: 35-56. DOI:10.1080/07370659508019343 |
| [38] |
Strauss B, Moy S M. Insensitive gun propellant: US, 5325782[P], 1994.
|
| [39] |
Bracuti A J. Crystal structure of 2-nitrimino-5-nitro-hexahydro-1, 3, 5-triazine[J].
Journal of Chemical Crystallography, 2004, 34(2): 135-140. DOI:10.1023/B:JOCC.0000014700.03335.80 |
| [40] |
Cliff M D, Dagley I J, Parker R P. Synthesis of 2-nitroimino-5-nitrohexahydro-1, 3, 5-triazine[J].
Propellants Explosives Pyrotechnics, 1998, 23(3): 179-181. |
| [41] |
Miller C G. Synthesis of 2-Nitroimino-5-nitrohexahydro-1, 3, 5-triazine: US, 20100326575[P], 2010.
|
| [42] |
Metelkina E L. 2-Nitroguanidine derivatives: X. synthesis and nitration of 4-nitriminotetrahydro-1, 3, 5-oxadiazine and 2-nitriminohexahydro-1, 3, 5-triazine and their substituted derivatives[J].
Russian Journal of Organic Chemistry, 2007, 43(10): 1437-1440. DOI:10.1134/S1070428007100041 |
| [43] |
李永祥, 王建龙, 王艳红, 等. 一种合成2-硝亚胺基-5-硝基-六氢化-1, 3, 5-三嗪(NNHT)的新方法[J].
有机化学, 2010, 31(2): 256-259. LI Yong-xiang, WANG Jian-long, WANG Yan-hong, et al. A novel synthetic method of 2-nitroimino-5-nitro-hexahydro-1, 3, 5-triazine (NNHT)[J]. Chinese Journal of Organic Chemistry, 2010, 31(2): 256-259. |
| [44] |
Gersumsky W D, Sutherland H. Nitroguanidine preparation: US, 2878290[P], 1959.
|
| [45] |
Hagn Hermann. Verfahren zur Herstellung von nitroguanidin mit hohem reinheits-grad und hoher spezifischer oberflaeche: DE1142860[P], 1963.
|
| [46] |
Thoma Matthias. Production of nitroguanidine from guanidine nitrate and nitric acid: DE2745774[P], 1979.
|
| [47] |
Latypov N V, Johansson M, Yudina-Wahlström L N, et al. Synthesis and characterization of1, 2-dinitroguanidine (DNG and its derivatives[C]∥ New Trends in Research of Energetic Materials, Proceedings of Seminar, 9th, Pardubice, 2006, (Pt. 1): 160-168.
|
| [48] |
Pepekin V I, Afanas′ev G T. Explosive properties of 1, 2-dinitroguanidine and its compositions with graphite[J].
Khim Fizika (Chem Phys Report), 2005, 24(4): 66-68. |
| [49] |
Astachov A M, Revenko V A, Vasiliev A D, et al. 1, 2-Dinitroguanidine: structure and properties[C]∥ Internation Annual Conference of ICT, 2006:173/1-173/12.
|
| [50] |
Altenburg T, Klapötke T M, Penger A, et al. Two outstanding explosives based on 1, 2-dinitroguanidine: ammoniumdinitroguanidine and 1, 7-diamino-1, 7-dinitrimino-2, 4, 6-trinitro-2, 4, 6-triazaheptane[J].
Z Anorg Allg Chem, 2010, 636: 463-471. DOI:10.1002/zaac.v636:3/4 |
Synthesis methods of energetic nitroguanidine(NQ) derivatives were reviewed. The performance of some compounds in these energetic NQ derivatives was introduced.




