氮杂环类含能化合物因具有高生成焓、高密度、高氧平衡等优点, 已经成为高能量密度材料领域的热点之一。与传统的含能材料相比, 1, 3-二氧化-1, 2, 3, 4, -四嗪环是一种新颖的含能结构单元[1-6], 具有氮含量高, 燃烧产物清洁的特点[4-8]。呋咱并[3, 4-e] -4, 6-二氧化-1, 2, 3, 4-四嗪(FTDO)[9]是典型的1, 2, 3, 4-四嗪含能材料, 其实测密度为1.85 g·cm-3[10], 生成焓为672.94 kJ·mol-1[11], 计算爆速和爆压分别为9802 m·s-1和44.78 GPa。FTDO是一种具有潜在应用价值的含能材料, 既可作为火箭推进剂的氧化剂组分, 又可作为燃气发生剂使用[12]。实验发现FTDO安定性较差, 特别是水解安定性较差。国外报道FTDO极易水解, 在水介质中加热水解可以得到新型富氮含能材料5H-[1, 2, 3]三唑并[4, 5-c]呋咱(2)[13] (Scheme 1), 其氮含量高达63.06%, 计算生成焓、爆速、爆压和爆热分别为904.89 kJ·mol-1、8849 m·s-1、33.30 GPa和10127 J·g-1。
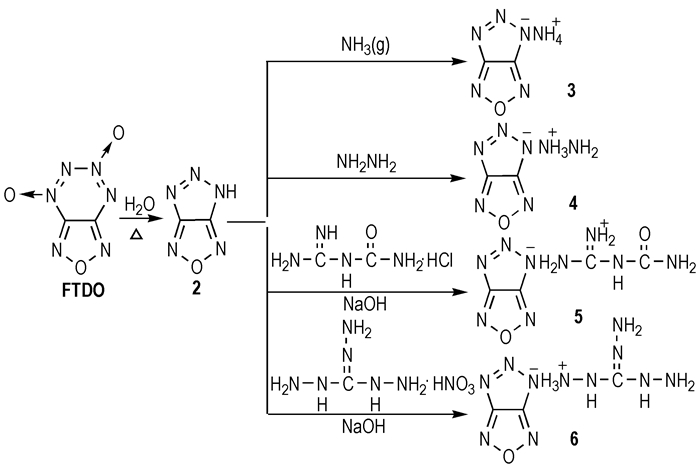
|
Scheme1 |
5H-[1, 2, 3]三唑并[4, 5-c]呋咱是一种弱的有机酸, pKa1, pKa2分别为5.1, 16.3[13], 这使该化合物的应用受到很大限制, 但由于其分子中存在酸性H, 因此也是一种重要的含能材料合成中间体。本文利用化合物2与氨气、水合肼、脒基脲盐酸盐、三氨基胍硝酸盐[14]为原料, 设计、合成了[1, 2, 3]三唑并[4, 5-c]呋咱铵盐(3)、[1, 2, 3]三唑并[4, 5-c]呋咱肼盐(4)、[1, 2, 3]三唑并[4, 5-c]呋咱脒基脲盐(5)、[1, 2, 3]三唑并[4, 5-c]呋咱三氨基胍盐(6)等4种未见文献报道的含能衍生物(Scheme 1), 采用红外光谱、核磁共振光谱、元素分析等进行了结构表征, 采用DSC研究了5H-[1, 2, 3]三唑并[4, 5-c]呋咱及其衍生物的热分解性能。
2 实验部分 2.1 主要仪器与试剂Nexus 870傅里叶变换红外光谱仪(美国Thermo Nicolet公司); AV500核磁共振仪(瑞士Bruker公司); Vario EL Ⅲ元素分析仪(德国Exementar公司); ZF-Ⅱ型三用紫外灯(上海安亭电子仪器厂); LC-2010A型高效液相色谱仪(日本岛津公司); Q-200型差示扫描量热仪(美国TA公司),动态氮气气氛,压力为0.1 MPa,升温速率为10 ℃·min-1,试样量为0.5~1.0 mg,试样皿为铝盘。
FTDO,自制; 去离子水、氨气、水合肼(80%)、无水硫酸镁、氢氧化钠、碳酸氢钠、甲醇、四氢呋喃均为分析纯,成都科龙化工试剂厂; 无水乙醚,分析纯,西陇化工股份有限公司; 脒基脲盐酸盐和三氨基胍硝酸盐均为工业级,上海翔立化工助剂有限公司。
2.2 实验原理实验原理见Scheme 1。
2.3 实验步骤 2.3.1 5H-[1, 2, 3]三唑并[4, 5-c]呋咱(2)的合成搅拌下, 在20~30 ℃, 将1.56 g (10 mmol)FTDO加入150 mL去离子水中, 升温至80 ℃反应5 h。然后冷却至15 ℃, 用50×5 mL的乙醚萃取, 水洗至中性, 用无水硫酸镁干燥, 蒸馏除去溶剂得到黄色固体(2) 0.854 g, 收率为76.92%。1H NMR (DMSO-d6, 500 MHz), δ: 14.40(s, 1H); 13C NMR (DMSO-d6, 500 MHz), δ:163.18; 14N NMR(DMSO-d6, 500 MHz)265.00 (ν1/2=1500 Hz), 408.53(υ1/2=3750 Hz), 15NNMR (DMSO-d6, 500 MHz) 266.66(N—N—N), 393.50(N—N—C), 432.85(O—N—C); IR(KBr,cm-1)ν: 3251, 1444(NH), 1602(C=N), 1525 (N=N); Anal. Calcd for C6H11N5O2: C 21.63, H 0.91, N 63.06; Found: C 21.05, H 1.15, N 62.73。
2.3.2 [1, 2, 3]三唑并[4, 5-c]呋咱铵盐(3)的合成将化合物(2) 330 mg (3 mmol)溶于25 mL四氢呋喃-甲醇溶液(1:1)中, 搅拌下, 在20~30 ℃, 向该溶液中通入氨气, 持续通氨气并保持此温度反应2 h, 然后将反应液倒入冰水中, 过滤, 水洗, 干燥得到褐色固体125.4 mg, 收率为33.04%。1H NMR (DMSO-d6, 500 MHz), δ: 4.21(s, 4H); 13C NMR (DMSO-d6, 500 MHz), δ: 154.46, 136.50; IR(KBr, cm-1)ν: 3186(NH4+), 1635(C=N), 1534(N=N); Anal.Calcd for C6H11N5O2: C 18.75, H 3.15, N 65.61; Found: C 19.78, H 3.25, N 64.79。
2.3.3 [1, 2, 3]三唑并[4, 5-c]呋咱肼盐(4)的合成将化合物(2) 330 mg (3 mmol)溶于25 mL四氢呋喃-甲醇溶液(1:1)中, 搅拌下, 在20~30 ℃, 向该溶液中缓慢滴加80%的水合肼, 滴加完毕, 保持此温度反应2 h, 然后将反应液倒入冰水中, 过滤, 水洗, 干燥得到黄色固体160 mg, 收率为37.78%。1H NMR (DMSO-d6, 500 MHz), δ: 6.74(s, 5H); 13C NMR (DMSO-d6, 500 MHz), δ: 154.60, 135.98; IR(KBr, cm-1)ν:3331(NH2), 3187, 1619(C=N), 1524(N=N); Anal. Calcd for C6H11N5O2: C 19.51, H 4.91, N 62.58; Found: C 19.95, H 4.39, N 61.92。
2.3.4 [1, 2, 3]三唑并[4, 5-c]呋咱脒基脲盐(5)的合成将化合物(2) 330 mg (3 mmol)溶于25 mL四氢呋喃-甲醇溶液(1:1)中, 搅拌下, 在60 ℃, 向该溶液中缓慢滴加1 mL 20%的氢氧化钠溶液(5 mmol), 滴加完毕, 保持此温度反应0.5 h, 然后分批加入0.55 g(3 mmol)脒基脲盐酸盐, 继续反应3 h, 完毕将反应液冷却到冰点, 过滤, 水洗, 干燥得到红褐色固体240 mg, 收率为38.10%。1H NMR(DMSO-d6, 500 MHz), δ: 6.87 (s, 6H), δ:7.1(s, 1H); 13C NMR(DMSO-d6, 500 MHz), δ: 154.64, 139.00;IR(KBr, cm-1)ν: 3469 (NH2), 3349(NH), 3178, 1721(C=O), 1638(C=N), 1513; Anal.Calcd for C6H11N5O2: C 22.54, H 3.31, N 59.14; Found: C 23.36, H 3.75, N 58.47。
2.3.5 [1, 2, 3]三唑并[4, 5-c]呋咱三氨基胍盐(6)的合成将化合物(2) 330 mg (3 mmol)溶于25 mL四氢呋喃-甲醇溶液(1:1)中, 搅拌下, 室温, 向该溶液缓慢滴加1 mL 20%氢氧化钠溶液(5 mmol), 滴加完毕, 保持此温度反应0.5 h, 然后分批加入0.50 g(3 mmol)三氨基胍硝酸盐, 继续反应3 h, 完毕将反应液冷却到冰点, 过滤, 水洗, 干燥得到棕黄色固体310 mg, 收率为48.49%。1H NMR (DMSO-d6, 500 MHz), δ: 4.49(s, 3H), δ: 8.63(s, 6H); 13C NMR (DMSO-d6, 500 MHz), δ: 159.48; IR(KBr,cm-1)ν: 3355(NH2), 3319(NH), 3212(NH3+), 1688(C—N), 1635(C=N), 1525(N=N); Anal.Calcd for C6H11N5O2: C 16.75, H 4.22, N 71.60; Found: C 15.98, H 3.95, N 69.99。
3 结果与讨论 3.1 水解机理探讨FTDO中, N3由于带有配位氧且旁边与两个N原子相连, 所以电子密度较低, 因此水分子优先进攻N3生成中间体7, 中间体7存在三种共振结构式(Ⅰ, Ⅱ, Ⅲ), 共振结构Ⅲ中N2的配位氧进攻N3, 导致N3, N4的双键断裂, 同时脱去一分子的HNO3, 生成化合物2, 其中化合物2以三种共振结构存在[1], 水解机理如Scheme 2。
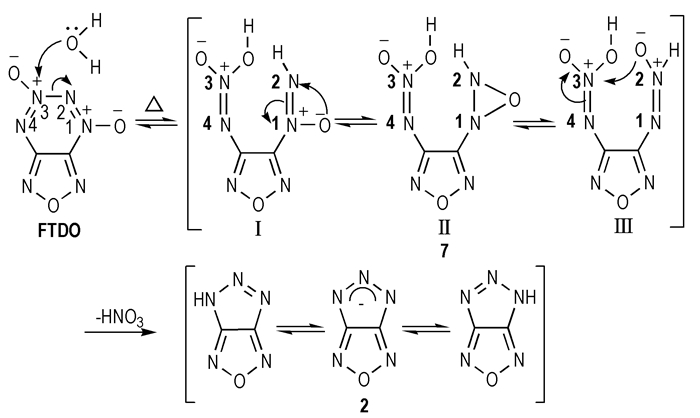
|
Scheme2 |
通过上述机理, 可以看出水分子作为碱进攻FTDO, 但是随着水解反应的进行, 生成的HNO3会使反应体系呈酸性, 必然导致水分子活性下降, 从而使反应体系向左移动。设定反应温度为80 ℃, FTDO为0.78 g(5 mmol), 考察反应体系中加入NaHCO3对水解反应的影响, 结果见表 1。由表 1可见, 反应体系中加入等摩尔比的NaHCO3时, 反应2 h原料FTDO点消失(用TLC薄层层析色谱监测, 甲醇:氯仿=1:5为展开体系, Rf=0.7);反应体系中加入两倍摩尔比的NaHCO3时, 反应1.5 h原料点消失(用TLC监测)。由此可得, 反应体系中加入适量的碱时, 反应速率变快, 但纯度和产率有所降低; 可以证明体系中加入适量碱时, 可以中和反应生成的HNO3, 促进反应向右移动。
| 表 1 NaHCO3用量对水解反应的影响 Tab.1 Effect of sodium bicarbonate on the hydrolytic reaction |
设定反应时间为5 h, 考察反应温度对化合物2收率的影响, 结果见表 2。由表 2可见, 反应温度60 ℃时, FTDO并未反应(用TLC监测), 只有温度高于70 ℃时, 水分子活性才足够强, 促使反应顺利进行; 进一步提高温度至80 ℃时, 收率为76.92%;反应温度进一步升高时, 收率反而下降, 其原因可能是反应温度太高, 反应过程中化合物2部分分解所致。因此, 反应最佳温度为80 ℃。
| 表 2 反应温度对化合物2产率的影响 Tab.2 Effect of reaction temperature on the yield of compound 2 |
设定反应温度为80 ℃, 考察了反应时间对化合物2收率的影响, 结果见表 3。由表 3可见, 反应时间为2 h和3 h时, FTDO并未反应(用TLC监测); 反应4 h以上原料才能完全反应; 但是反应时间太长, 收率又有所降低, 其原因可能是高温下反应时间太长化合物2分解所致, 故反应的最佳时间为5 h。
| 表 3 反应时间对化合物2产率的影响 Tab.3 Effect of reaction time on the yield of compound 2 |
化合物2, 4, 5和6的DSC曲线如图 1所示。由图 1可见, 四种化合物在没有达到分解温度前, 比较稳定; 四种化合物热分解过程不经过吸热熔化的相变过程, 而是固相直接分解。化合物2和4在173.23,144.82 ℃时分别有一个明显吸热放热峰, 表明化合物2和4在该温度下发生了剧烈的放热分解反应; 化合物5在172.81, 215.33, 295.36 ℃时有三个吸热放热峰, 其中215.33 ℃处峰型较为尖锐; 化合物6在164.94,307.49 ℃时有两个吸热放热峰, 其中164.94 ℃处峰型较为尖锐; 化合物2, 4和6放热峰型尖锐, 温度跨度较小, 表明这三种物质具有显著起爆药放热特征, 可用于起爆药。
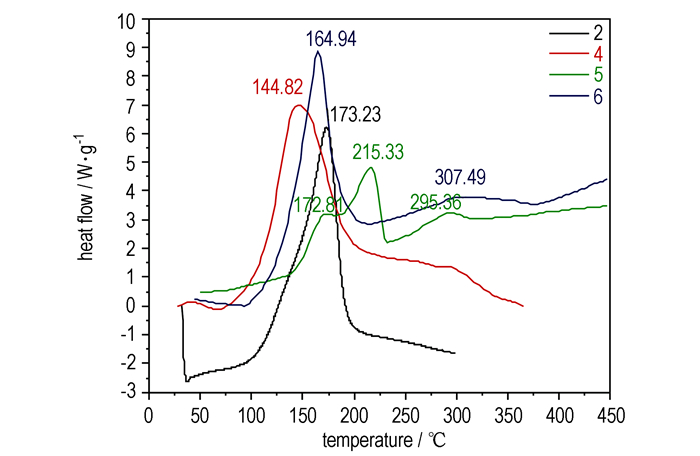
|
图 1 化合物2, 4, 5和6的DSC曲线 Fig.1 DSC curves of compounds 2, 4, 5 and 6 |
(1) 富氮含能材料FTDO极易水解, 在80 ℃下反应5 h即可获得新型含能材料5H-[1, 2, 3]三唑并[4, 5-c]呋咱, 收率为76.92%。探讨了FTDO反应机理, 实验发现:反应体系中加入适量NaHCO3, 可中和水解产物硝酸, 促进水解反应的进行。
(2) 自主设计并合成了[1, 2, 3]三唑并[4, 5-c]呋咱铵盐(3)、[1, 2, 3]三唑并[4, 5-c]呋咱肼盐(4)、[1, 2, 3]三唑并[4, 5-c]呋咱脒基脲盐(5)和[1, 2, 3]三唑并[4, 5-c]呋咱三氨基胍盐(6)等4种未见文献报道的5H-[1, 2, 3]三唑并[4, 5-c]呋咱含能衍生物, 并采用红外光谱、核磁共振光谱、元素分析等进行了结构表征, 并采用DSC热分析手段研究了化合物2、4、5和6的热性能, 其初始热分解峰分别为173.23, 144.82, 172.81, 164.94 ℃, 其中化合物2、4和6放热峰型尖锐, 温度跨度较小, 表明这三种物质具有显著起爆药放热特征, 可用于起爆药。
| [1] |
董海山. 高能量密度材料的发展及对策[J].
含能材料, 2004(增刊): 1-11. DONG Hai-shan. The development and countermeasure of high energy density materials[J]. Chinese Journal of Energetic Matetrical(Hanneng Cailiao), 2004(supplement): 1-11. |
| [2] |
黄明, 李洪珍, 董海山, 等. 呋咱类含能材料合成进展2004全国含能材料发展与应用学术研讨会[C]//中国厦门, 2004: 73-78.
|
| [3] |
李加荣. 呋咱系列含能材料的研究进展[J].
火炸药学报, 1998, 21(3): 56-90. LI Jia-rong. Progress of the furazan energetic material[J]. Chinese Journal of Explos Propellants, 1998, 21(3): 56-90. |
| [4] |
Hiskey M, Chavez D. Progress in high-nitrogen chemistry in explosives, propellants and pyrotechnics[C]//Proc. 27th International Pyrotechnics Seminar. USA Colorado: 2000: 3-14.
|
| [5] |
Hiskey M, Chavez D. Insensitive high-nitrogen compounds: DE 776133[P]. 2001.
|
| [6] |
伍越寰.
有机化学[M]. 合肥: 中国科学技术大学出版社, 2002.
|
| [7] |
岳守体. 高氮含能化合物的合成及其应用相关性研究[D]. 长沙: 国防科技大学, 2003.
YUE Shou-ti. Synthesis and application of high-nitrogen energetic compound[D]. Changsha: National University of Defense Technology, 2003. |
| [8] |
徐松林. 高氮含能化合物的合成放大及其炸药性能研究[D]. 长沙: 国防科技大学, 2005.
XU Song-lin. Magnify synthesis and explosives of high-nitrogen energetic compound[D]. Changsha: National University of Defense Technology, 2005. |
| [9] |
Churakov A M, Ioffe S L, Tartakovsky V A, et al. Synthesis of[1, 2, 5]oxadiazole[3, 4-e][1, 2, 3, 4]tetrazine 4, 6-di-N-oxide[J].
Mendeleev Commun, 1995, 5(6): 227-228. DOI:10.1070/MC1995v005n06ABEH000539 |
| [10] |
Lempert D B, Nechiporenko G N, Soglasnova S I, et al. Specific momentum of rocket propellants containing oxidizers based on C, N, and O atoms versus the enthalpy of formation and elementary composition of the oxidizer[J].
Khim, Fiz, 2004, 23(5): 75-81. |
| [11] |
Pepekin V I, Matyushin Yu N, T V Gubina. Enthalpy of formation and explosive properties of 5, 6-(3, 4-furazano)-1, 2, 3, 4-tetrazine-1, 3-dioxide[J].
Russina Journal of Physical Chemistry B, 2011, 5(1): 97-100. DOI:10.1134/S1990793111020102 |
| [12] |
Kalmykov P I, Burtsev Yu A, Kuznetsova N P, et al. Phase state and features of formation of the structure of eutectic alloys based on DF-2[C]//Proc. 3th All-Russian Conf. Energetic Condensed Systems (Chernogolovka), Yaunus, Moscow, 2004: 64-66.
|
| [13] |
Zelenov V P, Lobanova A A. Behavior of[1, 2, 5] oxadiazole[3, 4-e][1, 2, 3, 4]tetrazine 4, 6-di-N-oxide in various media[J].
Russian Chemical Bulletin, 2008, 57(7): 1384-1389. DOI:10.1007/s11172-008-0180-y |
| [14] |
WANG Bo-zhou, ZHANG Guo-fang, HUO Huan, et al. Synthesis, characterization and thermal properties of energetic compounds derived from 3-amino-4-(tetrazol-5-yl)furazan[J].
Chinese Journal of Chemistry, 2011, 29: 2421-2427. DOI:10.1002/cjoc.v29.11 |
An energetic material 5-H-[1, 2, 3]triazolo[4, 5-c][1, 2, 5]oxdiazole and its four novel energetic derivatives were synthesized from[1, 2, 5]oxadiazolo[3, 4-e] [1, 2, 3, 4] tetrazine 4, 6-di-N-oxide(FTDO).




