偶氮四唑胍(GZT)是一种高氮含能材料(氮含量78.8%), 分解温度261.51 ℃(升温速率为10 ℃·min-1), 气体生成量975 mL·g-1[1], 具有产气量大、撞击感度、摩擦感度和燃烧温度低等特点[2-3], 可应用于低燃温推进剂[4-8]和发射药[9]及气体发生剂[10-12]中。关于GZT的热分解行为, Sivabalan[13], Hammerl[1]和Damse[14-15]等采用热重分析、差热分析、热重-红外联用和热裂解-色谱-质谱联用(Py-GC-MS)等技术手段对其热分解进行了研究, 并提出了相应的分解机理。MIN-HSIEN LIU[16]采用自洽场和从头算量子计算方法计算了GZT的分解历程。上述文献中关于GZT的热分解行为解释存在矛盾之处, 有些解释不合理, 提出的分解机理过于简单, 对最终产物并未加以确定。因此本研究采用热重分析(TG)、差示扫描量热法(DSC)、固体原位池/红外和Py-GC-MS等技术手段研究了GZT的热分解行为。
2 试样及试验试样GZT, 西安近代化学研究所自制, 红外吸收峰与文献[1]报道一致, 纯度经高效液相色谱分析大于99.9%。
热重分析采用TA2850型热重仪。实验条件:样品量0.7~1.0 mg; 升温速率2.5, 10, 20 ℃·min-1; 动态氮气气氛, 流速50 mL·min-1; 测试压力0.1 MPa。
差示扫描量热法采用DSC910S量热仪。试验条件:样品量0.8~1.0 mg; 升温速率2.5, 10,15,40 ℃·min-1; 动态氮气气氛, 流速50 mL·min-1; 10 ℃·min-1升温速率下的试验压力0.1, 3, 5, 7 MPa; 其余升温速率下的试验压力为0.1 MPa。
固体原位池/红外试验(situ/IR), 采用NEXUS870型傅里叶变换红外光谱仪和厦门大学的固体原位反应池。试验条件: 0.7 mg的样品与150 mg KBr充分混合研磨后压片; 升温速率, 10 ℃·min-1; 检测温度范围, 20~450 ℃; 红外光谱分辨率4 cm-1, 光谱采集速率11files/min, 8scans/file, 检测器为DTGS型。
热裂解-色谱-质谱分析试验(Py-GC-MS), 采用GC-MS-QP2010型PLUS质谱仪。采用直接进样和热裂解-色谱进样方式。直接进样时进样杆的温度范围为室温~300 ℃, 线性升温速率10 ℃·min-1。热裂解试验中的裂解温度分别为239, 259, 270, 300 ℃。离子源温度为300 ℃, 分析器温度100 ℃。
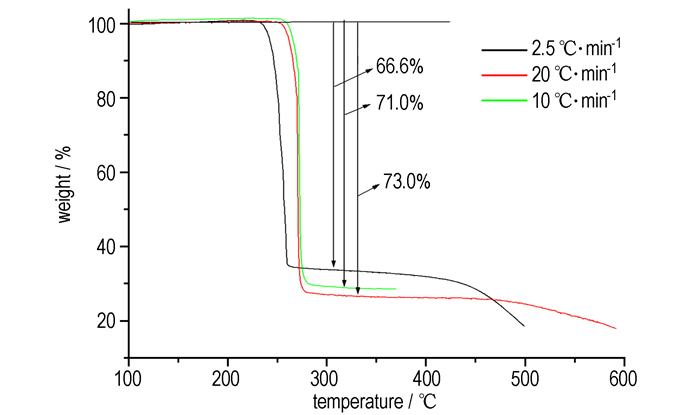
3 结果与讨论 3.1 热分解行为不同升温速率下GZT的TG曲线见图 1, 不同试验条件下GZT的部分DSC曲线见图 2。
|
图 1 不同升温速率下GZT的TG曲线 Fig.1 The TG curves of GZT at different heating rates |

|
图 2 不同实验条件下GZT的DSC曲线 Fig.2 The DSC curves of GZT under different experimental conditions |
由图 1可知, 在200~600 ℃之间GZT有两个明显的失重过程, 其中第一阶段快速失重, DSC曲线上与之对应的是一快速放热峰, 当第一阶段结束后, TG曲线缓慢下降, 直到高于400 ℃才表现出明显失重(第二阶段)。分解温度范围随升温速率变化而变化, 第一阶段的失重量随升温速率的增加而增加, 且都在60%以上, 表明GZT的分解过程是一个复杂的分解过程, 并不存在如碳酸钙分解一样简单的分解机理。当升温速率为2.5 ℃·min-1时, 第一阶段失重过程发生在230~250 ℃之间, 失重量为66.64%。文献[15]认为GZT分解分几个明显的阶段, 第一阶段为偶氮四唑开环分解反应生成N2和NH2CN, 第二阶段为胍上的C—N断裂生成NH2和NH2CN等。此文献只通过10 ℃·min-1下的TG试验的失重量(59%)与(N2)3和(NH2CN)2在GZT分子中的质量百分数比较就提出其分解机理不合理, 这也说明了仅通过TG一种分析技术来研究含能材料(具有复杂分解机理)的分解机理不合适。如果上述文献提出的假设正确, 则第一阶段的失重量不会随升温速率的变化而变化, 且恒等于(N2)3和(NH2CN)2的质量百分数(59%), 而不同升温速率下的试验结果显示第一阶段的失重量随升温速率变化而变化。这一点也可以从GZT的DSC试验结果(图 2)获得。同一压强,不同的升温速率下GZT的分解热随升温速率的增加而增加, 且当升温速率为40 ℃·min-1时, 在主放热峰后存在一个吸热峰, 这表明GZT的第一分解过程是由放热反应和吸热反应共同参与的复杂过程, 即不仅仅是偶氮四唑分解的放热过程, 也存在胍分解的吸热过程。初步表明GZT的第一分解过程中在质子转化后形成的偶氮四唑和胍都参与了分解, 只是分解程度不同。同一升温速率下, 分解热随压强的增加而增加, 这表明GZT的气相分解产物在高压下对分解热也具有贡献。失重量随升温速率的变化而变化主要是由于偶氮四唑和胍分解形成的NH2CN既可以分解形成NH3, HCN和N2也可以快速生成二聚体和三聚体化合物(绝大部分的三聚氰胺是由胍分解产生的NH2CN聚合而成, 偶氮四唑分解形成的NH2CN绝大部分发生分解)。在GZT的DSC曲线上, 主分解放热峰前未见吸热熔融峰, 这表明GZT以固相分解反应为主, 与RDX等物质分解时的熔融分解过程不同, 这也是GZT能提高RDX改性双基推进剂燃速[17]的原因之一。
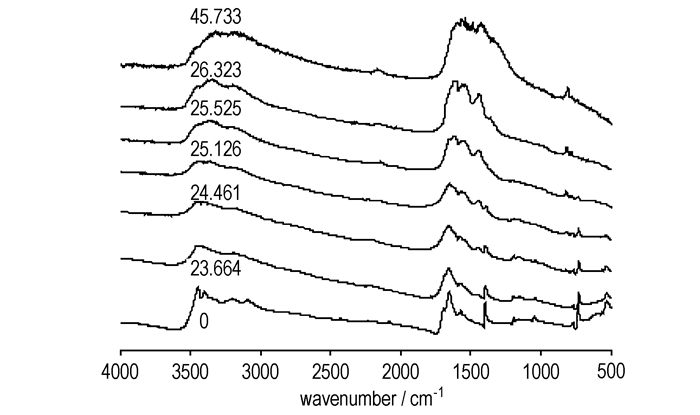
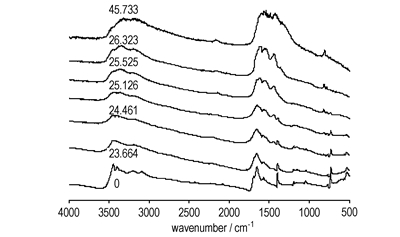
3.2 凝聚相分解产物研究采用固体原位池/红外研究了GZT的凝聚相在线性加热过程中的变化, 不同时刻的凝聚相红外谱图见图 3, 不同红外吸收峰的强度、归属和消失或出现的时间见表 1。
|
图 3 GZT加热过程中红外吸收峰的变化 Fig.3 The typical IR spectra of condensed products in the situ/IR experiment of GZT |
| 表 1 GZT在加热过程中红外吸收峰的波数、强度、消失或产生时间及归属 Tab.1 Time appeared or disappeared of infrared absorption peak and assignment of GZT in heating process |
吸收峰2824 cm-1是N原子上的孤对电子和H原子形成的氢键的特征吸收峰, 大约在94 ℃消失, 表明GZT的热分解是从分子内和分子间氢键的断裂开始的。当温度由110℃升高到210 ℃时, 吸收峰1584, 3089, 2427, 3396 cm-1依次消失, 可能是阳离子上的质子转移到阴离子上形成了非离子型化合物。当加热到230 ℃时, C=N+的特征吸收峰3198, 2231, 2082, 1696 cm-1消失, 这与硝酸胍的开始分解温度一致, 可能是胍上的C=N发生了断裂, 这表明在GZT的分解第一阶段胍发生了分解, 与热分析结果一致。240 ℃时, 1, 3, 5-三嗪环的特征吸收峰1451 cm-1和819 cm-1产生并随温度的升高逐渐分别移向1435 cm-1和807 cm-1。当温度为250 ℃时, 异三嗪环的特征吸收峰781 cm-1产生并随温度的升高移向779 cm-1, 强度逐渐减弱最后消失。温度为255 ℃时, 四唑环的特征吸收峰(1160,1196,1398 cm-1)和NH2的变形振动吸收峰1654 cm-1消失, 而NH4+的特征吸收峰3204 cm-1和—N3的特征吸收峰2140 cm-1产生。随着温度的升高, 2140 cm-1移向2160 cm-1。由于2140cm-1是—N3基团的吸收峰, 2160 cm-1为N3负离子的吸收峰, 表明最终产物NH4N3是经过叠氮基中间产物而生成的, 且叠氮基中间产物是在第一分解阶段生成, 即是通过偶氮四唑分解而成。温度为450 ℃时, 除三个独立的吸收峰2160,809,799 cm-1外, 还有两个呈扫帚状的宽吸收带3440~3160 cm-1和1608~1400 cm-1, 可能是分解产生的碳等所致, 且异三嗪环的特征吸收峰781 cm-1消失, 可能是在高温下异三嗪环不稳定转化为三嗪环[23, 26]。在整个加热过程中吸收谱的基线逐渐上移, 可能是GZT分解过程中产生的高沸点凝聚相物质NH4N3和三聚氰胺类等形成的气溶胶所致[25, 27-28]。
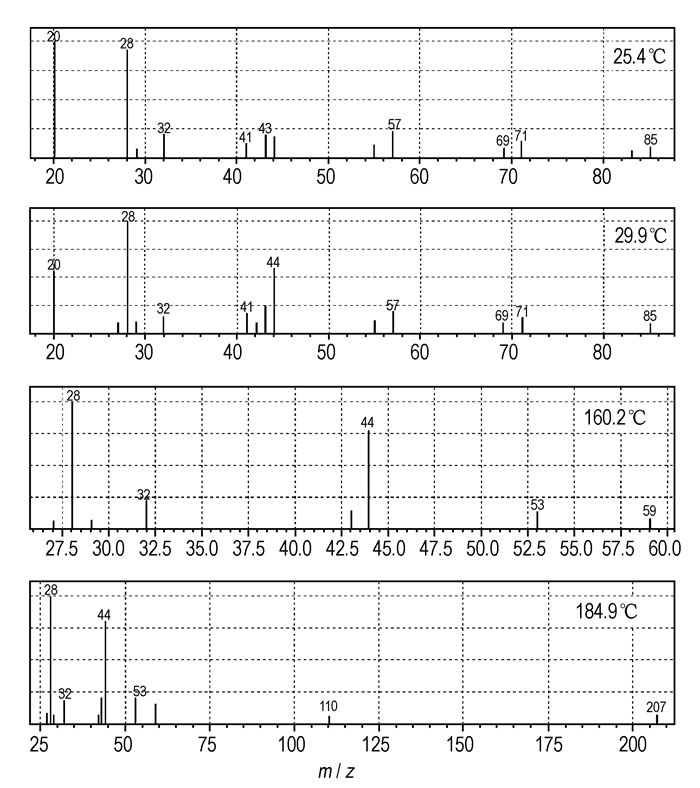
3.3 气相产物分析采用直接进样方式, 在线性升温(10 ℃·min-1)的条件下研究了GZT在不同能量源作用下的气体产物, 部分质谱图见图 4; 在温度分别为239,259,270,300 ℃条件下, 热裂解—色谱—质谱联用所得的GZT裂解质谱图见图 5。离子碎片m/z值、强度和归属见表 2。
|
图 4 GZT直接进样在线性升温条件下的质谱图(10 ℃·min-1) Fig.4 Mass spectra of GZT with the sample direct injection at 10 ℃·min-1 |

|
图 5 GZT热裂解-色谱-质谱试验获得的质谱图 Fig.5 The mass spectra of GZT by Py-GC-MS |
| 表 2 GZT的离子碎片峰值、强度及归属 Tab.2 Peak, intensity and assignment of dissociated fragments of GZT |
由图 4、图 5和表 2可知, GZT的热分解产物HCN、N2和N2H4及胍的逐步离解碎片可从离子碎片峰m/z=27, 28, 29, 30, 31, 32, 41, 42, 43, 44, 55, 56, 57,59得以确定。HNCNH或NH2CN以及NH2CN的二聚体C2H4N4和三聚体C3H6N6可从碎片离子峰m/z=41, 42, 82, 83, 84,126得以确定, 且在热的作用下, GZT更易于生成三聚氰胺及聚合物。
直接进样时, 在较低温度下(70 ℃以下)GZT直接气化不存在加热过程, 气体分子在离子源的轰击下断裂成各种碎片; 温度升高, 会有部分GZT先发生分解然后经过离子源的轰击进而碎裂。由图 4和表 2可知, 在低温阶段存在碎片离子m/z=97, 69, 71, 不存在m/z=110的碎片; 在较高温度下(160 ℃以上)存在m/z=110的碎片, 不存在离子峰m/z=97, 69, 71, 这表明在不同的能量形式(离子源和热)作用下, GZT存在不同的解离历程。气态分子在离子源的作用下除了四唑环开环以外(这可由大量的m/z=28碎片证实), C—Nazo也会断裂。在较高温度下离子碎片m/z=110的存在表明有可能形成了中间产物叠氮四唑[29-30], 这也能很好地解释固体原位红外中2140 cm-1吸收峰的存在及变化。
由图 5和表 2可知, 热裂解产物中都存在m/z=111和m/z=126的碎片离子, 而不存在碎片离子m/z=97, 69, 71, 表明在热的作用下四唑环开环反应是主要分解过程, 且分解形成了三聚氰胺等物质, 碎片m/z=111的出现也表明可能形成了叠氮四唑。由于三聚氰胺很稳定且随温度升高逐渐失去NH2生成大分子化合物嘧嘞胺, 直到700 ℃以上才能完全分解[31], 这与GZT的TG曲线和红外分析结果一致。
尽管有离子峰m/z=43, 42和29的存在, 但也不能肯定有HN3气体产生, 因为N2H4也可以产生这些碎片离子, 且GZT失去HN3后的相应离子碎片m/z=123, 122和80并没有发现。从不同温度的热裂解质谱图可见, m/z=28(N2)是最早出现的离子碎片且强度最大, 表明GZT上的四唑环开环反应是其主要分解途径。
部分离子碎片可能的结构式:
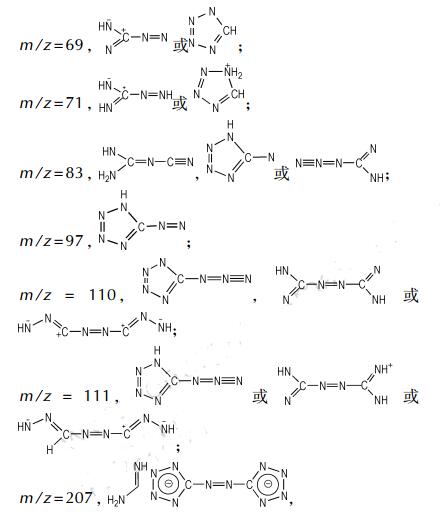
|
其中, 氨基四唑的m/z也等于85但由于偶氮键的强度大于C—N键, 因此认为此种可能性很小, 这与文献[16]的计算结果一致。
3.4 GZT的分解机理从固体原位池/红外和质谱分析可知, 加热时, GZT的质子从阳离子转移到阴离子上形成胍和偶氮四唑, 再分别发生分解。阳离子胍发生断裂形成了氰胺(NH2CN), 氰胺及其二聚体在一定温度下形成三聚氰胺。随温度的升高, 三聚氰胺转化为嘧嘞胺等高沸点难分解物质[25]。偶氮四唑在加热的条件下有多种分解路径。一种路径是四唑环同时发生开环反应, 失去N2生成HCN和N2等。另一路径是加热时只有一个四唑环发生开环反应, 经中间产物叠氮四唑最后形成如NH4N3等多种产物。由此可知, 在热作用下, GZT的主要分解机理见图 6。但这两个实验均无法确定有无HN3气体产生。
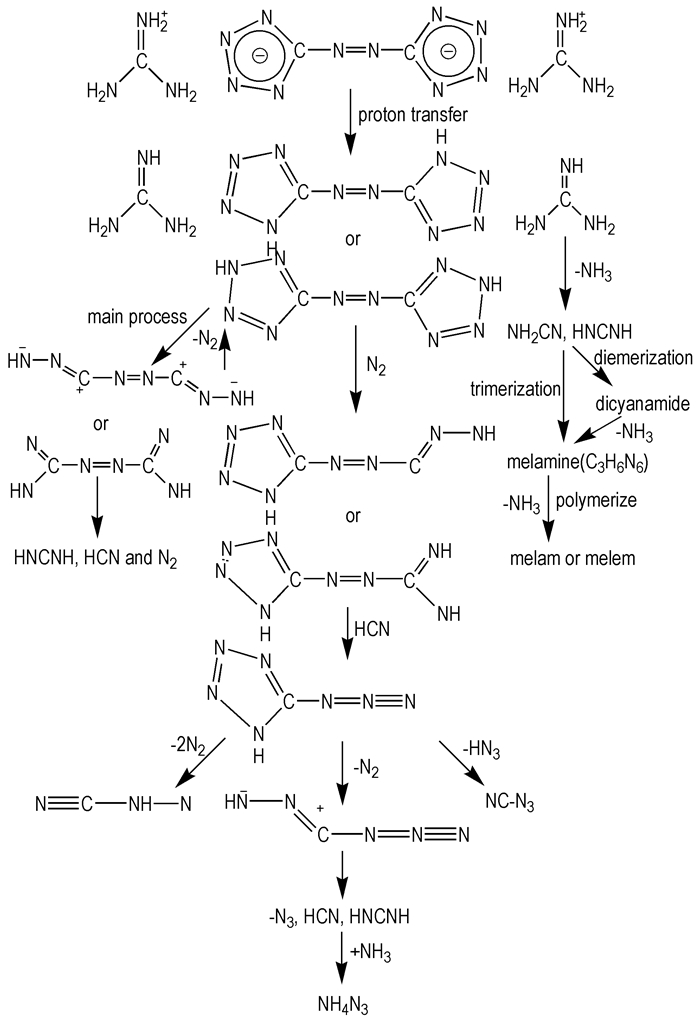
|
图 6 GZT的主要分解机理 Fig.6 The main thermal decomposition mechanism of GZT |
在离子源的作用下, GZT除了上述的分解机理外还存在另一分解途径,即C—Nazo断裂, 然后各自发生分解, 分解过程见图 7。
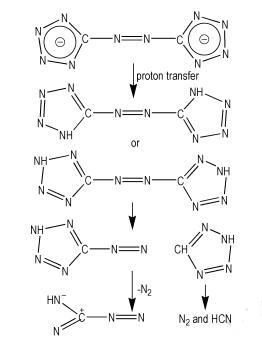
|
图 7 GZT的在离子源作用下C—Nazo断裂解离过程 Fig.7 Cleavage of C—Nazobond of CTZ attacked by ion source |
(1) GZT的热分解研究表明, GZT的分解第一阶段是一个放热过程和吸热过程共存的复杂反应阶段, 主要由偶氮四唑的放热分解和胍的吸热分解构成。
(2) 固体原位池/红外分析表明, GZT的分解首先是偶氮四唑阴离子与胍阳离子之间发生质子转移, 形成偶氮四唑和胍, 然后分别分解, 并有含—N3的中间产物生成, 最后形成三聚氰胺及NH4N3等高沸点化合物。
(3) 质谱分析表明, 在热的作用下偶氮四唑的开环反应是主要分解途径, 在离子源轰击作用下还存在C—Nazo断裂分解途径。GZT分解在热的作用下可能形成了叠氮四唑的中间产物, 最终产物为三聚氰胺等高沸点物质。
| [1] |
Hammerl A, Michael A H, Gerhard H, et al. Azidoformamidinium and guanidinium 5, 5'-azotetrazolate salts[J].
J Chem Mater, 2005, 17(14): 3784-3793. DOI:10.1021/cm050684f |
| [2] |
Michael A H, Nir G, James R S. High-nitrogen energetic materials derived from azotetrazolate[J].
J Energetic Mater, 1998, 16(2-3): 119-127. DOI:10.1080/07370659808217508 |
| [3] |
Martin K, Bucerius, Karlsruhe, et al. Gas generating mixture containing copper diamminedinitrate: US5663524[P], 1997.
|
| [4] |
Yeu-Cherng L, Wierenga P. Advanced propellant/additive development for fire suppressing gas generators[C]//Proceedings of Halon Options Technical Working Conference. 2000: 361-370.
|
| [5] |
Menke K, Gunser G, Bohnlein J, et al. Combustion modification of AN propellants with energetic binders by TAGN and GZT[C]//9-IWCP Workshop on Combustion and Propulsion, Lerici, Italy, 2003.
|
| [6] |
Menke K, Gunser G, Schnoering M, et al. Burning rate enhancement of AN-propellants by TAGN and GZT[C]//34st International Annual conference of ICT, 2003.
|
| [7] |
Menke K, Born M, Kempa P B, et al. AN/PolyGLYN propellants-minimum smoke propellants with reduced sensitivity[C]//37st International Annual Conference of ICT, 2006.
|
| [8] |
Teague W, Wright A. Effect of energetic fuel additives on the temperature of hybrid rocket combustion[R]. AIAA99-31027.
|
| [9] |
胡鸣怡. 多功能炸药[J].
核武器与高技术, 2003(4): 53-58. HU Ming-yi. Mutifunctional explosives[J]. Nuclear Weapons & High Technology, 2003(4): 53-58. |
| [10] |
Klaus, M. Stable nitrogen-rich composition: US5198046[P], 1993.
|
| [11] |
Schmid H, Eisenreich N. Investigation of a two-stage airbag module with azide-free gas generators[J].
Propellants, Explosives and Pyrotechnics, 2000, 25(5): 230-235. DOI:10.1002/(ISSN)1521-4087 |
| [12] |
Khandhadia P S, Burns S P. Thermally stable nonazide auto motive air-bag propellants: US 6306232[P], 200.
|
| [13] |
Sivabalan R, Talawar M B, Senthilkumar N, et al. Studies on azotetrazolate based high nitrogen content high energy materials potential additives for rocket propellants[J].
Journal of Thermal Analysis and Calorimetry, 2004, 78: 781-792. |
| [14] |
Damse R S, Naik N H, Ghosh M, et al. Thermoanalytical screening of nitrogen-rich compounds for ballistic requirements of gun propellant[J].
J Propulsion and Power, 2009, 25(1): 249-256. DOI:10.2514/1.35789 |
| [15] |
Damse R S, Naik N H, Ghosh M, et al. Structure-decomposition mechanism relationship for the energetic nitrogen rich compounds[C]//38st International Annual Conference of ICT, 2007.
|
| [16] |
Liu M H, Cheng S R, Cheng K F, et al. Kinetics of decomposition pathways of an energetic GZT molecule[J].
J Quantum Chemistry, 2008, 108(3): 482-486. DOI:10.1002/qua.v108:3 |
| [17] |
蔚红建, 王琼, 陈佳宏. 含偶氮四唑胍的RDX-CMDB推进剂的燃烧性能和热行为研究[J].
固体火箭技术, 2012, 35(2): 216-220. WEI Hong-jian, WANG Qiong, CHEN Jia-hong. Study on the combustion characteristics and thermal behaviors of RDX-CMDB propellants containing guanidinium azotetrazolate[J]. Journal of Solid Rocket Technology, 2012, 35(2): 216-220. |
| [18] |
王义惠, 杜志明, 何春林, 等. 偶氮四唑二胍盐的合成优化与性能表征[J].
含能材料, 2008, 16(5): 581-584. WANG Yi-hui, DU Zhi-ming, HE Chun-lin, et al. Synthesis and characterization of GZT[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2008, 16(5): 581-584. |
| [19] |
Koji Nakanshi P H.
Solomon Infrared Absorption Spectroscopy[M]. Holden-day, Inc, 1977 |
| [20] |
Frankel M B, Burns E A, Brtler J C, et al. Derivatives of dicyanamide[J].
J Organic Chem, 1963, 28(9): 2428-2432. DOI:10.1021/jo01044a068 |
| [21] |
Costa L, Camino G J. Thermal behavior of melamine[J].
Thermal Analysis, 1988, 34: 423 DOI:10.1007/BF01913181 |
| [22] |
何春林, 杜志明, 丛晓民, 等. 偶氮四唑二胍的表征及性能研究[J].
化学推进剂与高分子材料, 2009, 7(6): 31-34. HE Chun-lin, DU Zhi-ming, CONG Xiao-min, et al. Study on characterization and performance of guanidinium azotetrazolate[J]. Chemical Propellants & Polymeric Materials, 2009, 7(6): 31-34. |
| [23] |
Levchik S V, Balabanovich A I, Ivashkevich O A, et al. Thermal decomposition of tetrazolate containing polymers.V. poly-1-vinyl-5-aminotetrazolate[J].
Polymer Degradation and stability, 1995, 47: 333-338. DOI:10.1016/0141-3910(94)00130-8 |
| [24] |
Dows D A, Whittle E, Pimentel G C. Infrared spectrum of solid ammonium azide: a vibration assignment[J].
J Chem Physic, 1955, 23(8): 1475-1479. DOI:10.1063/1.1742333 |
| [25] |
张兴高, 朱慧, 阳世清, 等. 高氮含能化合物偶氮四唑三氨基胍盐的热分解研究[J].
固体火箭技术, 2007, 30(3): 238-242. ZHANG Xing-gao, ZHU Hui, YANG Shi-qing, et al. Study on thermal decomposition of high-nitrogen energy compound TAGZT[J]. Journal of Solid Rocket Technology, 2007, 30(3): 238-242. |
| [26] |
Fischer G, Holl G, Thomas M K, et al. A study on the thermal decomposition behavior of derivatives of 1, 5-diamino-1H-tetrazole (DAT): A new family of energetic heterocyclic-based salts[J].
Thermochim Acta, 2005, 437(1-2): 168-178. DOI:10.1016/j.tca.2005.06.034 |
| [27] |
Lesnikovich A I, Ivashkevich O A, Levchik S V, et al. Thermal decomposition of aminotetrazoles[J].
Thermochim Acta, 2002, 388(1-2): 233-251. DOI:10.1016/S0040-6031(02)00027-8 |
| [28] |
Gao A, Oyumi Y, Brill T B, et al. Thermal decomposition of energetic materials 49. Thermolysis routes of mono-and diaminotetrazoles[J].
Combustion and Flame, 1991, 83(3-4): 345-352. DOI:10.1016/0010-2180(91)90081-L |
| [29] |
Hammerl A, Klapotke T M, Mayer P, et al. Synthesis, structure, molecular orbit calculations and decomposition mechanism for tetrazolyazide CHN7, its phenyl derivative phCHN7 and tetrazolylpentazole CHN9[J].
Propellants, Explosive and Pyrotechnics, 2005, 30(1): 17-26. DOI:10.1002/prep.200400081 |
| [30] |
Hammerl A, Klapotke T M, Noth H, et al. Synthesis, structure, molecular orbit and valence bond calculations for tetrazoleazide, CHN7[J].
Propellants, Explosives and Pyrotechnics, 2003, 28(4): 165-173. DOI:10.1002/(ISSN)1521-4087 |
| [31] |
Williams G K, Palopoli S F, Brill T B, et al. Thermal decomposition of energetic materials 65. Conversion of insensitive explosives (NTO, ANTA) and related compounds to polymeric melon-like cyclic azine burn-rate suppressants[J].
Combustion and Flame, 1994, 98(3): 197-204. DOI:10.1016/0010-2180(94)90235-6 |
The thermal behavior of guanidinium azotetrazolate (GZT) was studied using the thermogravimetry and differential scanning calorimetry. The thermal decomposition mechanism of GZT was proposed based on the investigation of products in condensed and gas phases by the combination techniques of solid in situ cell with the rapid-scan Fourier transform infrared spectroscopy and pyrolysis-gas-chromatography-mass-spectrometry (Py-GC-MS).



