高氮化合物具有高密度[1-2]、高生成焓[3-5]、热稳定性好[6-8]等一系列优良的性质, 因此受到人们的广泛关注。已经报道的高氮化合物主要以氮杂环类为主, 例如嘧啶[9]、咪唑[10]、三唑[11]、四唑[12-14]、五唑[15]、三嗪[16-18]、四嗪[19-23]、七嗪[24-25]等。这些氮杂环骨架自身包含了较多的C—N键、N—N键和NᆖN键等高焓化学键, 如果再向其分子结构中引入一些含能取代基, 如氨基、硝基和叠氮基等, 其能量水平将会进一步提高, 例如在氮杂环上每引入一个叠氮基, 其生成焓至少增加87 kJ·
近年来, 国内外研究人员从理论和实验方面均对叠氮杂环类含能化合物进行了大量的研究, 主要包括叠氮咪唑类、叠氮三唑类、叠氮四唑类、叠氮五唑类以及叠氮三嗪类、叠氮四嗪类和叠氮七嗪类等。目前, 关于叠氮三唑类含能化合物的研究主要集中在3-叠氮基-1, 2, 4-三唑及其衍生物的合成及性能, 因此本文主要针对3-叠氮基-1, 2, 4-三唑及其衍生物的合成研究展开论述, 为相关研究提供借鉴。
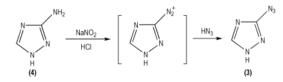
2 3-叠氮基-1, 2, 4-三唑1968年, Denault G C[28]等首次报道了3-叠氮基-1, 2, 4-三唑的合成路线, 该路线以盐酸胍(
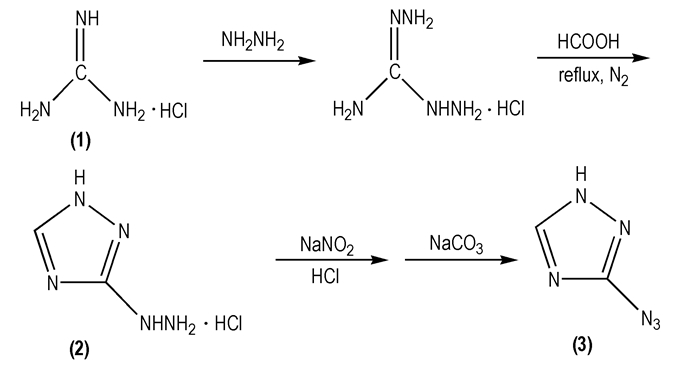
|
Scheme 1 |
2004年, Kofman T P等[29]采用另一条路线合成了3-叠氮基-1, 2, 4-三唑(
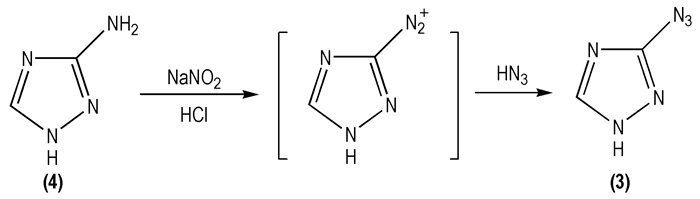
|
Scheme 2 |
由于3-叠氮基-1, 2, 4-三唑(
是利用烷基化试剂对3-叠氮基-1, 2, 4-三唑(
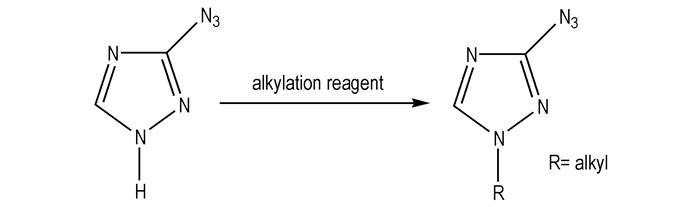
|
Scheme 3 |
2004年, Kofman T P等[29]研究了3-叠氮基-1, 2, 4-三唑(
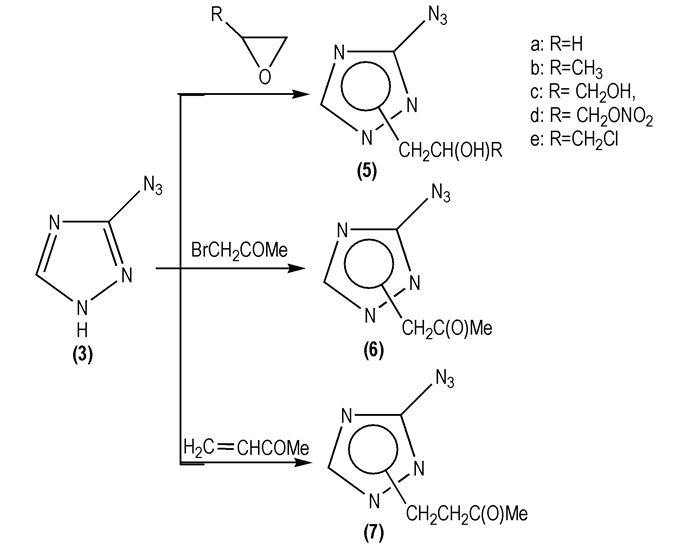
|
Scheme 4 |
2005年, Xue H等[30]以3-叠氮基-1, 2, 4-三唑(
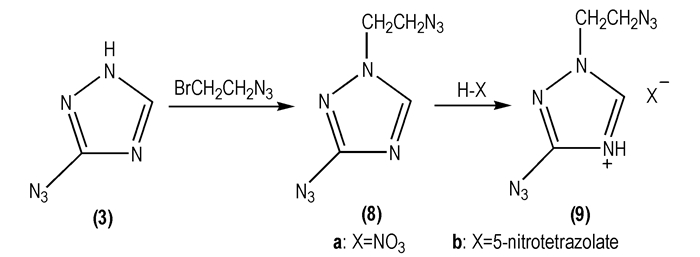
|
Scheme 5 |
利用卤化芳基试剂对3-叠氮基-1, 2, 4-三唑(
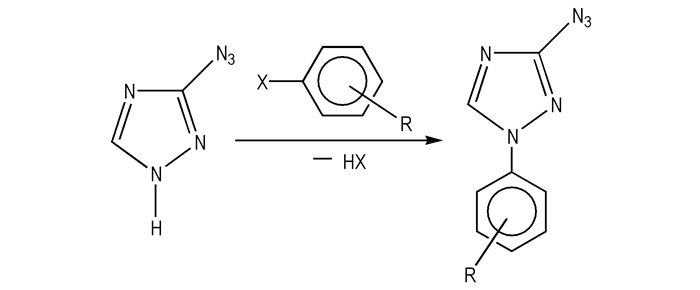
|
Scheme 6 |
1975年, Ricardo G等[31]研究了3-叠氮基-1, 2, 4-三唑(
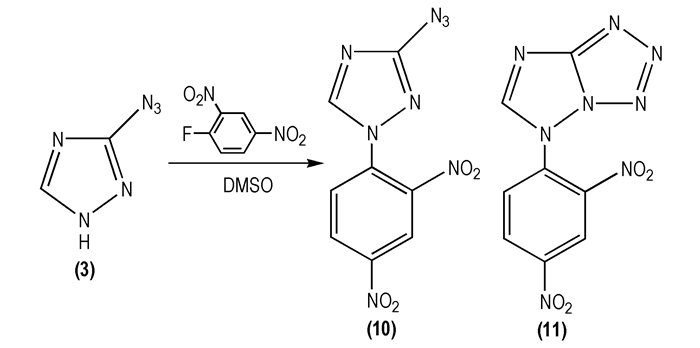
|
Scheme 7 |
Kofman T P等[29]研究了3-叠氮基-1, 2, 4-三唑(
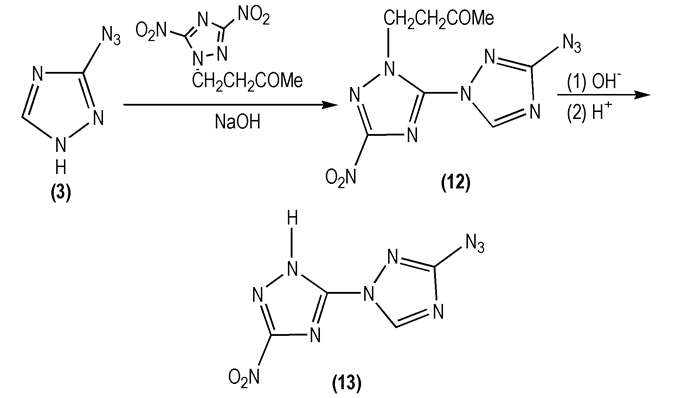
|
Scheme 8 |
Kofman T P等[29]以溴/氢氧化钠作为溴化反应体系, 研究了3-叠氮基-1, 2, 4-三唑(
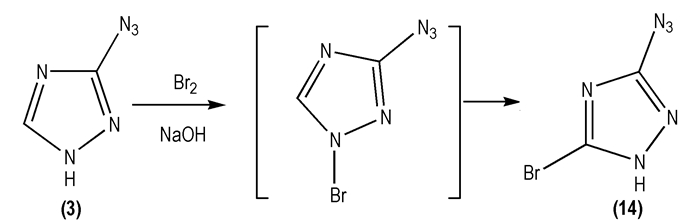
|
Scheme 9 |
2010年, 冯金玲等[33]以3-叠氮基-1, 2, 4-三唑(
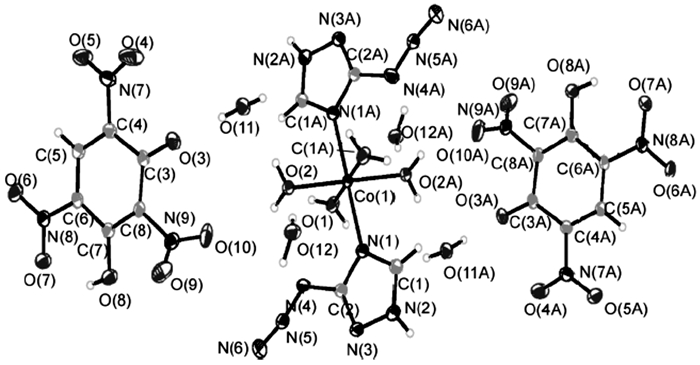
|
图 1 [Co(AZT) |
2008年, 李生华等[34]以3, 3′, 5-三氯-4, 4′-偶氮-1, 2, 4-三唑(
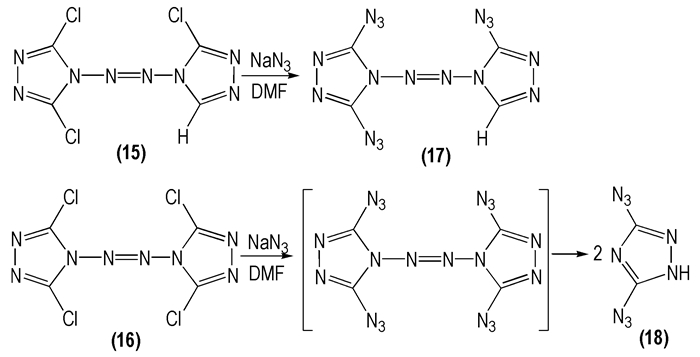
|
Scheme 10 |
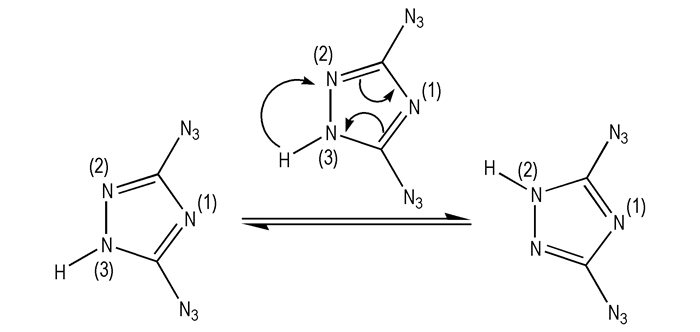
|
Scheme 11 |
2005年, Hong Xue等[11]进行了一系列叠氮基取代的三唑类化合物及其含能离子盐的合成研究。首先以3, 5-二叠氮-1, 2, 4-三唑(
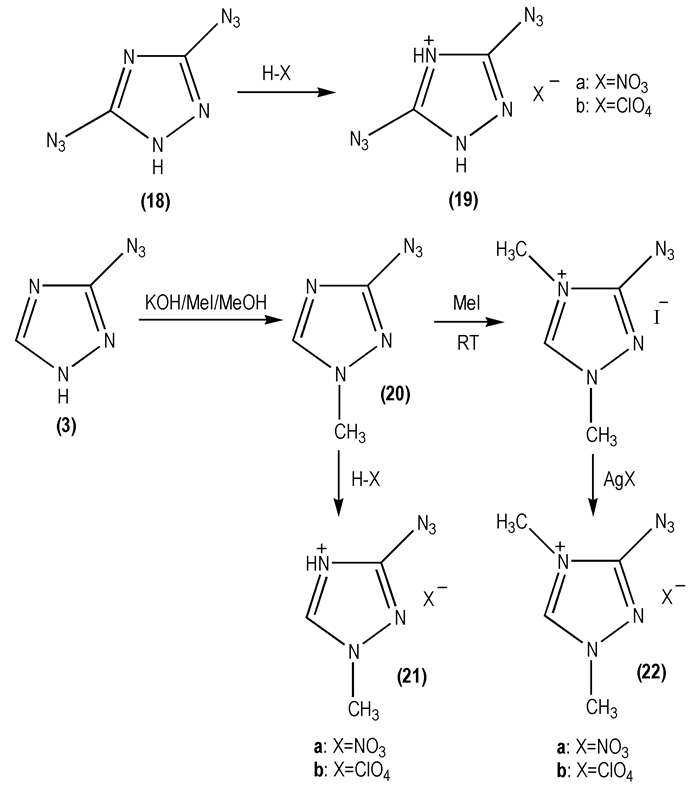
|
Scheme 12 |
|
表 1 3-叠氮基-1, 2, 4-三唑盐 |
2003年, Kofman T P等[35]进行了3-叠氮基-5-氨基-1, 2, 4-三唑(
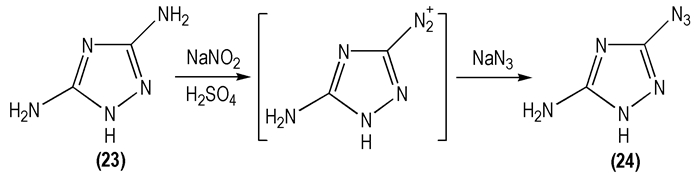
|
Scheme 13 |
为了提高反应收率, Kofman T P等[35]利用基团保护-脱保护方案对Scheme 13所示合成路线进行了优化, 即首先将3, 5-二氨基-1, 2, 4-三唑(
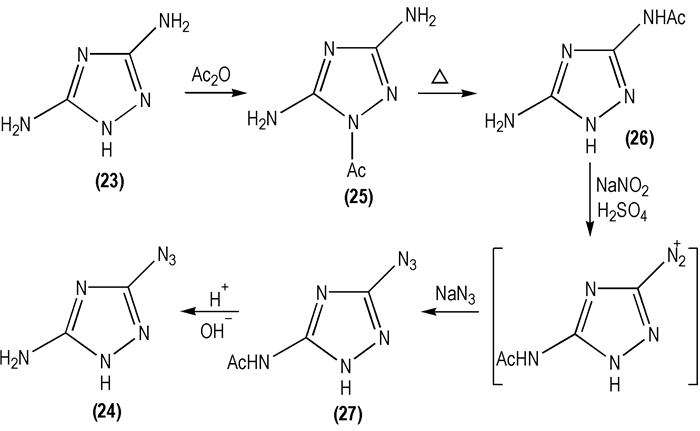
|
Scheme 14 |
2008年, 美国专利[36]公开了一种3-叠氮基-5-氨基-1, 2, 4-三唑(
|
Scheme 15 |
在合成3-叠氮基-5-氨基-1, 2, 4-三唑(
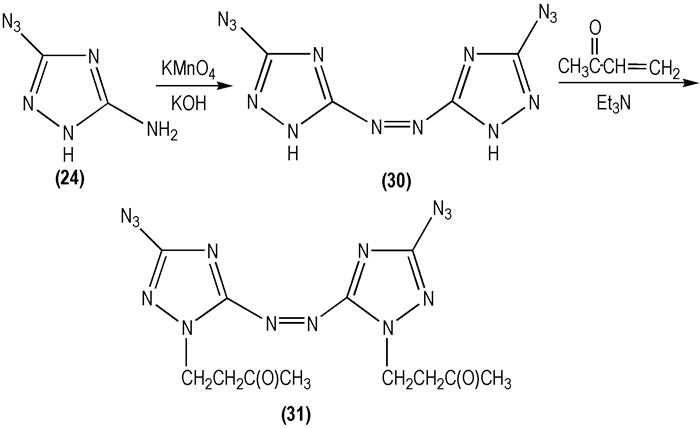
|
Scheme 16 |
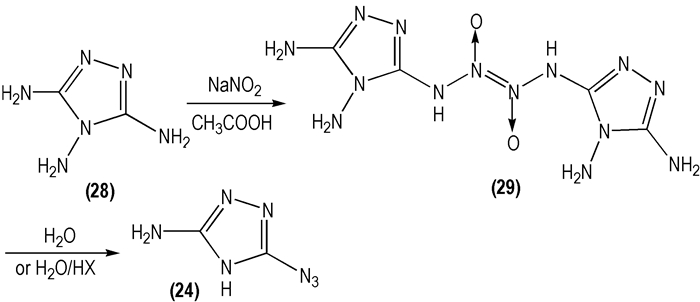
2006年, Magdy B等[37]以3, 4, 5-三氨基-1, 2, 4-三唑(
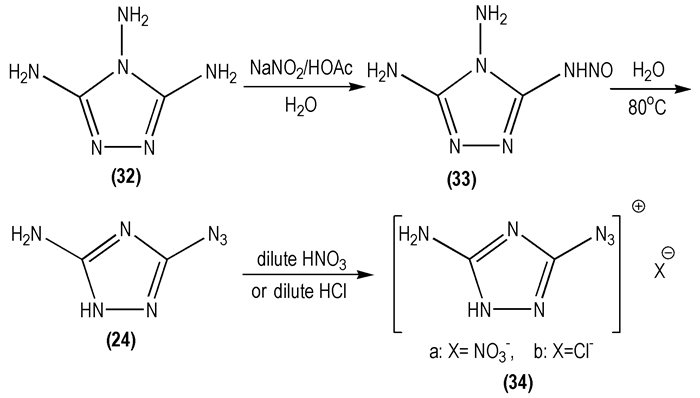
|
Scheme 17 |
1965年, Takimoto H H等[38]以三氨基胍盐酸盐(
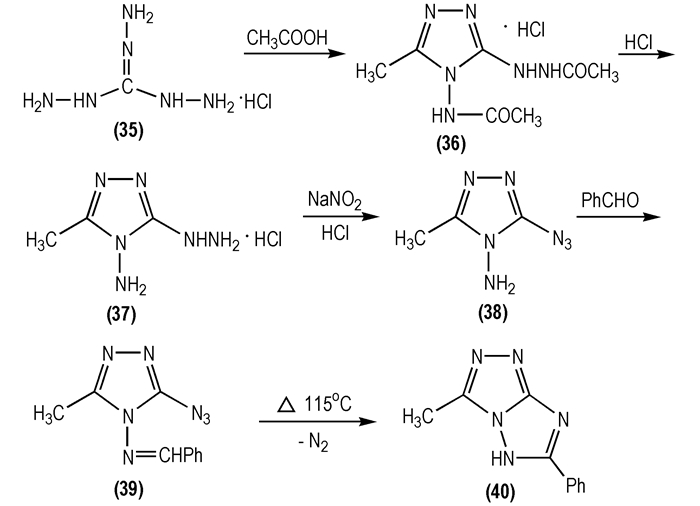
|
Scheme 18 |
1966年, Takimoto H H等[39]以3-叠氮基-4-氨基-5-甲基-1, 2, 4-三唑(
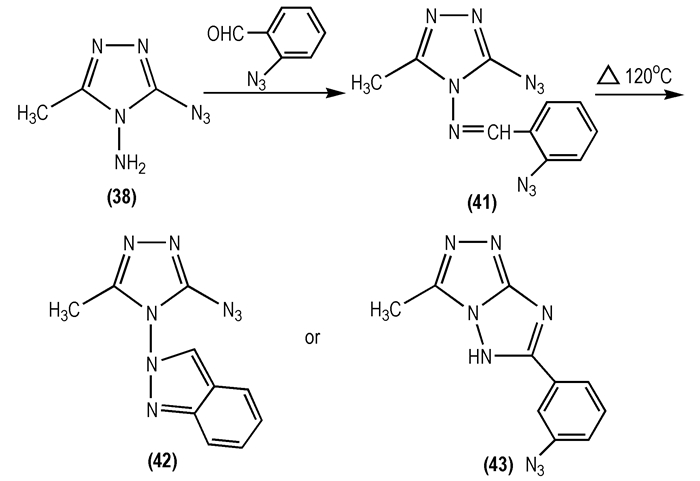
|
Scheme 19 |
1974年, Pevzner M S等[40]首次报道了3-硝基-5-叠氮基-1, 2, 4-三唑(
|
Scheme 20 |
|
图 2 3-硝基-5-叠氮基-1, 2, 4-三唑( |
2011年, Wang K等[42]以98%硫酸/70%硝酸为硝化体系, 对3-叠氮基-5-氨基-1, 2, 4-三唑(
|
Scheme 21 |
|
表 2 3-叠氮基-5-氨基-1, 2, 4-三唑( |
2005年, Xue H等[43]以3-叠氮基-1, 2, 4-三唑(
|
表 3 四种鎓盐( |
|
Scheme 22 |
目前, 关于叠氮三唑类含能化合物的研究主要集中在3-叠氮基-1, 2, 4-三唑及其衍生物(主要包括
| [1] |
Chavez D E, Hiskey M A, Gilardi R D. 3, 3′-Azobis(6-amino-1, 2, 4, 5-tetrazine): A novel high-nitrogen energetic material[J].
Angewandte Chemie International Edition, 2000, 39(10): 1791-1793. DOI:10.1002/(SICI)1521-3773(20000515)39:10<1791::AID-ANIE1791>3.0.CO;2-9 |
| [2] |
Kerth J, Lobbecke S. Synthesis and Characterization of 3, 3′-Azobis(6-amino-1, 2, 4, 5-tetrazine)DAAT-a new promising nitrogen-rich compound[J].
Propellants, Explosives, Pyrotechnics, 2002, 27(3): 111-118. DOI:10.1002/1521-4087(200206)27:3<111::AID-PREP111>3.0.CO;2-O |
| [3] |
Huynh M H V, Hiskey M A, Hartline E L. Polyazido high-nitrogen compounds: hydrazo-and azo-1, 3, 5-triazine[J].
Angewandte Chemie International Edition, 2004, 43(37): 4924-4928. DOI:10.1002/(ISSN)1521-3773 |
| [4] |
Zhou G, Zhang J L, Wong N B, et al. Computational studies on a kind of novel energetic materials tetrahedrane and nitro derivatives[J].
Journal of Molecular Structure: THEOCHEM, 2004, 668: 189-195. DOI:10.1016/j.theochem.2003.10.054 |
| [5] |
Neutz J, Grosshardt O, Schaufele S, et al. Synthesis, Characterization and thermal behaviour of guanidinium-5-aminotetrazolate(GA)-A new nitrogen-rich compound[J].
Propellants Explosives Pyrotechnics, 2003, 28(4): 181-188. DOI:10.1002/(ISSN)1521-4087 |
| [6] |
Huynh M H V, Hiskey M A, Pollard C J, et al. 4, 4′, 6, 6′-Tetra-substituted hydrazo-and azo-1, 3, 5-triazines[J].
Journal of Energetic Materials, 2004, 22(4): 217-229. DOI:10.1080/07370650490893054 |
| [7] |
Churakov A M, Smimov O Y, Ioffe S L, et al. Benzo-1, 2, 3, 4-tetrazine 1, 3-dioxides: synthesis and NMR study[J].
European Journal of Organic Chemistry, 2002, 14: 2342-2349. |
| [8] |
Tartakovsky V A. The design of stable High nitrogen systems[J].
Materials Research Society Symposium Proceedings, 1996, 418: 15-24. |
| [9] |
Ye C F, Gao H X, Boatz J A. Polyazidopyrimidines: high-energy compounds and precursors to carbon nanotubes[J].
Angewandte Chemie International Edition, 2006, 45(43): 7262-7265. DOI:10.1002/(ISSN)1521-3773 |
| [10] |
Vilarrasa J, Olivella S J. Diazo-, azo-, and azidoazoles. V. MINO Calculations on the 2-azidoimidazole/imidazo[1, 2-d]tetrazole equilibrium[J].
Journal of Hetercyclic Chemistry, 1979, 16(4): 685-688. DOI:10.1002/jhet.v16:4 |
| [11] |
Xue H, Gao Y, Brendan B, et al. New energetic salts based on nitrogen-containing heterocycles[J].
Chemistry of Materials, 2005, 17: 191-198. DOI:10.1021/cm048864x |
| [12] |
Hammerl A T, Klapötke T M. Tetrazolylpentazoles: nitrogen-rich compounds[J].
Inorganic Chemistry, 2002, 41: 906-912. DOI:10.1021/ic0108134 |
| [13] |
Hammerl A T, Klapötke T M. [N2H5]+2[N4C—N=N—CN4]2-: A new high-nitrogen high-energetic materia[J].
Inorganic Chemistry, 2001, 40: 3570-3575. DOI:10.1021/ic010063y |
| [14] |
Hammerl A T, Klapötke T M, Mayer P. Synthesis, structure, molecular orbital calculations and decomposition mechanism for tetrazolylazide CHN7, its phenyl derivative PhCN7 and tetrazolylpentazole CHN9[J].
Propellants Explosives Pyrotechnics, 2005, 30(1): 17-26. DOI:10.1002/prep.200400081 |
| [15] |
Chung G, Schmidt M W, Gordon M S. An ab initio study of potential energy surfaces for N8 isomers[J].
The Journal of Physical Chemistry, 2000, 104: 5647 DOI:10.1021/jp0004361 |
| [16] |
Huynh M H V, Hiskey M A, Archuleta J G. Preparation of nitrogen-rich nanolayered, nanoclustered, and nanodendritic carbon nitrides[J].
Angewandte Chemie International Edition, 2005, 44(5): 737-739. DOI:10.1002/(ISSN)1521-3773 |
| [17] |
Gillan E G. Synthesis of nitrogen-rich carbon nitride networks from an energetic molecular azide precursor[J].
Chemistry of Materials, 2000, 12(12): 3906-3912. DOI:10.1021/cm000570y |
| [18] |
Kebenich E, Klapötke T M, Knizek J, et al. Characterization, crystal structure of 2, 4-bis(triphenylphosphanimino)tetrazolo[5, 1-a]-[1, 3, 5]triazine, and improved crystal structure of 2, 4, 6-triazido-1, 3, 5-triazine[J].
European Journal of Organic Chemistry, 1998, 12: 2013-2016. |
| [19] |
Huynh M H V, Hiskey M A, Archuleta J G. 3, 6-Di(azido)-1, 2, 4, 5-tetrazine: a precursor for the preparation of carbon nanospheres and nitrogen-rich carbon nitrides[J].
Angewandte Chemie International Edition, 2004, 43(42): 5658-5661. DOI:10.1002/(ISSN)1521-3773 |
| [20] |
Huynh M H V, Hiskey M A, Archuleta J G. 3, 6-Di(azido)-1, 2, 4, 5-tetrazine: a precursor for the preparation of carbon nanospheres and nitrogen-rich carbon nitrides[J].
Angewandte Chemie International Edition, 2004, 116(42): 5776-5779. |
| [21] |
Huynh M H V, Hiskey M A, Chavez D E. Synthesis, characterization, and energetic properties of diazido heteroaromatic high-nitrogen C—N compound[J].
Journal of American Chemical Society, 2005, 127(36): 12537-12543. DOI:10.1021/ja0509735 |
| [22] |
Chavez D E, Hiskey M A, Gilardi R D. Novel high-nitrogen materials based on nitroguanyl-substituted tetrazines[J].
Organic Letters, 2004, 6(17): 2889-2891. DOI:10.1021/ol049076g |
| [23] |
李小童, 庞思平, 于永忠. 3, 6-二叠氮基-1, 2, 4, 5-四嗪的合成及理论研究[J].
化学学报, 2007, 65(10): 971-976. LI Xiao-tong, PANG Si-ping, YU Yong-zhong. Synthesis and theoretical studies of 3, 6-diazido-1, 2, 4, 5-tetrazine[J]. Acta Chim Sinica, 2007, 65(10): 971-976. DOI:10.3321/j.issn:0567-7351.2007.10.016 |
| [24] |
Miller D R, Swenson D C, Gillan E G. Synthesis and structure of 2, 5, 8-triazido-s-heptazine: an energetic and luminescent precursor to nitrogen-rich carbon nitrides[J].
Journal of American Chemical Society, 2004, 126(17): 5372-5373. DOI:10.1021/ja048939y |
| [25] |
Miller D R, Swenson D C, Gillan E G. Nitrogen-rich carbon nitride network materials via the thermal decomposition of 2, 5, 8-triazido-s-heptazine[J].
Inorganic Chemistry, 2007, 46(7): 2767-2774. DOI:10.1021/ic061296y |
| [26] |
Swain P K, Singh H, Tewari S P. Energetic ionic salts based on nitrogen-rich heterocycles: A prospective study[J].
Journal of Molecular Liquids, 2010, 151: 87-96. DOI:10.1016/j.molliq.2009.11.009 |
| [27] |
Petrie M A, Sheehy J A, Boatz J A, et al. Novel high-energy density materials. synthesis and characterization of triazidocarbenium dinitramide, -perchlorate, and-tetrafluoroborate[J].
Journal of American Chemical Society, 1997, 119(38): 8802-8808. DOI:10.1021/ja9714189 |
| [28] |
Denault G C. Marx H H. Energy of combustion and differential thermograms of organic azides[J].
Journal of Chemical and engineering Data, 1968, 13(4): 514-516. DOI:10.1021/je60039a016 |
| [29] |
Kofman T P, Krasonv K N. Reactions of 3-azido-1, 2, 4-triazole with electrophiles[J].
Russian Journal of Organic Chemistry, 2004, 40(11): 1651-1656. DOI:10.1007/s11178-005-0074-5 |
| [30] |
Xue H and Shreeve J M. Energetic ionic liquids from azido derivatives of 1, 2, 4-triazole[J].
Advanced Materials, 2005, 17: 2142-2146. DOI:10.1002/(ISSN)1521-4095 |
| [31] |
Ricardo G, Montse R, Jaume V. Diazo-, azo-et azidoazoles. Ⅲ. Tautomérie azido/tétrazole dans des nouveaux azidoazoles(1). Journal of Hetercyclic Chemistry, 1976, 13: 281.
|
| [32] |
Joseph T W, Roland K R. Chemical synthesis of the 1, 2, 4-triazole nucleosides related to uridine, 2′-deoxyuridine, thymidine, and cytidine[J].
The Journal of Organic Chemistry, 1970, 35(8): 2635-2641. DOI:10.1021/jo00833a033 |
| [33] |
冯金玲, 张建国, 李志敏, 等. 高氮含能配合物[Co(AZT)2(H2O)4](HTNR)·4H2O的合成、晶体结构及性质[J].
化学学报, 2010, 24: 2493-2499. FENG Jin-ling, ZHANG Jian-guo, LI Zhi-min, et al. Synthesis, crystal structure and properties of a novel high-nitrogen energetic complex[Co(AZT)2(H2O)4](HTNR)·4H2O[J]. Acta Chimica Sinica, 2010, 24: 2493-2499. |
| [34] |
李生华, 庞思平, 李小童, 等. 多叠氮三唑类高氮化合物的合成与晶体结构[J].
有机化学, 2008, 28(4): 727-731. LI Sheng-hua, PANG Si-ping, LI Xiao-tong, et al. Synthesis and crystal structure of novel highly nitrogen-containing compound of polyazidotriazole[J]. Chinese Journal of Organic Chemistry, 2008, 28(4): 727-731. |
| [35] |
Kofman T P and Namestnikov V I. Synthesis of 3-azido-5-amino-1, 2, 4-triazole[J].
Russian Journal of Organic Chemistry, 2003, 39(4): 579-584. DOI:10.1023/A:1026072221020 |
| [36] |
John W F, Michael E S, Michael D W. Method for azidoaminotriazole, nitrosoguanazine, and related compounds: US 7375221[P], 2008.
|
| [37] |
Magdy B, John W F, Richard G, et al. Selective nitrosation of guanazine: preparation of azidoaminotirazole and nitrosoguanazine anion-Cu(II) complexes[J].
Tetrahedron Letters, 2006, 47: 6663-6666. DOI:10.1016/j.tetlet.2006.06.177 |
| [38] |
Takimoto H H, Denault G C, Hotta S. Synthesis and reactions of 5-alkyl-4-amino-3-hydrazino-s-triazoles[J].
The Journal of Organic Chemistry, 1965, 30: 711-713. DOI:10.1021/jo01014a013 |
| [39] |
Takimoto H H, Denault G C, Hotta S. The thermal decomposition of 3-azido-4-benzylideneamino-s-triazoles[J].
Journal of Hetercyclic Chemistry, 1966, 3(2): 119-123. DOI:10.1002/jhet.5570030201 |
| [40] |
Pevzner M S, Martynova M N. Acid-base properties of 3-azido-1, 2, 4-triazoles[J].
Khim Geterotsikl Soed, 1974(9): 1288-1291. |
| [41] |
Dániel Izsák, Thomas M K. Preparation and crystal structure of 5-azido-3-nitro-1H-1, 2, 4-triazole, Its methyl derivative and potassium salts[J].
Crystals, 2012, 2(2): 294-305. |
| [42] |
Wang K, Damon A P, Jean′ne M S. 3-Azido-N-nitro-1H-1, 2, 4-triazol-5-amine-based energetic salts[J].
Chemistry-A European Journal, 2011, 17(51): 14485-14492. DOI:10.1002/chem.v17.51 |
| [43] |
Xue H, Gao Y, Twamley B, et al. Energetic azolium azolate Salts[J].
Inorganic Chemistry, 2005, 44: 5068-5072. DOI:10.1021/ic050284u |
The progresses on the synthesis and performance of 3-azido-1,2,4-triazole and its derivatives were reviewed.



