奥克托今(HMX)具有爆速高、能量大、热安定性好等优点, 被广泛应用于制备混合炸药、火箭推进剂和高能发射药等[1-3], 是目前武器装备中用途最广、用量最大的单质炸药之一。因此, HMX一直是备受世界各国重视的重要战略物资, 然而在其生产和使用过程中排放的废水含有多种毒性物质, 具有毒性大、难生物降解、排放量大等特点。因此, 寻求一种高效、低成本的处理方法很有必要。目前, 对于废水的处理主要有光催化、吸附法、电化学等方法[4-10], 这些传统的处理方法效率较低, 处理后的残留物仍为污染物或危险物, 需做进一步处理才能排放。因此, 对炸药废水及废物处理的新方法有待进一步研究开发。
Fenton氧化法作为一种高级氧化技术, 在处理难降解炸药废水中具有独特的优势。Fenton氧化法由
废水来自HMX生产过程中产生的废水, 为淡黄色透明澄清液体, 初始pH为1.8, HMX废水中硝胺类化合物含量为206 mg·
取50 mLHMX废水置于烧杯中, 调节废水pH到预定值(酸性), 准确称取实验所需的
水样COD测试仪, XJ-Ⅰ型, 广东省医疗器械厂; 可见分光光度计, JK-721型, 上海精科仪器有限公司; BOD测定仪, ET99724-6, 德国-哈纳科技。
3 结果与讨论 3.1 降解原理Fenton氧化体系中通过一系列的链式反应, 产生了大量的自由基·OH[13]。
| $\begin{eqnarray} \text{Fe}^{2+}+ \text{H}_{2}\text{O}_{2}→\text{Fe}^{3+}+·\text{OH}+\text{OH}^{-} \end{eqnarray}$ | (1) |
| $\begin{eqnarray} ·\text{OH}+ \text{Fe}^{2+}→\text{Fe}^{3+}+\text{OH}^{-} \end{eqnarray}$ | (2) |
| $\begin{eqnarray} ·\text{OH}+ \text{H}_{2}\text{O}_{2}→\text{H}_{2}\text{O}+\text{HO}_{2}· \end{eqnarray}$ | (3) |
当有机物(以RH表示)存在时, ·OH与RH进行反应产生新的自由基R·。新的自由基R·又会被
| $\begin{eqnarray} \text{RH}+·\text{OH}→\text{R}·+ \text{H}_{2}\text{O} \end{eqnarray}$ | (4) |
| $\begin{eqnarray} \text{R}·+ \text{Fe}^{3+}→\text{Fe}^{2+}+ \text{Product} \end{eqnarray}$ | (5) |
取50 mLHMX废水置于烧杯中, 固定温度为20 ℃, 调节废水pH为3,
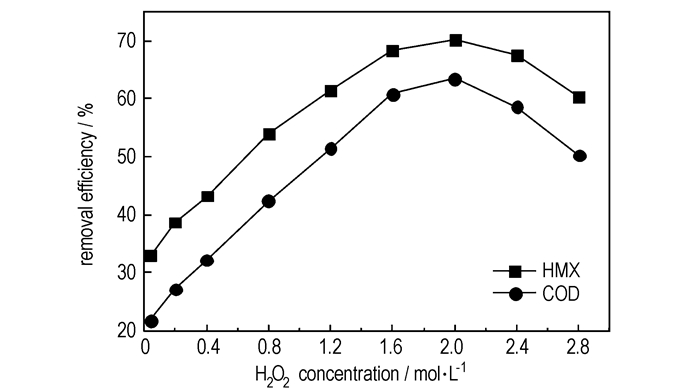
|
图 1 |
从图 1中可以看出, COD去除率与HMX去除率随着
| $\begin{eqnarray} \text{Cr}_{2}\text{O}_{7}~^{2-}+3\text{H}_{2}\text{O}_{2}+8\text{H}^{+}→2\text{Cr}^{3+}+3\text{O}_{2}+7\text{H}_{2}\text{O}_{2} \end{eqnarray}$ | (6) |
因此, 在实际处理HMX废水时, 应投加适量的
固定温度为20 ℃, 废水pH为3,
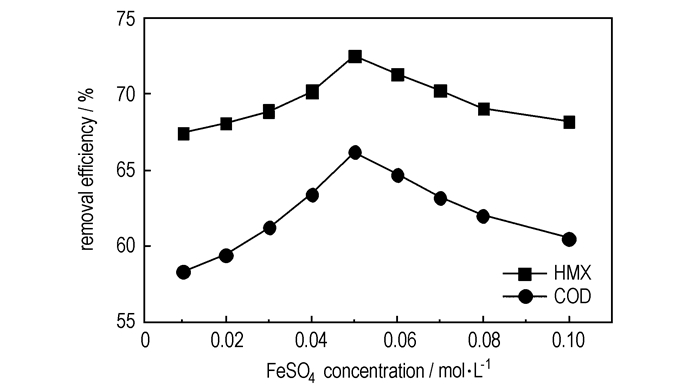
|
图 2 |
从图 2中可以看出,
固定温度为20 ℃,
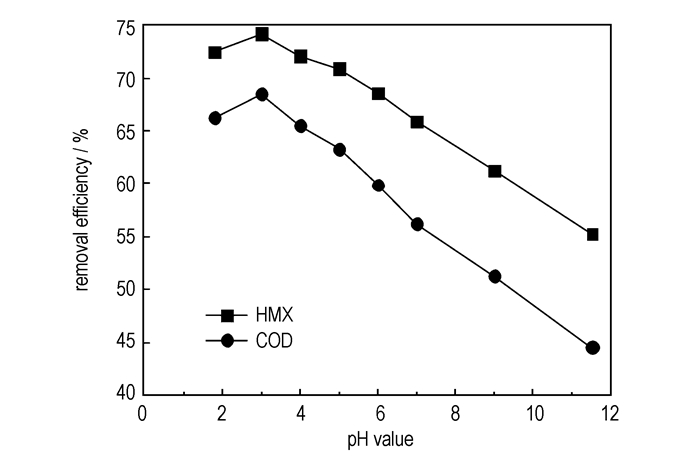
|
图 3 pH值对HMX废水处理效果的影响 Fig.3 Effect of pH value on the removal efficiency of HMX wastewater |
从图 3可以看出, 废水COD去除率与HMX去除率随pH值的增大, 呈现先微增后不断下降的趋势。在pH=3时, 废水的处理效果最好, 废水COD去除率与HMX去除率分别达到了68.5%, 74.2%, 而且酸性条件明显比碱性条件处理效果好。这是因为Fenton试剂在酸性条件下氧化能力最强, 在中性或碱性条件下,
| $\begin{eqnarray} \text{Fe}^{3+}+\text{H}_{2}\text{O}_{2}→\text{Fe}^{2+}+\text{HO}_{2}·+\text{H}^{+} \end{eqnarray}$ | (7) |
由式(7)可知, 当pH值较低, 即溶液中
| $\begin{eqnarray} ·\text{OH}+\text{H}^{+}+\text{e}^{-}→\text{H}_{2}\text{O} \end{eqnarray}$ | (8) |
这导致羟基自由基的无效消耗。再者, 当pH值过低时, 会生成一些复杂的铁水络合物, [Fe(
固定pH值为3,
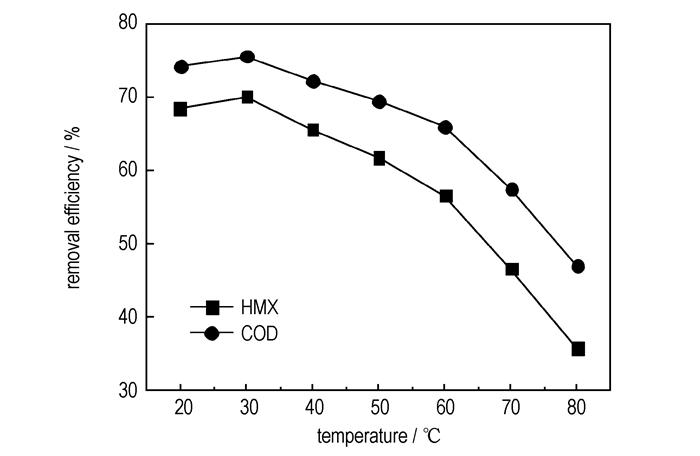
|
图 4 温度对HMX废水处理效果的影响 Fig.4 Effect of temperature on the removal efficiency of HMX wastewater |
从图 4可以看出, 随着温度的升高, HMX废水COD去除率与HMX去除率先增大后逐渐下降。30 ℃时, 废水的COD去除率与HMX去除率由20 ℃时的68.5%和74.2%分别升高到70.1%和75.6%, 根据反应动力学可知, 温度升高, 反应速率加快。但是30 ℃后随着温度的升高, 废水的处理效果反而不断降低,这是因为当温度过高时, 虽然加快了主反应的速度, 但同时也加快了
取50 mLHMX废水置于烧杯中, 调节水样pH值为3, 选择温度为20 ℃,
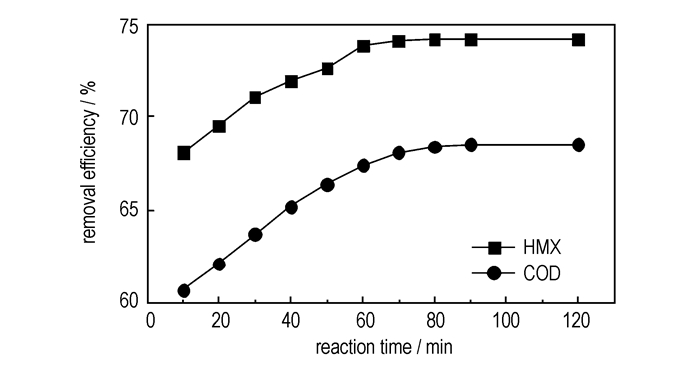
|
图 5 处理时间对HMX废水处理效果的影响 Fig.5 Effect of reaction time on the removal efficiency of HMX wastewater |
从图 5中可以看出, 随着时间的延长, 废水COD去除率与HMX去除率逐渐增大, 反应10 min时, 废水的COD去除率与HMX去除率即可达到60.7%和68.1%, 这是因为Fenton反应速度较快, 产生的羟基自由基能在较短的时间内将有机物氧化分解。60 min后COD去除率与HMX去除率的增大趋势变缓, 90 min时, COD去除率与HMX去除率基本不变。产生这一现象, 一方面因为随着反应的进行, 消耗的Fenton试剂越来越多,
另外,还发现, 在HMX废水处理时, 其HMX去除率均大于COD去除率, 这是因为, HMX氧化降解成小分子物质比其彻底矿化为
对6种
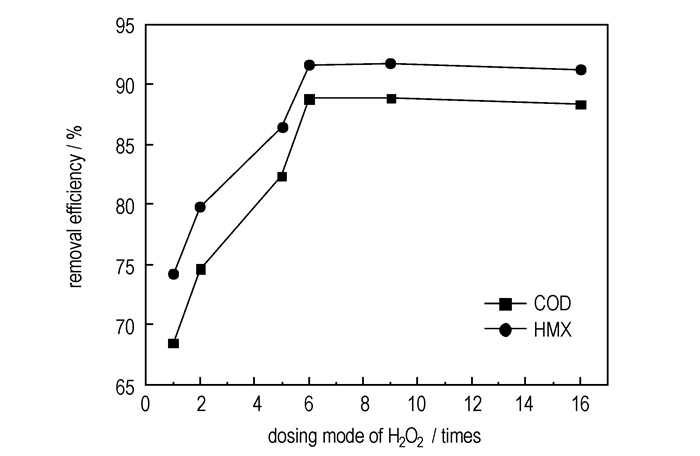
|
图 6 |
从图 6可以看出, 当
上述结果表明,适宜的操作条件为: pH值3, 温度20 ℃,
(1) Fenton氧化法深度降解HMX生产废水适宜的操作条件为: pH值3、反应时间90min、
(2) 在适宜的操作条件下, HMX生产废水的COD去除率可达88.8%, HMX去除率可达91.58%, BOD/COD由原水的0.013提高到0.328, 达到可生化处理要求。
| [1] |
Agamemnon Koutsospyrosa, Julius Pavlovb, Jacqueline Fawcettbd, et al. Degradation of high energetic and insensitive munitions compounds by Fe/Cu bimetal reduction[J].
Journal of Hazardous Materials, 2012, 219-220: 75-81. DOI:10.1016/j.jhazmat.2012.03.048 |
| [2] |
WANG Luo-xin, TUO Xin-lin, YI Chang-hai, et el. Ab initio calculations of the effects of H+ and NH4+ on the initial decomposition of HMX[J].
Journal of Molecular Graphics and Modelling, 2008, 27: 388-393. DOI:10.1016/j.jmgm.2008.06.007 |
| [3] |
WEI Zhi-Xian, XU Yan-Qing, LIU Hai-Yan, et el. Preparation and catalytic activities of LaFeO3 and Fe2O3 for HMX[J].
Journal of Hazardous Materials, 2009, 165: 1056-1061. DOI:10.1016/j.jhazmat.2008.10.086 |
| [4] |
AN Fu-qiangn, FENG Xiao-qin, GAO Bao-jiao. Adsorption mechanism and property of a novel adsorption material PAM/SiO2 towards 2, 4, 6-trinitrotoluene[J].
Journal of Hazardous Materials,, 2009, 168: 352-357. DOI:10.1016/j.jhazmat.2009.02.042 |
| [5] |
张丹, 郭伟男, 余江. 体相光催化处理有机废水新工艺[J].
化工学报, 2011, 62(4): 1077-1083. ZHANG Dan, GUO Wei-nan, YU Jiang. New photocatalytic reactor for treatment of organic wastewater[J]. CIESC Journal,, 2011, 62(4): 1077-1083. |
| [6] |
Kyung-Duk Zoh, Jeffrey I, et al. Treatment of hydrolysates of the high explisives hexahydro-l, 3, 5-trinitro-l, 3, 5-triazine and octahydro-l, 3, 5, 7-tetranitro-l, 3, 5, 7-tetrazocine using biological denitification[J].
Water Environment Research, 1999, 71(2): 148-155. DOI:10.2175/106143099X121490 |
| [7] |
苏远波, 李清彪, 王远鹏, 等. 脉冲电源电解处理含氰含银电镀废水[J].
化工学报, 2009, 60(9): 2308-2313. SU Yuan-bo, LI Qing-biao, WANG Yuan-peng, et al. Silver recovery and cyanide removal from silver-plating wastewater using pulse-electrolysis[J]. CIESC Journal, 2009, 60(9): 2308-2313. |
| [8] |
常海, 吕效平. 超声降解四氯化碳与甲基橙混合废水的研究[J].
高校化学工程学报, 2011, 25(1): 155-160. CHANG Hai, LV Xiao-ping. Degradation of carbon tetrachloride and methyl orange mixed wastewater by ultrasound[J]. Journal of Chemical Engineering of Chinese Universities,, 2011, 25(1): 155-160. |
| [9] |
Asher Brenner, Zeev Ronen, et al. Use of hexahydro-l, 3, 5-trinitro-l, 3, 5-triazine as a nitrogen source in biological treatment of munitions wastes[J].
Water Environment Research, 2000, 72(4): 469-475. DOI:10.2175/106143000X138012 |
| [10] |
王贵珍, 李丽欣, 李永真, 等. 毛竹活性炭制备及其对含苯酚废水吸附的研究[J].
高校化学工程学报, 2010, 24(4): 700-704. WANG Gui-zhen, LI Li-xin, LI Yong-zhen, et al. Study on the preparation of bamboo activated carbon and its phenol adsorption properties[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(4): 700-704. |
| [11] |
Hyeongsu Che, Sun gjun Bae, Woojin Lee. Degradation of trichloroethylene by Fenton reaction in pyrite suspension[J].
Journal of Hazardous Materials, 2011, 185: 1355-1361. DOI:10.1016/j.jhazmat.2010.10.055 |
| [12] |
Kaidar Ayoub, Sylvie Nélieu, Eric D. TNT oxidation by Fenton reaction: reagent ratio effect on kinetics and early stage degradation pathways[J].
Chemical Engineering Journal, 2011, 173: 309-317. DOI:10.1016/j.cej.2011.07.022 |
| [13] |
Zoh K D, Stenstrom M K. Fenton oxidation of hexahy-dro-1, 3, 5-trinitro-1, 3, 5-triazine (RDX) and octahydro-1, 3, 5, 7-tetranitro-1, 3, 5, 7-tetrazocine (HMX)][J].
Water Research, 2002, 36(5): 1331-1341. DOI:10.1016/S0043-1354(01)00285-8 |
| [14] |
朱宪, 姬文琦, 田玲, 等. 超(近)临界水氧化法降解炸药废水的工艺优化与动力学研究[J].
高校化学工程学报, 2009, 23(6): 1058-1063. ZHU Xian, JI Wen-qi, TIAN Ling, et al. The technology optimization and reaction dynamics of simulated explosive industrial wastewater degradation by super(Sub)critical water oxidation method[J]. Journal of Chemical Engineering of Chinese Universities,, 2009, 23(6): 1058-1063. |
| [15] |
尹娟娟, 袁凤英, 宋伟冬, 等. 超声助Fenton试剂处理HMX炸药废水[J].
火炸药学报, 2009, 32(1): 55-58. YIN Juan-juan, YUAN Feng-ying, SONG Wei-dong, et al. Treatment of HMX wastewater with US/ Fenton technology[J]. Chinese Journal of Explosives & Propellants,, 2009, 32(1): 55-58. |
| [16] |
李娴, 霍冀川, 叶旭. 纳米TiO2光催化降解梯恩梯和奥克托今的研究[J].
含能材料, 2008, 16(4): 401-405. LI Xian, HUO Ji-chuan, YE-Xue. Effects of nano-T iO2 on photocatalytic degradation reaction of TNT and HMX[J]. Chinese Journal of Energeticmaterials(Hanneng Cailiao),, 2008, 16(4): 401-405. |
| [17] |
白红娟, 张景林. 废水中微量残留炸药奥克托今、黑索今测定方法的研究[J].
中国安全科学学报, 2003, 13(10): 38-40. BAI Hong-juan, ZHANG Jing-lin. Study on method of determination of residual HMX and RDX in wastewater[J]. China Safety Science Journal,, 2003, 13(10): 38-40. DOI:10.3969/j.issn.1003-3033.2003.10.011 |
| [18] |
王丽娟, 林年丰, 齐翀, 等. 曝气微电解-絮凝工艺预处理嘧啶废水[J].
吉林大学学报(工学版), 2008, 38(6): 1501-1504. WANG Li-juan, LIN Nian-feng, QI Zhong, et al. Pretreatment of pyrimidine wastewater by aerated micro-electrolysis and flocculation technique[J]. Journal of Jilin University (Engineering and Technology Edition), 2008, 38(6): 1501-1504. |
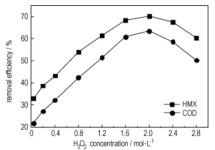
Effect of H2O2 concentration on the removal efficiency of HMX was investigated with the removal efficiency of HMX and COD.



