2. 中国药科大学药学院, 江苏 南京 210009
2. School of Pharmacy, China Pharmaceutical University, Nanjing 210009, China
高能量密度材料(High-energy density materials, HEDMs)在炸药和推进剂领域中有着至关重要的作用, 常通过在HEDMs分子中引进笼状结构或者更多氮原子和/或氧原子等基团, 如叠氮基(—N3)、硝基(—NO2)、硝胺基(—N—NO2)等, 改变化合物结构或电性分布, 以提高其能量和密度[1]。众所周知, 硝胺类化合物特别是环状硝胺, 如1, 3, 5-三硝基1, 3, 5-三氮杂环己烷(RDX), 1, 3, 5, 7-四硝基-1, 3, 5, 7-四氮杂环辛烷(HMX)等, 已被人们作为模板或含能基底材料给予了多种结构修饰[2]。将环硝胺间的亚甲基转换成羰基, 形成一种环硝基脲结构可改善环状硝胺的多方面性能[3], 诸如: (1)脲结构的内在高密度特性[3]可增加单或二硝基脲衍生物密度; (2)二硝基脲结构属于富氧基团, 有助于提高化合物的氧平衡; (3)单硝基脲结构利于分子间氢键的形成, 以降低含能化合物的感度[4]。本文重点介绍环硝基脲系列含能化合物的合成及性能研究进展, 为该方面的深入研究提供参考。
2 环硝基脲类化合物的合成环硝基脲类化合物的合成路线和制备工艺, 目前主要有以下两种方法: (1)脲缩合-硝化法, 即以醛(主要是甲醛和乙二醛)和脲(等二胺)为原料, 经过缩合反应闭环形成环脲仲胺中间体, 再经N-硝化制得相应的环硝基脲衍生物; (2)小分子缩合-硝化法, 即环脲的形成是通过小分子的缩合制得, 再经N-硝化得到环硝基脲类化合物。
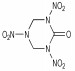
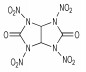
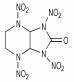
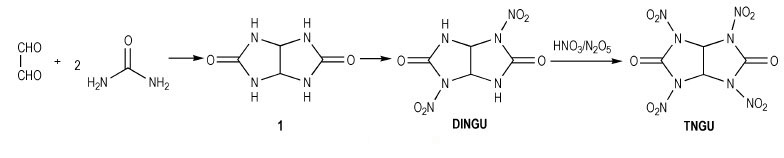
2.1 脲缩合-硝化法 2.1.1 以咪唑烷-2-酮类衍生物为中间体合成环脲硝胺万道正等[5]在1965~1966年, 首先设计并使用甘脲(1)为原料在0~5 ℃条件下合成了双环脲硝胺类含能化合物: 1, 3, 4, 6-四硝基甘脲(TNGU), 当时合成过程未公开。直至10年后, Boileau等[6-7]首次公开发表了以二硝基甘脲制取四硝基甘脲的专利, 报道了TNGU部分爆轰性能及用途。Boileau等[8]以乙二醛和尿素为原料合成出甘脲, 再经HNO3硝化得到1, 4-二硝基甘脲(DINGU)和1, 3-二硝基甘脲混合物, 经水煮除去1, 3-二硝基甘脲, 最后以HNO3/N2O5为硝化体系合成出四硝基甘脲, 反应式如Scheme 1所示。该法起始原料简单、易得, 反应步骤较少, 但由于产物四硝基甘脲易水解, 使得对中间体1, 4-二硝基甘脲的硝化须采用硝化能力强, 几乎不产生水的HNO3/N2O5体系(Scheme 1)。
|
Scheme 1 |
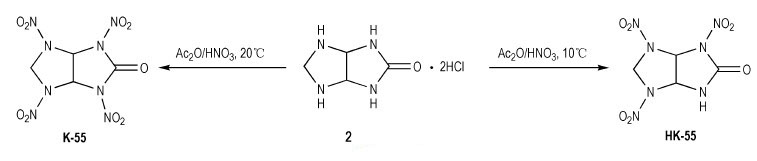
Pagoria等[4]以2, 4, 6, 8-四氮杂双环[3.3.0]辛烷-3-酮二盐酸盐(2)为原料进行硝化, 发现在低于15 ℃时, 得到2, 6, 8-三硝基-2, 4, 6, 8-四氮杂双环[3.3.0]辛烷-3-酮(HK-55);而在20~50 ℃时, 得到2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂双环[3.3.0]辛烷-3-酮(K-55), 反应式如Scheme 2所示。
|
Scheme2 |
相对甘脲(1),化合物2少了一羰基,又亚甲基较之羰基有较好的供电性与稳定性,使得2能在比较温和的Ac2O/HNO3体系中硝化,生成具有硝胺和环脲硝胺结构的稠环产物。因而与四硝基甘脲相比, HK-55和K-55水解稳定性有了较大的提升, 制备时反应温度较高, 反应中产生的水并没有引起HK-55和K-55水解。
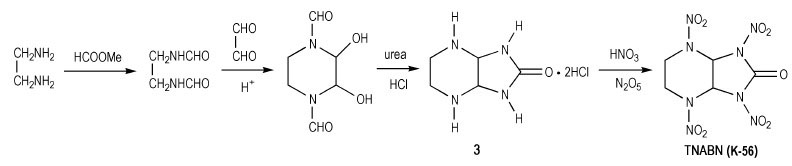
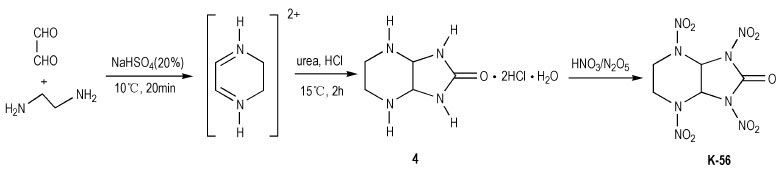
为进一步提高含有羰基硝胺类化合物的稳定性, 人们合成出K-56, 即在K-55分子内插入一个亚甲基, 形成稳定性更好的六元环结构。对于K-56的制备, Graindorge等[9]以乙二胺与甲酸甲酯为原料, 经N-甲酰化、醛胺缩合得哌嗪中间体, 再与脲反应, 闭环得到咪唑烷-2-酮类衍生物: 2, 5, 7, 9-四氮杂双环[4.3.0]壬烷-8-酮二盐酸盐(3), 经HNO3/N2O5硝化, 制得2, 5, 7, 9-四硝基-2, 5, 7, 9-四氮杂双环[4.3.0]壬烷-8-酮(TNABN, K-56), 反应式如Scheme 3所示。之后, Agrawal等[10]简化了Graindorge等制备K-56的过程, 以乙二醛和乙二胺为原料, 缩合得二氢吡嗪正离子中间体, 再与脲一锅煮反应直接合成出化合物(3)中间体, 用HNO3/N2O5硝化得到K-56, 反应式如Scheme 4所示。,
|
Scheme 3 |
|
Scheme 4 |
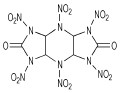
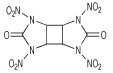
Boyer及其合作者[11]曾报道了2, 4, 6, 8, 10, 12-六硝基-2, 4, 6, 8, 10, 12-六氮杂三环[7.3.0.03, 7]十二烷-5, 11-二酮(HHTDD)和4, 6, 10, 12-四硝基-2, 4, 6, 8, 10, 12-六氮杂三环[7.3.0.03, 7]十二烷-5, 11-二酮的合成, 皆经由母体二盐酸盐(4)用20%N2O5/HNO3或者Ac2O/HNO3硝化得到, 反应式如Scheme 5所示。

|
Scheme 5 |
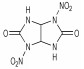
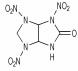
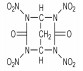
Adolph等[12]曾使用硝硫混酸或Ac2O/HNO3体系作为硝解剂, 在室温下将N-叔丁基氮杂环己烷衍生物中的N-叔丁基直接硝化为N-硝基胺类化合物。直至1994年, Mitchell等[13]借鉴上述方法, 设计以脲、胺和醛为原料, 制得2-氧-5-叔丁基-1, 3, 5-三氮杂环己烷(TBT)作为前体, 直接硝化合成出2, 4, 6-三硝基-2, 4, 6-三氮杂环己酮(K-6, 又称: RDX酮), 其合成路线如Scheme 6所示。分别采用HNO3/N2O5/乙酸酐、HNO3/N2O5/三氟乙酸酐、乙腈/NO2BF4等不同的硝化剂来完成TBT的硝化过程, 发现在乙腈/NO2BF4中制备RDX酮的产率最好, 为61%[14]。
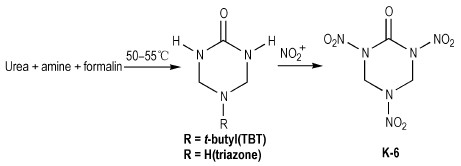
|
Scheme 6 |
此法以甲醛、叔丁胺和脲经Mannish反应缩合环化, 起始原料易得、便宜, 反应操作安全、简单。但是,前体缩合物TBT的产率仅60%左右, 反应总产率较低, 且第二步硝化反应还有一些副反应, 产物不纯。
2.1.3 以四氢嘧啶-2(1H)-酮类衍生物为中间体合成环脲硝胺Agrawal等[10]以三乙氧基甲烷和乙烯乙烷基醚为原料, 首先制得1, 1, 3, 3-四乙氧基丙烷。该丙二醛缩醛衍生物在强酸性条件下酸解即与脲缩合闭环形成2, 4, 6, 8-四氮杂双环[3.3.1]壬烷-3, 7-二酮(5)中间体, 再经Ac2O/HNO3硝化生成2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂双环[3.3.1]壬烷-3, 7-二酮(TNPDU), 反应式如Scheme 7所示。
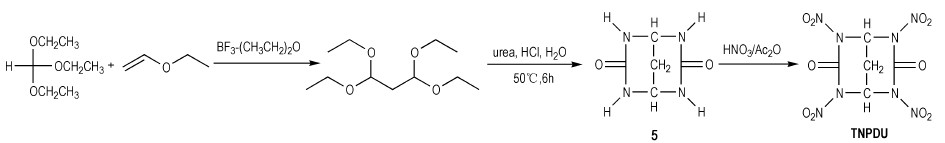
|
Scheme 7 |
与具有双五元环结构单元的甘脲(1)和化合物2合成相比, 该法中形成的5中间体可能因具有双六元环结构, 环张力减小, 故可在比较温和的硝化条件下得到所需产物。
综合以上方法表明: (1)脲缩合-硝化法原料易得, 步骤简单, 比较容易生成环脲中间体与五元或六元含氮杂环相并的环脲衍生物, 再以不同的硝化剂体系硝化, 可制得相应的环脲硝胺类产物; (2)通过选择不同的醛、胺类衍生物, 可设计合成不同的环脲硝胺类含能化合物; (3)闭环反应后形成的四氢嘧啶-2(1H)-酮类衍生物中间体(见Scheme 7)比咪唑烷-2-酮类中间体具有更好的反应活性, 因此可使用较温和的硝化剂体系来完成硝化过程。
2.2 小分子缩合-硝化法本法和前法的不同之处在于:环脲中间体是用非脲小分子缩合而得的, 常首先用胺和异氰酸盐或异氰酸酯作用形成脲类化合物, 再经环合得环脲, 最后经硝化制得环脲硝胺衍生物。
Rothstein等[15-16]对1, 3, 4, 6-四硝基八氢环丁基-[1, 2-d:3, 4-d′]二咪唑基-2, 5-二酮(TDCD, 见Scheme 8)进行理论计算得, 密度1.99 g·cm-3, 爆压为32.8 GPa, 爆速为8410 m·s-1。由于该计算过程没有考虑环丁烷的环张力(108.68 kJ·mol-1), 故Chapman等[17]推测其性能可能会比理论计算结果更佳, 他们以2, 2-二乙氧基乙胺为原料与异氰酸钾反应, 制得相应的脲衍生物, 经环化制得1H-咪唑-2(3H)-酮(6)中间体, 再经乙酰化得N, N′-二乙酰基-1H-咪唑-2(3H)-酮(7), 经光催化(2+2)反应生成N-四乙酰基取代的环脲中间体(8), 弱碱性条件下脱酰基后, 得9,再经过硝化生成TDCD。
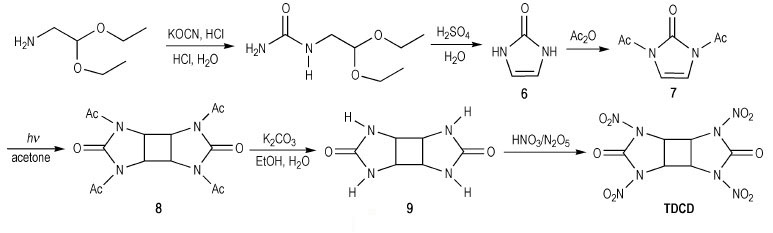
|
Scheme 8 |
Pagoria等[4]首先合成出N, N′-二乙酰基-1H-咪唑-2(3H)-酮(A), 并以7为原料经溴化、乙撑二硝胺(Ethylenedinitramine, EDNA)环化得到N-乙酰基取代的环脲中间体。实验发现, N, N′-二乙酰基取代的化合物在三乙胺(或氨)-乙腈溶液中较易脱一个保护基生成含N-单酰基取代的混合物(见Scheme 9), 再以20%N2O5/HNO3室温硝化生成N-硝基-N-乙酰基环脲中间体10。
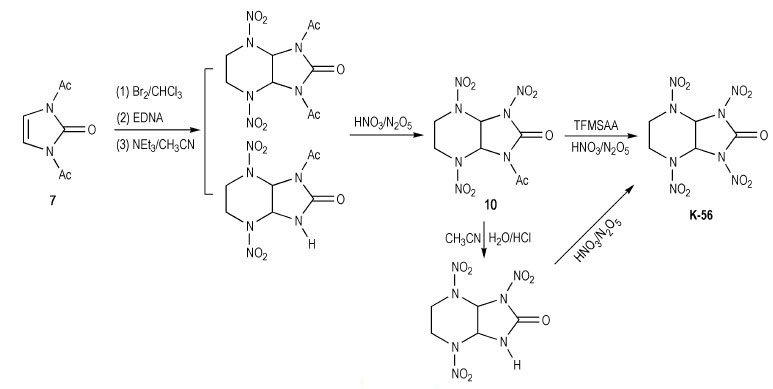
|
Scheme 9 |
值得一提的是, 反应中形成的N-硝基-N-乙酰基环脲衍生物C在不同温度下, 分别于20%N2O5/HNO3, Ac2O/20%N2O5/HNO3等硝化体系中没有发生硝基置换乙酰基的反应, 须使用三氟甲磺酸酐(TFMSAA)/20%N2O5/HNO3的硝化体系才可在脱N-乙酰基同时硝化得到K-56, 产率为69%。
与脲缩合-硝化法相比较, 小分子缩合-硝化法步骤增多, 操作过程较复杂, 如引进乙酰基来保护氨基, 若N-乙酰基不及时脱除则需要非常苛刻的硝化条件才能完成N-硝化过程。然而, 由于小分子结构的多样性和合成方法的灵活性, 故小分子缩合-硝化法在设计、合成一些特殊结构的多环硝基脲类化合物的过程中仍将起到重要作用。
3 环脲硝胺类化合物的性能 3.1 水解稳定性最早以及最熟知的含单或双环硝基脲的例子分别是1, 4-二硝基甘脲(DNGU)和1, 3, 4, 6-四硝基甘脲(TNGU), 因此比较两者的稳定性可从一定程度上说明含单或双硝基脲结构含能化合物的一般特性:具有双硝基脲结构单元的含能化合物水解稳定性不好, 而具有单硝基脲结构的化合物却有较好的水解稳定性。Boileau等[8]发现四硝基甘脲在水及极性溶剂中易水解, 且在样品处理过程中需用无水惰性溶剂洗涤, 而1, 4-二硝基甘脲在沸水中仅缓慢分解。
胡荣祖等[18-20]研究了多种环脲硝胺结构化合物的水解稳定性, 发现酸性条件和水蒸气都会影响2, 4, 6, 8, 10, 12-六硝基-2, 4, 6, 8, 10, 12-六氮杂三环[7.3.0.03, 7]十二烷-5, 11-二酮(HHTDD)的稳定性, 他们还提出了该化合物在中性条件下可能的水解反应机理, 如Scheme 10所示。然而, 研究发现4, 6, 10, 12-四硝基-2, 4, 6, 8, 10, 12-六氮杂三环[7.3.0.0]十二烷-5, 11-二酮却对水稳定, 而在沸腾的甲醇中则会非常缓慢地分解[11]。实验证明, 2, 4, 6-三硝基-2, 4, 6-三氮杂环己酮与其他的环状二硝基脲结构相比较也有更好的水解稳定性, 包括K-55、HK-55等, 原因可能是其含有六元环结构。
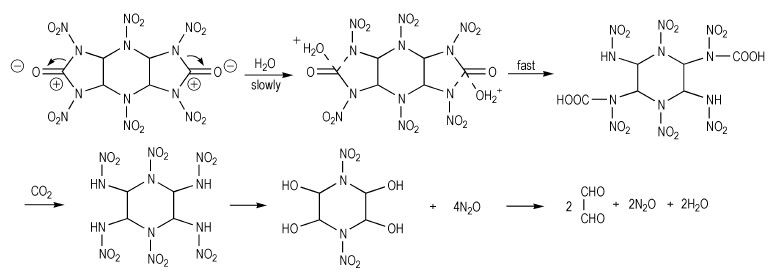
|
Scheme 10 Plausible mechanism of the hydrolysis reaction |
Brill等[21]研究发现1, 3, 4, 6-四硝基八氢环丁基-[1, 2-d:3, 4-d′]二咪唑基-2, 5-二酮(TDCD)可溶于极性有机溶剂, 如DMF、DMSO等, 当加入水时便会发生水解反应。但该化合物在室温下对稀H2SO4稳定, 在稀H2SO4中回流6~8 h, 可转变成1, 2, 3, 4-环丁基四硝胺(CBTN)。
由此可见, 由于环硝基脲结构单元中α-N原子上的硝基为强吸电性基团, 可对羰基产生强烈的吸电诱导效应, 增强了羰基碳原子的电正性而容易受到亲核试剂(如OH-)的进攻, 表现出水解不稳定性。而六元环单硝基脲结构可能减弱了环张力以及环脲中未被N-硝化的内酰胺(—CONH—)结构削弱了羰基的电正性和易形成分子内/间氢键, 增强了分子的稳定性。
3.2 其他性能通过增加炸药分子中的并环数、相对分子量和所含的爆炸性基团, 可达到提高化合物能量和密度的目的, 但这也常导致化合物的稳定性降低。环脲硝胺类化合物因具有脲骨架单元和较多的N—NO2官能团, 使其具有密度大和爆速高等性能特点。一些已经合成的环脲硝胺类化合物的性能见表 1。
| 表 1 一些环脲硝胺类含能化合物的性能1) Tab.1 Performance of some cyclourea nitro-amine energetic compounds |
由表 1可知, 与其它系列含能化合物相比, 环脲硝胺系列含能化合物的密度绝大多数大于1.90 g·cm-3。其中, 胡荣祖等[20]合成出2, 4, 6, 8, 10, 12-六硝基-2, 4, 6, 8, 10, 12-六氮杂三环[7.3.0.03, 7]十二烷-5, 11-二酮(HHTDD)结晶密度高达2.00 g·cm-3。
一般环脲硝胺类化合物以脂环和稠环为主, 这类炸药中高氮多硝基的结构单元和环张力的存在使得它们具有高爆速等良好的爆轰性能, 其中HHTDD的实测爆速达到9546 m·s-1(装药密度为1.995 g·cm-3), 但摩擦感度和撞击感度都比较高。肖鹤鸣等[28]明确指出, 该化合物是迄今为止爆速最高的高能化合物, 具有较高的研究价值和广阔的应用前景。
4 结论与展望环脲硝胺系列化合物是一类高密度、高爆速含能化合物, 其合成方法中的脲缩合-硝化法步骤简单、原料易得, 在起始原料和实验条件的选择上具有广阔的空间, 且反应过程中形成的六元环结构更适宜用温和的硝化剂, 这些对于设计、合成以环脲硝胺为母体的含能衍生物具有较大的指导意义; 而小分子缩合-硝化法常需引入基团保护, 使反应操作步骤增多, 且对使用的硝化剂体系要求较高, 但由于小分子结构的多样性, 使得合成原料的选择更广泛, 合成方法的选用更灵活, 这对于合成一些具有特殊结构或综合性能好的环脲硝胺类化合物具有参考价值。
从环脲硝胺类化合物性能看, 该类含能材料依然存在传统CHNO类炸药中能量与感度及稳定性的本质矛盾。如HHTDD的密度大, 爆速高, 氧平衡为零, 但感度、爆发点和热安定性都不太理想; 而一些含单硝基环脲类化合物由于存有未被N—硝化的内酰胺(—CONH—)结构, 削弱了羰基的电正性和易形成分子内和分子间氢键, 增加了分子结构的稳定性,感度降低, 但同时也减低了其能量性能。这表明, 这类含能材料仍具备提高其密度和爆炸性能的可能性, 也存在降低其易损性能的空间, 在发展新型含能材料方面,环脲硝胺类化合物不可忽视。
因此, 为了实现环脲硝胺类化合物在含能材料领域的最大应用潜力, 可从以下方面开展研究: (1)以环脲硝胺为基本结构单元, 从分子结构层面进行合理修饰, 如通过引进氨基等官能团提高分子结构的稳定性与密度, 降低感度等, 从而设计出综合性能良好的含能化合物; (2)对已知化合物的合成路线进行优化改进, 缩短合成路线、提高反应收率以实现工业化生产及其实际应用。
| [1] |
Talawar M B, Sivabalan R, Mukundan T, et al. Environmentally compatible next generation green energetic materials (GEMs)[J].
Journal of Hazardous Materials, 2009, 161: 589-607. DOI:10.1016/j.jhazmat.2008.04.011 |
| [2] |
Badgujar D M, Talawar M B, Asthana S N, et al. Advances in science and technology of modern energetic materials: an overview[J].
Journal of Hazardous Materials, 2008, 151: 289-305. DOI:10.1016/j.jhazmat.2007.10.039 |
| [3] |
Sikder A K, Sikder Nirmala. A review of advanced high performance, insensitive and thermally stable energetic materials emerging for military and space applications[J].
Journal of Hazardous Materials A, 2004, 112: 1-15. DOI:10.1016/j.jhazmat.2004.04.003 |
| [4] |
Pagoria P F, Mitchell A R, Jessop E S. Nitroureas Ⅱ. synthesis of bicyclic mono-and dinitrourea compounds[J].
Propellants, Explosives, Pyrotechnics, 1996, 21: 14-18. DOI:10.1002/(ISSN)1521-4087 |
| [5] |
彭忠吉, 万道正. 四硝基甘脲及其水解产物的合成研究[J].
兵工学报, 1980(3): 23-27. PENG Zhong-ji, WAN Dao-zheng. The synthetic study of tetranitroglycoluril and its hydrolyzed product[J]. Acta Armamentarii, 1980(3): 23-27. |
| [6] |
Boileau J, Emeury J L, Kehren J. Tetranitroglycoluril, Herstellungsverfahren dafuer und verwendung als explosivesivstoff: DE 2435651[P], 1975-02-06.
|
| [7] |
Boileau J, Emeury J L, Kehren J. Explosivstoffe auf der basis von dinitroglycoluril: DE 2462330[P], 1976-12-02.
|
| [8] |
Boileau J, Emeury J L, Kehren J. Tetranitroglycoluril and method of preparation thereof: US 4487938[P], 1984-12-11.
|
| [9] |
Graindorge H R, Lescop P A, Terrier F, et al. Synthesis of 2, 5, 7, 9-tetranitro-2, 5, 7, 9-tetraazabicyclo[4. 3. 0]nonanone[C]//Proceedings of the 211st American Chemical Society National Meeting, Washington, DC, 1996, 623: 43-50.
|
| [10] |
Sikder A K, Bhokare G M, Sarwade D B, et al. Synthesis, characterization and thermal behaviour of 2, 4, 6, 8-tetranitro-2, 4, 6, 8-tetraazabicyclo[3.3.1]nonane-3, 7-dione(TNPDU) and one of its methylene analogues[J].
Propellants, Explosives, Pyrotechnics, 2001, 26: 63-68. |
| [11] |
Vedachalam M, Ramakrishnan V T, Boyer J H, et al. Facile synthesis and nitration of cis-syn-cis-2, 6-dioxodecahydro-1H, 5H-diimidazo[4, 5-b:4′, 5′-e]pyrazine[J].
The Journal of Organic Chemistry, 1991, 56: 3413-3419. DOI:10.1021/jo00010a043 |
| [12] |
Cichra D A, Adolph H G. Nitrolysis of dialkyl tert-butylamines[J].
The Journal of Organic Chemistry, 1982, 47: 2474-2476. DOI:10.1021/jo00133a047 |
| [13] |
Mitchell A R, Pagoria P F, Coon C L, et al. Nitroureas Ⅰ. Synthesis, scale-up and characterization of K-6[J].
Propellants, Explosives, Pyrotechnics, 1994, 19: 232-239. DOI:10.1002/(ISSN)1521-4087 |
| [14] |
Ritter H, Braun S, Cshafer M, et al. Relationship between crystal shape and explosive properties of K-6[C]// International Annual Conference of ICT 32nd(Energrtic Materials), 2001, 91/1-91/14. CAN 135: 333014.
|
| [15] |
Rothstein L R, Petersen R. Predicting high explosive detonation velocities from their composition and structure[J].
Propellants, Explosives, 1979, 4: 56-60. DOI:10.1002/(ISSN)1521-4087 |
| [16] |
Rothstein L R. Predicting high explosive detonation velocities from their composition and structure (Ⅱ)[J].
Propellants, Explosives, 1981, 6: 91-93. DOI:10.1002/(ISSN)1521-4087 |
| [17] |
Fischer J W, Hollins R A, Lowe-Ma C K, et al. Synthesis and characterization of 1, 2, 3, 4-cyclobutanetetranitramine derivatives[J].
The Journal of Organic Chemistry, 1996, 61: 9340-9343. DOI:10.1021/jo9613040 |
| [18] |
HU Rong-zu, LING Yan-jun, FANG yin-gao, et al. The hydrolytic stability of some cyclourea compounds[J].
Journal of Thermal Analysis, 1996, 46: 1283-1289. DOI:10.1007/BF01979242 |
| [19] |
HU Rong-zu, LU Xing-sen, FANG Yin-gao. Thermal behaviour of 2, 4, 6, 8, 10, 12-hexanitro-2, 4, 6, 8, 10, 12-hexaaza-tricyclo[7, 3, 0, 03, 7]dodecane-5, 11-dione[J].
Journal of Energetic Materials, 1993, 11: 219-241. DOI:10.1080/07370659308227812 |
| [20] |
胡荣祖, 方银高, 卢兴森. 环脲硝胺化合物稳定性的研究[J].
火炸药, 1981(5): 1-11. |
| [21] |
Oyumi Y, Brill T B. Thermal decomposition of energetic materials XXVIII. Predictions and results for nitramines of bis-imidazolidinedione: DINGU, TNGU and TDCD[J].
Propellants, Explosives, Pyrotechnics, 1988, 13: 69-73. DOI:10.1002/(ISSN)1521-4087 |
| [22] |
Sikder N, Bulakh N R, Sikder A K, et al. Synthesis, characterization and thermal studies of 2-oxo-1, 3, 5-trinitro-1, 3, 5-triazacyclohexane (Keto-RDX or K-6)[J].
Journal of Hazardous Materials, 2003, 96: 109-119. DOI:10.1016/S0304-3894(02)00169-3 |
| [23] |
Khire V H, Talawar M B, Prabhakaran K V, et al. Spectro-thermal decomposition study of 1, 4-dinitroglycoluril (DINGU)[J].
Journal of Hazardous Materials A, 2005, 119: 63-68. DOI:10.1016/j.jhazmat.2004.12.020 |
| [24] |
方银高. 二硝基甘脲合成方法的改进[J].
火炸药, 1983, 01: 14-17. |
| [25] |
Pagoria P F, Lee G S, Mitchell A R, et al. A review of energetic materials synthesis[J].
Thermochimica Acta, 2002, 384: 187-204. DOI:10.1016/S0040-6031(01)00805-X |
| [26] |
Hong Guan Lin, Zhu Chun Hua. Synthesis and properties of tetranitropropanediurea[C]//Proceedings of the 17th International Pyrotechnics Seminar combined with the 2nd Beijing International Symposium on Pyrotechnics and Explosives, Beijing: Beijing Institute of Technology Press, 1991: 193-195.
|
| [27] |
鲁鸣久. 一种新颖的高能炸药:六硝基六氮杂三环十二烷二酮[J].
火炸药学报, 2000, 23(1): 23-24. Lu Ming-jiu. Novel high explosive: hexanitrohexaazatricyclododecanedione[J]. Chinese Journal of Explosives & Propellants, 2000, 23(1): 23-24. |
| [28] |
邱玲, 肖鹤鸣, 居学海, 等. 六硝基六氮杂三环十二烷的结构和性能: HEDM分子设计[J].
化学物理学报, 2005, 18(4): 541-546. QIU Ling, XIAO He-ming, JU Xue-hai, et al. Structures and properties of hexanitrohexaazatricyclododecane: molecular design of HEDM[J]. Chinese Journal of Chemical Physics, 2005, 18(4): 541-546. |
Two synthetic methods of cyclourea nitro-amine derivatives are summarized: urea condensation-nitration method and small molecule condensation-nitration method. The characteristics of these compounds are revealed. The research direction of new insensitive energetic compounds based on cyclourea nitro-amine is prospected.