载人航天技术的发展, 对推进剂提出了更高的环保要求。传统的肼类推进剂具有剧毒、强腐蚀、污染环境等缺点, 因此开发无毒、无污染、环境友好的绿色液体推进剂已成为当前液体推进剂研究的主要方向。
离子液体是一类由有机阳离子与无机或有机阴离子组成、熔点低于100 ℃的盐类化合物, 具有低蒸汽压、强极性、高稳定性及性能可调等优点, 作为一种绿色溶剂已得到广泛研究[1]。近年来, 离子液体在推进剂领域中的应用也显示出良好的前景。MacFarlane等[2]发现以二氰胺根(N(CN)2-)为阴离子的离子液体通常具有较低的粘度, 例如[emim][N(CN)2]在25 ℃时的动力黏度为21 mPa·s; 另一方面, Schneider等[3]发现以N(CN)2-为阴离子的咪唑型离子液体与红烟或白烟硝酸混合能自燃, 预示着以二氰胺根为阴离子的离子液体有望成为一类新型无毒的可自燃液体火箭推进剂。
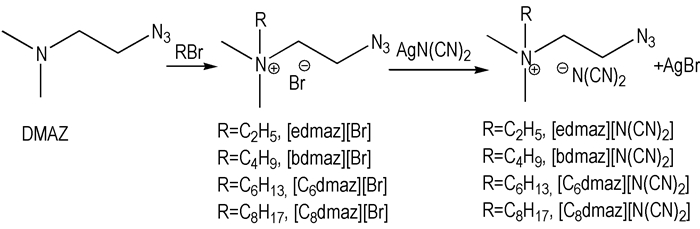
本研究拟通过合成一类含叠氮基的新型有机阳离子, 与二氰胺根阴离子结合形成离子液体, 并测量其离子液体的物性, 初步判断这些离子液体是否满足液体推进剂的物性要求。结合笔者的前期研究工作[4], 选择N, N-二甲基-2-叠氮乙胺(DMAZ)为起始物, 通过烷基化和复分解反应, 合成了四种以N(CN)2-为阴离子的叠氮铵类离子液体, 并对这些离子液体的密度、动力黏度和摩尔定压热容等物性进行了测量和讨论。
2 实验部分 2.1 试剂与仪器试剂:溴乙烷(纯度98%), 1-溴丁烷(纯度98%), 1-溴正己烷(纯度98%), 1-溴正辛烷(纯度98%), 1-溴正十二烷(纯度98%), 二氰胺钠(纯度96%), 上述试剂均为阿拉丁公司产品。硝酸银(AR), 乙腈(AR), 甲苯(AR), 乙酸乙酯(AR), 上述试剂均为国药集团产品。氘代DMSO(99.9%), 百灵威公司产品。
仪器: HT-4A数显恒温多头磁力搅拌(江苏省金坛市荣华仪器制造有限公司), 旋转蒸发器RE-2000B(上海亚荣生化仪器厂), Nicolet Nexus 470傅里叶变换红外光谱仪(美国Thermo Nexus公司), Bruker DMX-500核磁共振仪(德国Bruker公司), 高效液相色谱(Agilent 1260, C18), ESI-MS (Bruker Esquire 3000 plus), STA 409 PC同步热分析仪(德国耐驰仪器制造有限公司), DSC Q100(美国TA公司), Anton Paar DMA 5000M振动管密度计, Anton Paar AMVn粘度仪测定。
2.2 离子液体的合成([Rdmaz][N(CN)2])离子液体通过两步法合成得到(如Scheme 1所示)。首先DMAZ与不同链长的溴代烃(RBr)反应生成季铵溴盐([Rdmaz][Br]), 然后再与二氰胺银(AgN(CN)2)进行离子交换。DMAZ和AgN(CN)2的合成方法见文献[4, 5]。
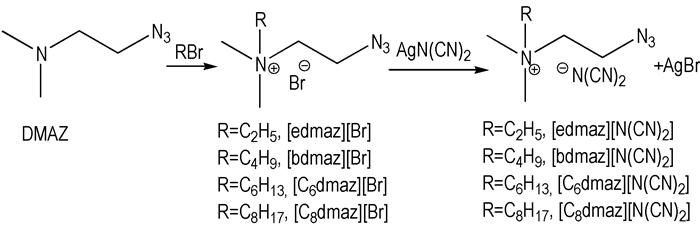
|
Scheme1 Synthesis of ionic liquids of [Rdmaz][N(CN)2] |
称取一定量的DMAZ (44 mmol)加入干燥的三口烧瓶中, 加入50 mL乙腈溶解, 冰水浴冷却, 边搅拌边用恒压滴液漏斗缓慢滴加新蒸溴代烃(53 mmol), 滴加完毕后, 继续搅拌30 min后撤去冰水浴, 然后在一定温度下继续搅拌若干时间, 旋转蒸发除去溶剂得到白色固体, 用乙腈/乙酸乙酯混合溶剂重结晶两次, 50 ℃真空干燥48 h, 得白色[Rdmaz][Br]固体。称取一定量的[Rdmaz][Br](25 mmol), 加入40 mL无水乙醇溶解, 然后再加入AgN(CN)2 (30 mmol), 避光室温搅拌12 h, 离心分离除去AgBr及未反应的AgN(CN)2, 旋转蒸发除去溶剂, 50 ℃真空干燥48 h, 得无色或淡黄色液体。
N, N-二甲基-N-乙基-2-叠氮乙基二氰胺铵, [edmaz][N(CN)2]:淡黄色(4.90 g, 94%). 1H NMR: δ=1.22~1.25 (m, 3H, CH3), 3.02 (s, 6H, CH3), 3.33~3.36 (m, 2H, CH2), 3.46~3.49 (m, 2H, CH2), 3.91~3.93 (m, 2H, CH2); 13C NMR: δ=119.56, 61.24, 60.03, 50.31, 44.51, 8.27; IR(NaCl, ν/cm-1) 3443(m), 3012(w), 2964(m), 2876(w), 2233(s), 2194(w), 2134(s), 1638(w), 1485(m), 1303(m), 910(w).
N, N-二甲基-N-正丁基-2-叠氮乙基二氰胺铵, [bdmaz][N(CN)2]:淡黄色(5.45 g, 92%). 1H NMR: δ=0.93-0.96 (m, 3H, CH3), 1.28~1.31 (m, 2H, CH2), 1.64~1.69 (m, 2H, CH2), 3.05 (s, 6H, CH3), 3.29~3.31 (m, 2H, CH2), 3.49~3.51 (m, 2H, CH2), 3.93~3.95 (m, 2H, CH2); 13C NMR: δ=119.04, 63.63, 61.27, 50.41, 44.03, 23.67, 19.09, 13.40; IR(NaCl, ν/cm-1) 3434(s), 3146(w), 3021(m), 2991(m), 26969(w), 2234(s), 2195(s), 2133(s), 1644(m), 1485(s), 1310(s), 1019(m), 909(m), 855(w), 809(m).
N, N-二甲基-N-正己基-2-叠氮乙基二氰胺铵, [C6dmaz][N(CN)2]:淡黄色(6.03 g, 91%). 1H NMR: δ=0.87~0.90 (m, 3H, CH3), 1.27~1.32 (m, 6H, CH2), 1.65~1.68 (m, 2H, CH2), 3.05 (s, 6H, CH3), 3.28-3.31 (m, 2H, CH2), 3.49~3.51 (m, 2H, CH2), 3.92~3.95 (m, 2H, CH2); 13C NMR: δ=119.07, 63.83, 61.22, 50.40, 44.03, 30.57, 25.32, 21.79, 21.62, 13.74; IR(NaCl, ν/cm-1) 3444(s), 3028(w), 2957(s), 2925(s), 2861(s), 2528(w), 2238(s), 2194(s), 2135(s), 1644(m), 1470(s), 1311(s), 1012(w), 906(m), 728(s).
N, N-二甲基-N-正辛基-2-叠氮乙基二氰胺铵, [C8dmaz][N(CN)2]:淡黄色(6.59 g, 90%). 1H NMR: δ=0.87~0.89 (m, 3H, CH3), 1.27~1.30 (m, 10H, CH2), 1.64~1.70 (m, 2H, CH2), 3.05 (s, 6H, CH3), 3.28-3.30 (m, 2H, CH2), 3.49~3.51 (m, 2H, CH2), 3.92~3.95 (m, 2H, CH2); 13C NMR: δ=119.07, 63.81, 61.20, 50.40, 44.03, 31.11, 28.38, 28.36, 25.68, 22.00, 21.66, 13.89; IR(NaCl, ν/cm-1) 3499(s), 3027(m), 2975(s), 2927(s), 2857(s), 2533(w), 2235(s), 2195(s), 2134(s), 1644(m), 1470(s), 1311(s), 909(m), 724(w).
2.3 物性测定采用ESI-MS (Bruker Esquire 3000 plus)检测离子液体中可能残余的Br-和Ag+。经检测, 所有离子液体样品中均无Br-或Ag+。采用500 MHz核磁共振仪(NMR, Bruker DMX-500)记录1H NMR和13C NMR谱(以DMSO-d6为溶剂), 化学位移以Me4Si为参比。采用Nicolet Nexus 470傅里叶变换红外仪记录FT-IR谱图。
采用Anton Paar DMA 5000M振动管密度计测量离子液体的密度(ρ), 测温范围: 25~60 ℃; 采用Anton Paar AMVn黏度计测量离子液体的动力黏度(η), 测温范围: 25~60 ℃; 采用差示扫描热量计(DSC, TA Q100)分析离子液体在-120~20 ℃范围内的相变(用液氮冷却), 以及在25~120 ℃范围内的定压热容(样品放在密闭铝容器里, 升温速率10 ℃·min-1)。用热重/差示扫描热量计(TG/DSC, NETZSCH STA 409 PG/PC)测定离子液体的热分解温度, 温度扫描范围: 30~500 ℃, 升温速率10 ℃·min-1。
3 结果与讨论合成了五种通式为[Rdmaz][N(CN)2]的离子液体, 其中R分别为乙基(e), 正丁基(b), 正己基(C6), 正辛基(C8)和正十二烷基(C12)。研究发现, 当R为C12时, 得到的产物室温下为固体, 其余产物室温下均为液体, 因此本研究只对四种离子液体的性质进行了测试和讨论。
3.1 烷基链长对离子液体物性的影响表 1分别给出了四种离子液体在25 ℃下的密度(ρ)、动力黏度(η)和摩尔定压热容(Cp, m)。由表 1可知, 四种离子液体的密度均大于1 g·cm-3, 同时也大于DMAZ的密度[6], 满足液体推进剂对高密度的要求。
| 表 1 25 ℃时[Rdmaz][N(CN)2]离子液体的密度、动力黏度和摩尔定压热容 Tab.1 Density, dynamic viscosity and molar heat capacity for ionic liquids of [Rdmaz][N(CN)2] at 25 ℃ |
由表 1可知, 离子液体的密度随烷基链中碳数增加而减小, 该变化规律与[1-烷基-3-甲基咪唑][双(三氟甲烷磺酰)亚胺]([Rmim][(CF3SO2)2N])离子液体相似[7]。另外, R为甲基的离子液体在25 ℃时的密度为1.15 g·cm-3[8], 这与表中数据的变化规律也是一致的。
利用25 ℃时的密度数据, 根据式(1)计算了各离子液体的分子体积(Vm), 结果见表 1。由表 1可见, 离子液体的分子体积随烷基链长的增加而增大, 且均大于DMAZ的分子体积, 与事实一致; 另外, 一个亚甲基(—CH2—)对离子液体分子体积的贡献几乎是一个常数(约0.0269 nm3)。
| $ {V_{\rm{m}}} = {M_{\rm{w}}}/\left( {N \times \rho } \right) $ | (1) |
式中, MW为相对分子质量, g·mol-1; N为Avogadro常数; ρ为25 ℃时的密度。
另据表 1可知, 四种离子液体的动力黏度总体上随烷基链长的增加而增加, 但并非线性增加。[edmaz][N(CN)2]的动力黏度为5.3 mPa·s, 略高于DMAZ的动力黏度, 能够满足液体推进剂对黏度的要求; 其余三种离子液体的动力黏度较大(>100 mPa·s), 并随烷基链中碳数的增加缓慢增大。烷基链长对离子液体动力黏度的类似影响规律也有文献报道, 例如[Rmim][(CF3SO2)2N]离子液体的动力黏度也随烷基链中碳数的增加而增大[7]。此外, 四种离子液体的摩尔定压热容也是随烷基链长的增加而增加的。
3.2 温度对离子液体密度的影响密度与温度的关系如图 1所示。由图 1可知, 密度随温度的升高而线性减小, 两者之间可用(2)式拟合:
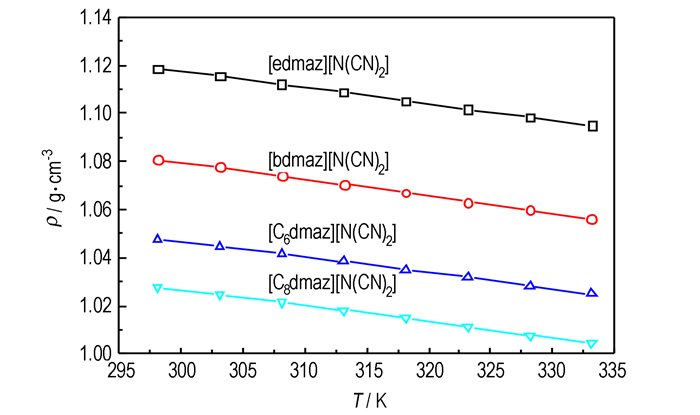
|
图 1 [Rdmaz][N(CN)2]离子液体的密度与温度的关系 Fig.1 Dependence of density on temperature for ionic liquids of [Rdmaz][N(CN)2] |
| $ \rho = A + BT $ | (2) |
式中, A和B为拟合参数, 其数值见表 2。由标准偏差(s)可知, 两者线性关系很好。
| 表 2 方程(2)的拟合参数 Tab.2 Correlation parameters for Equation (2) |
图 2为动力黏度与温度的关系图。由图 2可知, 离子液体的动力黏度随温度升高而降低, 两者可用Vogel-Fulcher-Tamman (VFT)方程拟合:
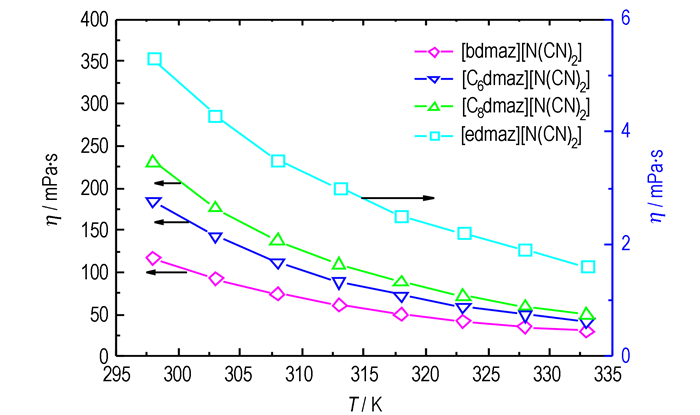
|
图 2 [Rdmaz][N(CN)2]离子液体的动力黏度与温度的关系 Fig.2 Dependence of dynamic viscosity on temperature for ionic liquids of [Rdmaz][N(CN)2] |
| $ \eta = {\eta _0}\exp \left[ {B/\left( {T - {T_0}} \right)} \right] $ | (3) |
式中, η0、B和T0为拟合参数, 其数值见表 3。
| 表 3 VFT方程的拟合参数 Tab.3 Correlation parameters for VFT equation |
表 4给出了四种离子液体的玻璃化转变温度(Tg)和分解温度(Td)。由表 4可知, [edmaz][N(CN)2]离子液体的Tg为-102 ℃, 低于其它三种离子液体, 其余三种离子液体的Tg相差不大, 在-89~-92 ℃之间, 说明这四种离子液体可以在低温下使用。另外, 四种离子液体的分解温度均在241~242 ℃之间, 与烷基链长基本无关。
| 表 4 [Rdmaz][N(CN)2]离子液体的热性质 Tab.4 Thermal properties for ionic liquids of [Rdmaz][N(CN)2] |
本研究还测定了四种离子液体在不同温度下的摩尔定压热容, 结果如图 3所示。由图 3可知, 每一种离子液体的摩尔定压热容随温度的升高而增大, 摩尔定压热容与温度之间的关系可用(4)式拟合:
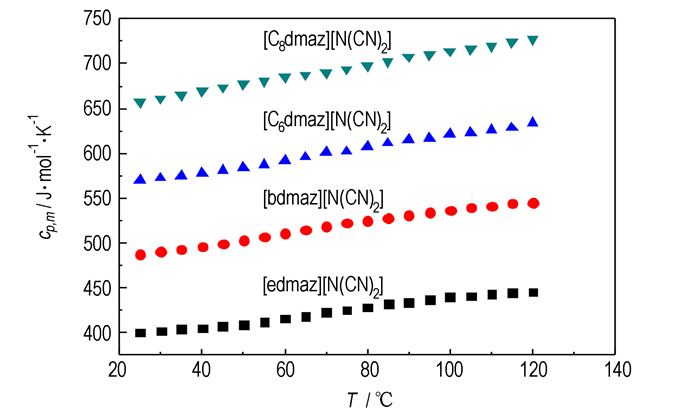
|
图 3 [Rdmaz][N(CN)2]摩尔定压热容与温度的关系 Fig.3 Dependence of molar heat capacity on temperature for ionic liquids of [Rdmaz][N(CN)2] |
| $ {C_{p,{\rm{m}}}} = a + bT + c{T^2} $ | (4) |
式中, a, b和c均为拟合参数, 其数值见表 5。
| 表 5 方程(4)的拟合参数 Tab.5 Correlation parameters for Equation (4) |
以N, N-二甲基-2-叠氮乙胺为起始物, 通过烷基化和复分解反应, 合成了四种以二氰胺根为阴离子的叠氮铵类离子液体([Rdmaz][N(CN)2], R=乙基(e), 正丁基(b), 正己基(C6), 正辛基(C8))。结果发现, 随烷基链中碳数的增加, 离子液体的密度减小、动力黏度和摩尔定压热容增加, 热稳定性与烷基链长基本无关。四种离子液体均没有明确的熔点, 只存在一个玻璃化转变温度(Tg), 其中[edmaz][N(CN)2]的Tg为-102 ℃, 低于其它三种离子液体, 另外三种离子液体的Tg相差不大, 在-89~-92 ℃之间。密度与温度之间存在良好的线性关系, 而动力黏度与温度之间满足VFT方程, 摩尔定压热容与温度之间可用方程cp, m=a+bT+cT2拟合。
| [1] |
Plechkova N V, Seddon K R. Applications of ionic liquids in the chemical industry[J].
Chem Soc Rev, 2008, 37(1): 123-150. DOI:10.1039/B006677J |
| [2] |
MacFarlane D R, Golding J, Forsyth S, et al. Low viscosity ionic liquids based on organic salts of the dicyanamide anion[J].
Chem Comm, 2001, 16: 1430-1431. |
| [3] |
Schneider S, Hawkins T, Rosander M, et al. Ionic liquids as hypergolic fuels[J].
Energy & Fuels, 2008, 22: 2871-2872. |
| [4] |
孙甜甜, 厉刚. 水介质中N, N-二甲基-2-叠氮乙胺盐酸盐的合成动力学[J].
含能材料, 2013, 21(1): 49-52. SUN Tian-tian, LI Gang. Reaction kinetics of synthesizing 2-azido-N, N-dimethylethylamine hydrochloride in aqueous solution[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(1): 49-52. |
| [5] |
MacFarlane D R, Forsyth S A, Golding J, et al. Ionic liquids based on imidazolium, ammonium and pyrrolidinium salts of the dicyanamide anion[J].
Green Chem, 2002, 4: 444-448. DOI:10.1039/b205641k |
| [6] |
Mellor B. A preliminary technical review of DMAZ: a low-toxicity hypergolic fuel[R]. ESA SP-557, 2004.
|
| [7] |
Tokuda H, Hayamizu K, Ishii K, et al. Physicochemical properties and structures of room temperature ionic liquids. 2. Variation of alkyl chain length in imidazolium cation[J].
J Phy Chem B, 2005, 109: 6103-6110. DOI:10.1021/jp044626d |
| [8] |
Joo Y H, Gao H, Zhang Y, et al. Inorganic or organic azide-containing hypergolic ionic liquids[J].
Inorg Chem, 2010, 49(7): 3282-3288. DOI:10.1021/ic902224t |
Four ionic liquids with formula of [Rdmaz][N(CN)2], R=ethyl(e), n-butyl(b), n-hexyl(C6) and n-octyl(C8), were synthesized through a metathesis reaction of quaternized N, N-dimethyl-2-azidoethylamine (DMAZ) with different alkyl chain length with silver dicyanamide. The density, dynamic viscosity and thermal properties of these ionic liquids were measured over a wide temperature range.



