高能量密度烃类燃料是一类致密、体积热值高的液体燃料, 其作为单独组分或高能添加组分能有效提高燃料的单位体积热值, 在燃料箱体积恒定的情况下可增加能量供给, 是飞行器高航速、远航程的重要保障。从20世纪50年代起, 高能量密度燃料就一直是军用喷气燃料发展的重点。笼状化合物由于其具有的环张力、致密、高生成焓等属性, 因此这类新型材料的设计、合成和性能研究一直是高能量密度燃料研究的重点, 国内外已有较多文献对其研究进展情况进行了综述[1-3]。在各种笼状化合物中, 金刚烷结构高度对称, 具有密度大(1.07 g·cm-3)、热值高(燃烧热为(-6027.7±0.4) kJ·mol-1)等特点, 是很有潜力的高密度烃类燃料的候选物。本文针对具有金刚烷骨架结构的高密度烃类化合物, 从分子结构、性能、合成以及应用等方面综述金刚烷类高能量密度燃料的研究进展。
2 金刚烷及其衍生物的分子结构与性质金刚烷(adamantane, ADH)是由10个碳原子和16个氢原子构成的笼状烃, 分子中的碳原子采取sp3杂化, 形成稳定六元环结构的椅式构象1。六元环己烷相互结合可以组成多环笼状烃, 当环的结构单元数分别为1、2、3时没有同分异构体; 单元结构为4时其同分异构体有3种(scheme 1, 4、5、6), 且可能形成对映异构体(scheme 1, 6a与6b)[4-5]。理论上, 椅式构象1可以形成规律的稠密结构(scheme 1, 7)。
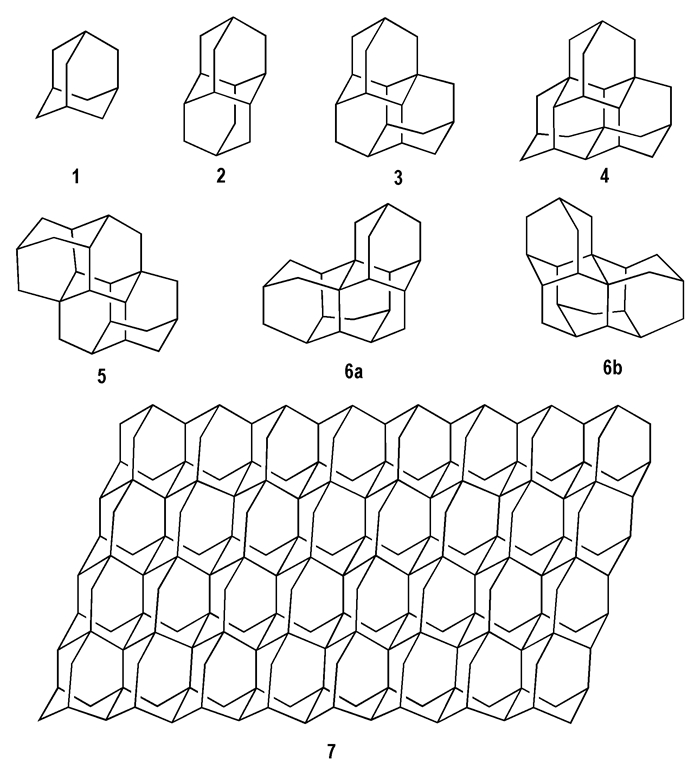
|
Scheme1 The molecular structures of diamondoids |
金刚烷中低聚化合物的性质如表 1所示[6], 从表 1可知, 随着化合物分子量的增加, 金刚烷化合物的结构更加紧密, 对应的密度、比热容、燃烧焓、生成焓以及升华焓均有所增加, 而熔点呈逐渐降低的趋势, 这是由于分子对称性变化所致。高聚衍生物的性能研究报道较少。
| 表 1 金刚烃的主要性质[6] Tab.1 Properties of diamondoids |
在金刚烷分子中引入高能或氧化基团(如硝基、硝酯基、叠氮基、氰基、异氰基等), 能有效提高化合物的能量。其中硝基类化合物尤为重要[7-8]。由于目前已合成的多硝基金刚烷较少, 多硝基金刚烷的性质多经过理论计算得到(见表 2)[7-10], 随着分子量的增大, 硝基数目的增多, 多硝基金刚烷化合物比热容和密度均有所增加。而生成热则不仅与所含硝基数有关, 还受硝基连接位置、相对距离的影响, 如偕二硝基使2, 2-二硝基金刚烷的生成热在二硝基金刚烷的六种同分异构体中最高; 桥头碳效应(减小生成热、增加分子稳定性), 使1, 3-二硝基金刚烷的生成热在二硝基金刚烷的六种同分异构体中最低[9]。值得注意的是, 表 2中生成热最低的是1, 3, 5, 7-四硝基金刚烷, 四个硝基均连在桥头碳上, 分子的对称性很高, 桥头碳效应使其特别稳定, 感度很低[11]它是最早合成出来的多硝基化合物。
硝胺类高能化合物黑索今(环三亚甲基三硝胺, RDX)、奥克托今(1, 3, 5, 7-四硝基-1, 3, 5, 7-四氮杂环辛烷, HMX)都是应用广泛的高能炸药, CL-20(六硝基六氮杂异伍兹烷, HNIW)也获得了实际应用, 与此结构类似多硝基六氮杂金刚烷也是很好的高能侯选物。由于六氮杂金刚烷具有较大的正生成热(236.95 kJ·mol-1[12], 而金刚烷的生成热为负值(-132.85kJ·mol-1 [12], 多硝基六氮杂金刚烷具有比多硝基金刚烷更高的能量特性, 表 3为理论计算得到的多硝基六氮杂金刚烷化合物的性质[12-13]。由表 3中可见, 多硝基六氮杂金刚烷化合物均具有较高的能量特性, 尤其是2, 4, 6, 8, 9, 10-六硝基六氮杂金刚烷的生成热最高。
作为一种多环、非极性烃类分子, 金刚烷可溶于大多数有机溶剂, 且在非极性溶剂中的溶解度普遍高于极性溶剂, 尤其是在结构相似的挂式四氢双环戊二烯(JP-10)和环己烷中溶解度较高。25 ℃条件下单和双金刚烷在烃类溶剂中溶解性见表 4[14-15], 而金刚烷高聚衍生物的溶解性鲜有报道。近年来金刚烷在超临界流体(如二氧化碳、甲烷、乙烷、CClF3、N2O等)中的溶解性能也有一些研究[16-17]。
| 表 4 25 ℃条件下金刚烷和双金刚烷的溶解度[14-15] Tab.4 Solubilities of adamantane and diamantane in liquid solvent at 25 ℃ |
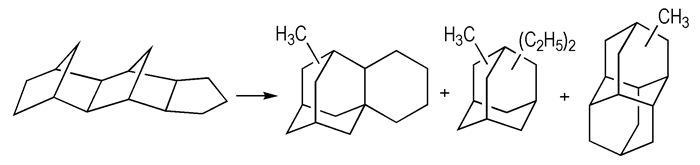
非取代的金刚烷分子虽然具有较高的密度和燃烧热值, 但由于其熔点高, 在燃料中溶解较差, 很难直接作为高能燃料主体或添加剂使用。烷基取代的金刚烷分子具有优良的低温性能, 其原因是由于烷基官能团的引入, 破坏了金刚烷分子高对称性, 同时, 烷基取代基还起到高效增溶的作用, 能促进固态组分在溶液中的溶解[3]。如在固体的二金刚烷中引入三个甲基就可以把高熔点的母体转变成熔点为-54 ℃的低粘度流体[3]。美国mobil公司[3]发现金刚烷类燃料即是富含致密、笼状、菱形多环烷烃分子的复杂混合物, 且主要组分是一金刚烷、二金刚烷、三金刚烷、甲基取代衍生物以及少量的C22H28、C26H32和更高分子量的同系物(scheme 2)。
|
Scheme2 The mobile bay diamondoids[3] |
金刚烷的合成方法主要有:一是AlCl3催化异构法[18-19]; 二是超强酸法(包括液体超强酸法和固体超强酸法)[20-21]; 三是沸石催化异构法[22]; 四是室温离子液体合成法[23], 这些方法各有其优缺点。超强酸催化异构化法具有高活性、高选择性, 但由于超强酸用量很大、反应时间较长, 而且液体超强酸腐蚀性强, 固体超强酸使用寿命较短, 近期内尚难实现工业化[20-21]。从环境友好和降低生产成本的角度来看, 沸石催化异构化法具有一定优势, 日本学者研究的沸石催化工艺已经实现工业化, 但其产率相对较低[22]。国内实现工业化生产的合成路线只有AlCl3法[18], 其缺点是催化剂AlCl3用量大、寿命短、腐蚀性强, 产物难以分离, 收率低。近期研究表明, 在传统工艺基础上添加助催化剂可显著提高收率。如余丽品[19]等以endo-THDCPD为原料、二氯乙烷为溶剂、AlCl3作催化剂(其用量与endo-THDCPD的质量比为0.56)、水作助催化剂(其用量与AlCl3的质量比为0.01), 在80 ℃下反应5 h, 金刚烷的收率达86.4%。
双金刚烷和三金刚烷多采用酸催化重排反应进行合成, 影响转化的主要因素分别为前体的结构和催化剂[5]。1965年Cupas等[24]采用降冰片烯[2+2]聚合物(具有3种立体异构体, 分别为Scheme 3中Ia, Ib, Ic)为原料、三氯化铝为催化剂首次成功合成了双金刚烷, 可能由于前体中含有张力较大的四元环, 因此其收率仅为1%。Gund等[25]采用三溴化铝作为催化剂、正丁基溴作为溶剂, 使双金刚烷收率提高到10%~11%。以Scheme 3中的Id和Ie为原料、三溴化铝、正丁基溴作为催化剂和溶剂, 双金刚烷收率可提高到30%[25]。Gund利用Binor-S(Scheme 3, If)作为起始原料, 经过加氢反应生成一种更利于重排为双金刚烷的前体——四氢Binor-S(C14H20), 再经过酸催化剂重排异构化合成双金刚烷, 收率显著提高[26]。
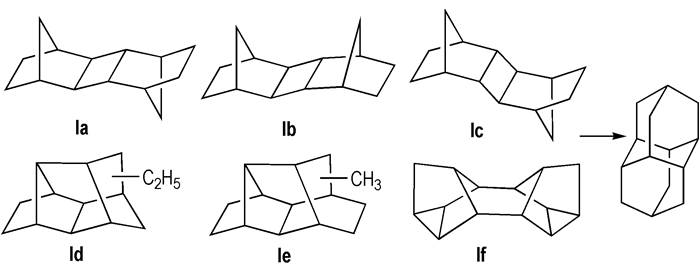
|
Scheme3 Synthesis of diamantane by hydrogenation and isomerization |
Williams等[27]采用环辛四烯的二聚物为起始原料, 在锌铜合金的催化下与CH2I2反应, 使两个双键环化生成三元环; 然后经贵金属Pd催化加氢, 断开两个三元环, 形成分子式为C18H24的七环前体(Scheme 4, IIa); 此前体在AlBr3-HBr-丁基溴构成的酸性催化剂作用下重排为三金刚烷, 产物总收率2%~5%。Hamilton等[28]利用Binor-S为起始原料, 先在氮气保护下、以Pt为催化剂, 250 ℃时催化脱氢生成多环单烯烃(Scheme 4, IIb, IIc); 然后在氢气存在下、以Pt以及三氯化铝为催化剂使脱氢产物与丁二烯发生Diels-Alder反应, 加氢重排合成三金刚烷, 收率为60%。Farooq等[29]直接以七环十八烷(Scheme 4, IId, IIe)为前体, 分别采用3种液体超强酸[B(OSO2CF3)3、F3CSO3H-SbF5(1:1)、F3CSO3H-B(OSO2CF3)3(1:1)]催化合成三金刚烷, 产物收率均在70%左右。
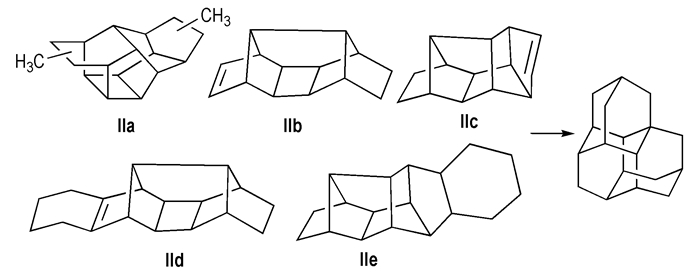
|
Scheme4 Synthesis of triamantane by hydrogenation and isomerization[24] |
虽然烷基金刚烃分子具有优良的性能, 可以作为高能量密度燃料主体或添加剂使用, 但由于其分子结构复杂, 合成并不容易。已见报道的烷基取代多金刚烷的合成主要是高级正构烷烃热裂解和多环烷烃加氢异构化。Gordadze[30]研究表明, 以高级正烷烃为起始原料, 经热裂解反应, 可生成烷基取代的C(10)—C(13)金刚烷类和C(14)—C(16)二金刚烷类衍生物(Scheme 5)。
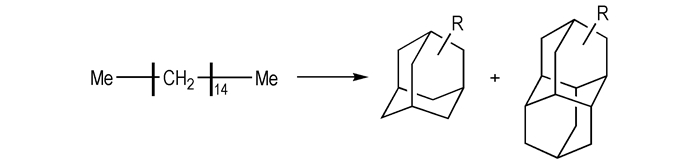
|
Scheme5 Synthesis of diamondoids by high-temperature cracking of higher n-alkanes[30] |
天津大学邹吉军教授[31-32]以四氢三环戊二烯为原料, 选用酸性离子液体作为重排和异构化的催化剂, 合成出烷基单金刚烷和甲基二金刚烷混合物(Scheme 6), 其可作为航天航空用高性能液体碳氢燃料。
3.2 递推法合成金刚烷及其衍生物Brcagiu[33]等以金刚烷为起始原料, 经氧化、环化、异构化等多步反应合成了双金刚烷(如Scheme 7所示)。Burns[34]等在此基础上以双金刚烷为原料, 先后合成了三金刚烷和四金刚烷。该法反应步骤多、路线长、工艺复杂、目标产物收率低。其它高级金刚烷由于分子量增加, 结构更加复杂, 合成难度不断增加, 至今未见报道。
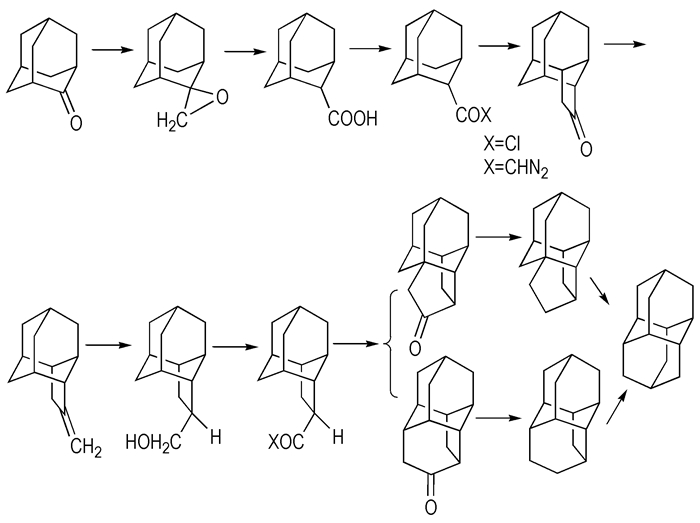
|
Scheme7 Synthetic of diadamantane[33] |
为了改进金刚烷的性能, 使之更适宜于用于高能量密度材料, 一些含能基团如硝基、硝酸酯基等都已引到其骨架上。随着金刚烷环上硝基数目的增加, 其能量和其它爆轰性能也随之提高。金刚烃骨架中含有仲、叔、季3种碳原子(金刚烷和双金刚烷只含有叔、仲), 由于季碳原子上的4个键都是C—C键, 不能功能化。对仲、叔碳原子而言, 通常叔碳原子的活性更高、形成的活性中间体更稳定, 因此金刚烃功能化主要集中于叔碳原子。金刚烃中的叔碳原子易于发生溴代以及氧化反应, 得到的溴代和羟基金刚烷衍生物可以进一步转化。如四硝酸酯基金刚烷可由金刚烷经溴化、水解、酯化反应生成[35](如Scheme 8所示)。
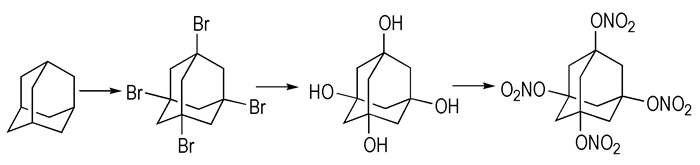
|
Scheme8 Synthetic route to 1, 3, 5, 7-tetranitroxyadamantane[35] |
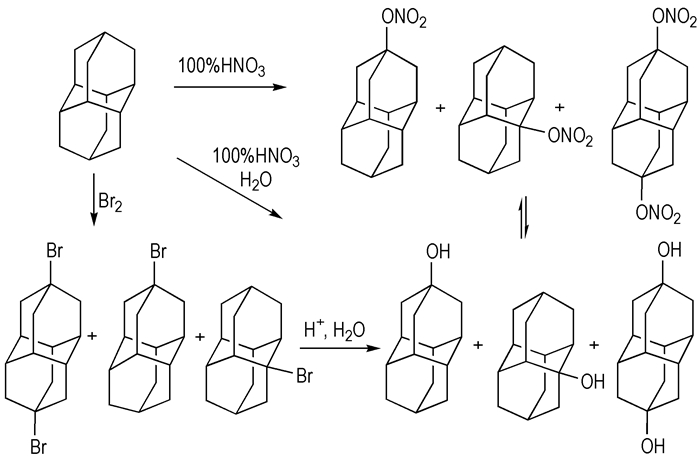
双金刚烷的溴化产物多为单取代或轴对称的双取代产物[36]。羟基双金刚烷可以通过溴代双金刚烷水解获得[37], 或直接由双金刚烷氧化(氧化剂为间氯过氧苯甲酸、三甲基过氧化硅或者高锰酸钾)得到, 但后者的产率较低。双金刚烷用100%硝酸氧化后再水解可以得到较高产率的羟基化合物。其中短时间内得到的产物多为单羟基, 长时间得到双羟基产物。羟基产物经硝化反应可得硝基酯衍生物[38](如Scheme 9所示)。
|
Scheme9 Synthetic route to nitrate diadamantane[38] |
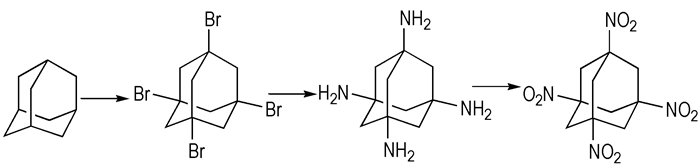
1, 3, 5, 7-四硝基金刚烷是一种有前景的钝感耐热含能材料。Sollott以金刚烷为原料, 经溴化、碘置换、光解酰化、水解、中和、氧化六步制得了1, 3, 5, 7-四硝基金刚烷, 总产率为7.8%[39]。Sollott合成法[39]中使用了昂贵的二碘甲烷以及大量的乙腈, 成本高、毒性大、环境污染大。近年来, 南京理工大学罗军课题组[40]对Sollott合成法进行了改进, 将第三步光解酰化改为AIBN自由基引发, 总产率提高到16.8%。具体工艺是先按经典方法合成1, 3, 5, 7-四溴金刚烷, 然后氨解反应制成1, 3, 5, 7-四氨基金刚烷, 再氧化得到1, 3, 5, 7-四硝基金刚烷(如Scheme 10所示)。此方法仅三步反应, 提高了收率, 降低了反应成本(其中尿素氨解总产率可达到28.5%)。此外, 多硝基取代双金刚烷也可由Sollott法制得, 文献[41]就报道了四硝基取代双金刚烷的合成路线。
|
Scheme10 Synthetic route to 1, 3, 5, 7-tetranitroadamantane[40] |
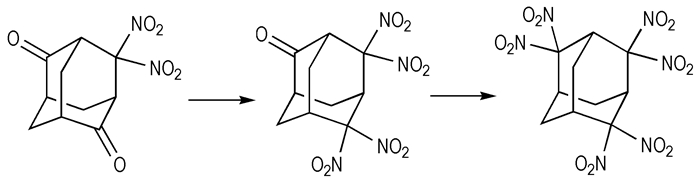
Scholl反应是合成携二硝基的经典反应。如2, 2, 4, 4-四硝基金刚烷可以由4, 4-二硝基金刚肟经Scholl反应转化而成[42]。已有文献报道采用4, 4, 6, 6-四硝基金刚烷-2-酮和4, 4-二硝基金刚烷-2, 6-二酮为原料合成了2, 2, 4, 4, 6, 6-六硝基金刚烷[43](如Scheme 11所示)。
|
Scheme11 Synthetic route of 2, 2, 4, 4, 6, 6-hexanitroadamantane[43] |
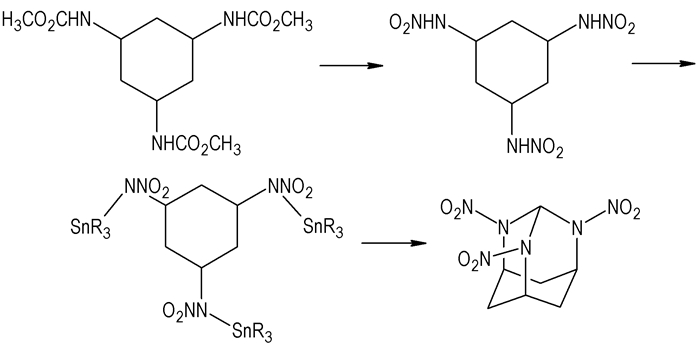
前文提到多硝基多氮杂金刚烷具有很好的能量属性, 是很好的高能材料候选物。但目前仅有三硝基三氮杂金刚烷的合成报道, 即非笼状多硝铵化合物可经环化反应合成多硝基多氮杂金刚烷, 如由三硝胺基环己烷合成三硝基三氮杂金刚烷[44](如Scheme 12所示)。
|
Scheme12 Synthetic route of 2, 4, 10-trinitro-2, 4, 10-triazaadamantane[44] |
燃料RF-1的主要成分是一金刚烷衍生物, RF-2包含一金刚烷、二金刚烷和三金刚烷衍生物, RF-3主要为二金刚烷和三金刚烷衍生物, RF-4大部分为三金刚烷衍生物。表 5列出了mobil公司油气田中产出的RF系列金刚烷衍生物燃料的主要性能, 其中, 随着平均碳原子数的增加, 燃料的密度、闪点、最低泵送温度和热值均增加。
| 表 5 Mobil公司金刚烷衍生物燃料和美军JP-10燃料的主要性质[3] Tab.5 Properties of Mobil diamondoid fuels and JP-10 |
RF系列金刚烷燃料中, 烷基取代金刚烷衍生物大幅降低了分子熔点, 低温性能有所提高, 且兼有高效增溶作用, 能促进固态组分在溶液中的溶解。此外, RF系列金刚烷类燃料的质量热值与JP-10相当, 但体积热值却比JP-10大, 这是金刚烷分子结构致密性的结果。引擎测试结果表明, 在较大的空燃比范围内, RF-1、RF-2、RF-3单位体积燃烧释放的能量远远大于JP-10, 证明了金刚烷类燃料具有提高航程的巨大潜力[3]。美国已实现RF系列燃料的工业化生产[3], 但由于其为混合物、结构复杂, 且属于天然燃油的富集提取, 产出有限, 价格昂贵; 此外, 与JP-10相比, RF系列燃料冰点高, 低温性能相对较差, 进而限制了其大规模应用。
人工合成金刚烷高能燃料的研究也已取得了一定成果。Gordadze[30]课题组报道了正烷烃热裂解合成金刚烷的可能性; 天津大学邹吉军[31-32]报道多环烃类化合物经重排异构化可合成高性能液体金刚烷燃料, 所合成的高能燃料含有质量不低于50%的金刚烷化合物, 20 ℃下密度不小于1 g·cm-3, 体积热值不小于42 MJ·L-1, 冰点不高于-70 ℃。
5 展望高能量密度金刚烷燃料的合成已经取得了一定进展, 但绿色、廉价、稳定的合成金刚烷烃类衍生物的工艺值得进一步研究, 尤其是通过理论计算和分子设计, 合成出能量密度更高、低温性能良好的高级金刚烷烃类衍生物值得期待。同时, 如能合成多硝基金刚烷(六硝基以上)或2, 4, 6, 8, 9, 10-六硝基六氮杂金刚烷, 其不仅是理想的高能量密度单质炸药, 也可以在高能量密度推进体系中用作性能改进的氧化组分。此外, 以低温性能良好的烃类化合物为基础燃料, 添加高能量密度的金刚烷烃类衍生物或含有轰爆性能的多硝基金刚烷衍生物, 研究燃料的复配工艺, 开发出适用于不同使用环境的燃料品种值得期待。
| [1] |
刘飞, 薛金强, 王连心, 等. 高密度烃燃料合成与复配研究进展[J].
化学推进剂与高分子材料, 2012(02): 35-42. LIU Fei, XUE Jin-qiang, WANG Lian-xin, et al. Research progress in synthesis and blending of high-density hydrocarbon fuels[J]. Chemical Propellants & Polymeric Materials, 2012(02): 35-42. DOI:10.3969/j.issn.1672-2191.2012.02.007 |
| [2] |
杜新胜, 朱玲, 张霖. C5原料合成高密度烃类燃料的研究进展[J].
化工中间体, 2013(06): 8-12. DU Xin-sheng, ZHU Ling, ZHANG Lin. The research progress of C5 synthesized from high-density hydrocarbon fuels[J]. Chemical Intermediate, 2013(06): 8-12. |
| [3] |
Chung H S, Chen C S H, Kremer R A, et al. Recent developments in high-energy density liquid hydrocarbon fuels[J].
Energy & Fuels, 1999, 13: 641-649. |
| [4] |
Dahl J E, Liu S G, Carlson R M K. Isolation and structure of higher diamondoids, nanometer-sized diamond molecules[J].
Science, 2003, 299: 96-99. DOI:10.1126/science.1078239 |
| [5] |
Hartmut S, Andrey A F, Peter R S. Diamonds are a chemists best friend: diamondoid chemistry beyond adamantane[J].
Angew Chem Int Ed, 2008, 47: 1022-1036. DOI:10.1002/(ISSN)1521-3773 |
| [6] |
朱华, 郭建维, 刘卅, 等. 金刚烃类化合物研究进展(Ⅰ)结构与性质[J].
化工进展, 2011, 30(3): 566-572. ZHU Hua, GUO Jian-wei, LIU Sa, et al. Research progress of diamondoids(Ⅰ): Structure and properties[J]. Chemical Industry and Engineering Progress, 2011, 30(3): 566-572. |
| [7] |
Zauer E A, Zauer O A. Enthalpies of formation of nitro-, nitroxy-, and nitrosoadamantanes[J].
Russian Journal of General Chemistry, 2010, 80(10): 1974-1976. DOI:10.1134/S1070363210100166 |
| [8] |
XU Xiao-juan, XIAO He-ming, GONG Xue-dong, et al. Theoretical studies on the vibrational spectra, thermodynamic properties, detonation properties, and pyrolysis mechanisms for polynitroadamantanes[J].
J Phys Chem A, 2005, 109: 11268-11274. DOI:10.1021/jp040472q |
| [9] |
王飞, 许晓娟, 肖鹤鸣, 等. 多硝基金刚烷生成热和稳定性的理论研究[J].
化学学报, 2003, 61(12): 1939-1943. WANG Fei, XU Xiao-juan, XIAO He-ming, et al. Theoretical studies on heat of formation and stability for polynitroadamantanes[J]. Acta Chimica Sinica, 2003, 61(12): 1939-1943. DOI:10.3321/j.issn:0567-7351.2003.12.010 |
| [10] |
许晓娟, 肖鹤鸣, 居学海, 等. 多硝基金刚烷红外光谱和热力学性质的理论研究[J].
含能材料, 2005, 13(1): 40-44. XU Xiao-juan, XIAO He-ming, JU Xue-hai, et al. Theoretical study on the vibrational spectra, thermodynamic properties for polynitroadamantanes[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2005, 13(1): 40-44. |
| [11] |
Sollott G P, Gilbert E E. A facile route to 1, 3, 5, 7-tetraaminoadamantane. Synthesis of 1, 3, 5, 7-tetranitroadamantane[J].
J Org Chem, 1980, 45(26): 5405-5408. DOI:10.1021/jo01314a051 |
| [12] |
XU Xiao-juan, XIAO He-ming, JU Xue-hai, et al. Computational studies on polynitrohexaazaadmantanes as potential high energy density materials[J].
J Phys Chem A, 2006, 110: 5929-5933. DOI:10.1021/jp0575557 |
| [13] |
XU Xiao-juan, ZHU Wei-Hua, XIAO He-ming. Theoretical predictions on the structures and properties for polynitrohexaazaadamantanes (PNHAAs) as potential high energy density compounds (HEDCs)[J].
Journal of Molecular Structure: Theochem, 2008, 853: 1-6. DOI:10.1016/j.theochem.2007.11.034 |
| [14] |
刘卅, 郭建维. 金刚烷的结构、溶解性及热力学性质[J].
含能材料, 2006, 14(6): 485-490. LIU Sa, GUO Jian-wei. Structure analysis, solubility and thermodynamics properties of adamantane[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 485-490. |
| [15] |
Reiser J, McGregor E, Jones J, et al. Adamantane and diamantane; phase diagrams, solubilities, and rates of dissolution[J].
Fluid Phase Equilibria, 1996, 117(1-2): 160-167. DOI:10.1016/0378-3812(95)02949-4 |
| [16] |
Smith V S, Teja A S. Solubilities of diamondoids in supercritical solvents[J].
Journal of Chemical and Engineering Data, 1996, 41(4): 923-925. DOI:10.1021/je960085c |
| [17] |
Thomas K, Kai O L, Dirk T, et al. Correlation of the solubility of low-volatile organic compounds in near-and supercritical fluids[J].
Journal of Supercritical Fluids, 2002, 23: 209-224. DOI:10.1016/S0896-8446(02)00003-7 |
| [18] |
张香文, 邱立勤, 陶然, 等. 三氯化铝催化体系合成金刚烷[J].
石油化工, 1999, 28(8): 546-548. ZHANG Xiang-wen, QIU Li-qin, TAO Ran, et al. Studies on the AlCl3 catalyst systems for the synthesis of adamantine[J]. Petrochemical Technology, 1999, 28(8): 546-548. |
| [19] |
余丽品, 武文良, 周志伟. AlCl3-微量水催化体系两步法合成金刚烷[J].
南京工业大学学报:自然科学版, 2006, 28(3): 86-89. YU Li-pin, WU Wen-liang, ZHOU Zhi-wei. Synthesis of adamantane using AlCl3-trace water catalyst system by two steps[J]. Journal of Nanjing University of Technology, 2006, 28(3): 86-89. |
| [20] |
蒋瑞六, 蒋持衡. C5馏分的综合利用—超强酸合成金刚烷[J].
江苏化工, 1996, 24(6): 25-26. JIANG Rui-liu, JIANG Chi-heng. Comprehensive utilization of C5-fraction-synthesis of adamantine by ultrastrony acid catalyst[J]. Jiangsu Chemical Industry, 1996, 24(6): 25-26. |
| [21] |
Kawai T, Ueno W, Fujiura R. Process for producing adamantane compound: US 6472575[P]. 2002.
|
| [22] |
滕奕刚, 张志勇, 陈兴强, 等. 金刚烷合成技术进展[J].
化学推进剂与高分子材料, 2011, 9(4): 49-52. TENG Yi-gang, ZHANG Zhi-yong, CHEN Xing-qiang, et al. Technique progress in synthesis of adamantane[J]. Chemical Propellants & Polymeric Materials, 2011, 9(4): 49-52. |
| [23] |
Huang M Y, Wu J C, Shieu F S, et al. Isomerization of exo-tetrahydrodicyclopentadiene to adamantane using an acidity-adjustable chloroaluminate ionic liquid[J].
Catalysis Communications, 2009, 10(13): 1747-1751. DOI:10.1016/j.catcom.2009.05.030 |
| [24] |
Cupas C, Schleyer P V R, Trecker D J. Congressane[J].
J Am Chem Soc, 1965, 87(4): 917-918. DOI:10.1021/ja01082a042 |
| [25] |
Wingert W S. GC-MS analysis of diamondoid hydrocarbons in smackover petroleums[J].
Fuel, 1992, 71: 37-43. DOI:10.1016/0016-2361(92)90190-Y |
| [26] |
Gund T M, Williams V Z J, Osawa E, et al. A convenient, high-yield preparation of diamantine(congressane)[J].
Tetrahedron Lett, 1970, 11: 3877-3880. DOI:10.1016/S0040-4039(01)98613-7 |
| [27] |
Gund T M, Osawa E, Williams Van Z J, et al. Diamantane. I. Preparation of diamantane. Physical and spectral properties[J].
J Org Chem, 1974, 39(20): 2979-2987. DOI:10.1021/jo00934a009 |
| [28] |
Hamilton R, McKervey M A, Rooney J J, et al. Gas-phase reactions on platinum-short synthesis of triamantane[J].
J Chem Soc Chem Commun, 1976, 24: 1027-1028. |
| [29] |
Farooq O, Farnia S M F, Stephenson M, et al. Superacid-catalyzed near-quantitative isomerization of C4n+6H4n+12(n=1-3) polycyclic precursors to diamondoid cage hydrocarbons promoted by 1-haloadamantanes and sonication[J].
J Org Chem, 1988, 53: 2840-2843. DOI:10.1021/jo00247a035 |
| [30] |
Gordadze G N, Giruts M V. Synthesis of adamantane and diamantane hydrocarbons by high-temperature cracking of higher n-alkanes[J].
Neftekhimiya, 2008, 48(6): 412-417. |
| [31] |
Wang L, Zou J J, Zhang X W, et al. Rearrangement of tetrahydrotricyclopentadiene using acidic ionic liquid: synthesis of diamondoid fuel[J].
Energy Fuels, 2011, 25: 1342-1347. DOI:10.1021/ef101702r |
| [32] |
Ma T T, Feng R, Zou J J, et al. Ionic liquid catalytic rearrangement of polycyclic hydrocarbons: a versatile route to alkyl-diamondoid fuels[J].
Ind Eng Chem Res, 2013, 52: 2486-2492. DOI:10.1021/ie303227g |
| [33] |
Fărcasiu D, Bohm H, Schleyer P V R. Step wise elaboration of diamondoid hydrocarbons. Synthesis of diamantane from adamantine[J].
J Org Chem, 1977, 42(1): 96-102. DOI:10.1021/jo00421a018 |
| [34] |
Burns W, McKervey M A, Mitchell T R B, et al. A new approach to the construction of diamondoid hydrocarbons. Synthesis of anti-tetramantane[J].
J Am Chem Soc, 1978, 100(3): 906-911. DOI:10.1021/ja00471a041 |
| [35] |
Gilbert E E. 1, 3, 5, 7-Tetranitroxyadamantane: US4476060[P]. 1983.
|
| [36] |
Schwertfeger H, Fokin A A, Schreiner P R. Diamonds are a chemist′s best friend: Diamondoid chemistry beyond adamantane[J].
Angew Chem Int Ed, 2008, 47: 1022-1036. DOI:10.1002/(ISSN)1521-3773 |
| [37] |
Davis M C, Liu S. Selective apical bromination of diamantane and conversion to the dihydroxy and dicarboxylic acid derivatives[J].
Synth Commun, 2006, 36(23): 3509-3514. DOI:10.1080/00397910600943428 |
| [38] |
Fokina N A, Tkachenko B A, Merz A, et al. Hydroxy derivatives of diamantine, triamantane, and [121]tetramantane: Selective preparation of bis-apical derivatives[J].
Eur J Org Chem, 2007(28): 4738-4745. |
| [39] |
Gilbert E E, Sollott G P. 1, 3, 5, 7-Tetranitroadamantane and process for preparing same: US4329522[P]. 1982.
|
| [40] |
罗军, 李娅琼. 用改进的Sollott法合成1, 3, 5, 7-四硝基金刚烷[J].
火炸药学报, 2011, 05: 13-15. LUO Jun, LI Ya-qiong. Synthesis of 1, 3, 5, 7-Tetranitroadmantane via modified Sollott′s route[J]. Chinese Journal of Explosive & Pellant, 2011, 05: 13-15. DOI:10.3969/j.issn.1007-7812.2011.05.004 |
| [41] |
Sollott G P, Gilbert E E. 1, 4, 6, 9-Tetranitrodiamantane: US4535193[P]. 1985.
|
| [42] |
Dave P R, Ferraro M, Ammon H L, et al. Synthesis of 2, 2, 4, 4-tetranitroadamantane[J].
J Org Chem, 1990, 55(14): 4459-4461. DOI:10.1021/jo00301a047 |
| [43] |
Dave P R. Process for the preparation of 2, 2, 4, 4, 6, 6-hexanitroadamantane: US5202508[P]. 1992.
|
| [44] |
Arnold T N, Andrew P C, Stephen L C, et al. Synthesis of polyazapolycyclic caged polynitramines[J].
Tetrahedron, 1998, 54: 11793-11812. DOI:10.1016/S0040-4020(98)83040-8 |
The development and progress about structures, properties, syntheses and applications of high energetic density diamondoid compounds were summarized.