双呋咱并吡嗪类化合物是近年来研究较多的一类新型呋咱化合物, 其分子结构对称, 且带有两个或更多的呋咱官能团, 多数具有较高的熔点、密度、能量和正生成焓, 有着广泛的应用前景[1-2]。俄罗斯于20世纪90年代末起开展了大量的研究工作, 得到了以4, 8-二硝基双呋咱并[3, 4-b:3′, 4′-e]吡嗪(PIPER)为代表的一系列高能化合物[3]。PIPER计算密度为2.00 g·cm-3, 生成焓为774 kJ·mol-1, 计算爆速和爆压分别为9700 m·s-1和45 GPa, 性能十分优异, 但由于热力学稳定性不高, 应用受限, 因此探索高能且稳定的双呋咱并吡嗪类化合物具有重要意义[4-5]。
4H, 8H-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(DFP)是合成各种双呋咱并吡嗪类衍生物的母体化合物, 其自身具有较强的富电子性, 易与亲电试剂发生取代反应得到不同的N-取代衍生物。双呋咱并吡嗪衍生物结构对称性高, 氮氧含量丰富, 作为含能材料有巨大潜力, 但目前研究仅限于合成工作[3, 6], 未涉及热性能和物化及爆轰性能研究。本研究以DFP为原料, 参考文献[6-7], 经过成盐、取代、加成、硝化、氯化、叠氮化等反应, 在国内首次合成了六种双呋咱并吡嗪衍生物(Ⅰ~Ⅵ); 利用红外光谱、核磁共振和元素分析等鉴定了各化合物的结构; 采用差示扫描量热(DSC)分析、热重(TG)法, Gaussian 09[9]和VLW程序[10]考察了化合物Ⅱ、Ⅳ、Ⅵ的热性能和部分物化及爆轰性能, 为该类化合物的进一步研究和应用提供了数据支持。
2 实验部分 2.1 试剂与仪器DFP由实验室自制; 3-氯-4-硝基呋咱根据文献方法制得[8]; 100%硝酸由工业级硝酸蒸馏制得; 甲醛水溶液(37%)、氢氧化钾、乙酸酐、氯化亚砜、叠氮化钠、三乙胺、丙酮、甲醇, 石油醚(60~90 ℃), 乙酸乙酯均为分析纯; 乙腈为色谱纯。
ZF-Ⅱ型三用紫外仪, 上海市安亭电子仪器厂; NEXUS 870型傅里叶变换红外光谱仪, 美国热电尼高力公司; AV 500型(500MHz)超导核磁共振仪, 瑞士BRUKER公司; VARIO-EL-3型元素分析仪, 德国EXEMENTAR公司; LC-2010A型高效液相色谱仪(归一化法), 日本岛津公司; Q-200型差示扫描量热仪, 美国TA公司; TA 2950热重仪, 美国Nicolet公司; X-6型显微熔点测定仪, 北京泰克仪器有限公司。
2.1.1 差示扫描量热(DSC)实验美国TA公司Q-200型差示扫描量热仪, 动态氮气气氛, 压力: 0.1 MPa(化合物Ⅳ、Ⅵ), 1 MPa(化合物Ⅱ), 升温速率为10 ℃·min-1, 试样量0.5~1.0 mg, 试样皿为铝盘。
2.1.2 热重(TG)实验美国Nicolet公司TA2950热重仪, 动态氮气气氛; 温度范围为30~500 ℃; 升温速率: 10 ℃·min-1; 试样量约1.0 mg, 试样皿为铝盘。
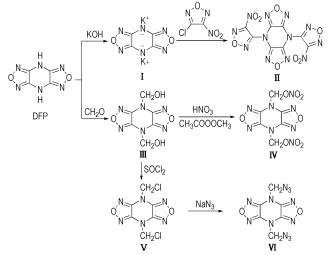
2.2 合成路线
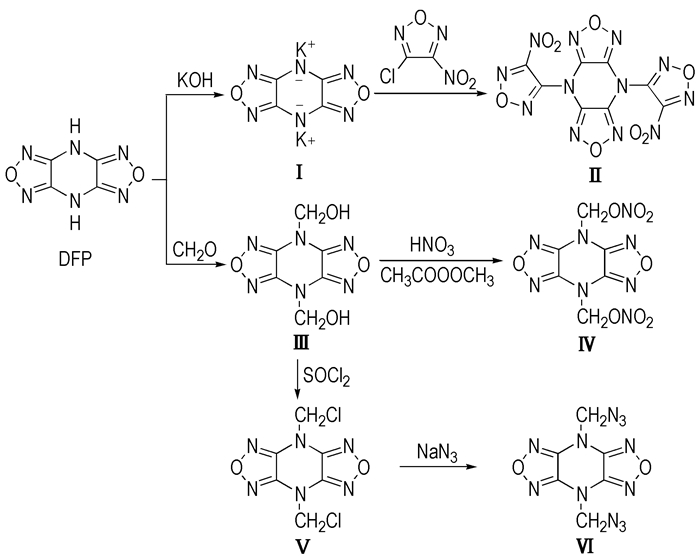
|
Scheme 1 |
将DFP(3.32 g, 20.0 mmol)溶于60 mL甲醇中, 10 ℃下向其中缓慢滴加氢氧化钾(2.46 g, 44.0 mmol)的水溶液(6 mL), 于室温下搅拌0.5 h, 有大量黄色固体生成。停止反应, 过滤, 所得固体用甲醇和丙酮各洗一遍, 干燥得黄色粉末状固体4.43 g, 收率91.6%, m.p: 240~241 ℃(分解)。
13C NMR (DMSO-d6, 125 MHz), δ: 157.66; IR (KBr, ν/cm-1): 1557 (C=N), 1532, 1381, 1341, 1011 (呋咱环), 887, 774; Anal. Calcd for C4K2N6O2: C 19.83, N 34.69; Found C 19.78, N 33.67。
2.3.2 4, 8-二(硝基呋咱基)-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(Ⅱ)的合成将化合物Ⅰ (0.73 g, 3 mmol)分散于无水乙腈(15 mL)中, 向其中加入3-氯-4-硝基呋咱(1.34 g, 9 mmol), 于80 ℃下搅拌反应12 h。冷却, 过滤除去无机盐, 滤液经旋蒸除去溶液, 粗品经柱色谱分离(洗脱剂为石油醚:乙酸乙酯=5:1), 得到白色粉末状固体0.37 g, 收率31.5%, m.p: 228~231 ℃。
13C NMR (DMSO-d6, 125 MHz), δ: 147.47, 145.94, 144.04; IR (KBr, ν/cm-1): 1643, 1585 (C=N), 1557 (C=N), 1491 (C—NO2), 1408, 1385 (C—NO2), 1333, 1156, 1103 (呋咱环), 1020 (呋咱环), 842; Anal. Calcd for C8N12O8: C 24.50, N 42.86; Found C 24.16, N 43.73。
2.3.3 4, 8-二(羟甲基)-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(Ⅲ)的合成将DFP(4.15 g, 25 mmol)分散于甲醛水溶液(37%, 10 mL)中, 加入2.5 mL水, 超声震荡反应10 min, 室温下继续搅拌反应24 h。过滤得到沉淀物, 分别用水洗三遍, 丙酮洗一遍, 干燥得到白色粉末状固体4.98 g, 收率88.1%, m.p: 309~313 ℃。
1H NMR (DMSO-d6, 500 MHz), δ: 7.10 (b, 2H, OH); 5.20 (s, 4H, CH2); 13C NMR (DMSO-d6, 125 MHz), δ: 146.74, 71.23; IR (KBr, ν/cm-1): 3404 (O—H), 1654, 1594 (C=N), 1463, 1414, 1355, 1065 (呋咱环), 1020, 998, 827, 705; Anal. Calcd for C6H6N6O4: C 31.87, H 2.67, N 37.16; Found C 31.54, H 2.67, N 36.86。
2.3.4 4, 8-二(甲基硝酸酯基)-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(Ⅳ)的合成将100%硝酸(3 mL)与乙酸酐(6 mL)混合, 10 ℃水浴中搅拌10 min, 分批加入化合物(1.13 g, 5 mmol), 20 ℃下反应2 h。反应结束后将硝化液倒入冰水(30 g)中, 生成大量白色沉淀。过滤并用水(4×10 mL)洗涤, 产物在水和丙酮的混合溶液里重结晶, 得白色粉末状固体1.06 g, 收率67.2%, m.p: 197.5 ℃ (DSC, 10 ℃·min-1, 分解)。
1H NMR (DMSO-d6, 500 MHz), δ: 6.28 (s, 4H, CH2); 13C NMR (DMSO-d6, 125 MHz), δ: 146.64, 75.80; IR (KBr, ν/cm-1): 3038, 2934, 1667 (O—NO2), 1596 (C=N), 1433, 1408, 1371, 1280 (O—NO2), 1048 (呋咱环), 1013, 954, 826; Anal. Calcd for C6H4N8O8: C 22.79, H 1.28, N 35.44; Found C 22.65, H 1.34, N 35.98。
2.3.5 4, 8-二(氯甲基)-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(Ⅴ)的合成圆底烧瓶中加入化合物Ⅲ (2.26 g, 10 mmol)和氯化亚砜(10 mL), 90 ℃下回流反应4 h。反应结束后旋蒸除去剩余的氯化亚砜, 剩余固体于真空下用氢氧化钾干燥, 在水和丙酮的混合溶液里重结晶, 得到白色粉末状固体1.97 g, 收率74.8%, m.p: 263~265 ℃。
1H NMR (DMSO-d6, 500 MHz), δ: 5.93 (s, 4H, CH2); 13C NMR (DMSO-d6, 125 MHz), δ: 146.77, 56.53; IR (KBr, ν/cm-1): 3054, 1646, 1591 (C=N), 1444, 1415, 1390, 1301, 1278, 1056 (呋咱环), 970, 824 (C—Cl), 696, 682; Anal. Calcd for C6H4N6O2Cl2: C 27.40, H 1.53, N 31.95; Found C 27.63, H 1.64, N 32.12。
2.3.6 4, 8-二(甲基叠氮基)-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(Ⅵ)的合成圆底烧瓶中加入化合物Ⅴ(0.66 g, 2.5 mmol), 叠氮化钠(0.42 g, 6.5 mmol)和丙酮(5 mL), 室温下搅拌反应24 h。反应结束后旋蒸除去丙酮, 所得产品经柱色谱分离(洗脱剂为石油醚:乙酸乙酯=5:1), 得到白色粉末状固体0.56 g, 收率81.0%, m.p: 125~127 ℃。
1H NMR (DMSO-d6, 500 MHz), δ: 5.36 (s, 4H, CH2); 13C NMR (DMSO-d6, 125 MHz), δ: 147.75, 62.80; IR (KBr, ν/cm-1): 3033, 2147, 2109 (N3), 1651, 1592 (C=N), 1443, 1412, 1355, 1308, 1232, 1141, 1032 (呋咱环), 1000, 912, 874, 821; Anal. Calcd for C6H4N12O2: C 26.09, H 1.46, N 60.86; Found C 26.75, H 1.49, N 60.72。
3 结果与讨论 3.1 4H, 8H-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(DFP)的反应性DFP分子中由于含有两个较强吸电子呋咱环, 导致分子结构中的两个亚氨基具有一定酸性,与KOH反应形成氮负离子,亲核性增强, 容易与带有活泼氢或卤素的亲电试剂(如烯烃、卤代烃、酰基卤等)发生取代反应, 得到双取代的衍生物。DFP及其衍生物分子中的呋咱环相对稳定, 通常条件下不会参与反应, 但在强酸性条件下加热会导致一个呋咱环开环, 因此在硝化反应时应注意掌握反应条件。
以上数种双呋咱并吡嗪衍生物中, 化合物Ⅱ、Ⅳ、Ⅵ分别含有硝基呋咱、硝酸酯及叠氮官能团, 氮氧含量相较其他化合物更高, 更适宜应用于含能材料。因此以下对化合物Ⅱ、Ⅳ、Ⅵ的热性能和物化爆轰性能进行了详细研究和探讨。
3.2 双呋咱并吡嗪化合物Ⅱ、Ⅳ、Ⅵ的热性能 3.2.1 4, 8-二(硝基呋咱基)-双呋咱并[3, 4-b:3′, 4′-e]吡嗪(Ⅱ)的热性能图 1为化合物Ⅱ在1 MPa(加压)下的DSC曲线, 从图 1中可以看出, 该曲线有一个吸热峰和一个放热峰, 显示了该物质的热分解过程。Tp1=230.4 ℃时的尖锐吸热峰为该物质的熔化峰, 显示该物质的熔点为230.4 ℃; Tp2=318.3 ℃时的放热峰为该物质的热分解放热峰, 该峰型较宽, 表明分解经历了较长时间。
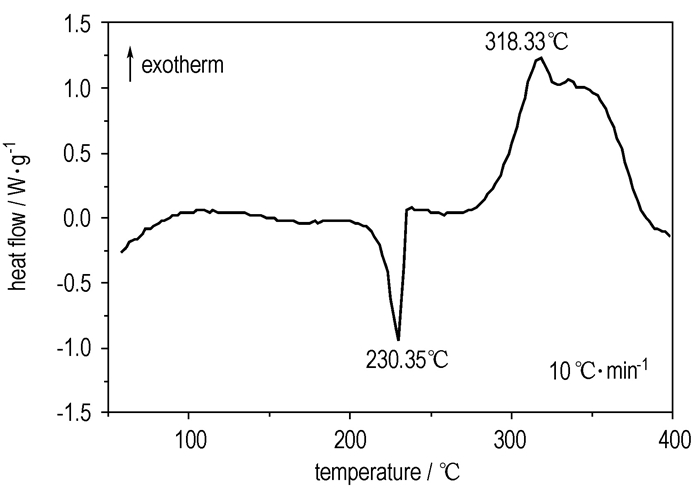
|
图 1 化合物Ⅱ的DSC曲线 Fig.1 DSC curve of compound Ⅱ at 1 MPa |
图 2为化合物Ⅱ在0.1 MPa(常压)下的TG/DTG曲线, 由图 2知, 在温度低于124.8 ℃时, 该物质失重较少, 累积失重仅为0.5%;当温度升至150 ℃后该物质开始失重, 直至296.0 ℃时热分解累积失重达91.9%。该化合物常压下的TG分析结果与加压条件下的DSC结果不同, 说明在不同测试条件下化合物Ⅱ的热力学行为不同。
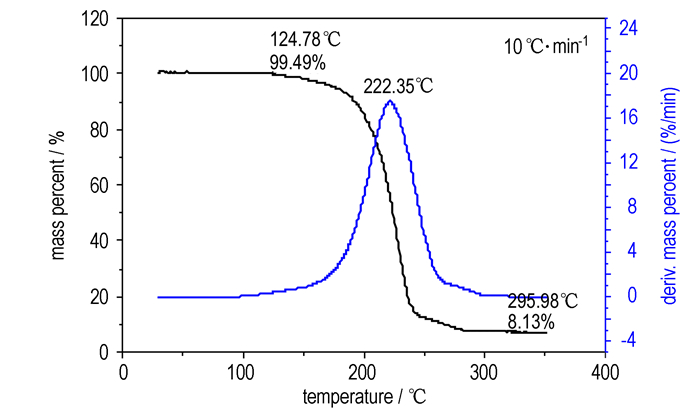
|
图 2 化合物Ⅱ的TG-DTG曲线 Fig.2 TG-DTG curve of compound Ⅱ at 0.1 MPa |
图 3为化合物Ⅳ在常压, 10 ℃·min-1下的DSC曲线。从图 3上未观察到化合物Ⅳ的吸热峰, 197.5 ℃时有一个尖锐的放热峰, 为该物质的热分解放热峰, 说明化合物Ⅳ未达到熔点即开始分解。

|
图 3 化合物Ⅳ的DSC曲线 Fig.3 DSC curve of compound Ⅳ at 0.1 MPa |
图 4为化合物Ⅳ在常压下的TG/DTG曲线。从图 4中可以看出该试样的热分解分为两个阶段, 但是两个过程又没有完全分开。在温度接近200 ℃时, 为该物质快速失重第一阶段, 至225.0 ℃累积失重为47.2%;第二阶段为缓慢失重过程, 至497.9 ℃时热分解累积失重达85.3%。由于DSC曲线上未出现吸热熔化峰, 因此DSC的放热峰和DTG的失重峰均为该物质的固相分解过程。

|
图 4 化合物Ⅳ的TG-DTG曲线 Fig.4 TG-DTG curve of compound Ⅳ at 0.1 MPa |
图 5为化合物Ⅵ在常压、10 ℃·min-1下的DSC曲线。图 5中Tp1=126.1℃时的尖锐吸热峰为该物质的熔化峰, 显示该物质的熔点; Tp2=250.5 ℃时的放热峰为该物质的第一个热分解放热峰, Tp3=297.3 ℃时的放热峰为该物质的第二个热分解放热峰。

|
图 5 化合物Ⅵ的DSC曲线 Fig.5 DSC curve of compound Ⅵ at 0.1 MPa |
图 6为化合物Ⅵ在常压下的TG/DTG曲线。从图 6中可以看出该试样的热分解分为独立的两个阶段。在温度低于148.4 ℃时, 该物质失重较少, 累积失重仅为2.5%;失重第一阶段的峰值出现在214.3 ℃, 至241.5 ℃时累积失重为52.4%;紧接着为失重第二阶段, 至315.5 ℃时热分解累积失重达94.4%。DSC曲线上的放热峰和TG-DTG曲线上的失重峰均为该物质的液相分解过程。
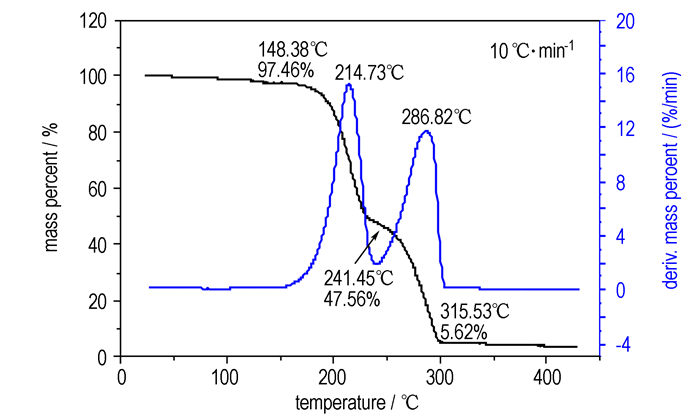
|
图 6 化合物Ⅵ的TG-DTG曲线 Fig.6 TG-DTG curve of compound Ⅵ at 0.1 MPa |
采用Gaussian 09[9]计算得到双呋咱并吡嗪化合物Ⅱ、Ⅳ、Ⅵ的密度(ρ)和生成焓(ΔHf0), 采用VLW[10]程序计算得化合物Ⅱ、Ⅳ、Ⅵ的爆速(D)和爆压(p), 并与HMX[11]进行了比较, 结果见表 1。
| 表 1 化合物Ⅱ、Ⅳ、Ⅵ和HMX的物化和爆轰性能 Tab.1 Performances of compounds Ⅱ、Ⅳ、Ⅵ and HMX |
从表 1中可以看出, 化合物Ⅳ的预估性能最为优异。其计算密度达2.00 g·cm-3, 爆压43 GPa, 均高于HMX, 而爆速与HMX接近。化合物Ⅱ和Ⅵ具有很高的正生成焓, 其中Ⅱ的生成焓高达1239 kJ·mol-1, 有望应用于推进剂组分中。
4 结论(1) 以DFP为原料, 经成盐、取代、加成、硝化、氯化、叠氮化等反应合成了六种双呋咱并吡嗪衍生物(Ⅰ~Ⅵ), 使用红外光谱、核磁共振和元素分析对每个化合物进行了表征。
(2) 通过DSC和TG手段考察了化合物Ⅱ、Ⅳ、Ⅵ的热稳定性, 其热分解峰温分别为318.3, 197.5, 250.5℃, 表明该类型的化合物具有较好的热稳定性。
(3) 通过Gaussian 09与VLW程序计算得到了化合物Ⅱ、Ⅳ、Ⅵ的部分物化及爆轰性能, 其中化合物Ⅳ的密度为2.00 g·cm-3, 爆压43 GPa, 均高于HMX,但其爆速(9067 m·s-1)与HMX相近, 是一种有发展前景的炸药。
| [1] |
Sheremetev A B, Yudin I L. Advances in the chemistry of furazano[J].
Russia Chemical Reviews, 2003, 72(1): 87-100. DOI:10.1070/RC2003v072n01ABEH000776 |
| [2] |
黄明, 李洪珍, 李金山. 高氮含能化合物的合成及反应性[J].
含能材料, 2006, 14(6): 457-462. HUANG Ming, LI Hong-zhen, LI Jin-shan. Review on synthesis of high-nitrogen energetic compouds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 457-462. |
| [3] |
Tselinskii I V, Mel′nikova S F, Romanova T V, et al. 4H, 8H-Difurazano[J].
Russia Journal of Organic Chemistry, 1997, 33(11): 1656-1665. |
| [4] |
Korolev V L, Petukhova T V, Pivina T S, et al. Quantum-chemical study of the structure and thermochemical properties of nitropiperazenes and nitrosopiperazines[J].
Chemistry of Heterocyclic Compounds, 2004, 40(12): 1568-1587. DOI:10.1007/s10593-005-0101-z |
| [5] |
Agrawal J P.
High Energy Materials. Propellants, Explosives and Pyrotechnics[M]. Weinheim: Wiley-VCH, 2005 |
| [6] |
Starchenkov I B, Andrianov V G, Mishnev A F. Chemistry of furazano[3, 4-b]pyrazine. 1. Synthesis and thermodynamic appraisal of 4, 8-dihydrodifurazano[3, 4-b]pyrazine and its derivatives[J].
Chemistry of Heterocyclic Compounds, 1997, 33(2): 216-228. DOI:10.1007/BF02256764 |
| [7] |
Sheremetev A B, Kulagina V O, Yudin I L, et al. Synthesis of trisfurazanylamine derivatives[J].
Mendeleev Communications, 2001, 11(3): 112-114. DOI:10.1070/MC2001v011n03ABEH001424 |
| [8] |
Sheremetev A B, Aleksandrova A B, Mantseva E V, et al. Synthesis of chlorofurazans from nitrofurazans[J].
Mendeleev Communications, 2000, 10(2): 67-68. DOI:10.1070/MC2000v010n02ABEH001250 |
| [9] |
Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Gaussian, Inc., Wallingford CT, 2009.
|
| [10] |
WU Xiong, LONG Xin-ping, HE Bi, et al. The VLW equation of state for detonation products[J].
Science in China, 2008, 38(12): 1129-1131. |
| [11] |
钟一鹏, 胡雅达, 江宏志.
国外炸药性能手册[M]. 北京: 兵器工业出版社, 1990.
|
Several difurazanopyrazine derivatives were synthesized using 4H, 8H-difurazano[3,4-b:3′,4′-e] pyrazine(DFP) as starting material and their structures were characterized by IR, NMR, and elemental analysis. The thermal properties and calculated detonation performance were also studied.



