2. 西安近代化学研究所, 陕西 西安 710065;
3. 中国白城兵器试验中心, 吉林 白城 137001;
4. 中国石油吉林石化公司化肥厂, 吉林 吉林 132021
2. Xi′an Modern Chemistry Reserch Institute, Xi′an 710065, China;
3. Baicheng Ordnance Test Center of China, Baicheng 137001, China;
4. Petrochina JiLin Petrochemical Company Fertilizer Factory, Jilin 132021, China
低价态铝簇配合物中铝元素的价态处于0价和+3价之间, 该化合物的颗粒为纳米级, 与纳米铝粉相比, 具有较高的活性, 配合物中含有大量的Al—Al金属键和含特殊配体R的Al—R配位键, 据文献报道[1], 若采用高能含氮的配体不仅可以对纳米粒子的活性起到保护作用, 而且对于改善和提高含能材料的能量及其能量释放速率具有重要的意义, 另外, 由于其内部含有大量的Al—Al金属键, 在热传导和超导材料方面也具有较大的应用潜力, 故研究低价态纳米铝簇配合物的结构特征至关重要。
虽然铝簇配合物的研究已有相关综述[1], 但本文则从铝簇配合物前驱体的制备与结构特征研究入手, 首先介绍了铝簇配合物的前驱体AlX(X=F, Cl, Br, Ⅰ)的制备方法研究状况; 其次从铝簇配合物的形成机理、配位模式、性能特征、原子特征等多方面分析了金属有机铝簇配合物、非金属铝簇配合物和具有Jellium模型结构的Alnm-铝簇配合物的结构特征; 最后对今后的研究工作进行了展望, 指明了研究方向, 为制备一定结构和特殊性能的低价态铝簇配合物奠定了基础。
2 前驱体AlX的制备研究要想合成理想的低价态纳米铝簇配合物, 对其前驱体AlX(X=F, Cl, Br, Ⅰ)的制备进行研究是首要前提。
经研究发现, 在ⅢA族元素中, 气态的一氯化物并不稳定, 在一定条件下易发生歧化反应, 表 1列出了几类MⅠX(g)(M=B, Al, Ga, In, Tl)发生歧化反应时的放热量。
| 表 1 MⅠX(g)歧化反应时所放出的热量 Tab.1 Energy released from the disproportionation reaction of MⅠX(g) |
从表 1可知, 随着原子半径的增大和电负性的减弱, 气态MⅠX发生歧化反应时放出的热量逐渐减少, 即其稳定性逐渐增强。
另外, 在常温下能够以固态形式存在的只有InCl[2]和TlCl[2], Ga和B两种元素也有相应的低价氯化物存在, 如GaⅠ(GaⅢCl4)[4]及分子簇合物BxClx(x=4, 8, 9)[5], 且随着原子序数的增加, 其稳定性逐渐增加, 但它们却并不是以GaCl和BCl的形式存在。
1948年Klemm W等[6]预言了+1价铝化合物存在的可能性, 直到20世纪70年代, Hansgeorg Schnöckel[7]才在高温和惰性气氛的条件下合成出了前驱体AlCl分子。该反应方程式如下:
| $ {\rm{Al}}\left( {\rm{l}} \right) + {\rm{HCl}}\left( {\rm{g}} \right)\xrightarrow{{1000\;^\circ {\rm{C}},p<20 \;{\rm{ pa}}}}{\rm{AlCl}}\left( {\rm{g}} \right) + 1/2{{\rm{H}}_{\rm{2}}}\left( {\rm{g}} \right) $ |
但Al元素的氧化态在+3的时候最稳定的, 前驱体AlCl中Al为+1价, 在常温下和接触空气的条件下很难单独存在, 甚至在较低的温度下也会发生歧化反应[8], 生成金属Al和AlCl3, 并通过低温红外证实了纳米金属Al的存在[8]。AlCl歧化反应方程式如下所示:
| $ 3{\rm{AlCl}}\left( {\rm{s}} \right)\xrightarrow{{-90\;^\circ {\rm{C}}}}2{\rm{Al}}\left( {\rm{s}} \right) + {\rm{AlC}}{{\rm{l}}_3}\left( {\rm{s}} \right) $ |
而为了使得AlX能够稳定存在, 保留AlⅠX中AlⅠ的活性, 需采用低温溶剂无氧隔离的技术保存, 且该溶剂需满足以下三个条件:(1)不能与AlCl反应, 以免变质; (2)具有挥发性, 可使初始生成的气态AlCl与之均匀混合; (3)具有足够低的熔点, 在低温下为液态。故可将质子溶剂以及卤代烃排除在外, 因为它们都易与MX发生键间反应。
Schnöckel课题组[2]经过不断实验, 发现选用乙醚与甲苯作为混合溶剂, 可使AlCl在223 K的温度下存放数周, 并通过计算Al与Cl元素的比例以及水解产生的H2的物质的量确定了“AlCl”的存在。
| $ {\rm{A}}{{\rm{l}}^ + } + 2{{\rm{H}}^ + } \to {\rm{A}}{{\rm{l}}^{3 + }} + {{\rm{H}}_2} $ |
同时研究发现, “AlBr”, “AlⅠ”, 以及“GaX”(X=Cl, Br, Ⅰ)都可以类似的方式获得较稳定溶液, 且该类MⅠX化合物随着M和X原子数目的增加而更稳定。
亚稳态的一卤化物溶液会发生歧化反应, 这与卤化物的性质、溶剂的性质以及浓度有关。此外, 可见光、温度及湿度的增加都有可能促使歧化反应的进行。
为避免AlⅠX发生歧化反应, 最彻底的方式, 就是选择合适的配体与之反应生成铝簇配合物, 由于该物质独特的结构特征, 可在常温、常压和与空气接触的条件下稳定存在。
3 几类低价态铝簇配合物的结构特征研究 3.1 低价态铝簇配合物的国内研究现状AlⅠX中的铝原子失去1个电子, 具有空的p轨道, 可以接受未成对电子, 表现出Lewis酸的特点, 与具有孤对电子的授体成键, 形成较为稳定的配合物, 同时金属铝原子外层还具有两个电子, 可以促使Al—Al键的形成。Werner Uhl等[9]在1988年报道了首例两中心两电子(2c-2e)Al—Al金属键的配合物[Al2{CH(SiMe3)2}4], 并综述了含Al—Al键的+2价铝的有机金属化合物的研究进展[10]。此后, 他们还报道了含Al—N键的形式多样的铝配合物, 其中代表性的配合物既有Al和N原子顺式排布的AlC2N四元环Z2Al—(Me3Si)C=C(H)—NR2(Z=CH2tBu, iBu, tBu)[11]的金属有机化合物, 以及具有鼓状结构的[Me3CAlNH]6[12], 立方体结构的(HAlNiPr)4[13]。金属铝的存在, 使该类铝配合物既表现出Lewis酸性, 又表现出Lewis碱性。
其中, 国内对于纳米铝簇配合物的研究很少, 且主要集中于理论计算方面, 如采用密度泛函理论的方法发现, Al4(iPrNNiPr)3[14]簇合物中含有Al—N键和N—N键两种键型, 而(ClAlNH)10[15]和(AlN)10[15]两个团簇分子中只有Al—N键唯一键型, 故与后两种簇合物相比, Al4(iPrNNiPr)3簇合物在合成富氮含能材料方面具有较大的研究价值。
2010年, 马登学[16]在B3LYP/6-311+G*水平上设计和计算了系列叠氮二卤化铝簇合物(AlN3X2)n(n=1~4, X=F, Cl, Br), 发现随聚合度(n)的增大, Al—Nα、Nα—Nβ和Al—X键长总体上逐渐增大, 而Nβ—Nγ键长则变短, 有利于形成AlN材料, 为合成高氮铝簇配合物奠定了一定的理论基础。
2010年, 陈秀敏等[17]研究了AlCl歧化反应分解法制备金属Al过程中[AlCl]n(n=1~10)的基态结构特征, 发现它们大都是以[Al]n骨架外接的Al—Cl键的n个Cl原子成型, 且其几何对称性较好, 另外[AlCl]n能够以[Al]n骨架为基础长大。
2013年, 卢凤仙[18]综述了不同类型簇化合物的结构特征, 并指出低价态铝簇化合物作为多学科交叉领域中的重要研究对象, 在光学、光电子学、磁学、化学、材料学和生物学等领域中具有巨大的应用价值。
南开大学团队通过碱金属还原偶联Me3SiCCSiMe3和铝的二碘化合物ArAlⅠ2(Ar=2, 6-iPr2C6H3), 首次报道了含有AlAlCC四元环的铝杂环丁烯化合物(ArAl)2(CSiMe3)2[19]; 使用大位阻的β-二亚胺配体成功合成了铝烯化合物HC[(CtBu)(NAr)]2Al, 并研究了其与苯基异腈、三联苯叠氮和水的反应规律[20]; 2010年, 对铝杂环丙烯的化学性质进行了研究, 发现其可作为前驱体合成相应的铝杂环化合物, 且能作为铝烯的替代物合成具有重键的化合物[21]; 2013年合成了四元环的铝卡宾和五元环的铝卡宾, 并对铝三元环进行了一些尝试[22]。国内对于铝簇配合物的实验研究较少, 其中南开大学团队的研究成果显著, 对合成铝簇配合物提供了一定的基础。
研究发现, 前驱体化合物AlX(X=F, Cl, Br, Ⅰ)与一定的配体反应, 生成金属有机化合物和非金属簇配合物, 可使处于低价态的AlⅠ的稳定性明显提高, 且活性得到保留。本节将从铝簇配合物的形成机理、配位模式、性能特征、原子特征等多方面介绍金属有机铝簇配合物、非金属铝簇配合物和具有Jellium模型结构的Alnm-铝簇配合物的结构特征。
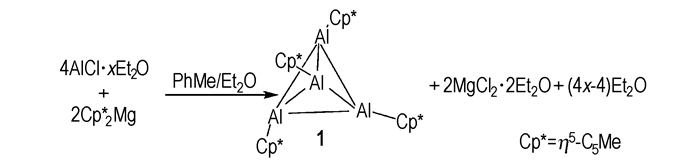
3.2 形成金属有机化合物 3.2.1 AlCp*(Cp*=η5-C5Me5)类化合物1991年, Dohmeier C等[23]发表了第一例Al(Ⅰ)金属有机化合物1Al4Cp4*, 这一化合物由AlX和MgCp2*(Cp*=η5-C5Me5)合成得到, 可以在常温常压下稳定存在。反应方程式如下:
|
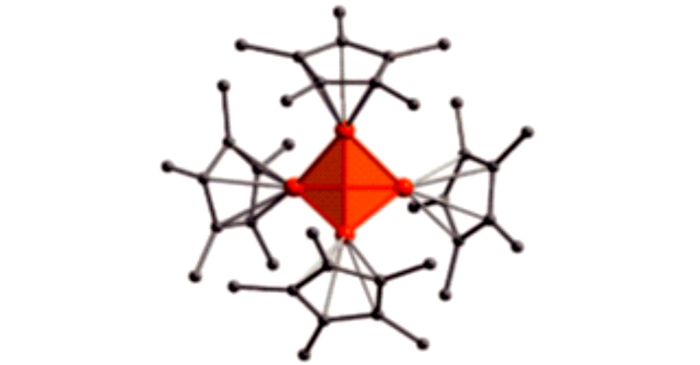
图 1为化合物1的X-射线单晶结构[24], 其中心Al4为四面体结构, 在硼分子簇合物中也有类似结构存在[25], 如:B4Cl4和B4tBu4。
化合物1为黄色八面体单晶, 对称性为Td。根据对温度的敏感性测试, 发现在不高于140 ℃时, 其对空气和湿度都不敏感, 当温度升至150 ℃时, 开始发生缓慢分解。化合物1对紫外光比较敏感[25], 当将化合物1在傅里叶变换离子回旋共振质谱光谱仪(Fourier transform ion cyclotron resonance mass spectrometer, FT-ICR-MS)中以弱的紫外光照射时会发生激光解析, 生成Al8Cp4*(化合物2), 化合物2以Al—Al键为骨架, 内部结构与化合物1类似, 由Al4四面体构成, 这四个Al原子分别与1个AlCp*(化合物3)结合, 形成闭合结构, 反应历程为:
| $ {\rm{A}}{{\rm{l}}_4}{\rm{Cp}}_4^*\xrightarrow[{-2{\rm{AlCp}}_3^*}]{{ + 6{\rm{AlC}}{{\rm{p}}^*}}}{\rm{A}}{{\rm{l}}_{\rm{8}}}{\rm{Cp}}_4^* $ |
Gauss等[26]在不同温度下由27Al NMR发现, 室温条件下, 在δ=-80(ω1/2=140 Hz)处有唯一的峰, 随着温度的升高, 在δ=-150(ω1/2=180 Hz)会出现一个属于AlCp*的峰, 其平衡反应方程式为:
AlX和MgCp2(Cp=η5-C5H5)反应也可以获得具有相同结构的化合物4 [29]:Al4Cp4, 但是Al4Cp4极不稳定, 在-30 ℃时即分解为AlCp单体(化合物5)。与化合物1相比, Cp环上无甲基, π电子受到的诱导效应减弱, 环电流减小, 削弱了其外部磁场; 同时, 由于Al4Cp4所形成的反馈p-π键合能力较强, 具有较高的共振磁场强度, 电子激发态能量化学位移增大, 使得η5-Cp配合物有较大的HOMO-LUMO(Highest Occupied Molecular Orbital; Lowest Unoccupied Molecular Orbital)分离能(图 2)。且在发生分解反应时存在一个热力学的势垒, 该势垒对于化合物1来说较化合物5的高, 从能量和几何构造来看, 铝簇配合物可能处于该势垒的顶部, 甚至可以认为铝簇配合物是正一价Al化合物生成金属铝的中间产物[30]。
|
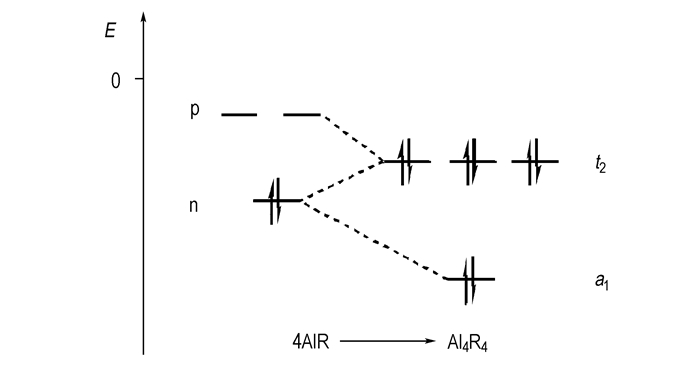
图 2 具有四面体结构的Al4R4的MO能量图[31] Fig.2 Section of the qualitative MO diagram of the Al4R4 tetrahedron[31] |
4个Al4R4分别提供一个具有孤对电子的HOMO, 这四个轨道分裂形成了具有强稳定性的一个a1轨道和3个t2轨道。同时AlX分子还具有空p轨道和π轨道, 与t2轨道作用, 整个分子稳定性增加。
因此Al4R4分子中键的强度取决于两个因素:t2-π相互作用力的强弱和HOMO与LUMO间的能级差, 且一般情况下, 前线轨道的能级差越小, 电子对在占据t2轨道时就越稳定。
而AlR分子的前线轨道的能级主要受两个因素影响:(1)配位原子R的电负性强弱, 配位原子R的电负性越大, 则Al原子周围的正电荷密度就越大, 同时可以减小HOMO的能量; (2)填充于Al原子空p轨道和π轨道形成反馈π键电子离域范围的大小, 离域范围越大, LUMO的能级越高。
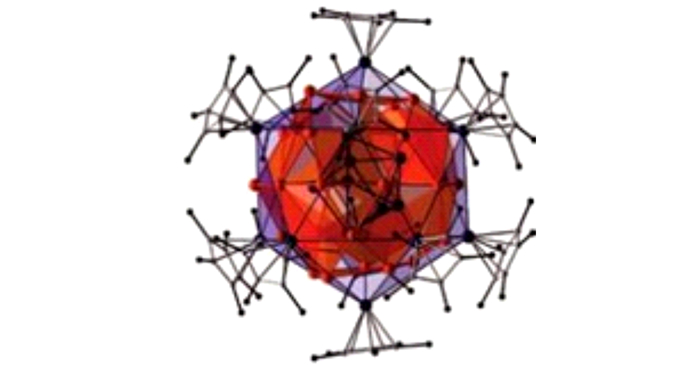
2004年, Jean Vollet等[32]报道了富金属纳米铝簇Al50Cp12*(化合物6, 图 3), 其Al—CCp*平均键长为233 pm, 稍大于单体AlCp*的键长(210 pm), HOMO-LUMO能隙为0.9 eV, 电离势和电子亲和势分别为4.22 eV和1.73 eV, 化学性质稳定[33]。
其中, 化合物6的直径为1.5 nm, 两个最近的簇合物之间的距离是1.8 nm, 8个铝原子形成扭曲反棱镜几何壳面, 被30个Al原子形成的三十二面体壳包覆, 外围是一个二十面体的Al12壳, 其中每个Al原子与一个Cp*相连[34]。
Hansgeorg Schnöckel等采用密度泛函理论(DFT)研究了非金属铝簇和裸露铝簇的能量和拓扑结构[35-36], 并计算了从气态铝簇配合物生成金属铝的量化关系[37]。相应的数据如图 4所示[24]。

|
图 4 化合物1, 3, 5及6的化合及分解能[24] Fig.4 Combination and decomposition energy of compound 1, 3, 5 and 6 |
从图 4中可知, Al4Cp4*(1)和Al4Cp4(4)的歧化分解能分别为233 kJ/17.25 mol和2441 kJ/17.25 mol, 即化合物1相对更稳定, 这与之前的实验结果相吻合。同时, 由Al50Cp12*(6)发生歧化反应生成Al4Cp4*(1)的势垒较高, 而由Al50Cp12发生歧化反应生成Al4Cp4(4)的势垒很小, 则Al4Cp4(4)比较容易发生分解反应生成单质铝和+3价铝化合物。
结合Al4Cp4*(1)即使在加热的条件下也不易分解这一特性, 在反应底物中不断加入AlCp*, 同时不断地移除AlCp3*就可以生成Al8Cp4*(2), Al50Cp12*(6)和Al20Cl10Cp8*(10)。
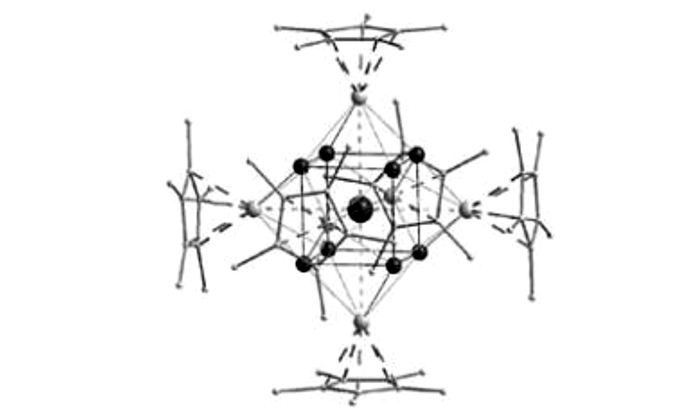
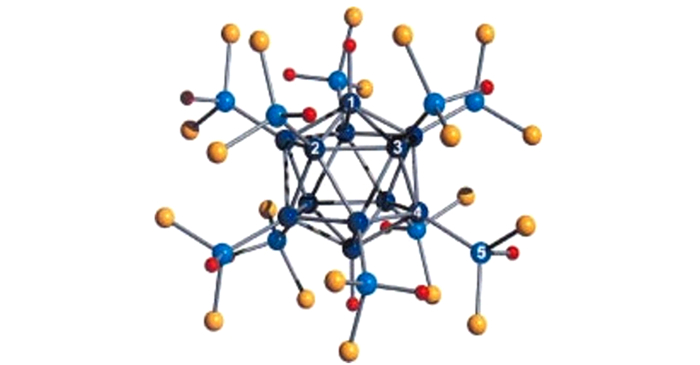
2005年, Jean Vollet等[38]将新制备的Al4Cp4*与[AlBr·NEt3]4(化合物8)溶于戊烷, 加热后, 淡黄色的溶液颜色变深, 同时析出金属铝, 得到化合物9:Al20Br10Cp8*, 于此同时, 还生成了两个副产物[AlBr2·NEt3]2和[AlBr3·NEt3]。在这个两个副产物中金属铝的价态发生了变化, 分别为+2和+3价。当MgCp2*与AlCl·Et2O反应时, 得到了化合物10:Al20Cl10Cp8*。
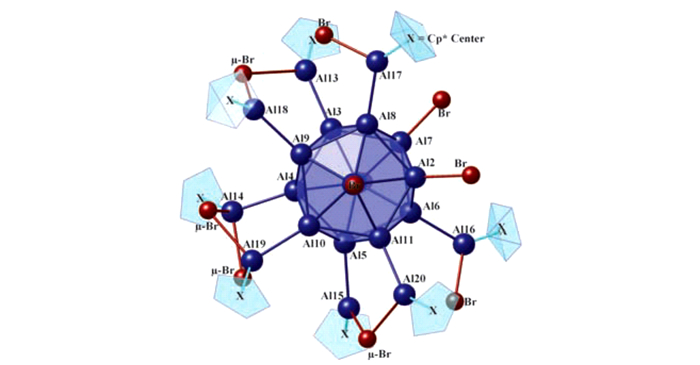
化合物9和化合物10具有车轮状结构, 化合物9的结构如图 5所示[38]。
|
图 5 化合物9的结构图(Cp*基团已简化)[38] Fig.5 Structure of compound 9 (Cp* groups are represented insimplified form for clarity)[38] |
2008年, Michael Huber等[39]报道了一例新的AlCp类化合物:Al4(C5Me4H)4(化合物11), 他们以AlBr和Mg(C5Me4H)2为反应基体, 在氮气氛围绝氧的条件下合成出来, 且发现在反应溶液中AlR(R=Cp, C5Me4H, Cp*)与Al4R4会达成一种平衡状态。
研究表明, 化合物7的稳定性较化合物3的稳定性强, 但是当温度升至室温时就会发生分解反应, 其相应的Al—Al键和Al—C键的平均键长及相应的热力学能也列于表 2中。观察Al—Al键的数据可知, 当环戊二烯上的供电子基团CH3越多时, Al—Al键长呈递增趋势, 其焓变也呈增加趋势。
| 表 2 Al4Hm-(m=4, 6)和AlnHn+2-(5≤n≤8)的绝热电子亲和能与HOMO-LUMO能隙的实验与理论值[43] Tab.2 Experimentally and theoretically determined values of adiabatic electron affinities(E) and HOMO-LUMO gaps for Al4Hm-(m=4, 6) and AlnHn+2-(5≤n≤8)[43] |
前驱体AlX(X=F, Cl, Br, Ⅰ)中的Al不仅可以跟环戊二烯及其衍生物的大π键结合生成有机金属化合物, 还可以与Si和P等富电子的原子结合, 发生加成、插入反应。
3.2.2 含有Si和P的金属有机铝簇化合物Al4Cp4*(化合物1)虽然不是非金属铝簇配合物, 但是其分解的单体产物AlCp*(化合物3)却是制备非金属铝簇配合物至关重要的中间体。
AlCp*(化合物3)具有两个未成对电子, 其化学活性较高, 可以发生插入反应、加成反应等。
同时金属铝还有空的d轨道, 当其与富电子基团发生反应会生成具有特殊结构的金属有机铝簇配合物。
在这些化合物物中既具有与Al4Cp4*(化合物1)结构相似的Al4[Si(tBu)3]4(化合物12), 又有以Si为中心原子的铝簇配合物SiAl14 Cp6*(化合物13)。
Al4[Si(tBu)3]4[39](化合物12)中Al—Al键长为260.4 pm, 较化合物1中Al—Al键长短, 且其稳定性较差, 对氧气尤其敏感。
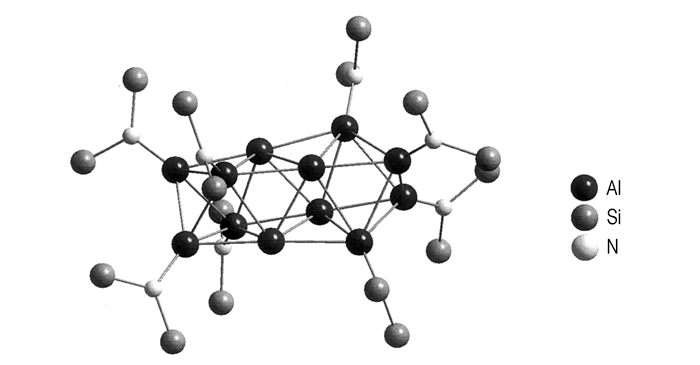
SiAl14Cp6*[40](化合物13)的合成方法有两种途径, 其一是通过化合物1与AlCl和SiCl4反应, 另一种是通过SiCp2*与AlCl。如图 6所示, 在化合物13结构中, Si原子居于8个Al原子所形成的立方体中心, 六个面上各有AlCp*所包覆[41]。
化合物13包含40个价电子, 具有Jellium模型结构, 所以从其结构角度讲, 化合物13比较稳定。但是通过质谱研究发现, 居于中心位置的Si原子受热易挥发。
3.2.3 AlnHm类化合物Li等[42]人采用脉冲电弧放电装置(pulsed arc discharge source, PACIS, 图 7)进行了Al4Hm的合成实验。
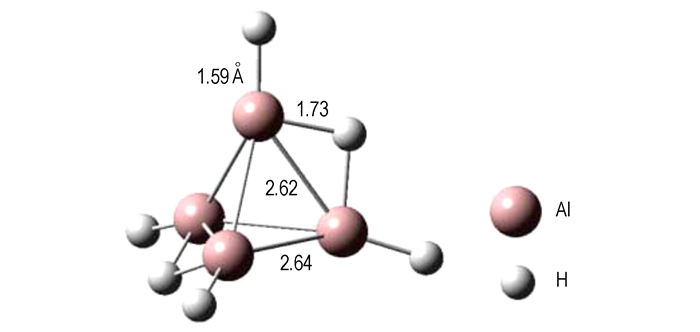
并采用质谱、光电子能谱等手段对其进行了分析表征, 发现这类高能簇合物在结构和性能上与硼簇相似, 并报道了具有扭曲四面体结构的Al4Hm(m=1~9)高能铝烷化合物。研究表明Al4H6(化合物14)具有变形四面体结构, 如图 8所示。
|
图 8 具有变形四面体结构的中性Al4H6分子计算结构[42] Fig.8 Calculated structure of neutral Al4H6 with a distorted tetrahedron[42] |
Al4H6的高稳定性取决于两个H+与Al4H42-结合时的高放热性, 即便排除掉库仑吸引力, 仍有约1500 kJ·mol-1热量放出; 且其HOMO-LUMO能隙为1.9 eV, 同样也暗示了Al4H6的稳定性较其他Al4Hm好, 且占有的比例最高。
2007年, A.Grubisic等[43]结合阴离子光电子能谱和密度泛函理论, 总结了由脉冲电弧集群电离源PACIS产生的AlnHm-(4≤n≤8, 0≤m≤10)的绝热电子亲和能EAa(Adiabatic Electron Affinities)值和HOMO-LUMO能隙, 见表 2, 可看出Al4H4、Al4H6和AlnHn+2(5≤n≤8)的绝热电子亲和能均很小, HOMO-LUMO能隙均很大, 表明它们的结构特征基本一致。
2010年, Xiang Li等[44]通过脉冲放电的方法制备出气相的AlnHm-阴离子, 其含氢量非常高, 由质谱图发现, 当n=5~8时, 含氢量最大为m=3n+1;当n=4时, 含氢量最大为m=14, 即Al4H14-。
利用密度泛函理论的方法计算发现, AlnHm-处于最低能量的结构模型为环状或链状, 且尽管该阴离子的尺寸会从Al4H13-增大到Al7H22-, 这两种结构的阴离子的Al—H平均键长却近似于常数174 pm, 稍大于中性化合物AlnH3n-(170 pm)。
通过下述公式分析了这类富氢物质的热稳定性:En=-[E(AlnH3n+1-)-E(Aln-1H3n-2-)-E(AlH3)](n=5~7), 得出, E5=1.06 eV, E6=1.04 eV, E7=0.98 eV。因此可以看出, 此类富氢物质能量的不同只取决于AlH3单元, 与分子的尺寸无关, 证明了该物质是以聚合物形式存在, 且AlH3单元不会导致能量增加。
3.3 含有不同配体的非金属铝簇配合物 3.3.1 以N(SiMe3)2为配体的纳米铝簇配合物如前所述, 在铝簇配合物中, 除了具有金属铝元素外, 还有其他非金属元素或参与配位, 或作为杂原子进入到铝簇配合物的内部, 使其结构特征表现出多样性与复杂性。非金属铝簇配合物作为铝簇配合物中的一种分类, 其特征表现在所含Al—Al键多于Al—R配位键。
铝簇前驱体化合物AlX中的卤素在一定条件下卤素元素X可以脱去或者被其他配体所取代而生成纳米铝簇。理论上, 随着卤素原子半径的增加, 卤素原子的电负性逐渐减弱, 卤素原子与铝原子的键合能变小, 更加容易脱去或被取代, 例如, 以LiN(SiMe3)2为配体与AlX反应成功合成出一系列的纳米铝簇配合物, 有Al7R6-(化合物15), Al12R8-(化合物16), [Al14R6Ⅰ6Li(OEt2)2]-(化合物17), Al69R183-(化合物18), Al77R202-(化合物19)。
据报道[45], Al7, Al12簇是LiN(SiMe3)2为配体与过量AlCl反应生成的, 研究表明在反应过程中, 会生成一个具有负一价的中间体化合物Al7R3X3-, 该中间体化合物不稳定, 很快会生成将氯原子全部取代的Al7R6-, Al12R8-簇, 并推断Al7R6-和Al12R8-簇是生成Al77簇的中间过渡态。
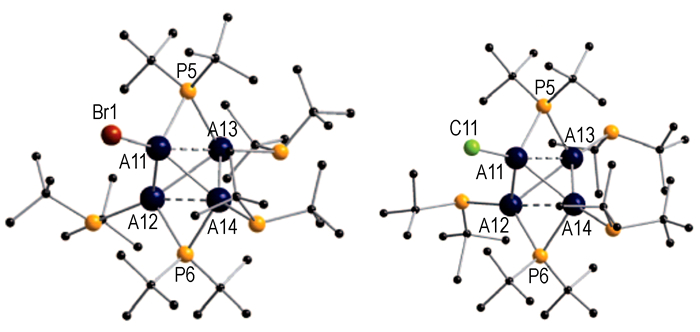
化合物15的结构如图 9所示, 中心Al原子由远处六个Al构成的扭曲八面体所包围, 其中六个远处的Al原子均与R相接[24]。研究发现[46], 对于Al7簇来说, 基态的稳定结构具有C3v对称性的特点, 但是Al7R6-簇的对称性为D3d, 而同系物中C3v簇的稳定性比D3d的稳定性较好, 其中, 最稳定的Al7簇为[Al7{NH2}6]-。
另一个中间体化合物16结构也比较特殊[24], 如图 10, 其结构与中性分子In12R8的结构相似[47], 但前者Al原子的价态为+0.58, 而后者In的价态为+0.66。
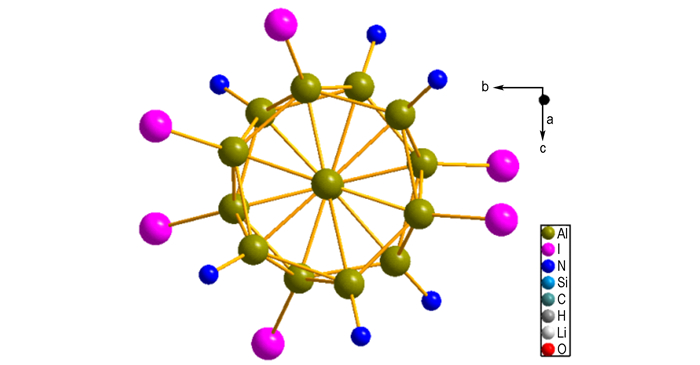
但是, 当选用相同配体与AlⅠ在55 ℃反应后缓慢降温, 几周后, 在7℃时得到深红棕色的平面晶体[45]。该化合物是由两个重叠的中心为Al原子的Al6环构成, 其中, 两中心Al原子间距为272.8pm, 其他Al—Al键长在257.0 pm(Al原子与Ⅰ配体键长)和291.0 pm(Al原子与N(SiMe3)2配体键长)间。在图 11所示的结构中, 前后两个纳米轮通过Al—Al键相互连接在一起, 增加了化合物17的稳定性:
[Al14{N(SiMe3)2}6Ⅰ6Li(OEt2)2]-[Li(OEt2)4]+·Tol(Tol=toluene)(化合物17)
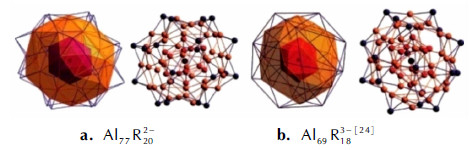
Al77和Al69簇是目前已经表征的铝原子数最多的纳米铝簇配合物, 两者的尺寸相近[48](前者为1.30 nm, 后者为1.27 nm), 均为面心立方结构, 最外围的Al原子分别各自与20个和18个N(SiMe3)2相接, 两者的中心Al原子周围均被12个最近的Al原子形成的壳所包围, 且Al12壳内的Al—Al键长也相近。如图 12所示分别为Al77R202-和Al69R183-(R=N(SiMe3)2)结构图。
2000年, X.G.Gong等[49]通过结构最优化和电子结构的计算证实了Al77簇的高稳定性, 并发现Al77与其配体间的反应类似于离子间的反应。
2002年, Hansgeorg Schnöckel等[50]分别计算了Al77和Al69簇中Al/R的比例(前者为3.85, 后者为3.83), 得出Al77和Al69簇中Al原子的平均氧化态分别为+0.234和+0.217, 而化合物15、16和17的分别为0.71、0.58、0.71, 同样说明前两者的稳定性较好。
3.3.2 AlnXn-2型分子下面介绍几种具有AlnXn-2型的纳米铝簇配合物主要有一下几种, 例如:Al22Br20·12THF(化合物20)、Al22Cl20·12THF(化合物21)和Al22Cl20·12THP(化合物22)。
十年前, 人们为了使一价态的第三主族元素稳定存在, 选用合适的配体合成了[AlCp*]4[20]、[GaC(SiMe3)3]4[51]、[InCp*]6[52]和[TlC(SiMe3)3]4[53]等多面体, 但是没有任何一个多面体如硼的卤化物一样是由卤素元素作为配体构成。后来人们合成了四面体结构的铝低价态卤化物, 如[AlBr·NEt3]4[54], 但该物质易形成具有电子缺陷的物质, 并易歧化为AlX3和铝单质。
Al22Br20·12THF[55]是第一例稳定多面体的铝低价态卤化物, 是由AlBr同甲苯和THF共缩合反应制得, THF的位阻小, 故Al原子之间会形成多中心键, 有效地避免了低价态铝元素的歧化反应。深蓝色:二十面体核的Al原子; 浅蓝色:AlBr2配体的Al原子; 橘色:Br原子; 红色:THF的O原子。键长[Å]:Al1—Al2 2.650+0.023(2.615), Al2—Al3 2.762+0.005(282.4), Al3—Al4 2.692+0.016(2.684), Al4—Al5 2.526+0.019(2.541), Al5—O1 1.892+0.038(1.937), Al5—Br1 2.299+0.039。
如图 13, 化合物20的中心结构为Al12的二十面体单元, 与其他Al化合物的Al—Al键长相比([AliBu]122-:267.0~269.6 pm; [AlCp*]4:276.9 pm; [AlBr2·OMePh]2:253.0 pm; 金属铝:286.0 pm), 非常相近, AlBr2单元与12个Al原子构成的二十面体上的其中10个相连, 20个Br原子平均的分布于二十面体的三角面上, 形成了一个扭曲的五角十二面体结构, THF分子从这些面的中心突出, 因此, 二十面体上的两个对位的Al原子并不是和AlBr2单元相连, 而是和THF分子形成配位键, 故Al22Br20·12THF亦可写成Al12[AlBr2·THF]10·2THF。
Al22Cl20·12THF[56]和Al22Cl20·12THP[56]与Al22Br20·12THF的晶体结构、化学性能非常相似, Al原子同样的可分为三类:Al1、Al2—Al4、Al5, 所有的Al—Al键都被包裹在簇合物的核心, 所有的Al—X键裸露在簇合物的核外, 表 3列出了上述三种Al22簇合物的平均铝原子尺寸, 并对Al22Cl20·10H2O(化合物21a)、Al22Cl20·12THF(化合物21b)的平均铝原子尺寸进行了计算, 可看出, 它们的平均铝原子尺寸非常相近。
Al22Cl20·12THF和Al22Cl20·12THP对空气和水分非常敏感, 且温度达到100 ℃以上时, 会分解成AlCl3·12THP和单质铝, 该簇合物可被假设成是形成单质铝的中间物。
为验证上述假设, 图 14以Al22Cl20·10H2O(s)+Al2Cl4·2H2O(s)为模型系统, 对离析物(24AlCl(g)+12H2O(g))和热力学上最稳定的最终产物(16Al(s)+4AlCl3·H2O(s)+4AlCl3·2H2O(s))进行了计算, 发现固态的21a(s)离析为气态的AlCl, 发生歧化反应时, 会释放出81%的能量, 可推断出Al22X20·12L(X=Br, Cl; L=THF; TPF)是AlX歧化分解为AlX3和Al的中间物质, 这对深化了解簇合物歧化反应的机理和活性状态有重要意义。

|
图 14 Al22Cl20·10H2O(s)+Al2Cl4·2H2O(s)模型系统的能量分布图[55] Fig.14 Energetic situation of Al22Cl20·10H2O(s)+ Al2Cl4·2H2O(s) model[55] |
除了前文所述的Al4H6外, Al4Rn(n≥4)型铝簇配合物还有如下几种:Al4R′6(化合物23), Al4R′5X(R′=PtBu, X=Cl, Br)(化合物24), Al4Br4·4L(L=NEt3)(化合物25)[54, 57]以及在光谱中探测到的阴离子簇Al42-(化合物27)。
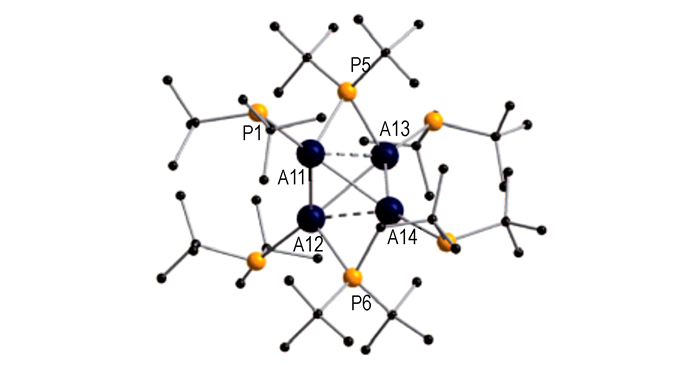
研究人员曾以甲苯/乙醚(摩尔比为3:1)混合物为溶剂, 在约1200 K的温度和无水无氧的条件下, 于77 K时得到AlBr[2, 8], 并在约200 K下退火处理得到深棕色的溶液, 将LiPtBu2加入其中后缓慢升温至室温, 除去LiBr固体和溶剂, 使残留物溶于戊烷中, 制备出Al4Br(PtBu2)5(化合物24a), 并用相同的方法制备了Al4Cl(PtBu2)5(化合物24b), 而Al4R′6化合物Al4(PtBu2)6(化合物23)的晶体是一周后在深棕色的溶液中得到的[58]。
如图 15, 与Al4H6相比, 化合物23带有庞大的取代基, 因而具有较长的Al—Al键:281 pm(无桥接)和312 pm(有桥接); 对于部分对称的化合物24a和24b来说, 其扭曲程度比Al4H6严重得多; 且化合物23、24a和24b (图 16)的终端Al—P键(240 pm)要稍微比桥接的Al—P—Al键短(246 pm)。
化合物23的形成机理有以下三种假设:(1)可视为Al2R′4[59]和Al2R′2[60]的归中反应(氧化值为1.5);(2)具有单体结构的AlR′2[61]和AlR′[62]的加成反应; (3)比较实际的反应基团是由两个Al2R′3[63]参与, 它可能是由AlR′2和AlR′反应形成, 也可能会在AlR′发生歧化反应(生成Al(s)和AlR′3)的溶液中形成, 此外也有可能是在溶液中由Al2R′4-[64]失去一个R′-离子后形成。
然而, 在AlX(X=Cl, Br)溶液中形成化合物23、24a和24b的反应过程极其的复杂, 期间不仅会形成Al—Al键, 还会伴随取代或置换反应的发生。到目前为止, 化合物23、24a和24b的反应机理还未得到实验验证。
Al4R′6分子键的形成与Al4H6相似, 然而对于化合物23来说, R′配合基是通过P原子直接与Al4结构相连, 因此, 有可能会有Al—P—Al键形成。Patrick Henke等[58]以Al4H42-与两个PH2+反应生成Al4H4(PH2)2的模型验证了该相似性。
由于许多已经合成并被表征了的Al4Rn(n≥4)型低价态化合物[65]的键的形成非常复杂, 目前已被科学家们认可的只有以下三类:(1)四面体Al4R4类分子的键是通过四个非定域化的Aln形成[2, 66](这种类型的第一个Al(l)化合物的例子是Al4Cp4*[67]); (2)第一个被人类所认识的Al(l)卤化物的晶体结构为Al4Br4·4L(L=ether)[54, 57], 它含有一个平面的四原子环, 具有2e-2c电子结构; (3)凭借PES(Photoelectron Spectroscopy)的方法, 科学家们研究发现Al42-和Al44-类型的簇合物[68-69]是裸露在外的Al四原子气相簇合物, 而最初它们却被看作是芳香族或反芳香族类的物质。
3.4 具有Jellium模型结构的Alnm-的结构特征研究Jellium模型结构的Alnm-是研究纳米铝簇配合物的一个重要的分支, 同时也是对纳米铝簇配合物进行理论计算研究的基础。
据Hüuermann[70]研究发现, 拥有Jellium模型结构的价电子数相同的簇合物, 如果原子本体由于配体的不同造成轻微的变形, 其能量的变化约为几千焦每摩尔左右, 电子壳几乎保持不变, 说明同类簇合物体积的变化对其本身的性能不会造成很大的影响, 配体数目的增加只会导致其体积变得“臃肿”, 但电子的稳定性会保持不变。尽管原子核不同, 但是具有相同价电子数目并带有不同配体的原子的性能却相似, 这类原子被命名为“超级原子”。
过去, 人们对铝簇配合物是否符合Jellium模型结构进行了大量的理论[71-75]和实验研究[76-79]。
2008年, Schnöckel H等[35]指出包含8、20、40、58、70等价电子数目的簇的结构较为稳定, Al7+和Al13-分别包含有20和40个价电子, 由Jellium模型得出, 这会导致电子壳的闭合, 故稳定性会增加[80]。
Al14+在许多铝的溅射光谱[81]、中性铝的质谱[82]和离子光谱[77]中出现过, 但是Leuchtner等[76]在实验中却没发现其存在。Al14+包含41个价电子, 但是对于壳的闭合只需40个价电子, 故其较好的稳定性似乎并不符合Jellium模型。另外Al13+拥有38个价电子, 也与壳的闭合不符合, 但Al13+比Al14+的结构更加紧凑, 故其可能更加的稳定。
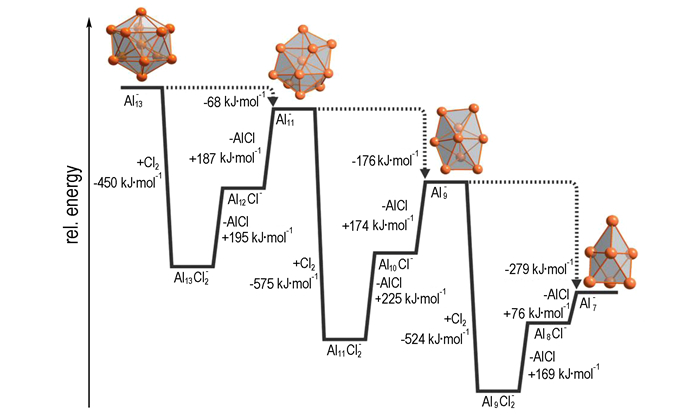
Jellium的简单模型被广泛应用于解释Al13-在质谱条件下的反应规律[74, 83-84]。Al13-簇含40个价电子, 其中心为二十面体的拓扑结构, 类似于Ar原子, 具有高度对称的壳体。图 17所示为Al13-簇在Cl2气氛中分解的能量图:
|
图 17 Al13-簇在Cl2氛中的能量降解图[36] Fig.17 Schematic energy diagram for degradation of the Al13-cluster in the presence of Cl2[36] |
Al13-离子暴露在Cl气氛中, 压力保持在10-9 Pa, 几十秒后可用质量光谱计观察到Al11-、Al9-、Al7-生成[85-87]。逐步反应的方程式如下:
| $ {\rm{Al}}_{13}^-\xrightarrow{{-2{\rm{AlCl}}}}{\rm{Al}}_{11}^-\xrightarrow{{ - 2{\rm{AlCl}}}}{\rm{Al}}_9^ - \xrightarrow{{ - 2{\rm{AlCl}}}}{\rm{Al}}_7^ - $ |
第一步, Al13-簇的表面氧化产生中间产物[Al13Cl12]-。根据密度泛函理论计算, 这步产生的反应热为-450 kJ·mol-1。在10-9Pa压力下, [Al13Cl12]-保留了振动和转动激发能, 并未因碰撞而消除。在一下步几纳秒的时间内, [Al13Cl12]-分裂为Al12Cl-和AlCl, 与相空间理论预测的一致[88]。接着Al12Cl-也分裂, 再次释放出AlCl, 形成Al11-。在该反应路线中, 估计Al12Cl-的寿命为几十分之一秒。反应的速率常数为kL=0.09 s-1, 故根据寿命估计, 平均每10 s一个Cl分子与一个Aln-簇分子碰撞, 并将在另一个0.1s内反应形成Aln-2-簇。2010年, Hansgeorg Schnöckel[24]认为在过量氯气的存在下, 由Al13-+Cl2反应序列得出Aln-中间体的动力学模型可解释为结合-消去反应, 且结合反应发生的速率接近于Langevin极限。
4 总结与展望低价态铝簇配合物是一个新的领域, 与传统的纳米铝粉相比, 两者的合成方法迥然不同; 其中Al原子的平均氧化态与传统Al原子的价态不同, 处于0到+3价之间, 可作为形成金属Al和+3价Al元素的中间体, 故铝簇配合物中铝元素的活性比纳米铝粉中铝元素的高; 含有丰富的Al—Al金属键, 且Al与其他配体会形成配位键并包裹在外部, 有效地保护了Al的活性, 而纳米铝粉暴露在空气中会在其表面形成一层氧化铝的包覆层, 使得活性Al的含量降低。若选用高氮配体合成新型铝簇配合物, 并取代纳米铝粉应用于含能材料中, 会提高含能材料中活性铝的含量, 使含能材料在能量的储存与释放方面的性能更加优越。
为使低价态的Al能够稳定存在, 并合成含特殊配体的具有特殊性能的低价态铝簇配合物, 今后的研究工作可从以下几个方面着手:(1)纳米铝簇配合物分子结构的设计; (2)制备方法的研究; (3)工艺条件的研究; (4)产物的实验和理论计算研究。
通过研究低价态铝簇配合物的结构特征, 可深刻理解金属铝的形成机理, 了解配合物的配位模式和物理、化学性能, 以及配合物中Al元素的活性状态及其活性铝的含量, 对合成具有特殊性能的富金属材料有着重要的实际意义, 可应用于高能富金属材料、热传导和超导材料等方面, 尤其在航天航空领域会表现出巨大的应用潜力, 若将低价态铝簇配合物应用于其中, 会从整体上提高人类探索外太空的技术水平, 如:(1)在火箭发射卫星的过程中需要相当大的能量, 若能制备出具有含能较高的铝簇配合物, 并将其应用于火箭燃料中, 能明显提高火箭运输卫星的能力, 并缩减燃料的使用量, 减小燃料舱体积; (2)高速飞行器中存在众多金属连接结构, 连接界面的热传导特性(界面接触热传导系数)是高速飞行器热控设计中必须考虑的重要因素之一, 铝簇配合物中含有大量的Al—Al金属键, 若将其制成合适的飞行器界面材料, 可明显改善飞行器的热传导特性; (3)铝簇配合物在一定临界温度下可实现超导性, 若制作成超导发射装置, 可取代火箭发射卫星或航天飞机, 会具有绿色环保、安全可靠和多次重复使用等优点。
| [1] |
毕研刚, 邱少君, 赵凤起, 等. 纳米铝簇配合物研究进展[J].
火炸药学报, 2012, 35(6): 1-6. BI Yan-gang, QIU Shao-jun, ZHAO Feng-qi, et al. Progress of research on nano-aluminum cluster complexes[J]. Chinese Journal of Explosives & Propellants, 2012, 35(6): 1-6. |
| [2] |
Dohmeier C, Loos D, Schnöckel H. Aluminum(Ⅰ) and gallium(Ⅰ) compounds:Syntheses, structures, and reactions[J].
Angewandte Chemie International Edition in English, 1996, 35(2): 129-149. DOI:10.1002/(ISSN)1521-3773 |
| [3] |
Tacke M, Kreienkamp H, Plaggenborg L, et al. GaCl:Ein roter, metastabiler Festkörper[J].
Zeitschrift für Anorganische Und Allgemeine Chemie, 1991, 604(1): 35-38. DOI:10.1002/(ISSN)1521-3749 |
| [4] |
Schmidbaur H. Arene complexes of monovalent gallium, indium, and thallium[J].
Angewandte Chemie, 1985, 97(11): 893-904. DOI:10.1002/(ISSN)1521-3757 |
| [5] |
Massey A G. The Subhalides of Boron[J].
Advances in Inorganic Chemistry, 1983, 26: 1-54. DOI:10.1016/S0898-8838(08)60090-2 |
| [6] |
Klemm W, Voss E, Geiersberger K. Einwertige Aluminiumverbindungen Ⅲ):Niedere Halogenide des Aluminiums[J].
Zeitschrift für Anorganische Chemie, 1948, 256(1-3): 15-24. DOI:10.1002/zaac.622560104 |
| [7] |
Schnöckel, H. Infrared absorption of aluminum chloride and aluminum bromide in solid noble gases[J].
Zeitschrift Fuer Naturforschung, 1976, 31B(9): 1291-1292. |
| [8] |
Tacke M, Schnöckel H. Metastable aluminum chloride, AlCl, as a solid and in solution[J].
Inorganic Chemistry, 1989, 28(14): 2895-2896. DOI:10.1021/ic00313a039 |
| [9] |
Uhl W. Tetrakis[bis(trimethylsilyl) methyl] dialan(4), eine verbindung mit Aluminium-Aluminium-Bindung[J].
Zeitschrift für Naturforschung.B, A Journal of Chemical Sciences, 1988, 43(9): 1113-1118. |
| [10] |
Uhl W. Organometallic compounds with aluminum-aluminum, gallium-gallium, and indium-indium bonds[J].
Angewandte Chemie, 1993, 105(10): 1449-1461. DOI:10.1002/(ISSN)1521-3757 |
| [11] |
Holtrichter-Röβmann T, Rösener C, Hellmann J, et al. Generation of weakly bound Al—N Lewis pairs by hydroalumination of ynamines and the activation of small molecules:phenylethyne and dicyclohexylcarbodiimide[J].
Organometallics, 2012, 31(8): 3272-3283. DOI:10.1021/om3001179 |
| [12] |
Uhl W, Hagemeier E, Layh M, et al. From tert-Butylhydrazine adducts of AlR3(R=Me, CMe3) to oligonuclear AlN cage compounds-evidence for a hydrazine twist across an Al3 triangle[J].
European Journal of Inorganic Chemistry, 2011, 2011(11): 1733-1743. DOI:10.1002/ejic.v2011.11 |
| [13] |
Uhl W, Molter J, Neumüller B. Synthesis of aluminum hydrazides by hydroalumination of 2, 3-diazabutadienes—formation of an Al4(N2)3 cage compound and an Al3(N2)3 macrocyclic ligand[J].
Chemistry-A European Journal, 2001, 7(7): 1510-1515. DOI:10.1002/(ISSN)1521-3765 |
| [14] |
邹清, 杜文亮, 马鸿雁. Al4(iPrNNiPr)3簇化合物的理论研究[J].
四川大学学报, 2003, 40(5): 921-925. ZOU Qing, DU Wen-liang, MA Hong-yan. Theoretical studies of Al4(iPrNNiPr)3 cage compounds[J]. Journal of Sichuan University, 2003, 40(5): 921-925. |
| [15] |
许小红, 金志浩, 王永兰. 氮铝簇合物的结构与稳定性[J].
西安交通大学学报, 2001, 35(2): 183-186. XU Xiao-hong, JIN Zhi-hao, Wang Yong-lan. Structure and stability of aluminum nitride clusters[J]. Journal of Xi'an Jiaotong University., 2001, 35(2): 183-186. |
| [16] |
马登学. 硼(铝)的叠氮簇合物结构和性质的理论研究[D]. 南京: 南京理工大学, 2010.
MA Deng-xue. Theoretical study on the structures and properties for the azide-clusters of boron and aluminium[D]. Nanjing: Nanjing University of Science & Technology, 2010. |
| [17] |
陈秀敏, 杨斌, 陶东平, 等. AlCl歧化反应分解法制备金属铝过程中[AlCl]n的形成机理[J].
物理化学学报, 2010, 26(2): 415-421. CHEN Xiu-min, YANG Bing, TAO Dong-ping, et al. Formation mechanism of[AlCl]n during production of aluminum by AlCl disproportionation[J]. Acta Physico-Chimica Sinica, 2010, 26(2): 415-421. |
| [18] |
卢凤仙. 低价态铝簇化合物的合成探索及膦杂吡唑铝配合物的合成与表征[D]. 山西: 山西师范大学, 2013.
LU Feng-xian. Exploration of low-valent aluminum cluster and synthesis and characterization of diazaphospholide aluminum complexes[D]. Shanxi: Shanxi Normal University, 2013. |
| [19] |
Li X, Cheng X, Song H, et al. Synthesis of HC[(CBut)(NAr)]2Al(Ar=2, 6-Pr2iC6H3) and its reaction with isocyanides, a bulky azide, and H2O[J].
Organometallics, 2007, 26(4): 1039-1043. DOI:10.1021/om061107j |
| [20] |
Li X, Song H, Cui C. Azaphosphaallyl anion lithium[ArNC(But)PAr]-Li+(THF)4 and its monomeric potassium and thallium complexes(Ar= 2, 6-iPr2C6H3)[J].
Dalton Transactions, 2009(44): 9728-9730. DOI:10.1039/b916501k |
| [21] |
张坤. 新颖有机铝、有机硼化合物的制备及其反应性质研究[D]. 天津: 南开大学, 2010.
ZHANG Kun. Synthesis and reactivity of the novel organoaluminum and organoboron compounds[D]. Tianjin: Nankai University, 2010. |
| [22] |
李晓斐. 新型一价铝、一价铊卡宾类似体及铝杂环丙烯化合物的合成及性质研究[D]. 天津: 南开大学, 2013.
LI Xiao-fei. Synthesis and reactivity of the novel aluminum, thallium analogues of carbenes and aluminacyclopropene complexes[D]. Tianjin: Nankai University, 2013. |
| [23] |
Dohmeier C, Robl C, Tacke M, et al. The tetrameric aluminum(Ⅰ) compound[J].
Angewandte Chemie International Edition in English, 1991, 30(5): 564-565. DOI:10.1002/(ISSN)1521-3773 |
| [24] |
Schno ckel H. Structures and properties of metalloid Al and Ga clusters open our eyes to the diversity and complexity of fundamental chemical and physical processes during formation and dissolution of metals[J].
Chemical Reviews, 2010, 110(7): 4125-4163. DOI:10.1021/cr900375g |
| [25] |
Neu A, Mennekes T, Paetzold P, et al. Novel tetraalkyltetraboranes of the type B4R4, B4H2R4 and B4H4R4[J].
Inorganica Chimica Acta, 1999, 289(1): 58-69. |
| [26] |
Gauss J, Schneider U, Ahlrichs R, et al. 27Al NMR spectroscopic investigation of aluminum(Ⅰ) compounds:ab initio calculations and experiment[J].
Journal of the American Chemical Society, 1993, 115(6): 2402-2408. DOI:10.1021/ja00059a040 |
| [27] |
Koch K, Burgert R, Stösser G, et al. Understanding of the structure, bonding, formation and decomposition of metalloid aluminum clusters--a Fourier transform ion cyclotron resonance study of solid AlCp*[J].
European Journal of Mass Spectrometry(Chichester, England), 2005, 11(5): 469 DOI:10.1255/ejms.739 |
| [28] |
Wolinski K, Hinton J F, Pulay P. Efficient implementation of the gauge-independent atomic orbital method for NMR chemical shift calculations[J].
Journal of the American Chemical Society, 1990, 112(23): 8251-8260. DOI:10.1021/ja00179a005 |
| [29] |
Gauss J. Calculation of NMR chemical shifts at second-order many-body perturbation theory using gauge-including atomic orbitals[J].
Chemical Physics Letters, 1992, 191(6): 614-620. DOI:10.1016/0009-2614(92)85598-5 |
| [30] |
Wrackmeyer B, Contreras R. 199 Hg NMR Parameters[J].
Annual Reports on NMR Spectroscopy, 1992, 24: 267-329. DOI:10.1016/S0066-4103(08)60200-8 |
| [31] |
Purath A, Dohmeier C, Ecker A, et al. Synthesis and crystal structure of the tetraaluminatetrahedrane Al4, the second Al4R4 compound[J].
Organometallics, 1998, 17(9): 1894-1896. DOI:10.1021/om971015h |
| [32] |
Vollet J, Hartig J R, Schnöckel H. Al50C120H180:A pseudofullerene shell of 60 carbon atoms and 60 methyl groups protecting a cluster core of 50 aluminum atoms[J].
Angewandte Chemie International Edition, 2004, 43(24): 3186-3189. DOI:10.1002/(ISSN)1521-3773 |
| [33] |
Clayborne P A, Lopez-Acevedo O, Whetten R L, et al. The Al50Cp12* cluster-A 138-electron closed shell(L=6) superatom[J].
European Journal of Inorganic Chemistry, 2011(17): 2649-2652. |
| [34] |
Bono D, Hartig J, Huber M, et al. 27Al NMR Study of the Metal Cluster Compound Al50C120H180[J].
Journal of Cluster Science, 2007, 18(1): 319-331. DOI:10.1007/s10876-007-0111-3 |
| [35] |
Schnöckel H. Formation, structure and bonding of metalloid Al and Ga clusters.A challenge for chemical efforts in nanosciences[J].
Dalton Transactions, 2008, 33: 4344-4362. |
| [36] |
Burgert R, Schnöckel H. Monitoring the dissolution process of metals in the gas phase:reactions of nanoscale Al and Ga metal atom clusters and their relationship to similar metalloid clusters[J].
Chemical Communications, 2008(18): 2075-2089. DOI:10.1039/b801224e |
| [37] |
Binnewies M, Milke E.
References[M]. Wiley-VCH Verlag GmbH, 2002 |
| [38] |
Vollet J, Burgert R, Schnöckel H. Al20Cp8*X10(X=Cl, Br):Snapshots of the formation of metalloid clusters from polyhedral AlnXm molecules[J].
Angewandte Chemie International Edition, 2005, 44(42): 6956-6960. DOI:10.1002/(ISSN)1521-3773 |
| [39] |
Huber M, Schnöckel H. Al4(C5Me4H)4:Structure, reactivity and bonding[J].
Inorganica Chimica Acta, 2008, 361(2): 457-461. DOI:10.1016/j.ica.2007.04.009 |
| [40] |
Purath A, Dohmeier C, Ecker A, et al. Synthesis and structure of a neutral SiAl14 cluster[J].
Journal of the American Chemical Society, 2000, 122(29): 6955-6959. DOI:10.1021/ja991890p |
| [41] |
WeiβK, Schnöckel H. FT/ICR-mass spectrometry in nanotechnology:the investigation of metalloid clusters[J].
Analytical and Bioanalytical Chemistry, 2003, 377(7-8): 1098-1101. DOI:10.1007/s00216-003-2202-9 |
| [42] |
Li X, Grubisic A, Stokes S T, et al. Unexpected stability of Al4H6:a borane analog[J].
Science, 2007, 315(5810): 356-358. DOI:10.1126/science.1133767 |
| [43] |
Grubisic A, Li X, Stokes S T, et al. Closo-alanes(Al4H4, AlnHn+ 2, 4≤n≤ 8):A new chapter in aluminum hydride chemistry[J].
Journal of the American Chemical Society, 2007, 129(18): 5969-5975. DOI:10.1021/ja0700404 |
| [44] |
Li X, Grubisic A, Bowen K H, et al. Communications:Chain and double-ring polymeric structures:Observation of AlnH3n+1-(n=4-8) and Al4H14[J].
The Journal of chemical physics, 2010, 132: 241103 DOI:10.1063/1.3458912 |
| [45] |
Köhnlein H, Stösser G, Baum E, et al. A metalloid Al14 cluster with the structure of a "nano-wheel"[J].
Angewandte Chemie International Edition, 2000, 39(4): 799-801. DOI:10.1002/(ISSN)1521-3773 |
| [46] |
Xiang H, Kang J, Wei S H, et al. Shape control of Al nanoclusters by ligand size[J].
Journal of the American Chemical Society, 2009, 131(24): 8522-8526. DOI:10.1021/ja900965w |
| [47] |
Wiberg N, Blank T, Nöth H, et al. Dodecaindane(tBu3Si)8In12—A compound with an In12 deltapolyhedron framework[J].
Angewandte Chemie International Edition, 1999, 38(6): 839-841. DOI:10.1002/(ISSN)1521-3773 |
| [48] |
Köhnlein H, Purath A, Klemp C, et al. Synthesis and characterization of an Al693-cluster with 51 naked Al atoms:analogies and differences to the previously characterized Al772- cluster[J].
Inorganic Chemistry, 2001, 40(19): 4830-4838. DOI:10.1021/ic0104297 |
| [49] |
Gong X G, Sun D Y, Wang X Q. Atomic and electronic shells of Al77[J].
Physical Review B, 2000, 62(23): 15413 DOI:10.1103/PhysRevB.62.15413 |
| [50] |
Schnöckel H, Köhnlein H. Synthesis and structure of metalloid aluminum clusters—intermediates on the way to the elements[J].
Polyhedron, 2002, 21(5): 489-501. |
| [51] |
Uhl W, Hiller W, Layh M, et al. [Ga4{C(SiMe3)3}4] with a Tetrahedral Ga4 Skeleton[J].
Angewandte Chemie International Edition in English, 1992, 31(10): 1364-1366. DOI:10.1002/(ISSN)1521-3773 |
| [52] |
Beachley Jr O T, Blom R, Churchill M R, et al. indium(Ⅰ) and-indium(Ⅲ) compounds:syntheses, reactivities, and x-ray diffraction and electron diffraction studies of In(C5Me5)[J].
Organometallics, 1989, 8: 346-356. DOI:10.1021/om00104a012 |
| [53] |
Uhl W, Keimling S U, Klinkhammer K W, et al. TlⅠ[C(SiMe3)3]—an alkylthallium(Ⅰ) compound with a distorted tetrahedron of Tl atoms in the solid state[J].
Angewandte Chemie International Edition in English, 1997, 36(1-2): 64-65. |
| [54] |
Mocker M, Robl C, Schnöckel H. Donor-stabilized aluminum(Ⅰ) bromide[J].
Angewandte Chemie International Edition in English, 1994, 33(17): 1754-1755. DOI:10.1002/(ISSN)1521-3773 |
| [55] |
Klemp C, Koeppe R, Weckert E, et al. Al22Br20·12THF:The first polyhedral aluminum subhalide—a step on the path to a new modification of aluminum[J].
Angewandte Chemie International Edition, 1999, 38(12): 1739-1743. DOI:10.1002/(ISSN)1521-3773 |
| [56] |
Klemp C, Bruns M, Gauss J, et al. Al22Cl20·12L(L=THF, THP):The first polyhedral aluminum chlorides[J].
Journal of the American Chemical Society, 2001, 123(37): 9099-9106. DOI:10.1021/ja004022x |
| [57] |
Schnockel H, Klemp C. Molecular aluminium and gallium subhalides[J].
Inorganic Chemistry Highlights, 2002(1): 1966 |
| [58] |
Henke P, Huber M, Steiner J, et al. Al4(PtBu2)6-a derivative of Al4H6-and other Al4 Species:a challenge for bonding interpretation between zintl ions and metalloid clusters[J].
Journal of the American Chemical Society, 2009, 131(15): 5698-5704. DOI:10.1021/ja9007563 |
| [59] |
Wiberg N, Amelunxen K, Blank T, et al. Tetrasupersilyldialuminum[(t-Bu)3Si]2Al-Al[Si(t-Bu)3]2:The Dialane(4) with the Longest Al-Al Bond to Date, §[J].
Organometallics, 1998, 17(24): 5431-5433. DOI:10.1021/om980469r |
| [60] |
Hardman N J, Wright R J, Phillips A D, et al. Synthesis and Characterization of the Neutral "Digallene" Ar'GaGaAr' and Its Reduction to Na2Ar'GaGaAr'(Ar'=2, 6-Dipp2C6H3, Dipp= 2, 6-iPr2C6H3)[J].
Angewandte Chemie, 2002, 114(15): 2966-2968. DOI:10.1002/(ISSN)1521-3757 |
| [61] |
Pankewitz T, Klopper W, Henke P, et al. Isomeric Al2R4, Mg2R2 Species and Oligomerisation Products:Investigation of Al—Al and Mg—Mg σ Bonding[J].
European Journal of Inorganic Chemistry, 2008, 2008(31): 4879-4890. DOI:10.1002/ejic.v2008:31 |
| [62] |
Haaland A, Martinsen K G, Shlykov S A, et al. Molecular structure of monomeric(pentamethylcyclopentadienyl) aluminum(Ⅰ) by gas-phase electron diffraction[J].
Organometallics, 1995, 14(6): 3116-3119. DOI:10.1021/om00006a065 |
| [63] |
Wiberg N, Blank T, Kaim W, et al. Compounds of silicon and homologues, 134-Supersilyl compounds of boron and homologues, 10-Tri(supersilyl) dialanyl(tBu3Si)3Al2' and tetra(supersilyl) cyclotrialanyl(tBu3Si)4Al3'-New stable radicals of a group 13 element from thermolysis of(tBu3Si)4Al2'[J].
European Journal of Inorganic Chemistry, 2000(7): 1475-1481. |
| [64] |
Wehmschulte R J, Ruhlandt-Senge K, et al. Reduction of a tetraaryldialane to generate aluminum-aluminum[J].
Inorganic Chemistry, 1993, 32(14): 2983-2984. DOI:10.1021/ic00066a002 |
| [65] |
Roesky H W. The renaissance of aluminum chemistry[J].
Inorganic Chemistry, 2004, 43(23): 7284-7293. DOI:10.1021/ic0400641 |
| [66] |
Linti G, Schnöckel H, Uhl W, Wiberg N. Clusters of the heavier group 13 elements[J].
Molecular Clusters of the Main Group Elements, 2004: 126-168. |
| [67] |
Gemel C, Steinke T, Cokoja M, et al. Transition metal chemistry of low valent group 13 organyls[J].
European Journal of Inorganic Chemistry, 2004, 2004(21): 4161-4176. DOI:10.1002/(ISSN)1099-0682 |
| [68] |
Kuznetsov A E, Birch K A, Boldyrev A I, et al. All-metal antiaromatic molecule:rectangular Al44- in the Li3Al4- anion[J].
Science, 2003, 300(5619): 622-625. DOI:10.1126/science.1082477 |
| [69] |
Kuznetsov A E, Corbett J D, Wang L S, et al. Aromatic mercury clusters in ancient amalgams[J].
Angewandte Chemie, 2001, 113(18): 3473-3476. DOI:10.1002/(ISSN)1521-3757 |
| [70] |
Häuermann U, Lidin S, Simak S I, et al. The structure of α-gallium and its relationship to deltahedral clusters[J].
Chemistry-A European Journal, 1997, 3(6): 904-911. DOI:10.1002/(ISSN)1521-3765 |
| [71] |
Jones R O. Simulated annealing study of neutral and charged clusters:Al and Ga[J].
The Journal of Chemical Physics, 1993, 99: 1194 DOI:10.1063/1.465363 |
| [72] |
Akola J, Häkkinen H, Manninen M. Ionization potential of aluminum clusters[J].
Physical Review B, 1998, 58(7): 3601 DOI:10.1103/PhysRevB.58.3601 |
| [73] |
Ahlrichs Reinhart, Elliott Simon D. Clusters of aluminum, a density functional study[J].
Physical Chemistry Chemical Physics, 1999, 1(1): 13-21. DOI:10.1039/a807713d |
| [74] |
Khanna S N, Jena P. Assembling crystals from clusters[J].
Physical Review Letters, 1993, 71(1): 208-208. |
| [75] |
Gong X G, Kumar V. Enhanced stability of magic clusters:A case study of icosahedral Al12 X, X= B, Al, Ga, C, Si, Ge, Ti, As[J].
Physical Review Letters, 1993, 70(14): 2078 DOI:10.1103/PhysRevLett.70.2078 |
| [76] |
Leuchtner R E, Harms A C, Castleman Jr A W. Aluminum cluster reactions[J].
The Journal of Chemical Physics, 1991, 94: 1093 DOI:10.1063/1.460716 |
| [77] |
Schriver K E, Persson J L, Honea E C, et al. Electronic shell structure of group-ⅢA metal atomic clusters[J].
Physical Review Letters, 1990, 64(21): 2539 DOI:10.1103/PhysRevLett.64.2539 |
| [78] |
de Heer W A, Milani P, Chtelain A. Nonjellium-to-jellium transition in aluminum cluster polarizabilities[J].
Physical Review Letters, 1989, 63: 2834-2836. DOI:10.1103/PhysRevLett.63.2834 |
| [79] |
Nakajima A, Hoshino K, Naganuma T, et al. Ionization potentials of aluminum-sodium bimetallic clusters(AlNa)[J].
The Journal of Chemical Physics, 1991, 95: 7061 DOI:10.1063/1.461434 |
| [80] |
Rao B K, Jena P. Evolution of the electronic structure and properties of neutral and charged aluminum clusters:A comprehensive analysis[J].
The Journal of Chemical Physics, 1999, 111: 1890 DOI:10.1063/1.479458 |
| [81] |
King F L, Ross M M. Abundance distributions and dissociations of sputtered aluminum, gallium, and indium cluster ions[J].
Chemical Physics Letters, 1989, 164(2): 131-136. |
| [82] |
Fuke K, Nonose S, Kikuchi N, et al. Reaction of aluminum clusters, Aln(n=7~24), with oxygen and ammonia[J].
Chemical Physics Letters, 1988, 147(5): 479-483. DOI:10.1016/0009-2614(88)85012-7 |
| [83] |
Jarrold M F, Bower J E. Chemisorption on the microsurface of metal clusters:activation barriers and chemical reactions for carbon monoxide, nitrogen, oxygen, and methane on aluminum cluster[J].
Journal of the American Chemical Society, 1988, 110(20): 6706-6716. DOI:10.1021/ja00228a017 |
| [84] |
Kaya K, Fuke K, Nonose S, et al. Reaction of Aln clusters with oxygen and ammonia[M]//Small Particles and Inorganic Clusters. Springer Berlin Heidelberg, 1989: 571-573.
|
| [85] |
Burgert R, Schnöckel H, Grubisic A, et al. Spin conservation accounts for aluminum cluster anion reactivity pattern with O2[J].
Science, 2008, 319(5862): 438-442. DOI:10.1126/science.1148643 |
| [86] |
Burgert R, Schnöckel H, Olzmann M, et al. The Chlorination of the[Al13]- Cluster and the Stepwise Formation of Its Intermediate Products, [Al11]-, [Al9]-, and[Al7]-:A Model Reaction for the Oxidation of Metals[J].
Angewandte Chemie International Edition, 2006, 45(9): 1476-1479. DOI:10.1002/(ISSN)1521-3773 |
| [87] |
Olzmann M, Burgert R, Schnöckel H. On the kinetics of the Al+ Cl reaction:Cluster degradation in consecutive steps[J].
The Journal of Chemical Physics, 2009, 131: 174304 DOI:10.1063/1.3257684 |
| [88] |
Olzmann M, Troe J. Rapid approximate calculation of numbers of quantum states W(E, J) in the phase space theory of unimolecular bond fission reactions[J].
Berichte der Bunsengesellschaft für Physikalische Chemie, 1992, 96(10): 1327-1332. DOI:10.1002/bbpc.v96:10 |
The recent advances in the low-valent aluminum cluster complexes were systematically reviewed, containing organometallic cluster complexes, metalloid aluminum cluster complexes and Alnm -aluminum cluster complexes with Jellium model.The structure characteristics of the low-valent aluminum cluster complexes were analyzed in the following aspects, such as formation mechanism, coordination mode, performance characteristic and so on.