目前, 低易损性钝感弹药依然是含能材料领域密切关注的焦点[1-2]。但是随着研究的不断深入, 人们发现许多含能材料的爆轰性能与其摩擦感度、撞击感度以及热稳定性等物理化学性质存在明显的矛盾。解决这些问题主要有以下两种途径:(1)在含能分子或离子中引入氢键[3]; (2)在研究单质炸药的基础上, 合成一系列含能离子化合物[4-5]。这是因为含能离子化合物不仅具有较多的分子内或分子间氢键, 可以在某种程度上增加含能材料的密度; 而且具有较小的蒸汽压和较高的生成焓, 可以在某种程度上提高含能材料的爆轰性能。因此, 含能离子化合物成为含能材料领域研究的热点。1-氨基-3-硝基胍作为一种潜在的含能材料, 不仅合成步骤简单、性能优异(ρ, 1.77 g·cm-3) [6], 而且结构中的—NHNH2基团中的—NH2在酸性下很容易质子化形成1-氨基-2-硝基胍阳离子; 另一方面, 4-硝胺基-1, 2, 4-三唑分子结构中不仅含有大量的含能N—N、C—N、C=N键, 而且该化合物结构中的—NHNO2基团在硝基的强吸电子作用下很容易去质子化形成—NNO2阴离子。基于以上原因, 本课题组合成了一种新型含能离子盐—1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐, 并研究了其热分解行为及爆轰性能。
2 合成 2.1 试剂与仪器4-氨基-1, 2, 4-三唑, 自制; 硝基胍, 吴江市东吴农化有限公司; 浓硝酸、浓硫酸、浓盐酸、水合肼、硝酸银以及甲醇等试剂均为市售分析纯或化学纯。
IR 435型红外光谱仪(日本岛津), 500 MHz核磁共振仪(德国Bruker公司), Finnigan TSQ Quantumultra AM型质谱仪(美国Thermal公司), NETZSCH STA 409 PC/PG热重分析仪, HGZ型落锤仪。
2.2 实验过程 2.2.1 4-硝胺基-1, 2, 4-三唑的合成参照文献[7]方法合成4-硝胺基-1, 2, 4-三唑。
2.2.21 -氨基-2-硝基胍盐酸盐的合成参照文献[8]方法合成1-氨基2-硝基胍盐酸盐。
2.2.3 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的合成取0.01 mol(1.29 g) 4-硝胺基-1, 2, 4-三唑固体, 搅拌使其完全溶于去离子水并置于装有磁力搅拌的三口瓶中; 然后向其中缓慢滴加等摩尔量的硝酸银溶液, 滴加过程中立即产生白色沉淀。滴加完毕, 30 ℃下继续反应2 h即可得到4-硝胺基-1, 2, 4-三唑的银盐。
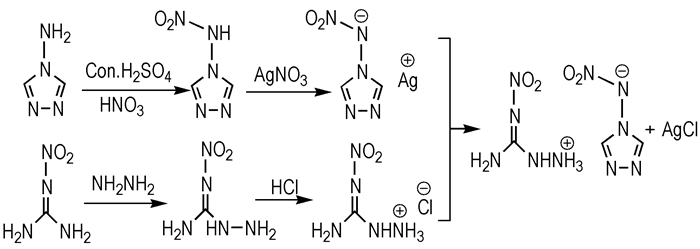
取0.01 mol(1.55 g)上述制备的1-氨基-2-硝基胍盐酸胍溶于20 mL去离子水, 然后将其缓慢滴加至上述4-硝胺基-1, 2, 4-三唑银盐的悬浮液中, 滴加完毕升温至50 ℃继续反应4 h。冷却至室温过滤出去滤渣, 收集滤液, 旋蒸除去溶剂得1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐白色固体(Scheme 1)。甲醇-水中重结晶, 纯度大于98.0%, 产率86.5%。1H NMR(DMSO-d6, 500 MHz) δ:8.17(s, 2H), 9.55(s, 6H); 13C NMR(DMSO-d6, 125 MHz)δ: 143.2, 161.8;IR(KBr, ν/cm-1):3402, 3316, 3135, 3090, 1771, 1666, 1408, 1357, 1311, 1172, 933, 660;ESI-MS(m/z):128 [M-H]-, 120 [M+H]+。
|
Scheme 1 Synthetic route of 1-amino-2-nitroguanidinium 4-nitroamino-1, 2, 4-triazole salt |
该反应的本质是1-氨基-2-硝基胍盐酸盐与4-硝胺基-1, 2, 4-三唑银盐的复分解反应。虽然4-硝胺基-1, 2, 4-三唑银盐在水溶液中呈悬浮状态, 但是相对于生成的不溶于水的氯化银, 4-硝胺基-1, 2, 4-三唑银盐在水溶剂中也存在一定的溶解度, 因此在一定反应条件下可以促使该反应的进行。此外, 由于1-氨基-2-硝基胍和4-硝胺基-1, 2, 4-三唑两种化合物已有文献报道, 因此本工作着重研究反应时间和反应温度对目标化合物1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐产率的影响。
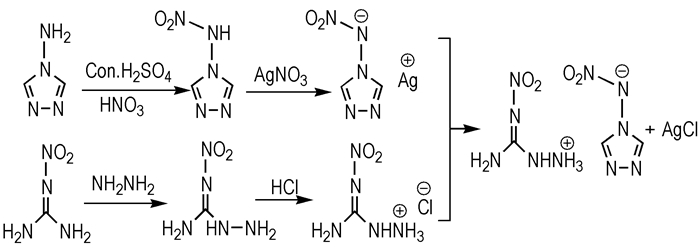
2.3.1 反应时间对目标化合物产率的影响在反应温度50 ℃下, 取等摩尔量的1-氨基-2-硝基胍盐酸盐和4-硝胺基-1, 2, 4-三唑银盐, 改变反应时间, 考察反应时间对目标化合物产率的影响, 结果如图 1所示。由图 1可见, 随着反应时间的增加目标产物的产率逐渐增加, 当反应时间为4 h时, 产率最高。此时再增加反应时间产率变化不明显, 分析可能原因是反应时间太短, 导致反应物反应不完全, 产率较低; 增加反应时间, 反应物之间可以充分接触, 因此目标化合物的产率有所增加; 反应时间为4 h左右, 反应达到平衡, 产率不再增加。故适宜的反应时间为4 h。
|
图 1 反应时间对产率的影响 Fig.1 Effect of the reaction time on the yield |
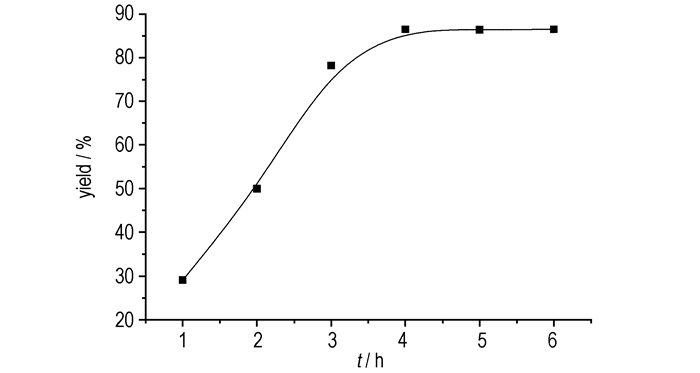
在反应时间为4 h下, 取等摩尔量的1-氨基-2-硝基胍盐酸盐和4-硝胺基-1, 2, 4-三唑银盐, 改变反应温度, 考察反应温度对目标化合物产率的影响, 结果如图 2所示。从图 2中可以看出, 随着温度的不断增加, 目标化合物产物的产率逐渐增加, 当反应温度为50 ℃时, 产率最大。继续增加反应温度, 目标产物产率略有下降。原因可能是随着温度升高, 反应逐渐被引发, 反应物之间充分反应, 因而目标化合物产率也随之增加。当温度高于50 ℃时, 目标化合物产率下降。这可能是因为反应物4-硝胺基-1, 2, 4-三唑银盐在高温下分解所致。故适宜的反应温度为50 ℃。
|
图 2 反应温度对产率的影响 Fig.2 Effect of the reaction temperature on the yield |
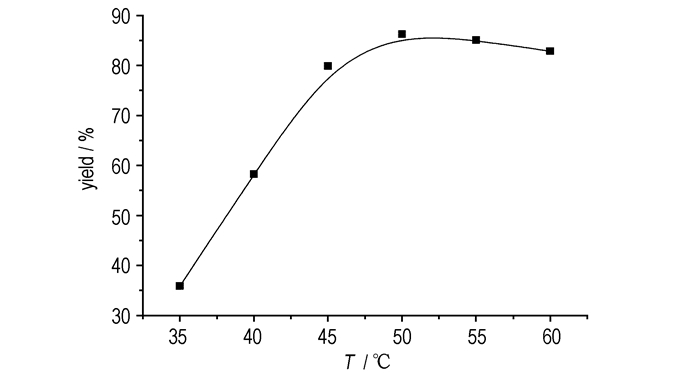
采用NETZSCH STA 409 PC/PG热重分析仪, 动态氮气气氛, 氮气流量40 mL·min-1, 温度范围30~400 ℃, 样品量为3.0 mg, 升温速率5 K·min-1条件下得到1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的TG-DSC谱图如图 3所示。TG曲线表明, 该化合物只存在一个失重阶段, 该阶段位于160~230 ℃, 失重为98%, 整个失重阶段目标化合物几乎完全分解。DSC曲线表明, 该化合物不存在熔融峰(熔化即分解), 只在175.5 ℃附近有存在一个尖锐的放热峰, 说明该化合物热稳定性较好; 峰形窄而尖, 说明在该温度范围发生了剧烈的热分解反应。
|
图 3 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的TG-DSC曲线(5 K·min-1) Fig.3 TG-DSC curve of 1-amino-2-nitroguanidinium 4-nitroamino-1, 2, 4-triazole salt at a heating rate of 5 K·min-1 |
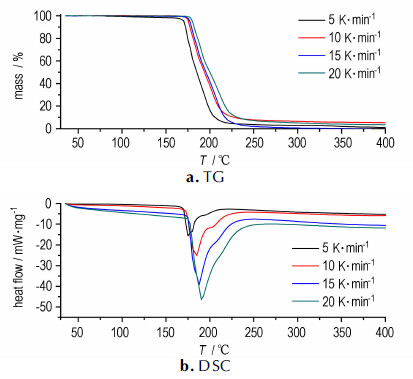
1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐在不同升温速率下(5, 10, 15, 20 K·min-1)的热性能分析见图 4。由图 4可见, 随着升温速率的不断增加, 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的TG和DSC曲线明显发生右移, 分解温度也随之提高。
|
图 4 不同升温速率下1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的TG和DSC曲线 Fig.4 TG and DSC curves of 1-amino-2-nitroguanidinium 4-nitroamino-1, 2, 4-triazole salt at different heating rates |
为进一步了解1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的热分解行为, 对其进行了热分解动力学分析。根据实验数据, 首先利用Kissinger(方程1)[9], Ozawa(方程2)[10]进行拟合计算, 得到表观活化能数据, 然后利用方程式(3)~(7)[11]进而计算得到相应的热力学参数, 计算结果列于表 1。
| 表 1 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的热分解动力学参数 Tab.1 Kinetic parameters of the thermal decomposition reaction for 1-amino-2-nitroguanidinium 4-nitroamino-1, 2, 4-triazole salt |
| $ {\rm{ln}}\frac{{{\beta _i}}}{{{T_{{\rm{p}}i}}^2}} = {\rm{ln}}\frac{{{A_K}R}}{{{E_K}}}-\frac{{{E_K}}}{{R{T_{{\rm{p}}i}}}} $ | (1) |
| $ {\rm{ln}}\beta = const.-0.4567\frac{{{E_0}}}{{R{T_{{\rm{p}}i}}}} $ | (2) |
| $ A = (\frac{{{k_B}T}}{h}){\rm{exp}}(\frac{{\Delta {S^ \ne }}}{R}) $ | (3) |
| $ \Delta {H^ \ne } = Ek-R{T_{{\rm{p}}0}} $ | (4) |
| $ \Delta {G^ \ne } = \Delta {H^ \ne }-{T_{{\rm{p}}0}}\Delta {S^ \ne } $ | (5) |
| $ {T_{{\rm{pi}}}} = {T_{{\rm{p0}}}} + b{\beta _i} + c{\beta _i}^2 + d{\beta _i}^3 $ | (6) |
| $ {T_{\rm{b}}} = \frac{{{E_0}-\sqrt {{E_0}^2-4{E_0}R{T_{{\rm{p}}0}}} }}{{2R}} $ | (7) |
式中, βi为线性升温速率, K·min-1; Tpi为峰值温度, ℃; Tp0为外推温度, K; A为指前因子, s-1; R为气体常数, 8.314 J·mol-1·K-1; kB为Boltzmannt常数, 1.3807×10-23J·K-1; h为Planck常数, 6.626×10-34J·s-1; Ek为Kissinger活化能, kJ·mol-1; Eo为Ozawa活化能, kJ·mol-1; ΔH≠为活化焓, kJ·mol-1; ΔG≠为吉布斯自由能, kJ·mol-1; ΔS≠为活化熵, J·mol-1·K-1; Tb, 临界爆炸温度, K。
由表 1可见, 利用Kissinger和Ozawa方法得到的表观活化能非常相近, 并且两种方法的线性相关性系数r都都接近1(rk和ro均为0.98), 因此该测试结果可信; 计算得到E、ΔH≠、ΔG≠、ΔS≠以及Tb的值分别为149.8 kJ·mol-1(Kissinger法), 149.6 kJ·mol-1(Ozawa法), 77.6 J·mol-1·K-1, 113.3 kJ·mol-1, 146.3 kJ·mol-1和436 ℃, 说明1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的热分解反应为放热的熵增反应; 爆炸临界温度为436 K, 说明1-氨基-2-硝基胍与4-硝胺基-1, 2, 4-三唑成盐后对提高化合物的热稳定性有促进作用, 保证了使用和存储过程的安全。
4 爆轰性能Kamlet-Jacobs公式是计算CaHbOcNd类高能量密度化合物爆速和爆压最常用、最简易的方法[12]:
| $ D = 1.01{(N{{\bar M}^{1/2}}{Q^{1/2}})^{1/2}}\left( {1 + 1.3\rho } \right) $ | (8) |
| $ p = 1.558{\rho ^2}N{{\bar M}^{1/2}}{Q^{1/2}} $ | (9) |
式中, D, 爆速, km·s-1; p, 爆压, GPa; ρ, 密度, g·cm-3; N, 每克炸药爆轰生成气体的量, mol·g-1; M , 气体产物的平均摩尔质量, g·mol-1; Q, 单位质量炸药的最大爆热, cal·g-1。
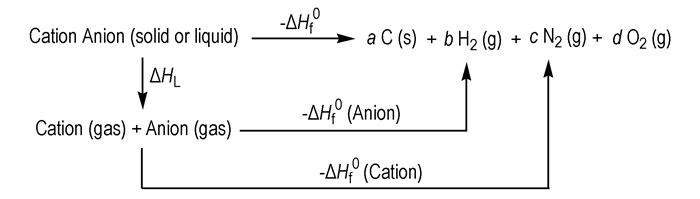
根据Kamlet-Jacobs方程, 为获得爆压、爆速等爆轰参数值, 首先运用Born-Haber循环(图 5)[13]计算得到目标化合物的标准摩尔生成焓。
|
图 5 离子液体形成的Born-Haber循环体系(产物摩尔量分别为a, b, c, d) Fig.5 The Born-Haber cycle of ionic liquids(a, b, c, d are molar mass of the products) |
根据该循环体系, 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的标准摩尔生成焓可用方程(10)[14]计算得到:
| $ \begin{array}{l} \Delta {H_{\rm{f}}}^0({\rm{ionic \;salt}}, 298{\rm{ K}}) = \sum \Delta {H_{\rm{f}}}^0\left( {{\rm{cation}}, 298{\rm{ K}}} \right)\\ + \sum \Delta {H_{\rm{f}}}^0\left( {{\rm{anion}}, 298{\rm{ K}}} \right)-\Delta {H_{\rm{L}}} \end{array} $ | (10) |
式中, ΔH(cation, 298 K)和ΔH(anion, 298 K)分别为阳离子和阴离子的生成焓, 可由文献[15]和[16]得到; ΔHL为离子盐的晶格能; 对1:1型离子盐, 考虑阳离子和阴离子非线性性质, ΔHL由方程(11)得到:
| $ \Delta {H_{\rm{L}}} = {U_{{\rm{POT}}}} + [p({n_{\rm{M}}}/2-2) + q({n_{\rm{X}}}/2-2)]RT $ | (11) |
式中, nM和nX分别由离子Mp+和Xq-的性质决定; p, q分别为阳阴离子电荷数; R, 气体常数, 8.314 J·mol-1·K-1; T, 温度, K。nM和nX的值, 对于单原子离子取3, 线型多原子离子取5, 非线型多原子离子取6。UPOT(kJ·mol-1)可由方程(12)得到:
| $ {U_{{\rm{POT}}}} = 1981.2{(\rho /M)^{1/3}} + 103.8 $ | (12) |
式中, M, 离子盐的分子量, g·mol-1; ρ, 目标化合物的密度, g·cm-3; 采用比重瓶法, 多次测量密度求平均值, 得到该化合物的实测密度为1.59 g·cm-3。综合以上各式, 求得该离子盐的生成热551.3 kJ·mol-1, 爆压26.6 GPa, 爆速8.05 km·s-1。
为进一步研究1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐在储存和使用过程中的稳定性, 根据GJB772A-1997标准中的方法601.1, 对样品进行撞击感度测试。撞击感度测试条件为:试验用落锤10 kg, 落高250 mm, 样品重50 mg, 环境温度22 ℃, 环境湿度60%。测试结果显示, 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的50发爆炸概率为18%。因此, 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐是一种潜在的钝感含能材料。以上数据都为研究1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的物理化学性质以及进一步合成以1-氨基-2-硝基胍阳离子为基的其他含能离子化合物提供了重要依据。
5 结论(1) 以4-氨基-1, 2, 4-三唑和1-氨基-2-硝基胍为原料, 制备了一种新型含能离子盐—1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐并优化了反应条件, 探讨了合成目标化合物的影响因素并得到最佳工艺条件:反应时间为4 h, 反应温度为50 ℃。目标产物产率最高为86.5%。
(2) 热分析表明, 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐在175.5 ℃附近存在剧烈的放热峰, 表观活化能(E), 活化熵(ΔS≠), 活化吉布斯自由能(ΔG≠), 活化焓(ΔH≠)和爆炸临界温度(Tb)分别为149.8 kJ·mol-1(Kissinger法), 149.6 kJ·mol-1(Ozawa法), 77.6 J·mol-1·K-1, 113.3 kJ·mol-1, 146.3 kJ·mol-1和436 K。
(3) 利用Born-Haber循环求得该化合物的生成热为551.3 kJ·mol-1; 基于理论密度和生成热并运用Kamlet-Jacobs公式进一步得到该化合物的爆速8.05 km·s-1, 爆压26.6 GPa。
(4) 撞击感度实验表明, 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐爆炸概率为18%, 是一种较为钝感的含能化合物。
| [1] |
金兴辉, 胡炳成, 贾欢庆, 等. 3, 7-二硝亚胺基-2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂双环[3.3.0]辛烷结构与性能的量子化学研究[J].
高等学校化学学报, 2013, 34(7): 1685-1690. JIN Xing-hui, HU Bing-cheng, JIA Huan-qing, et al. Studies of quantum chemistry of structure and properties of 3, 7-bis(nitroimino)-2, 4, 6, 8-tetranitro-2, 4, 6, 8-tetraazabicyclo[3.3.0] octane[J]. Chemical Journal of Chinese Universities, 2013, 34(7): 1685-1690. DOI:10.7503/cjcu20130011 |
| [2] |
Pagoria P F, Lee G S, Mitchell A R, et al. A review of energetic materials synthesis[J].
Thermochimica Acta, 2002, 384(1): 187-204. |
| [3] |
JIN Xing-hui, HU Bing-cheng, JIA Huan-qing, et al. Structure, thermal behavior, and energetic properties of 4-amino-1, 2, 4-triazole dinitroguanidine Salt[J].
Australian Journal of Chemistry, 2014, 67(2): 277-282. |
| [4] |
Zhang Y, Guo Y, Joo Y H, et al. 3, 4, 5-trinitropyrazole based energetic salts[J].
Chemistry-A European Journal, 2010, 16(35): 10778-10784. |
| [5] |
刘威, 李玉川, 李小童, 等. 5-氨基四唑硝仿盐的理论计算[J].
含能材料, 2013, 21(2): 213-216. LIU Wei, LI Yu-chuan, LI Xiao-tong, et al. Theoretical computation of 5-aminotetrazolium nitroformate[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(2): 213-216. |
| [6] |
张光全, 刘晓波, 黄明. 含能硝基胍衍生物的研究进展[J]. 含能材料, 2013, 21(5): 668-674.
ZHANG Guang-quan, LIU Xiao-bo, HUANG Ming. Chinese Journal of Energetic Materials(Hanneng Cailiao) 2013, 21(5): 668-674. |
| [7] |
Katritzky A R, Sommen G L, Gromova A V, et al. Synthetic routes towards tetrazolium and triazolium dinitromethylides[J].
Chemistry of Heterocyclic Compounds, 2005, 41(1): 111-118. |
| [8] |
Fischer N, Klapötke T M, Lux K, et al. Inorganic amino-nitro-guanidinium derivatives[J].
Crystals, 2012, 2(2): 675-689. |
| [9] |
Kissinger H E. Reaction kinetics in differential thermal analysis[J].
Analytical Chemistry, 1957, 29(11): 1702-1706. |
| [10] |
Ozawa T. A new method of analyzing thermogravimetric data[J].
Bulletin of The Chemical Society of Japan, 1965, 38(11): 1881-1886. |
| [11] |
Najafi M, Samangani A K. Non-isothermal kinetic study of the thermal decomposition of melamine 3-nitro-1, 2, 4-triazol-5-one salt[J].
Propellants, Explosives, Pyrotechnics, 2011, 36(6): 487-492. |
| [12] |
Kamlet-Jacobs M J, Jacobs S J. A simple method for calculating detonation properties of CHNO explosives[J].
Journal of Physical Chemistry, 1968, 48(1): 23-35. |
| [13] |
Thottempudi V, Shreeve J M. Synthesis andpromising properties of a new family of high-density energetic Salts of 5-nitro-3-trinitromethyl-1H-1, 2, 4-triazole and 5, 5'-bis(trinitromethyl)-3, 3'-azo-1H-1, 2, 4-triazole[J].
Journal of the American Chemical Society, 2011, 133(49): 19982-19992. |
| [14] |
Jenkins H D B, Tudeal D, Glasser L. Lattice potential energy estimation for complex ionic salts from density measurements[J].
Inorganic Chemistry, 2002, 41(9): 2364-2367. |
| [15] |
Fischer N, Klapötke T M, Stierstorfer J. 1-amino-3-nitroguanidine(ANQ) in high-performance ionic energetic materials[J].
Zeitschrift fur Naturforschung B-Journal of Chemical Sciences, 2012, 67(6): 573-588. |
| [16] |
Huang Y, Gao H, Twamley B, et al. Nitroaminotriazoles:nitrogen-rich precursors of stable energetic salts[J].
European Journal of Inorganic Chemistry, 2008, 2008(16): 2560-2568. |
A novel energetic salt 1-amino-3-nitroguanidinium 4-nitroamino-1, 2, 4-triazole salt was synthesized and characterized.




