近年,人们对高能量密度含能材料(HEDM)的要求越来越高,新含能材料的研究主要是寻找那些有更高爆炸性能、更低感度及热安定性良好的化合物[1]。为满足新型高能低(钝)感单质炸药的标准,即具有良好的热稳定性和与相关材料的相容性,对火、光、热、撞击、摩擦外界条件的刺激不敏感,有与黑索今(RDX)甚至奥克托今(HMX)相当的能量,炸药研究者不断努力寻找新型高能、低(钝)感单质炸药[2-3]。高氮杂环化合物中含有大量的N—N、C=N和C—N高能量的化学键,因而具有很高的生成焓。杂环的稳定性而使以环为基础的修饰和改性成为可能,这是其化学潜能的主要来源[4],故高氮杂环化合物的合成与应用成为含能材料领域研究的焦点。
多硝基咪唑类杂环化合物作为高氮化合物的代表过去通常作为药物被广泛研究[5-7],20世纪60年代,硝基咪唑类衍生物的药理研究达到顶峰。直至最近几十年才发现多硝基咪唑类杂环化合物具有优良的炸药特性,是一类值得深入探索研究的新型高能炸药[8]。多硝基咪唑类杂环化合物中氮原子的电负性较高,能形成类似苯环结构的大π键,作为炸药对外界刺激不敏感,热安定性较好。同时,硝基咪唑环具有较高张力,化学稳定性更强,较低的碳氢含量形成了较高的氧平衡。多硝基咪唑及其衍生物的代表有:1, 4-二硝基咪唑(1, 4-DNI, Ⅰ)、2, 4-二硝基咪唑(2, 4-DNI, Ⅱ)、4, 5-二硝基咪唑(4, 5-DNI, Ⅲ)、2, 4, 5-三硝基咪唑(2, 4, 5-TNI, Ⅳ)、1-甲基-2, 4-二硝基咪唑(2, 4-MDNI, Ⅴ)、1-甲基-4, 5-二硝基咪唑(4, 5-MDNI, Ⅵ)、1-甲基-2, 4, 5-三硝基咪唑(MTNI, Ⅶ)、1-苦基-2, 4-二硝基咪唑(2, 4-PDNI, Ⅷ)、1-乙酸乙酯-2, 4, 5-三硝基咪唑(CTNII, Ⅸ)、1-苦基-2, 4, 5-三硝基咪唑(PTNI, Ⅹ),其相互间的转换关系见Scheme 1。

|
Scheme 1 Synthesis routes of nitroimidazoles energetic materials |
由Scheme 1可知咪唑环上能发生异构化反应(如重排)、亲电取代反应(如硝化、碘代)等,向咪唑环上引入甲基、硝基、苦基等取代基可得到多种硝基咪唑类化合物。该类硝基咪唑类化合物大多具有良好的爆炸性、撞击感度、摩擦感度、安定性等,均可以与TNT、RDX、HMX等传统炸药相匹敌,且在推进剂和熔铸炸药方面应用广泛。自1995年Reddy Damavaipu等人[9]发现2, 4-DNI具有优良性能且是一种不敏感单质炸药后,硝基咪唑类化合物在含能材料领域被广泛研究。2001年,Jin Rai Cho[10]以咪唑为原料经过五步反应首次合成MTNI,同时对其感度及热稳定性进行了分析,指出MTNI为高能、钝感、热稳定性好的单质炸药,可作为TNT的替代品。自此之后,多硝基咪唑化合物尤其MTNI的合成及性能研究成为国内外炸药合成者关注的焦点。本文参考国内外文献,综述了以咪唑环为“母体”的10种硝基化合物的合成研究进展,对合成路线中存在的问题进行了简要评述,希望能为混合炸药的配制、熔铸炸药载体的配方等提供帮助。
2 硝基咪唑含能化合物 2.1 二硝基咪唑的合成及性能 2.1.1 1, 4-二硝基咪唑(1, 4-DNI, Ⅰ)1, 4-DNI是咪唑环上2位和4位的H被硝基取代的一种五元杂环化合物,为白色固体,熔点为92 ℃。MS(EI)m/z:158(M+),46(NO+),30(NO+); 1H NMR (CDCl3) δ:8.9(s, H, C2—H),9.2(s, H, C5—H)[9]。1, 4-DNI作为多硝基咪唑类化合物,虽不能作为炸药但也具备一定能量,是合成2, 4-DNI、MTNI等的重要中间体。据文献报道目前有两种合成方法:一是咪唑法,即以咪唑为原料,浓硫酸、乙酸酐和硝酸铵等组成的硝化剂直接硝化(见Scheme 2[11-13]); 二是硝基咪唑法,即以硝基咪唑为原料,以乙酸、乙酸酐和浓硝酸组成的硝化体系,硝化制得(见Scheme 3[14])。
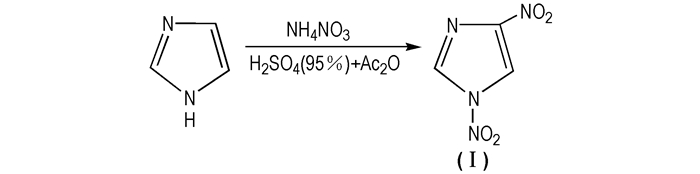
|
Scheme 2 Synthesis route of 1, 4-DNI from imidazole |
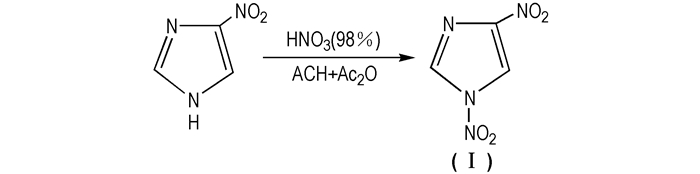
|
Scheme 3 Synthesis route of 1, 4-DNI from nitroimidazole |
1963年,Lnacini等[15]通过硝化2-硝基咪唑合成1, 4-DNI。由于2-硝基咪唑的价格昂贵,反应生成的副产物比较多,而且纯度低,得率低,因此这种方法很难实现工业化。后来又通过硝化4-硝基咪唑合成1, 4-DNI。
1983年,Grigoreva Valentin等[16]通过硝化4-硝基咪唑得到1, 4-DNI。具体合成路线为:将4-硝基咪唑、95%的硫酸和乙酸酐混合,升温至35~40 ℃,在此温度下反应3 h。之后降温至10~15℃并加硝酸铵,完毕后再升温至35~40 ℃,反应3 h。最后将反应液冷却至室温,并倒入冰水混合液中,静置片刻后用1, 2-二氯乙烷萃取。合并萃取相,蒸发溶剂得到1, 4-DNI,总得率为83%。此工艺的条件比较苛刻,加入硝酸铵易于成团,反应不易控制,容易发生危险。
1987年,Jerzy Suwinski等[12]把2-硝基咪唑加入到冰醋酸中,然后滴加发烟硝酸,加完后再加乙酸酐,此时反应温度会上升到40~45 ℃,在此温度下持续反应1 h。最后将反应液冲到冰水混合液中,静置,析出沉淀,抽滤,并用氯乙烯提纯,得率为88%。
1989年,M.Ross Grimmett等[17]将4-硝基咪唑溶解到冰醋酸中,然后滴加硝酸,滴完后冷却至室温并加乙酸,之后反应1 h。最后将反应液缓慢滴入碎冰中,静止片刻用二氯甲烷萃取,得1, 4-DNI,得率为85%。
1995年,Reddy Damavaipu等[9]对合成工艺进行改进,用冰醋酸溶解4-硝基咪唑,冷却到0 ℃,滴加98%的浓硝酸,然后控温5 ℃滴加乙酸酐,并在此温度下反应2 h,升温到25 ℃,继续反应8 h,得率为83%。鉴于此方法原料便宜,操作简单,纯度和得率较高,目前均采用此方法进行小批量生产。
2005年,曹端林等[11]在Scheme 3的基础上用浓硫酸代替乙酸,硝酸钠代替硝酸合成1, 4-DNI,即:硝酸钠34 g,乙酸酐75 mL,反应时间3 h,反应温度30~40 ℃,产率87%。同时研究了1, 4-DNI的热分解和稳定性。通过计算得到1, 4-DNI的熔化热为14.52 kJ·mol-1,分解热为151.11 kJ·mol-1。
2011年,刘慧君等[18]以4-硝基咪唑为原料,采用二氯甲烷为溶剂,五氧化二氮为硝化剂合成1, 4-DNI。对反应条件进行优化,最高得率为91%。此合成方法相对传统合成方法的优点是:(1)易控温; (2)无需处理废酸; (3)产物分离简单; (4)硝化的选择性高; (5)不会发生氧化等副反应; 缺点是五氧化二氮的制备难以实现工业化。
2012年,张俊娜等[19]在室温下于乙醇溶液中培养了1, 4-DNI的单晶,表明其属于正交晶系,空间群为P2I2I2I,晶体学参数为:β=90.00°,a=5.8323(13) nm,b=9.562(2) nm,c=10.302(2) nm,V=574.5(2) nm3,Z=4,Dc=1.828·cm-3,F(000)=320。
2.1.2 2, 4-二硝基咪唑(2, 4-DNI, Ⅱ)2, 4-DNI是1, 4-DNI的同分异构体,黄色固体,有无定型和晶体两种形态,溶于乙醇,不溶于水,密度为1.77 g·cm-3,熔点为277.9 ℃,爆速为8130 m·s-1,爆压为28.1 GPa,标准生成焓为290 kJ·mol-1。MS(EI)m/z:158(M+),46(NO2+),30(NO+); 1H NMR (CDCl3) δ:8.6(s,H, C2—H),11.7(s, H, C4—H)[9, 20]。在乙腈中培养得到的单晶为正交晶系,晶胞参数[21]为: a=10.127(2) Å,b=18.497(2) Å,c=6.333(2) Å,Z=8。Reddy Damavaipu等[9]首次发现2, 4-DNI的能量比TATB高约30%(见表 1),摩擦感度、撞击感度、爆发点、真空热及稳定性优于RDX和HMX,是一种不敏感单质炸药,同时也是合成2, 4, 5-TNI、MTNI等的中间体。为此,2, 4-DNI在含能材料领域的研究拉开序幕。王军[22]对2, 4-DNI进行了综合研究发现:2, 4-DNI虽有诸多优良性能,但却有一致命缺点,即酸性较强[22-23]。为了解决2, 4-DNI的酸性问题,杨威[24]、郑晓东[25]、崔荣[26]等合成了2, 4-DNI的金属盐、2, 4-DNI的有机铵盐及一系列配合物[24-26]。目前2, 4-DNI的合成方法主要有① 2-硝基咪唑硝化法(见Scheme 4[27])② 1, 4-DNI的热重排法(Scheme 5[16])。
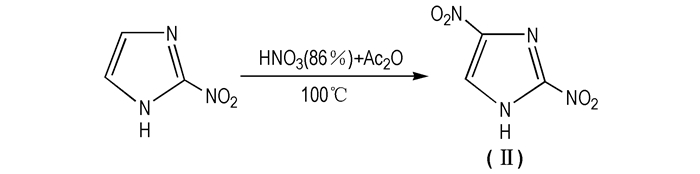
|
Scheme 4 Synthesis route of 2, 4-DNI from 2-nitroimidazole |
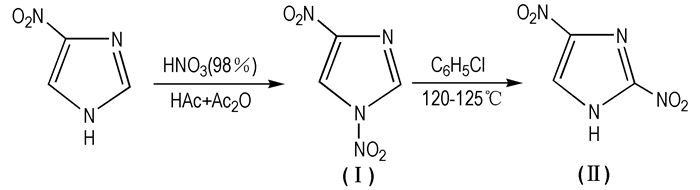
|
Scheme 5 Synthesis route of 2, 4-DNI from 4-nitroimidazole |
① 2-硝基咪唑法
1963年,Lancici等[27]合成了2, 4-DNI。具体合成路线为:将2-硝基咪唑加到86%的硝酸和乙酸酐(0 ℃)的混合液中,随后升温到100 ℃并反应2 h,再升温115 ℃反应30 min。最后将反应液冷却至室温并倒入冰水中,用乙酸乙酯萃取,得到2, 4-DNI,总得率为56%。2-硝基咪唑的价格昂贵,且反应的副产物较多,目标物得率低,该方法难以实现工业化生产。
② 热重排法
热重排法有两种[28, 30],溶剂热重排法和微波热重排法。溶剂热重排法:将1, 4-DNI加入到氯苯中,加热到120~125 ℃,反应3~4 h,经重排得到2, 4-DNI。Sharnin[28]指出在其它重排溶剂中,比如苄腈、苯甲醚等,不会得到2, 4-DNI。微波重排法:2004年,Bhaumik[29]等通过微波加热,将1, 4-DNI热重排得到2, 4-DNI。刘慧君[30-31]等利用微波辅助法得到2, 4-DNI,同时讨论了反应时间、微波功率等因素对目标产物的影响,最高得率可达98%。微波辅助法代替常规加热,缩短了反应时间,提高了转化率,适合工业化生产。
2.1.3 4, 5-二硝基咪唑(4, 5-DNI, Ⅲ)4, 5-DNI为黄色固体,熔点为188~189 ℃。MS(EI)m/z:158(M+),46(NO2+),30(NO+),1H NMR (CDCl3) δ:8.9(s, H, C2—H),11.3(s, H, N—H)。Bracutin[32]研究了4, 5-DNI的晶体结构,空间群为P21/n,晶胞参数:a=11.5360(8)Å,b=9.071(1)Å,c=11.822(1)Å,β=107.640(6)°,Z=8,ρ=1.78 g·cm-3。Bracutin提出由于硝基比硝氨基更加稳定,故硝基在C位上的取代比在N位上容易。同时发现4, 5-DNI分子结构和X射线衍射结构略有不同,这是由于相邻分子的堆积作用导致。同时,Bracutin[33]发现4, 5-DNI是一种很好的不敏感炸药,环上两个硝基的吸电子作用,导致N—H显酸性。李永祥等[34]将4, 5-DNI与氨气反应生成4, 5-DNI铵盐的水合物,消除了4, 5-DNI的酸性。4, 5-DNI铵盐可以作为燃烧催化剂,用于推进剂中。目前,通常直接硝化4-硝基咪唑或咪唑制备4, 5-DNI。
1979年,Novikov S S等[35]通过硝化4-硝基咪唑首次合成出4, 5-DNI。但是因4-硝基咪唑价格昂贵,故不适合大批量生产。
2006年,杨国臣等[36]以价格较低的咪唑为原料,改进了合成工艺条件。具体路线为:氮气保护,硝硫混酸为硝化剂,咪唑为原料,采用正加料、二次加料的方式即先滴加混酸,硝化硫酸咪唑盐,再在反应液中滴加98%的硝酸,合成4, 5-DNI(见Scheme 6)。
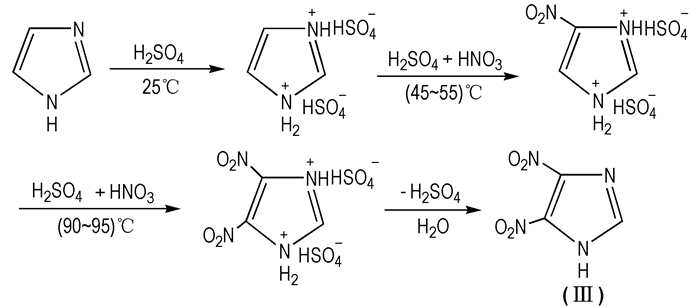
|
Scheme 6 Synthesis route of 4, 5-DNI |
2, 4, 5-TNI是咪唑环的2位、4位和5位的H被硝基取代的化合物, 熔点为248 ℃,爆速为8.73 km·s-1,爆压为32.1 GPa,密度为1.93 g·cm-3,标准生成焓为229.05 kJ·mol-1,感度低于RDX和HMX。Vadimiroff等[37]认为硝基咪唑的酸性随着硝基个数的增加而增加,碱性却相反。通常是向2, 4, 5-TNI的1位N上引入Na+或K+,使之成盐,此时能量与RDX相近且稳定性大大增加。高海翔等[38]将2, 4, 5-TNI与一些高氮碱性试剂中和合成出了多种2, 4, 5-TNI的含能离子盐,从而也解决了2, 4, 5-TNI的酸性问题,同时呈现良好的安定性。但这些以含能离子盐形式存在的炸药存在一个弱点:很强的吸潮吸湿性。这一致命缺点严重影响了其在炸药领域中的广泛应用,另外,由于成盐后导致感度普遍增高,其应用受到制约。为此,国内外研究者通过向硝基咪唑环上的1位N上引入了甲基、酯基、苦基、氨基、硝氨基等,分别得到1-甲基-2, 4, 5-三硝基咪唑[10]、1-乙酸乙酯-2, 4, 5-三硝基咪唑、1-苦基-2, 4, 5-三硝基咪唑[39]、1-氨基-2, 4, 5-三硝基咪唑、1-硝氨基-2, 4-二硝基咪唑[40]等多种新型高能低(钝)感炸药。
2, 4, 5-TNI的合成方法有两种。一是以2, 4, 5-三碘基咪唑为原料,在硝酸的作用下,生成2, 4, 5-TNI,收率不足10%。该方法收率较低,且副产物较多,故不能用于小批量生产。二是以咪唑为原料,两步硝化生成1, 4-DNI; 然后1, 4-DNI在氯苯作用下,热重排为2, 4-DNI; 2, 4-DNI在硝硫混酸作用下可生成2, 4, 5-TNI,收率为62%[41]。
2.3 衍生物的合成及性能 2.3.1 1-甲基-2, 4-二硝基咪唑(2, 4-MDNI, Ⅴ)2, 4-MDNI是2, 4-DNI的1位H被甲基取代得到的白色固体,熔点为142~143 ℃。IR(KBr, ν/cm-1):2899(CH3),1461,3152(CH, s),1138(C—N, s),1515(C—C, s),1556(NO2, s),1325(s)。1H NMR (DMSO-d6) δ:4.279(d, 3H, CH3),8.525(d, 1H, C5H)。杨威等[42]研究2, 4-MDNI的性能发现:2, 4-MDNI的感度很低,4MPa压力下热解温度为360.60 ℃,热稳定性优于2, 4-DNI。张晓玉等[43]在丙酮溶液中培养了2, 4-MDNI的单晶,经过分析检测得出:2, 4-MDNI为正交晶系,P2Ⅰ2Ⅰ2Ⅰ空间群,a=6.215(12) Å,b=9.431(19) Å,c=23.531(5) Å,V=1379.3(5) Å3,ρ=1.658 g·cm-3,Z=8,F(000)=704,μ=0.149 mm-1。目前2, 4-MDNI主要通过以咪唑为原料,经过两步硝化、重排,最后甲基化得到(Scheme 7)。
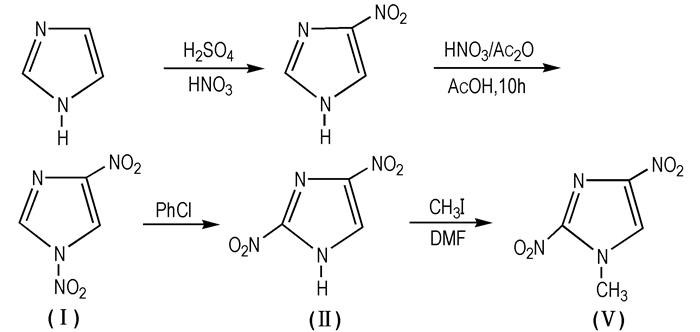
|
Scheme 7 Synthesis route of 2, 4-MDNI |
4, 5-MDNI是4, 5-DNI的1位H被甲基取代得到,黄色晶体,熔点为77 ℃,IR(KBr,ν/cm-1):3437(C=N),1052(C=C),1185(C—N),1547,1328(C—NO2),1423(CH3)。1H NMR (DMSO-d6) δ:3.63(d,3H,CH3),8.18(d,1H,C2H)。陈丽珍等[44]以乙腈为溶剂培养得到了4, 5-MDNI的单晶,并用X射线单晶衍射仪测定了晶体结构,分析表明:晶体属斜方晶系,空间群为Pna21,晶体学参数为:a=0.8412(2)nm,b=1.2646(3)nm,c=0.6563(1)nm,V=0.6982(3)nn3。Z=4,Dc=1.637 g·cm-3,μ=0.147 mm-1,F(000)=352。曹端林等[45]将4, 5-DNI与4, 5-MDNI对比发现:4, 5-MDNI的酸性较低,熔点较低,热安定性较低,熔铸性得到较大改善,装药更方便。目前,4, 5-MDNI主要通过甲基化法和直接硝化法合成。
① 甲基化法
宋磊等[46]以咪唑为原料,经过两步硝化得到4, 5-DNI,然后再甲基化得到4, 5-MDNI,同时优化了合成工艺,目标产物的总得率为62%,并讨论了4, 5-DNI的硝化机理(Scheme 8)。
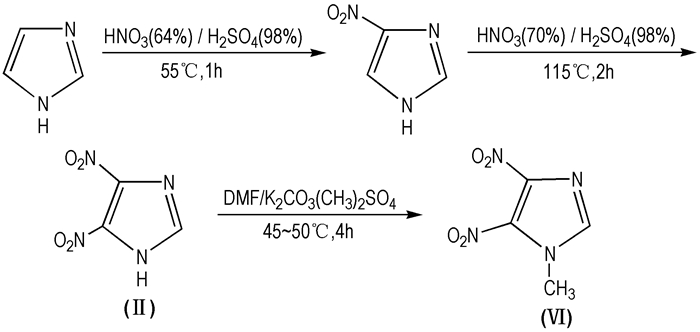
|
Scheme 8 Synthesis route of 4, 5-MDNI |
② 直接硝化法
曹端林等[47]以N-甲基咪唑为原料,通过一步硝化法得到4, 5-MDNI,通过正交试验得到最佳的工艺条件,同时对4, 5-MDNI进行了DSC分析,表明其熔点为78℃,热安定性良好。
2.3.3 1-甲基-2, 4, 5-三硝基咪唑(MTNI, Ⅶ)MTNI为黄色晶体,熔点为82 ℃,IR(KBr,ν/ cm-1):2899,2742,1454,1383 (—CH3),1503(=C),1574,1549,1327(—NO2)。1H NMR (DMSO-d6) δ:4.354 (s, 3H, CH3)。13C NMR (DMSO-d6) δ:37.7(CH3),133.429(C5),136.128(C2),139.914(C4)[48]。韩国的Jin Rai Cho[10]通过X射线衍射对MTNI晶体结构进行研究:斜方晶系,空间群为Pca21,晶胞参数为M=217.11,Z=8,a=8.6183(6)Å,b=17.7119(12) Å,c=10.6873(7) Å,V=1631.38(19) Å3,Dc=1.768g·cm-3。MTNI性能[10, 49-50]优良,主要表现为:(1)钝感,摩擦感度与TNT相当,撞击感度为14.6 cm与B炸药(19.8 cm)接近; (2)极好的爆炸性(爆速8.808 km·s-1,爆压35.58 GPa,爆热4472 kJ·kg-1),与RDX相当(爆速8.93 km·s-1,爆压37.3 GPa,爆热5041 kJ·kg-1); (3)低熔点,仅有82 ℃,与TNT接近,有望成为TNT的替代品; (4)热稳定性好,DSC曲线显示MTNI在309 ℃之前一直处于平稳状态,之后出现分解峰。MTNI集诸多优良性能于一体,在炸药领域备受关注,国内外研究者已对其展开广泛研究。目前,MTNI的合成路线有四种,分别是五步合成法、三步合成法、两步合成法、一步合成法,其中关于五步合成法和三步合成法的研究较多。
① 五步合成法
2001年,Jin Rai Cho[10]首次合成MTNI(Scheme 9)。该方法是以咪唑为原料在硝硫混酸中硝化得到4-硝基咪唑,然后再硝化得到1, 4-DNI,接着在氯苯中重排得到2, 4-DNI,之后,制得中间体2, 4, 5-TNI的钾盐,最后在重氮甲烷中甲基化得到MTNI。五步合成法的主要缺陷是步骤繁琐,总产率低,且不足10%。同时氯苯对环境造成严重污染,重氮甲烷在操作过程中危险性高。因此,该工艺尚未能实现工业化生产。
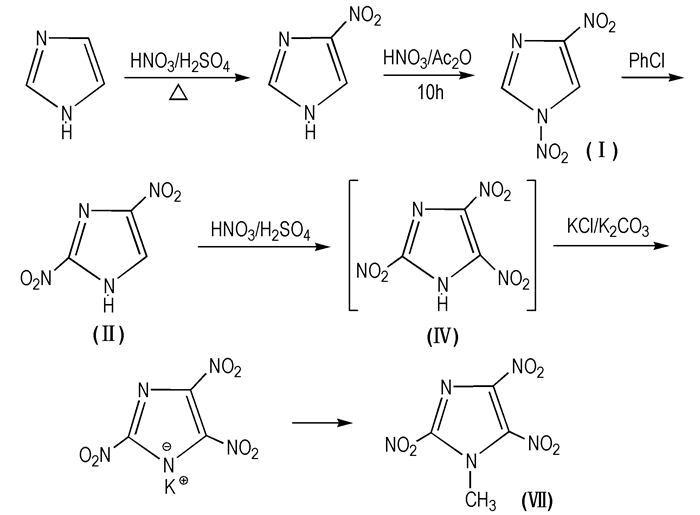
|
Scheme 9 Synthesis route of MTNI with five-step |
2007年,Damavarapu等[51]在专利中提到:可以用硫酸二甲酯代替重氮甲烷甲基化; 同时指出,可以先甲基化2, 4-DNI,最后再硝化的方法(见Scheme 10)。此合成方法在设计思路上有所改进,但硫酸二甲酯毒性高,导致该合成工艺尚未展开进一步研究。
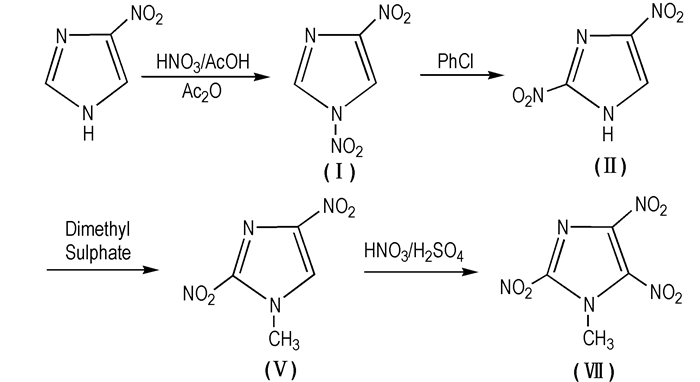
|
Scheme 10 Synthesis route of MTNI |
② 三步合成法
2006年,Jadhav等[52-53]采用碘代-硝化法合成了MTNI(Scheme 11)。该方法是以咪唑为原料在I 2/K I存在的碱性环境中于室温下反应24 h,得到2, 4, 5-三碘基咪唑(TⅡ); 然后,以DMF为溶剂得到2, 4, 5-T Ⅱ的钠盐,再在碘甲烷中甲基化; 最后,在100%的硝酸中硝化得到MTNI,得率为18%。碘代-硝化法的提出引起了广泛关注,此方法的合成仅在最后一步涉及到硝酸,降低了对环境的污染,且MTNI的得率有了提高,但不足之处是I 2价格较贵,导致反应成本略高。
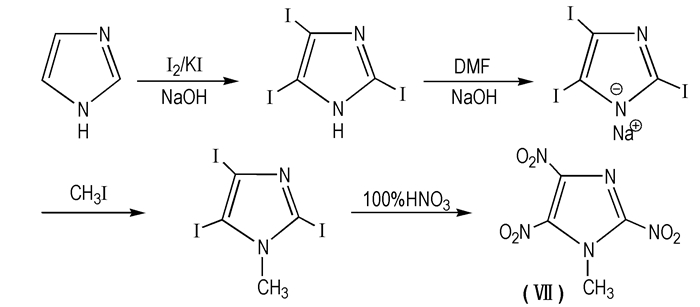
|
Scheme 11 Synthesis route of MTNI with three-step |
③ 两步合成法:
2009年,王小军等[54]以N-甲基咪唑为原料经两步硝化反应得到MTNI(见Scheme 12)。第一步硝化采用正加料法加料,发烟硝酸与发烟硫酸的体积比1:2,得到2, 4-MDNI; 第二步硝化采用反加法加料,发烟硝酸与发烟硫酸的体积比1:4。目标物的总得率为27%。
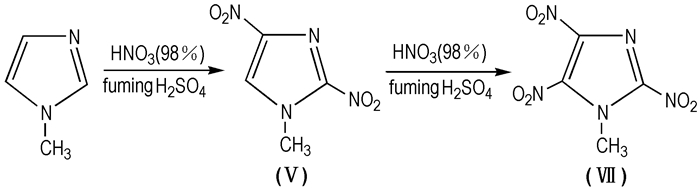
|
Scheme 12 Synthesis route of MTNI with two-step |
④ 一步合成法:
2011年,Raja Duddu等人[55-56]报道了关于MTNI的一步合成法(Scheme 13)。氮气保护,加入4.0 g 2, 4-MDNI于四口瓶中。随后加入5.0 g NO2BF4,搅拌15 min,升温至105 ℃, 固体物质溶解,产生类似糖浆状的粘稠物质。恒温105 ℃反应1.5 h,冷却后倒在碎冰上,用二氯甲烷萃取。合并萃取相,用水和碳酸氢钠溶液洗涤,硫酸钠干燥。蒸发溶剂,得到浅黄色的化合物,在乙醇中重结晶,得到MTNI,产率为74%。一步法工艺简单,且NO2BF4作为硝化剂无环境污染,无需废酸处理,无氧化性,反应副产物较少,因此选择性较高; 不足之处是NO2BF4价格较贵,导致成本较高。同时一步合成工艺中的其他原料和试剂不易直接得到,如MeNO2、2, 4-MDNI等,故该工艺距实现工业化生产仍有一定的距离。
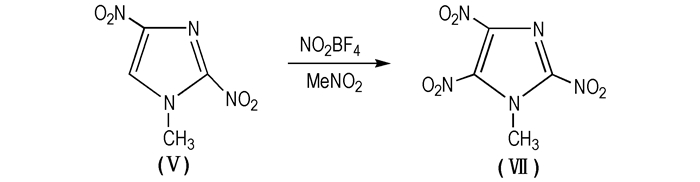
|
Scheme 13 Synthesis route of MTNI with one-step |
2, 4-DNI的1位上的H被苦基取代后可得到2, 4-PDNI。2, 4-PDNI为黄色固体,熔点为238~239 ℃,密度为1.81 g·cm-3,爆速为8.29 km·s-1,其感度较RDX低,爆速较2, 4-DNI高,且接近中性。由此可知引入苦基后,不仅解决了2, 4-DNI的酸性问题,同时提高了爆炸性能。目前关于2, 4-PDNI的合成报道较少,王小军等[57]以4-硝基咪唑为原料,通过硝化、重排、苦基化制备了2, 4-PDNI并研究了促进剂NaF对目标物得率的影响(Scheme 14)。
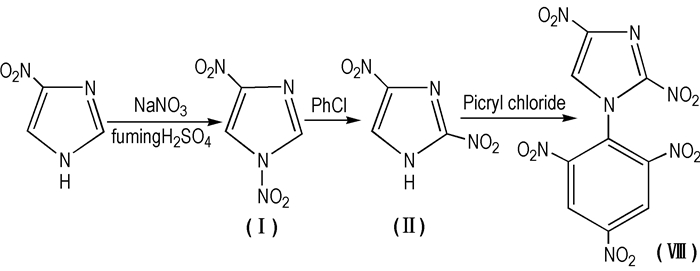
|
Scheme 14 Synthesis route of 2, 4-PDNI |
MTNI的1位上的甲基被乙酸乙酯基、苦基取代后可分别得到CTNII、PTNI。Jadhav等[52]从MTNI的三步法合成中得到启发,以碘代-硝化为思路,依据同样反应机理得到CTNII和PTNI,并指出多硝基咪唑环上引入甲基能够提高化合物的稳定性,引入苦基能够提高化合物的密度。同时模拟预测了MTNI、CTNII、PTNI等多种高能化合物的爆炸性能,得出:MTNI的爆速与RDX、NTO几乎相当, 可以作为TNT的替代品; MTNI、CTNII和PTNI的爆热均比TATB高(见表 2[52, 58])。
| 表 2 多硝基咪唑衍生物与高能炸药的爆炸性能比较[52, 58] Tab.2 The detonation performances of imidazole derivatives in comparison with other high-energy explosives |
硝基咪唑类含能化合物均具有高能低(钝)感的性质,在混合炸药和固体推进剂中应用极为广泛,世界各国围绕此类物质的合成展开了大量研究,尤其是MTNI的合成,虽逐步降低制造成本,但仍未实现工业化生产。为此,对该类物质的合成提出几点建议:
(1) 构建新型高氮多硝基咪唑类含能材料:向2, 4-DNI、4, 5-DNI、2, 4, 5-TNI的1位上的H上引入硝氨基,苦基,叠氮基,偶氮基,氧化偶氮基,硝基等对咪唑环进行修饰,同时解决1位H的酸性问题。
(2) 将超声波、微波等有机合成新技术应用到硝基咪唑类含能化合物的合成中,达到缩短时间、提高总得率的目的。
(3) 鉴于传统的合成硝基咪唑类含能化合物的方法中经常涉及到发烟硫酸、发烟硝酸的应用而带来的一系列问题,应该以廉价、低毒和高效为出发点,采用绿色硝化剂,如五氧化二氮、五氧化二磷、硝酸盐等。
依据多硝基咪唑的结构特点,笔者设计了一条理论上可行的合成MTNI的新路线,即碘代-硝化法(见Scheme 15),该路线仅涉及两步亲电取代反应。可行性分析:第一步以N-甲基咪唑为原料,由于甲基的供电子作用导致咪唑环上C原子电子云密度增大,从而为亲电取代反应的发生提供较大可能。拟采用硝酸/碘为碘化氧化体系[59],由于过量的硝酸与碘作用得到氧化性较强的碘酸,故该碘化氧化体系实际是由碘酸与碘组成。碘酸的加入产生了亲电性比碘更强的物质即I +,因此,第一步亲电取代反应理论上较易发生; 第二步硝化过程已在H.S.Jadhav[52]合成MTNI的路线中包含,故实际操作亦可行。H.S.Jadhav的方法中采用100%的硝酸为硝化剂,硝化效果不佳,导致目标物总得率较低,且纯硝酸在制备过程中易发生危险。新路线中拟采用硝化强度较高的超酸(金属硝酸盐和发烟硫酸组成)为硝化剂。对于反应活性较低的芳香唑类物质,该类硝化剂有较好的硝化效果[60]。希望此路线能够为MTNI的合成提供一定的参考。
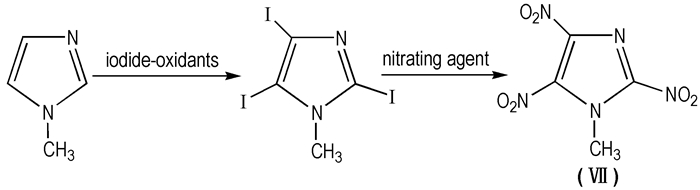
|
Scheme 15 Synthesis route of MTNI |
| [1] |
郑保辉, 罗观, 舒远杰, 等. 熔铸炸药研究现状与发展趋势[J].
化工进展, 2013, 32(6): 1341-1346. ZHENG Bao-hui, LUO Guan, SHU Yuan-jie, et al. Research status and prospect of melt-cast explosive[J]. Chemical Industry and Engineering Progress, 2013, 32(6): 1341-1346. |
| [2] |
Pagoria P F, Lee G S, Mitchell A R, et al. The synthesis of amino and nitrosubstituted heterocycles as insensitive energetic materials[R], 2001, Report UCRL-ID-142918.
|
| [3] |
阳世清, 徐松林, 雷永鹏. 氮杂环含能化合物的研究进展[J].
含能材料, 2006, 14(6): 475-477. YANG Shi-qing, XU Song-lin, LEI Yong-peng. The research progress of nitrogen heterocyclic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 475-477. |
| [4] |
曹端林, 李雅津, 杜耀, 等. 熔铸炸药载体的研究评述[J].
含能材料, 2013, 21(2): 157-165. CAO Duan-lin, LI Ya-jin, DU Yao, et al. Review on carriers for melt-cast explosives[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(2): 157-165. |
| [5] |
Albert B, Viviane M, Michel M. Process for the preparation of 1-hydroxyalky1-5-nitroimidazoles: EP 325513[P], 1989.
|
| [6] |
Maxime D C, Celine Botta, Monique Gasquet, et al. Lowering of 5-nitroimidazole's matagenicity: Towards optimal antiparasitic pharmacophore[J].
European Journal of Medicinal Chemistry, 2008, 11(7): 113-118. |
| [7] |
Viviane M, Michel M. Process for the preparation of 1-(3-chloro-2-hydroxyalkyl)-2methyl-5-nitro-imidazole (ornidazole): EP 399901[P], 1990.
|
| [8] |
Boiani M, González M. Imidazole and benzimidazole derivatives as chemotherapeutic agents[J].
Mini Rev Med Chem, 2005, 5(4): 409-424. DOI:10.2174/1389557053544047 |
| [9] |
Damavarpu R, Jayasuriya K, Theodore V, et al. 2, 4-dinitroimidazole: a less sensitive explosive and propellant made by thermal rearrangement of molten 1, 4-dinitroimidazole: USP 5387297[P], 1995.
|
| [10] |
Cho J R, Kim K J, Cho S G, et al. Synthesis and characterization of 1-methyl-2, 4, 5-trinitroimidazole (MTNI)[J].
J. Heterocyclic Chem, 2001, 38: 141-147. DOI:10.1002/jhet.5570380120 |
| [11] |
曹端林, 刘慧君, 李永祥. 1, 4-二硝基咪唑的合成及热分解[J].
火炸药学报, 2005, 28(3): 60-62. CAO Duan-lin, LIU Hui-jun, LI Yong-xiang. Synthesis and thermal decomposition of 1, 4-dinitromidazole[J]. Chinese Journal of Explosives and Propellants, 2005, 28(3): 60-62. |
| [12] |
Suwinski J, Salwinska E. Nitroimidazoles, part Ⅸ some reactions of 1, 4-DNI[J].
Pol J Chem, 1987, 61(7-12): 613-920. |
| [13] |
杨利, 高福磊, 凡庆涛, 等. 咪唑类含能化合物的研究进展[J].
含能材料, 2009, 17(3): 375-377. YANG Li, GAO Fu-lei, FAN Qing-tao, et al. Progress in imidazolium-based energetic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(3): 375-377. |
| [14] |
Sharni G P, Fassakhov R K, OrLov P P. 2, 4(5)-Dinitroimidazole : US 458553[P], 1975.
|
| [15] |
Lancini G C, Maggi N, Sensi P. Synthesis of some derivatives of 2-nitroimidazole with potential antitriehomonas activity[J].
Ed Sci, 1963, 18(3): 390-39. |
| [16] |
Grigoreva V N, Fassakhov R K, Gafarow A N, et al. Method of preparing 1, 4-dinitroimidazole: SU, 1416488[P], 1983.
|
| [17] |
Grimmett M R, Hua S T, Chang K C, et al. 1, 4-dinitroimidazole and derivatives: Structure and thermal rearrangement[J].
Aust, Chem, 1989, 42(8): 1281-1289. DOI:10.1071/CH9891281 |
| [18] |
刘慧君, 樊月琴, 冯峰, 等. 1, 4-DNI的绿色合成[J].
山西大同大学学报, 2011, 27(2): 37-38. LIU Hui-jun, FAN Yue-qin, FENG Feng, et al. The green synthesis of 1, 4-DNI[J]. Journal of Shanxi Datong University (Natural Science), 2011, 27(2): 37-38. |
| [19] |
张俊娜, 兰婷, 李明华, 等. 1, 4-二硝基咪唑的制备与晶体结构[J].
应用化工, 2012, 41(9): 1664-1667. ZHANG Jun-na, LAN Ting, LI Ming-hua, et al. Preparation and crystal structure of 1, 4-dinitroimidazole[J]. Applied Chemical Industry, 2012, 41(9): 1664-1667. |
| [20] |
刘慧君, 曹端林, 李永祥, 等. 2, 4-DNI的研究进展[J].
含能材料, 2005, 15(4): 269-272. LIU Hui-jun, CAO Duan-lin, LI Yong-xiang, et al. The progress of 2, 4-DNI[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2005, 15(4): 269-272. |
| [21] |
Bracuti A J. Crystal structure of 2, 4-dinitroimidazole (24DNI)[J].
Journal of Chemical Crystallography, 1995, 25(10): 625-627. DOI:10.1007/BF01665967 |
| [22] |
WANG Jun, DONG Hai-shan, ZHANG Xiao-yu, et al. Synthesis, Thermal stability and sensitivity of 2, 4-dinitroimidazole[J].
Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(6): 728-729. |
| [23] |
赵廷兴, 李磊, 董战, 等. 硝基唑类含能化合物的合成研究进展[J].
有机化学, 2014, 34: 304-315. ZHAO Ting-xing, LI Lei, DONG Zhan, et al. Research progress on the synthesis of energetic nitroazoles[J]. Chinese Journal of Organic Chemistry, 2014, 34: 304-315. |
| [24] |
杨威, 姬月萍, 汪伟, 等. 2, 4-二硝基咪唑有机胺盐合成与性能[J].
含能材料, 2010, 18(3): 270-272. YANG Wei, JI Yue-ping, WANG Wei, et al. Synthesis and properties of 2, 4-dinitroimidazole(2, 4-DNI)salts[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(3): 270-272. |
| [25] |
郑晓东, 崔荣, 李洪丽, 等. 2, 4-DNI铅盐的合成及性能[J].
火炸药学报, 2006, 29(16): 23-26. ZHENG Xiao-dong, CUI Rong, LI Hong-li, et al. Synthesis and properties of 2, 4-dinitroimidazole lead salt[J]. Chinese Journal of Explosives and Propellants, 2006, 29(16): 23-26. |
| [26] |
崔荣, 郑晓东, 毛治华, 等. 2, 4-二硝基咪唑铜配合物[J].
火炸药学报, 2007, 30(6): 27-30. CUI Rong, ZHENG Xiao-dong, MAO Zhi-hua, et al. Preparationand crystal structure of[Cu(DNI)2(H2O)]·3H2O[J]. Chinese Journal of Explosives and Propellants, 2007, 30(6): 27-30. |
| [27] |
Lancini G C, Maggi N, Sensi P. Synthesis of some derivatives of 2-nitroimidazole with potential anti-triehomonas activity[J].
Ed Sci, 1963, 18(3): 390-396. |
| [28] |
Sharnin G P, Fassakhov R K, Orlov P P, et al. Potential radiosensitizing agents[J].
Chem Abstu, 1975, 82: 156316 |
| [29] |
Bhaumik K, Akamanchi K G. 2, 4-dinitroimidazole: Microwave assisted synthesis and use in synthesis of 2, 3-dihydro-6-nitroimidazo oxazole analogues with antimycobacterial activity[J].
Journal of Heterocyclic Chemistry, 2004(1): 52-55. |
| [30] |
刘慧君, 樊月琴, 冯峰, 等. 微波辅助合成2, 4-二硝基咪唑[J].
含能材料, 2012, 18(1): 1-3. LIU Hui-jun, FAN Yue-qin, FENG Feng, et al. Synthesis of 2, 4-dinitroimidazole by microwave heating[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2012, 18(1): 1-3. |
| [31] |
Ravi P, Tewari S P. Microwave-assisted synthesis of 1-methyl-2, 4, 5-trinitroimidazole[J].
Propellants, Explosives, Pyrotechnics, 2012, 37: 544-548. DOI:10.1002/prep.v37.5 |
| [32] |
Bracutin A J. Crystal structure of 4, 5-dinitroimidazole (4, 5-DNI)[J].
Journal of Chemical Crystallgraphy, 1998, 28(5): 367-371. DOI:10.1023/A:1022412208854 |
| [33] |
Bracutin A J. Molecular structure of a new potential propellant oxidizer 4, 5-DNI[J].
Journal of Chemical Crystallography, 1998, 28(5): 367-371. DOI:10.1023/A:1022412208854 |
| [34] |
李永祥, 王建龙, 曹端林, 等. 4, 5-二硝基咪唑有机铵盐的制备[J].
火炸药学报, 2011, 34(3): 35-37. LI Yong-xiang, WANG Jian-long, CAO Duan-lin, et al. Synthesis of ammonium salt of 4, 5-dinitroimida zole[J]. Chinese Journal of Explosives and Propellants, 2011, 34(3): 35-37. |
| [35] |
Novikov S S, Khmel'nitskii L I, Novikova T S, et al. Dinitroimidazde and derivatives[J].
Chem Heterocycl Compd(Engl Transl), 1979, 6: 614 |
| [36] |
杨国臣, 刘慧君, 曹端林. 4, 5-二硝基咪唑的制备[J].
含能材料, 2006, 14(5): 349-351. YANG Guo-chen, LIU Hui-jun, CAO Duan-lin. Prepration of 4, 5-nitroimidazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(5): 349-351. |
| [37] |
Vadimiroff T. Acidity and basicidity of nitro substituted imidazoles technical rept, ADA2939969[R]. Springlield: NT IS, 1995.
|
| [38] |
Gao H X, Ye C F, Gupta O D, et a1. 2, 4, 5-Ttinitroimidazole-based energetic salts[J].
Chem Eur J, 2007, 13(14): 3854-3860. |
| [39] |
Jadhav H S, Talawar M B, Sivabalan R, et al. Synthesis, characterization and thermolysis studies on new derivatives of 2, 4, 5-trinitroimidazoles: Potential insensitive high energy materials[J].
Journal of Hazardous Materials, 2006, 143: 192-197. |
| [40] |
Qi-Long Yan, Svatopiuk Zeman, Ahmed Elbeih. Recent advances in thermal analysis and stability evaluation of insensitive plastic bonded explosives[J].
Thermochimica Acta, 2012, 3(3): 1-12. |
| [41] |
Cho J R, Kim K J, Cho S G, et al. Synthesis and characterization of 1-methyl-2, 4, 5-trinitroimidazoles (MTNI)[J].
Journal of Heterocyclic Chemistry, 2002, 39(1): 141-147. DOI:10.1002/jhet.v39:1 |
| [42] |
杨威, 姬月萍, 汪伟, 等. 1-甲基-2, 4-二硝基咪唑的合成及反应动力学[J].
火炸药学报, 2010, 33(3): 63-67. YANG Wei, JI Yue-ping, WANG Wei, et al. Synthesis and kinetics of 1-methyl-2, 4-dinitroimidazol[J]. Chinese Journal of Explosives and Propellants, 2010, 33(3): 63-67. |
| [43] |
张晓玉, 池钰, 黄明, 等. 1-甲基-2, 4-基咪唑的晶体结构与热力学性质[J].
含能材料, 2012, 20(6): 685-689. ZHANG Xiao-yu, CHI Yu, HUANG Ming, et al. Crystal structure and thermodynamic properties of 1-methyl-2, 4-dinitroimidazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2012, 20(6): 685-689. |
| [44] |
陈丽珍, 王小军, 耿天齐, 等. 1-甲基-4, 5-二硝基咪唑的晶体结构与热分解特性[J].
中北大学学报(自然科学版), 2012, 33(2): 159-163. CHEN Li-zhen, WANG Xiao-jun, GENG Tian-qi, et al. Crystal structure and thermal decomposition of 1-methyl-4, 5-dinitroimidazole[J]. Journal of North University of China(Natural Science), 2012, 33(2): 159-163. |
| [45] |
曹端林, 王小军, 杨彩云, 等. 1-甲基-4, 5-二硝基咪唑合成工艺[J].
含能材料, 2009, 17(6): 678-680. CAO Duan-lin, WANG Xiao-jun, YANG Cai-yun, et al. Synthesis of 1-methyl-4, 5-dinitroimidazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(6): 678-680. |
| [46] |
宋磊, 王建龙, 李永祥, 等. 1-甲基-4, 5-二硝基咪唑的合成及表征[J].
含能材料, 2009, 17(5): 531-533. SONG Lei, WANG Jian-long, LI Yong-xiang, et al. Synthesis and characterization of 1-methyl-4, 5-dinitroimidazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(5): 531-533. |
| [47] |
曹端林, 王小军, 杨彩云, 等. 1-甲基-4, 5-二硝基咪唑合成工艺[J].
含能材料, 2009, 17(6): 678-680. CAO Duan-lin, WANG Xiao-jun, YANG Cai-yun, et al. Synthesis of 1-methyl-4, 5-dinitroimidazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(6): 678-680. |
| [48] |
汪伟, 杨威, 姬月萍, 等. 1-甲基-2, 4, 5-三硝基咪唑的合成及表征[J].
火炸药学报, 2008, 31(6): 32-38. WANG Wei, YANG Wei, JI Yue-ping, et al. Synthesis and characterization of 1-methyl-2, 4, 5-trinitroimidazol[J]. Chinese Journal of Explosives and Propellants, 2008, 31(6): 32-38. |
| [49] |
殷明, 舒远杰, 熊鹰, 等. 硝基咪唑化合物结构与性质的理论研究[J].
化学学报, 2008, 66(19): 2117-2123. YIN Ming, SHU Yuan-jie, XIONG Ying, et al. Theoretical studies on structures and properties of nitroimidazole compounds[J]. Acta Chimica Sinica, 2008, 66(19): 2117-2123. DOI:10.3321/j.issn:0567-7351.2008.19.005 |
| [50] |
Gary K Lund, Ogden, Tom K. Highsmith, et al. Insensitive high performance explosive compositions: US 5529649[P], 1996-07-25.
|
| [51] |
Damavarapu, Paritosh R, Zhang M X, et al. Melt-cast explosive material: US 7304164[P], 2007-12-04.
|
| [52] |
Jadhav H S, Talawar M B, Sivabalan R, et al. Synthesis, characterization and thermolysis studies on new derivatives of 2, 4, 5-trinitroimidazoles: Potential insensitive high energy materials[J].
Journal of Hazardous Materials, 2006, 143: 192-197. |
| [53] |
刁莹, 王建龙, 王文艳, 等. 碘代法合成1-甲基-2, 4, 5-三硝基咪唑[J].
火炸药学报, 2012, 35(2): 40-43. DIAO Ying, WANG Jian-long, WANG Wen-yan, et al. Synthesis of 1-methyl-2, 4, 5-trinitroimidazole by iodo method[J]. Chinese Journal of Explosives and Propellants, 2012, 35(2): 40-43. |
| [54] |
王小军, 曹端林, 李永祥, 等. 1-甲2, 4, 5-三硝基咪唑的合成新工艺[J].
火炸药学报, 2009, 32(3): 16-18. WANG Xiao-jun, CAO Duan-lin, LI Yong-xiang, et al. New technology for synthesis of 1-methyl-2, 4, 5-trinitroimidazoles[J]. Chinese Journal of Explosives and Propellants, 2009, 32(3): 16-18. |
| [55] |
Duddu R, Zhang Mao-Xi, Damavarapu R, et al. Molten-state nitration of substituted imidazoles: new synthetic approaches to the novel melt-cast energetic material, 1-methyl-2, 4, 5-trinitroimidazole[J].
Synthesis, 2011, 17: 2859-2864. |
| [56] |
Ravi P, Tewari S P. Microwave-assisted synthesis of 1-methyl-2, 4, 5-trinitroimidazole[J].
Propellants, Explosives, Pyrotechnics,, 2012, 34: 544-548. |
| [57] |
王小军, 王霞, 鲁智艳, 等. 1-苦基-2, 4-二硝基咪唑的合成及表征[J].
火工品, 2012(5): 33-35. WANG Xiao-jun, WANG Xia, LU Zhi-yan, et al. Synthesis and characterization of 1-(2, 4, 6-trinitrophe nyl)-2, 4-dinitroimidazole[J]. Initiators & Pyrotechnics, 2012(5): 33-35. |
| [58] |
Jadhav P M, Sarangapani R, Prasanth H, et al. Quantum-chemical studies on thermodynamic feasibility of 1-methyl-2, 4, 5-trinitroimidazole processes[J].
J Mol Model, 2013, 19: 3027-3032. DOI:10.1007/s00894-013-1837-5 |
| [59] |
Ravi P, Koti R C, Saikia A, et al. Nitrodeiodination of polyiodopyrazoles[J].
Propellants Explosive Pyrotechnics, 2012, 37: 167-171. DOI:10.1002/prep.v37.2 |
| [60] |
Ravi P, Tewari S P. Facil and environmentally friendly synthesis of nitropyrazoles using montmorillonite K-10 impregnated with bismuth nitrate[J].
Catalysis Communications, 2012, 19: 37-41. DOI:10.1016/j.catcom.2011.12.016 |

The synthetic routes of nitroimidazoles energetic materials and their properties were summarized and described the disadvantages of these schemes, such as 1,4-DNI, 2,4-DNI and MTNI. Hope for to give a assistance for the development of explosives in energetic field.




