2. 96512部队, 陕西 汉中 723000
2. 96512 Troops, Hanzhong 723000, China
高温高浓度的过饱和硝酸铵(NH4NO3)溶液广泛用于含水工业炸药生产中, 正常使用条件下, 过饱和硝酸铵水溶液储存温度在120 ℃左右, 相对而言NH4NO3溶液是安全稳定的。但是过饱和的NH4NO3溶液作为氧化剂, 高温下可以发生自反应。在混入还原剂或其他物质后其物理化学性质和热力学性质可能发生变化, 影响到高温高浓度NH4NO3溶液的安全使用。因此研究高温高浓度NH4NO3溶液热稳定性尤其是杂质对其热分解的影响对工业炸药的安全生产具有重要的现实意义。
目前国内外学者如Saunders[1]、赵东风[2]、陈网桦[3]等通过对NH4NO3固体与部分常见杂质混合物的热分解性能研究认为, 氯化物, 酸性物质, 油脂类物质、氮氧化物和部分金属离子对NH4NO3的热分解有催化加速作用, 而尿素、NH3等则对NH4NO3的热分解有抑制作用。王春丽[4]、白燕等[5]利用自制装置对含杂质的NH4NO3水溶液临界爆炸温度进行测试研究得出了相似的结论。孙金华等[6]使用C80微量热仪(Setaram公司生产)研究NH4NO3盐酸混合物热流曲线计算混合体系热力学参数, 并利用Semenov模型[6]求解其自加速分解温度自加速分解温度(SADT)。以上研究主要集中于NH4NO3固体的研究, 但对于NH4NO3溶液研究还处于起步阶段, 对热分解反应机理尚缺乏深入的探讨。
高温高浓度NH4NO3溶液呈酸性, 在120~180 ℃时可分解为HNO3和NH3[7-8]。高温高浓度NH4NO3溶液运输及工业炸药制备过程很难避免与铁制品容器和设备接触, 在酸性条件下高温温高浓度NH4NO3溶液与铁质品会发生缓慢的氧化还原反应, 溶液极易混入铁离子和亚铁离子, 因此, 研究铁离子和亚铁离子对过饱和高温高浓度NH4NO3溶液热稳定性对工业炸药的安全生产十分重要。为此, 本研究利用C80微量热仪, 在高压池模拟存储运输中的高温密闭环境, 对Fe(NO3)3、过饱和NH4NO3溶液混合体系状态下的热分解进行了研究, 得到了体系热分解的热力学参数以及Fe(NO3)3对过饱和NH4NO3溶液的的热分解作用, 为工业炸药设计和安全生产提供了的依据。
2 实验设计 2.1 试剂与仪器NH4NO3, 分析纯, 分子量80.04, 含量不少于99%, 上海试剂一厂。Fe(NO)3·9H2O, 分析纯, 分子量404.00, 含量不少于98.5%, 天津博迪化工股份有限公司。
热分解实验仪器选用法国setaram公司C80微量热仪(如图 1), 其可测参量多, 测试药量比TG-DSC大, 实验精度高, 可模拟密闭环境进行实验。仪器主要参数①温度测试范围;室温~300 ℃②升温速率: 0.01~2 ℃·min-1③量热分辨率: 0.10 μW温度精度: ≤0.01 ℃。
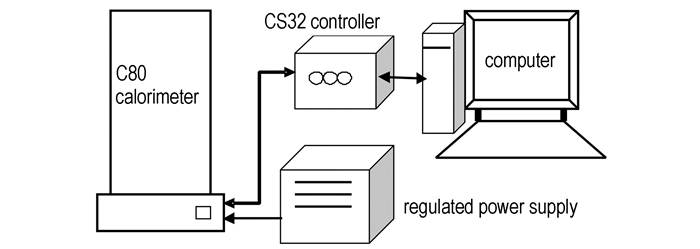
|
图 1 C80微量热仪示意图 Fig.1 Schematic diagram of C80 micro calorimeter |
(1) 纯NH4NO3干燥粉碎:将NH4NO3和Fe(NO3)3分别在50 ℃下真空干燥48 h, 使用前研磨粉碎。
(2) NH4NO3溶液的制备:考虑C80测试温度起点为室温, 高温高浓度NH4NO3溶液加入量热仪之后混合体系会迅速降温结晶, 且NH4NO3溶液的配制过程水分耗散低于0.2 g, 因此可使用重结晶体系进行测试。将NH4NO3按90%和95%的浓度配制, 加热至NH4NO3完全溶解后, 冷却析晶, 研磨粉碎。
(3) NH4NO3和Fe(NO3)3混合液的制备:使用95% NH4NO3溶液, 分别外加1%、2%、3%、4% Fe(NO3)3固体, 加热混合体系至完全溶解, 冷却析晶, 研磨粉碎。
(4) 取样分析:经过多次探索性试验, 在取样300 mg, 升温速率1 K·min-1, 温度测试范围30~285 ℃, 降温速率4 K·min-1的测试条件下得到较完整的热流曲线。故利用分析天平秤取300 mg结晶固体置于高压池中, 将高压池导入C80 calorimeter, 待仪器稳定, 热流平衡之后开始实验。
2.3 实验数据处理方法根据化学反应理论和阿伦尼乌斯定律[6], 反应初期M≈M0(M0反应前混合物质量, g; M为反应初期混合物质量, g), 如果单位质量反应物的反应放热量为ΔH, 可以得到
| $ \frac{{{\rm{d}}\mathit{H}{\rm{/d}}\mathit{T}}}{{{\rm{\Delta }}\mathit{H}{\mathit{M}_{\rm{0}}}}}{\rm{ = }}\mathit{A}{\rm{exp( - }}\frac{{{\mathit{E}_{\rm{a}}}}}{{\mathit{RT}}}{\rm{)}} $ | (1) |
两边取对数得:
| $ {\rm{ln(}}\frac{{{\rm{d}}\mathit{H}{\rm{/d}}\mathit{T}}}{{{\rm{\Delta }}\mathit{H}{\mathit{M}_{\rm{0}}}}}{\rm{) = ln}}\mathit{A}{\rm{ - }}\frac{{{\mathit{E}_{\rm{a}}}}}{{\mathit{RT}}} $ | (2) |
式中, A, 指前因子,L·mol-1·s-1; Ea, 活化能, kJ·mol-1; R, 普适气体常量, 8.3145 J·mol-1·K-1; T, 热力学温度, K; ΔH, 单位质量反应物的反应放热量, kJ·kg-1。
将实测的样品反应初期热流速数据代入式(2), 并作出
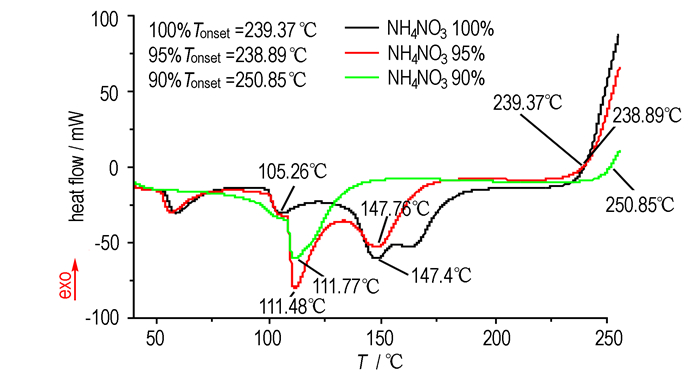
采用C80微量热仪对不同浓度NH4NO3溶液进行热分析, 其热流曲线如图 2所示。
|
图 2 不同含水量硝酸铵溶液热流曲线 Fig.2 Heat flow curves of ammonium nitrate in different water content |
在研究的温度范围内NH4NO3有四种稳定存在的晶型: Ⅳ(斜方晶系-16.9~-32.3 ℃)、Ⅲ(单斜晶系32.3~84.2 ℃)、Ⅱ(三角晶系84.2~125.2 ℃)、Ⅰ(立方晶系, 125.2~169.6 ℃)。因此在升温前期会出现三个吸热峰如图 2所示, 分别对应着不同的三个晶型变化[9], 即Ⅳ→Ⅲ、Ⅲ→Ⅱ、Ⅱ→Ⅰ。纯NH4NO3与重结晶含水NH4NO3热流曲线存在差别。在升温前期95% NH4NO3溶液和纯NH4NO3热流曲线几乎重合, 60 ℃出现第一个吸热峰, 此吸热峰为NH4NO3的晶体变化Ⅳ→Ⅲ。低温状态下95% NH4NO3水溶液有较强的晶体性质。当升温到超过100 ℃以后两条热流曲线开始迅速分化, 95%的NH4NO3溶液相较于纯NH4NO3吸热峰更深且相后推移, 水在体系中对NH4NO3热分解的抑制作用开始显现。超过100 ℃以后水的蒸发速度开始加速, 消耗体系更多热量, 使得吸热峰向下凹陷的更深, 同时也使得晶体的晶变温度向后推移。第三个吸热峰之后95% NH4NO3溶液已经开始溶解。90%NH4NO3溶液呈现较强的液体性质, 不会出现以上的晶型变化, 只在100 ℃左右出现一个水蒸发的吸热峰。
当温度升高到180 ℃以上时热流曲线开始缓慢的开始有热流补偿, 当达到某一温度时热流平衡值为零且后续放热反应速率迅速增加[6], 这个临界温度称之为自反应起始温度(Tonset)。不同含水量硝酸铵混合体系的Tonset见表 1。由图 2和式(2)计算得到热力学参数Ea、A、R2, 结果见表 1。
| 表 1 不同含水量NH4NO3混合体系热力学参数 Tab.1 Thermodynamic parameter of AN in different water content |
由表 1可以看出, 随着水含量的增加体系活化能升高, 体系发生热分解的难度增加, 使其放热量减少。100%NH4NO3与95%NH4NO3溶液Tonset相差不大, 可忽略, 但90%NH4NO3呈现一定的溶液性质之后, Tonset急剧升高, 可以认为H2O可提高自反应起始温度抑制NH4NO3热分解。
分析认为, 这是由于高温状态下NH4NO3可分解生成硝酸, 硝酸电离参加后续的反应所致。Wood[5]认为分解生成的硝酸在整个的体系中可以起到催化的作用, 催化机理如下:
| $ \rm{N}{{\rm{H}}_{\rm{4}}}\rm{N}{{\rm{O}}_{\rm{3}}}\xrightarrow{>\rm{120}\ ℃\ \ }\rm{HN}{{\rm{O}}_{\rm{3}}}\rm{+N}{{\rm{H}}_{\rm{4}}}\rm{-174}\rm{.3}\ \rm{kJ} $ | (Ⅰ) |
| $ \rm{HN}{{\rm{O}}_{\rm{3}}}\rm{+}{{\rm{H}}^{\rm{+}}}\underset{\to }{\mathop{\leftarrow }}\, {{\rm{H}}_{\rm{2}}}\rm{NO}_{3}^{+}\to {{\rm{H}}_{\rm{2}}}\rm{O+NO}_{2}^{+} $ | (Ⅱ) |
| $ \rm{NO}_{2}^{+}\rm{+N}{{\rm{H}}_{\rm{3}}}\to \rm{N}{{\rm{H}}_{\rm{3}}}\rm{NO}_{2}^{+}\to {{\rm{N}}_{\rm{2}}}\rm{O+}{{\rm{H}}_{\rm{3}}}{{\rm{O}}^{\rm{+}}} $ | (Ⅲ) |
NH4NO3溶液中水的增加使反应(Ⅱ)向逆反应推移, 抑制了NH4NO3的热分解, 其次水在固液体中比热容最大, 溶液体系需要向其提供更多的热量, 进而增加体系的热稳定性。水对NH4NO3溶液而言是一种惰性物质, 抑制了NH4NO3的热分解。提高NH4NO3自反应起始温度。
3.2 硝酸铁含量对热分解反应的影响为研究Fe(NO3)3对NH4NO3溶液热稳定性的影响, 研究采用C80为量热仪对含不同浓度Fe(NO3)3的95% NH4NO3溶液进行热分析, 图 3展示了不同含量Fe(NO3)3混合样品热分析实验升温前、后期C80热流曲线。
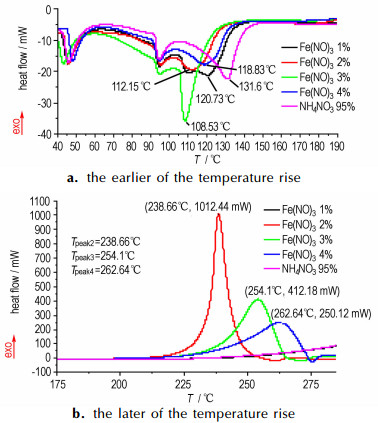
|
图 3 不同含量Fe(NO3)3混合样品热流曲线 Fig.3 Heat flow curves of Fe(NO3)3 mixed sample in different content |
升温前期五组样品在90 ℃前曲线几乎重合, 即在低温状态下Fe(NO3)3对NH4NO3的热流变化影响较小, 但是当温度升高到105 ℃以上之后Fe(NO3)3的影响效果开始显现出来。四组样品的第三个吸热峰向前推移了10 ℃以上, 尤其是含Fe(NO3)33%的样品吸热峰降低了23 ℃。
图 3a中样品出现了较为剧烈的放热峰变化, 此时实验样品发生了剧烈的放热反应。由图 3b和热分析方法[6]计算得出热力学参数见表 2。
| 表 2 不同含量Fe(NO3)3混合样品热力学参数 Tab.2 Thermodynamic parameters of Fe(NO3)3 mixed sample in different content |
Fe(NO3)3的引入使混合体系的自反应起始温度发生剧烈变化, 从95% NH4NO3溶液的238.89 ℃下降到2%Fe(NO3)3的201 ℃, 温度下降了37.89 ℃, 而随着Fe(NO3)3含量的增加, 自反应的起始温度变化不大。对于放热峰而言, Fe(NO3)3的作用不可忽视。由表 2可以看出, 在可测的放热峰值中, 随着Fe(NO3)3含量的增加放热峰值呈下降趋势。可见, Fe(NO3)3对混合体系的“催化”效果与Fe(NO3)3的含量有关, 由于Fe(NO3)3不稳定, 其自身的热分解会消耗部分能量, 因而, 高温下仅提高Fe(NO3)3的含量对热分解速率影响不大。
由表 2可以看出, 95%NH4NO3溶液活化能为220 kJ·mol-1, 随着Fe(NO3)3含量的增加, 五组不同混合样品体系活化能总体下降, 虽然在Fe(NO3)3含量为2%~3%时有微小的反复, 但是并不影响总体下降的趋势。Fe(NO3)3使得整个体系的表观活化能下降, 当Fe(NO3)3含量达到4%时, 体系活化能下降了56 kJ·mol-1。体系的反应变得容易, 反应速率加快。由表 2还可以看出, Fe(NO3)32%、3%、4%三组样品ΔH随着Fe(NO3)3含量的增加下降, 可见Fe(NO3)3含量在一定程度内可以减少体系放热量。从化学反应方面对热分解机理可以表述如下:
Fe(NO3)3是一种易溶于水的物质, 在一定条件下对整个混合体系NO2+的形成具有非常重要的意义。在高温条件下(超过120℃)混合体系会呈现溶液状态, 部分NH4NO3会电离成NH4+、NO3-两种离子(化学方程式(3)), 而Fe(NO3)3是一种极易形成络合物Fe[(NO3)4]-的路易斯酸[10], 可以发生络合反应(4)、(5)、(6)甚至形成更加复杂的络合物但是难度相对较大, 主要的络合反应仍然是反应(4), 此反应加速了NH4NO3的电离分解。
| $ \rm{N}{{\rm{H}}_{\rm{4}}}\rm{N}{{\rm{O}}_{\rm{3}}}\to \rm{NH}_{4}^{+}\rm{+NO}_{3}^{-} $ | (3) |
| $ \rm{Fe(N}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{3}}}\rm{+NO}_{3}^{-}\to \rm{Fe }[\rm{ (N}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{4}}}{{\rm{ }]\rm{ }}^{\rm{-}}} $ | (4) |
| $ \rm{Fe }[\rm{ (N}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{4}}}{{\rm{ }]\rm{ }}^{\rm{-}}}\rm{+NO}_{3}^{-}\to \rm{Fe }[\rm{ (N}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{5}}}{{\rm{ }]\rm{ }}^{\rm{2-}}} $ | (5) |
| $ \rm{Fe }[\rm{ (N}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{5}}}{{\rm{ }]\rm{ }}^{\rm{2-}}}\rm{+NO}_{3}^{-}\to \rm{Fe }[\rm{ (N}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{6}}}{{\rm{ }]\rm{ }}^{\rm{3-}}} $ | (6) |
在120 ℃以上时会发生NH4NO3的初级热分解反应形成HNO3[7-8]。HNO3是一种强氧化性的物质, HNO3可以和NH4+反应形成NO2+离子, NO2+离子是一种极不稳定的状态, NO2+在NH3的作用下会生成氮氧化物释放出来。
| $ \rm{N}{{\rm{H}}_{\rm{4}}}\rm{N}{{\rm{O}}_{\rm{3}}}\xrightarrow{>\rm{120}\ ℃\ }\rm{HN}{{\rm{O}}_{\rm{3}}}\rm{+N}{{\rm{H}}_{\rm{3}}} $ | (7) |
| $ \rm{HN}{{\rm{O}}_{\rm{3}}}\rm{+NH}_{4}^{\rm{+}}\to \rm{NO}_{2}^{\rm{+}}\rm{+}{{\rm{H}}_{\rm{2}}}\rm{O} $ | (8) |
| $ \rm{N}{{\rm{H}}_{\rm{3}}}\rm{+NO}_{2}^{\rm{+}}\to {{\rm{N}}_{\rm{2}}}\rm{O+H}_{3}^{\rm{+}}\rm{O} $ | (9) |
上述研究表明, Fe(NO3)3可通过形成络合物加速NH4NO3的热分解, 降低NH4NO3溶液的热稳定性。含量达到2%的Fe(NO3)3在高温高浓度NH4NO3溶液中有催化的作用, 破坏体系稳定, 加速热量的释放。但是当Fe(NO3)3的含量超过4%则会降低NH4NO3的溶解度, 减少电离量。Fe3+对NH4NO3溶液而言是一种具有催化作用的物质, 可加速NH4NO3的热分解, 破坏体系稳定。故在使用铁质容器生产、存储和运输高温高浓度NH4NO3溶液时应及时检查NH4NO3溶液的升温和锈蚀情况。
4 结论(1) 90% NH4NO3的Tonset、Ea由100%NH4NO3的239.37 ℃、176.4 kJ·mol-1上升到250.85 ℃、324.15 kJ·mol-1, 自反应难度升高。
(2) 水对NH4NO3溶液而言是一种惰性物质, 可以抑制NH4NO3的热分解, 提高NH4NO3自反应起始温度。
(3) 95% NH4NO3的Tonset为238.89 ℃加入Fe(NO3)3之后Tonset下降, Fe(NO3)3含量2%时Tonset为201.13 ℃, 下降了37.76 ℃, Fe(NO3)3对95% NH4NO3溶液中NH4NO3热分解有“催化作用”。
(4) 高温条件下, 95% NH4NO3与Fe(NO3)3的混合溶液中Fe3+可形成络合物Fe[(NO3)4]-, 加速NH4NO3的热分解, 破坏混合溶液体系的热稳定性。
(5) 使用铁质容器或管道存储和输送高温高浓度NH4NO3溶液时, 应及时检查溶液温度和设备腐蚀情况。
致谢: 本研究得到了工业和信息化部安全生产司的大力支持与资助, 特表示感谢。| [1] |
Saunders H L. Thermal decomposition of ammonium nitrate[J].
J Chem Soc, 1922, 121: 698-711. |
| [2] |
赵东风, 彭力, 王文东. 无机添加剂对硝酸铵拒爆性的影响研究[J].
燃烧化学学报, 2006, 34(1): 113-116. ZHAO Dong-feng, PENG Li, WANG Wen-dong. Effects of inorganic additives on the misfire of modified ammonium nitrate[J]. Journal of Fuel Chemistry and Technology, 2006, 34(1): 113-116. |
| [3] |
陈网桦, 陈利平, 吴燕, 等. 硝酸及氯离子对高温硝酸铵水溶液热危险性的影响研究[J].
中国安全科学学报, 2007, 17(5): 101-105. CHEN Wang-hua, CHEN Li-ping, WU Yan, et al. Influence of nitrate acid and chlorine ion on the decomposition of ammonium nitrate in aqueous solution with high temperature[J]. China Safety Science Journal, 2007, 17(5): 101-105. |
| [4] |
王春丽, 曹雄. 杂质对硝酸铵水溶液临界爆炸温度的影响[J].
工业安全与环保, 2011, 37(2): 42-46. WANG Chun-li, CAO Xiong. Influence of the impuritles on the critical explosion temperature of ammomium nitrate solution[J]. Industrial Safety and Environmental Protection, 2011, 37(2): 42-46. |
| [5] |
白燕. 硝酸铵水溶液热稳定性研究[J].
工业安全与环保, 2009, 3(8): 4-6. BAI Yan. Study of the thermal stability of ammonium nitrate in aqueous solution[J]. Industrial Safety and Environmental Protection, 2009, 3(8): 4-6. |
| [6] |
孙金华, 丁辉.
化学物质热危险性评价[M]. 北京: 科学出版社, 2005.
SUN Jin-hua, DING Hui. Chemical thermal hazard evaluation[M]. Beijing: Science Press, 2005. |
| [7] |
Jimmie C Oxley, James L Smith, Evan Rogers, et al. Ammonium nitrate thermal stability and explosivity modifiers[J].
Thermochimical Acta, 2002, 384(1-2): 23-45. DOI:10.1016/S0040-6031(01)00775-4 |
| [8] |
Turcotte P R, Lightfoot D, Fouchard R, et al. Thermal Hazard assessment of AN and AN-based explosives[J].
Journal of Hazardous Merterials, 2003, A101: 1-27. |
| [9] |
李艺, 惠君明. 几种添加剂对硝酸铵热稳定性的影响[J].
火炸药学报, 2005, 28(1): 76-80. LI Yi, HUI Jun-ming. Effect of several additives on thermal characteristics of ammonium nitrate[J]. Chinese Journal of Explosives & Propellants, 2005, 28(1): 76-80. |
| [10] |
刘艳珠. 金属硝酸盐配位的水杨酸酯硝基化、亚硝基化反应[D]. 南昌: 南昌大学, 2009.
LIU Yan-zhu. Nitration and nitrosation reactions of ester salicylate coordinated by metal nitrates[D]. Nanchang : Nanchang University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-11902-2010076558.htm |
Thermal analysis for different concentrations of NH4NO3 solution and 95% NH4NO3 solution with different content of Fe(NO3)3 were studied by C80 micro thermal instrument in closed environment.




