含能材料经历了从传统的普通炸药到多硝基含能化合物的发展过程。近年来, 富氮含能化合物受到了国内外学者的普遍关注[1]。富氮化合物分子结构中含有大量的化学键N—N、C—N、N=N、C=N等, 因此具有高正生成焓和高能量密度, 某些化合物还具有高热稳定性。作为新型含能材料, 富氮含能化合物主要应用于高能钝感炸药[2]、小型推进系统固体燃料[3-4]、无烟烟火剂[5-6]、气体发生剂[7-8]、无焰低温灭火剂[9-10]等军事化学和爆炸安全领域。富氮化合物主要包括含能五元氮杂环(三唑、四唑、呋咱)和六元氮杂环(三嗪、四嗪)以及它们的衍生物。富氮化合物燃烧时分子中含有的氢和氧会化合生成水蒸汽, 在100℃时会迅速凝结为液体, 一定程度上降低了气体生成量, 同时在水蒸气相变时会导致系统压力产生明显波动, 这在很大程度上限制了其在气体发生剂等领域的应用。同时分子中氢含量的增加会降低含能材料本身的密度, 也使其用作高能炸药时的爆轰性能(如爆压、爆速等)降低。因而, 减少富氮化合物分子结构中氢元素的含量, 是含能材料应用领域研究人员追求的目标之一。除此之外, 既不含有氢、也不含有碳和氧的全氮化合物反应生成的气体为100%的氮气, 更是该领域科学家关注和追求理想含能材料, 只是目前研究结果显示这类化合物不仅难以制备, 多数稳定性较差。而分子中含有一定量的氧元素, 能够调整分子结构, 使分子更加容易达到氧平衡, 所以对无氢含氧富氮化合物的研究是该研究领域的研究热点。
为此, 本文对无氢富氮化合物的研究进展进行了全面的综述, 主要分为呋咱类无氢含氧富氮化合物、含硝基无氢富氮化合物、无氢无氧富氮化合物和全氮化合物四类。系统综述了这些化合物的合成路线、基本性能及其应用情况, 并对无氢富氮化合物的发展前景进行了展望。
2 呋咱类无氢含氧富氮化合物呋咱化合物的母体结构为五元氮氧杂环。呋咱环在含能材料的合成中是一个非常重要的结构, 环上的氮若连接氧即为氧化呋咱, 其含氧量和分子结晶密度更高。其分子中的活泼的氧原子会在环中形成一个“隐藏”的硝基结构, 这使得呋咱及其衍生物在高含氮化合物中具有特殊的地位。
呋咱类无氢含氧富氮化合物由于具有高能量密度、高标准生成焓、高氮含等优点, 已成为当前高能量密度材料的开发重点[11]。下面是几种已经报道的呋咱类无氢含氧富氮化合物。
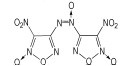
2.1 硝基呋咱类无氢含氧富氮化合物(1) 3, 4-二硝基呋咱(DNF)和3, 4-二硝基氧化呋咱(DNFX)
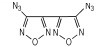
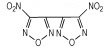
3, 4-二硝基呋咱(DNF)和3, 4-二硝基氧化呋咱(DNFX)的结构如Scheme 1所示。
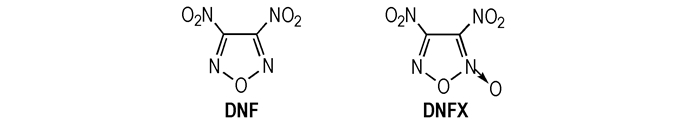
|
Scheme1 Structure of DNF and DNFX |
1994年, Novikova T S等人[12]首次采用H2O2、浓H2SO4、Na2WO4混合氧化剂氧化二氨基呋咱合成了3, 4-二硝基呋咱(DNF), 研究表明, DNF的晶体密度是1.62 g·cm-3, 熔点15 ℃, 沸点168 ℃, 理论爆速9500 m·s-1, 是一种敏感的高能量密度化合物。在实际应用中[13]、DNF是一种重要的构建高能量密度化合物的活性单元, 可合成一大批性能优异的呋咱醚[14]、羟基呋咱[15], 氯基呋咱[16]等, 这些化合物可与嗪类、唑类等基团反应, 生成大量含能化合物, 如3, 6-双(4-硝基呋咱基-3-氧)-氧化四嗪[14], 该化合物可与CL-20比拟。
Godovikova T I等[17-18]报道合成了3, 4-二硝基氧化呋咱(DNFX), 从它的结构中可以看出, DNFX是一种高度氧化的杂化化合物。DNFX在室温下是浅黄色流性液体, 会缓慢分解, 在-15 ℃~-20 ℃时稳定存在。DNF和DNFX均是高感度炸药, 虽含能量极高, 但很不稳定很难应用[19]。
(2) 呋咱并[3, 4-e]-1, 2, 3, 4-四嗪-1, 3-二氧化物(FTDO)
1995年, 俄罗斯Zelinsky有机化学研究所Churakov A M等[20]在乙腈溶液中, 用NO2BF4氧化3-氨基-4-叔丁基氧化偶氮呋咱得到呋咱并四嗪杂环化合物(FTDO), 合成路线如Scheme 2所示。
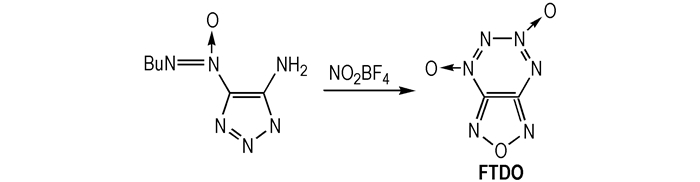
|
Scheme2 Synthesis of FTDO |
Churakov A M等[20]对FTDO进行了结构表征和性能测试, 研究表明, FTDO是一种黄色晶体, 可以在0 ℃的条件下长时间稳定存在, 其熔点110~112 ℃, 密度1.85 g·cm-3, 生成热660 kJ·mol-1, 爆速9802 m·s-1, 爆压44.78 GPa, 可以在含能材料领域应用[21-22]。
(3) 3, 4-二硝基呋咱基氧化呋咱(DNTF)的合成
2002年中国西安近代化学研究所的胡焕性等[23]以丙二腈、亚硝酸钠、盐酸羟胺及盐酸为起始原料, 经三步反应首次合成了DNTF。由于该工艺路线收率很低, 总产率19.4%, 故DNTF的制备成本较高, 从而使其发展和应用受到了很大限制。
2011年, 中国工程物理研究院化工材料研究所的王军等人[24]采用新的工艺条件, 使DNTF的收率提高到38%, 材料成本大大降低。其合成路线如Scheme 3所示。
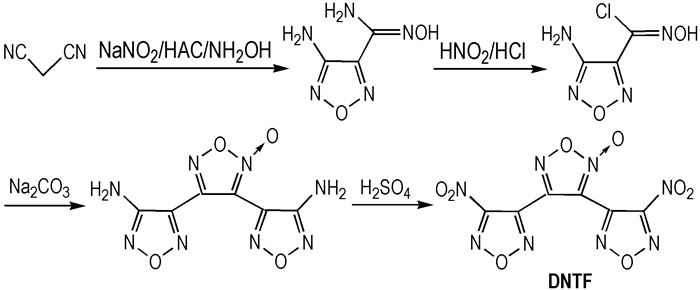
|
Scheme3 Synthesis of DNTF |
3, 4-二硝基呋咱基氧化呋咱(DNTF)[25]为白色晶体, 标准生成焓644.3 kJ·mol-1, 密度1. 937 g·cm-3, 熔点110 ℃, 爆发点308 ℃(5 s延迟期), 撞击感度94%(10 kg落锤, 25 cm落高), 摩擦感度12%(90 ℃), 威力为168. 4% TNT当量, 理论爆速9250 m·s-1, 实测爆速8930 m·s-1(1. 86 g·cm-3), 理论爆热值为6054 kJ·kg-1[26]。
DNTF综合性能优于奥克托金(HMX), 而接近于CL-20, 并且合成危险性小、工艺简单、稳定性好, 是一种具有潜在应用前景的新型高能量密度材料, 可广泛用于多种新型高威力弹药、推进剂和火工品中[27]。
2.2 偶氮呋咱类无氢含氧富氮化合物在富氮化合物中引入=N—或—N=N(O)有利于提高化合物的标准生成焓、化合物的密度、爆速和爆压, 降低感度[11, 29]等性能。含能化合物爆速和爆压的提高主要是通过化合物的氧平衡, 生成热, 密度的提高来实现, 但氧平衡和生成热增加的同时通常也增加了化合物的机械感度, 只有密度的增加既能提高性能又不增加机械感度。偶氮键、联氨键的相连增加了杂环的共轭性, 也有助于降低化合物的机械感度。
下面介绍几种已经报道的偶氮呋咱呋咱类无氢含氧富氮化合物。
(1) 3, 3′-二叠氮基-4, 4′-偶氮呋咱(DADAF)
2013年南京理工大学的高莉等[28]以3, 4-二氨基呋咱为起始原料, 合成了3, 3′-二叠氮基-4, 4′-偶氮呋咱(DADAF)和5-[4-叠氮基呋咱基]-5H-[1, 2, 3]三唑并[4, 5-c][1, 2, 5]呋咱内盐Ⅰ, 化合物DADAF和化合物(Ⅰ)均是无氢含氧的富氮化合物。两种化合物的合成路线如Scheme 4所示。
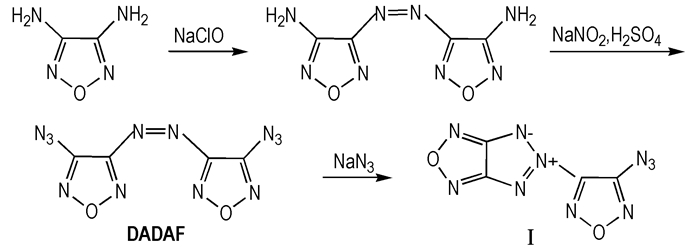
|
Scheme4 Synthesis of DADAF and Ⅰ |
DADAF是黄色晶体, 在室温下放置于空气中数天完全转化成化合物Ⅰ, 颜色变成无色晶体。文献[29]中通过13C NMR确定了DADAF的结构, 通过1H NMR、13C NMR、MS和IR确定了Ⅰ的结构。研究表明, DADAF分解温度是65 ℃, 与所测熔点相同, 密度1.75 g·cm-3, 生成焓1362 kJ·mol-1, 爆压30.59 GPa, 爆速8370 m·s-1。目前还未见其应用方面的报道。
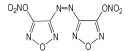
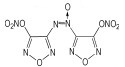
(2) 4, 4′-二硝基-3, 3-偶氮呋咱(DNAzBF)和4, 4′-二硝基-3, 3′-氧化偶氮呋咱(DNABF)
1994年, Novikova T S [12]等人报道合成了4, 4′-二硝基-3, 3-偶氮呋咱(DNAzBF)和4, 4′-二硝基-3, 3′-氧化偶氮呋咱(DNABF), 结构如Scheme 5所示。

|
Scheme5 Structure of DNAzBF and DNABF |
研究表明, DNAzBF密度1.84 g·cm-3, 生成焓703 kJ·mol-1, 爆压18.7 GPa, 爆速9700 m·s-1。在高能推进剂中可做氧化剂使用, 具有广泛的应用前景。
DNABF密度1.91 g·cm-3, 生成焓694 kJ·mol-1, 爆压45.6 GPa, 爆速9800 m·s-1[30]。目前还未见其应用方面的报道。
(3) [3, 4-c:3′, 4′-g]-双呋咱-[1, 2, 5, 6]-四嗪(DFT)
2000年, 美国Los Alamos国家实验室的Chavez D等人[31]采用三氯异氰脲酸作为氧化剂氧化DAF合成了DFT。合成路线如Scheme 6所示。
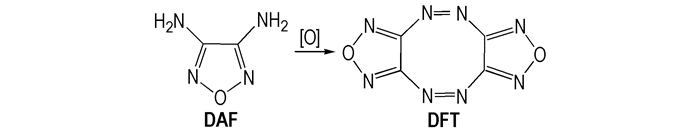
|
Scheme6 Synthesis of DFT |
Chavez D等[31]对DFT进行了密度, 生成焓、晶体结构和爆轰性能等参数的表征和测试。研究表明, 该化合物密度为1.91 g·cm-3, 生成焓为+204 kJ·mol-1, 晶体结构研究表明DFT是一个船型结构, 并且撞击感度高达到4 cm(2.5 kg重锤高度), 可以用作起爆药等含能材料。
表 1列出了近年来研究者关注的其它一些偶氮呋咱类无氢含氧富氮化合物的爆炸性能:生成焓、密度、爆速、爆压[29]。
| 表 1 一些呋咱类无氢含氧富氮化合物的爆炸性能 Tab.1 Properties of furazan type nitrogen-rich compounds without hydrogen |
由表 1数据可以看出, 在呋咱化合物中引入偶氮桥或氧化偶氮桥具有以下优点: (1)有利于提高化合物的标准生成焓。朱卫华等[32]研究表明, 在分子中引入—N=N(O)或—N=N—能够极大的增加呋咱化合物的生成焓, 利用基团加和法计算标准生成焓时引入氮氮键可使物质的标准生成焓提高211.6 kJ·mol-1。(2)有利于降低感度, 提高热稳定性。因为—N—N(O)—或—N=N—与呋咱环形成大的共轭结构, 芳香性增大。如DAAF分解温度高达315 ℃, 摩擦感度大于0.36 J[33]。(3)有利于提高化合物的密度。如有相同取代基的偶氮或氧化偶氮桥联二呋咱化合物的密度比两呋咱环直接相连化合物密度高。另外氧化偶氮桥呋咱化合物比偶氮桥呋咱化合物密度稍高, 可能的原因是:一方面氧平衡得到改善, 另一方面晶体堆积比较紧密。经理论计算双呋咱密度为1.66 g·cm-3, 偶氮呋咱为1.70 g·cm-3, 氧化偶氮呋咱1.75 g·cm-3; (4)有利于提高爆速和爆压。研究表明[34], 对于具有相同取代基的二呋咱化合物, —N=N(O) —和—N=N—连接的二呋咱化合物的爆速和爆压均相对较高。如双呋咱、偶氮呋咱、氧化偶氮呋咱的爆速依次为7140、7720、8070 km·s-1, 爆压依次为21.46、25.55、28.44 GPa。
3 含硝基无氢含氧富氮化合物一般来说, 提高富氮化合物的生成焓和密度能够提高其爆轰性能, 通过硝化反应引入—NO2可以增加化合物的氮氧含量, 并且N—N、C—N、N—O的加入有利于增加化合物的正生成焓和密度[29], 是合成有使用价值的高氮化合物的重要技术途径。并且研究已经表明, 对于多氮化合物, 当分子中连上一定量的硝基后, 会降低化合物的生成焓, 提高其密度, 利于提高化合物的爆速、爆压等性能, 发挥其作为含能材料的最大威力[35-36]。
(1) 2, 4, 6-三硝仿基-1, 3, 5-三嗪(TNTA)
1995年Shastin A V等[37]合成出2, 4, 6-三硝仿基-1, 3, 5-三嗪(Scheme 7, Ⅰ)。
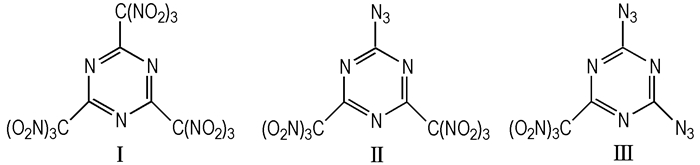
|
Scheme7 TATN and its derivative |
研究表明, TNTA的熔点是90~91 ℃, 易爆炸, 在空气中不稳定, 只能保存在5~10 ℃的CCl4溶液中。硝仿基团含有三个硝基, 可以在一定程度上弥补三嗪环氮氧含量的不足。
Shastin A V等[38-41]进而研究了利用三硝仿三嗪的亲核取代生成三嗪环硝仿取代物, 它在保证含能化合物氧平衡生成热的基础上可以降低其机械感度。化合物Ⅱ和Ⅲ(Scheme 7)为叠氮基取代其中的一个或两个硝仿基团的取代物。一叠氮的取代物Ⅱ分离出来是油状粘性物有水解的倾向, 二叠氮取代物Ⅲ是固体不易水解, 熔点96~97 ℃, 但这两种物质都对摩擦和撞击敏感。
(2) 三(3-硝基-1, 2, 3-三唑)苯
2012年, Venugopal Thottempudi [36]合成了三(3-硝基-1, 2, 3-三唑)苯, 结构如Scheme 8所示。研究表明, 三(3-硝基-1, 2, 3-三唑)苯的分解温度是38 ℃, 密度是1.82 g·cm-3, 生成焓2113 kJ·mol-1, 爆压是31.20 GPa, 爆速是8376 m·s-1, 由此可见, 三(3-硝基-1, 2, 3-三唑)苯生成焓高, 密度大, 爆轰性能优良, 是一种具有潜在应用价值的含能化合物。
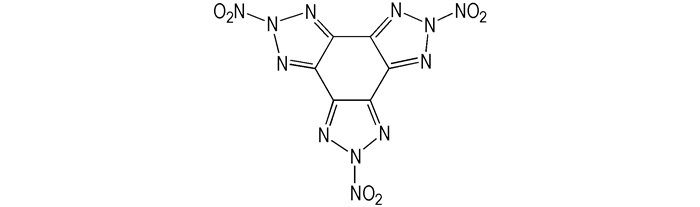
|
Scheme8 Trinitrotris(triazolo)benzene |
(3) 2, 2′-偶氮双(5-硝基四唑)和1, 1′-偶氮双(3, 5-二硝基-1, 2, 4-三唑)
Klaptke T M等[42]报道合成了2, 2′-偶氮双(5-硝基四唑), 具有N8结构, 是一种性能优良的含能化合物, 生成热1092 kJ·mol-1, 感度≤1 J。
1999年, Jeffrey C B [43]合成了1, 1′-偶氮双(3, 5-二硝基-1, 2, 4-三唑), 目前未见其性能报道。
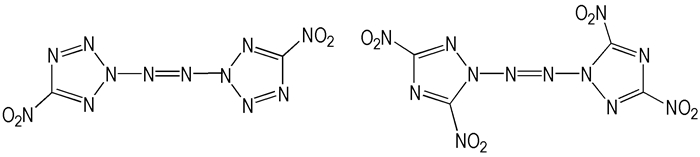
|
Scheme9 2, 2′-Azobis(5-nitrotetrazole) and 1, 1′-azobis(3, 5-dinitro-1, 2, 4-triazole) |
随着富氮含能化合物研究的逐步深入, 只含有C—N键的无氢无氧富氮化合物具有敏感的机械感度, 可以用于起爆药等领域, 已经引起了研究者的重视。
2004年美国Los Alamos Natl实验室的Huynh M H V等[44]报道了Scheme 10中的化合物Ⅳ, 名称为4, 4′, 6, 6′-四叠氮基偶氮-1, 3, 5-三嗪, 其密度为1.72 g·cm-3, 生成热是2171 kJ·mol-1, DSC起始分解温度为200 ℃。化合物Ⅳ通过重氮化和氧化反应制得。该法合成成本高, 产率低, 物质本身密度偏低, 稳定性不好, 这大大限制了它的应用。

|
Scheme10 Nitrogen-rich compounds without hydrogen and oxygen |
2004年Huynh M H V等[45-46]报道了化合物Ⅴ, 它是深红色晶体, 熔点130 ℃(分解), 生成热为1088 kJ·mol-1, 密度1.77 g·cm-3, 爆压31.3 GPa, 爆速8.45 km·s-1。该化合物虽然也具有很好发展前景, 但是密度偏低, 稳定性不好, 因此还需进一步改善其性能。
同年, Huynh M H V等[47]还报道了化合物Ⅵ的合成, 名称为2, 5, 8-三叠氮-s-庚嗪, 它是橙褐色固体, 在185 ℃分解, 冲击感度是6 N·m, 文献培养了化合物Ⅵ的单晶, 对其进行了TG-DTA热分析研究, 但未对密度和生成热进行研究。
5 全氮化合物相对于传统C、H、O、N类含能材料, 全氮材料具有高密度、高生成焓、超高能量及爆轰产物清洁无污染等优点, 因此有希望作为新一代超高能含能材料应用于炸药、发射药和推进剂等领域[48-50]。
近年来, 国内外研究者已经成功研究了N3—N13结构的全氮衍生物, 聚合氮和N原子簇等全氮物质。国外关于全氮的相关研究已有所突破, N5+等离子和五唑类系列衍生物等相继被合成出来, 并且对数以千计的氮簇化合物的结构、稳定性甚至含能性质等进行了理论预测[51-58]; 国内在五唑化合物合成以及全氮化合物的理论研究等方面也有可喜的进展[59-60]。
目前已经合成出来的全氮结构有N3+、N4+、N5+。1890年, 美国的Curtius和Radenhausen[61]发现了第一种全氮离子N3+, 这是理论意义上的第一种全氮物质。2002年, 意大利的Cacace等人报道通过对氮气进行电子轰击得到了亚稳态的N4+, 并证明其结构为线形[55, 62]。1998年, 美国的Christe等成功合成出呈线状结构的N5+[63-64],
已经研究的全氮类化合物种类很多, 但大多数仍然处于理论研究阶段。Scheme 11是N8立方烷和连五唑的结构。
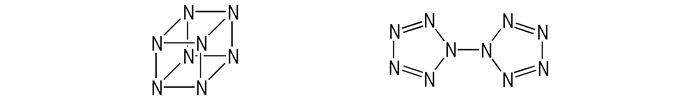
|
Scheme11 N8 cubane and bis-pentazoles |
理论计算得出N8立方烷的密度为2.65 g·cm-3, 爆热为(2226±21) kJ·mol-1, 爆速为14570 m·s-1, 爆压为137 GPa。N8立方烷的理论研究已有数十年, 但至今没有合成方面的报道[65-67]。
连五唑是环形N10结构, 2004年加拿大的WANG Li-jie[68]运用DFT和MP2方法研究了连五唑的稳定性, 研究表明, 连五唑的稳定性太差, 不适合用作含能材料。
N12是近年来研究较多的全氮结构, 庞思平课题组[69]在成功合成偶氮三唑和偶氮四唑的基础上, 提出了合成N12的可能的路线, 如Scheme 12。
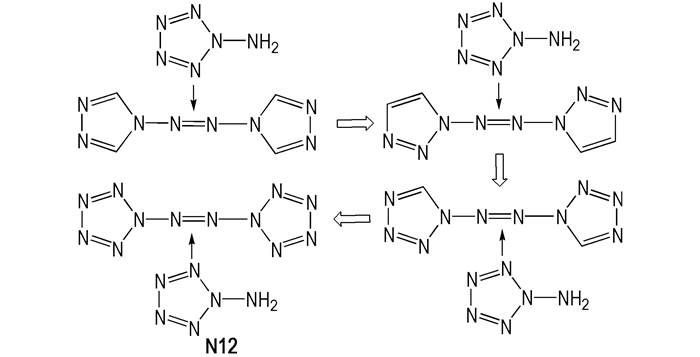
|
Scheme12 Synthesis of N12 |
综述了目前国内外报道的呋咱类无氢含氧富氮化合物、含硝基无氢富氮化合物、无氢无氧富氮化合物和全氮化合物的合成、表征及其应用性能研究方面的进展情况, 此类物质大多在高能钝感炸药、推进剂和气体发生剂领域具有应用前景。可以看出, 当前国内外对无氢富氮化合物的研究主要集中在呋咱类化合物, 而对嗪类(四嗪、三嗪)和唑类(三唑、咪唑、四唑)的叠氮基、硝基和并环类无氢富氮化合物的研究相对较少, 这方面的工作报道较多的是分子设计理论研究。例如, 由于叠氮基的引入会让反应过程和生成物的稳定性大大降低, 容易发生爆炸危险, 故综合性能优良、具有实用价值的叠氮基富氮化合物尚待进一步深入探索研究。
总体而言, 结构中不含有氢的富氮化合物由于无法形成氢键, 多数化学稳定性较差。该领域的研究工作未来仍将以两个方面为研究重点:一是借助量子化学计算和结构分析软件等手段, 不断从理论上设计各种新的化合物, 并对其性能进行理论预测, 对其中的部分物质也会进行探索性的合成和制备研究, 全氮化合物是关注焦点。二是对部分综合性能优良、具有使用价值的富氮化合物进行合成工艺优化、放大以及应用性研究, 目前来看, 分子结构中带硝基的呋咱类、唑类、嗪类和并环类的无氢富氮化合物中, 有望发现部分在高能炸药、推进剂及气体发生剂具有实际应用价值的物质, 这是应用研究工作者关注的重点。
| [1] |
Sivabalan R, Talawar M B, Senthilkumar N, et al. Studies on azotetrazolate based high nitrogen content high energy materials potential additives for rocket propellants[J].
Journal of Thermal Analysis and Calorimetry, 2004, 78(3): 781-792. |
| [2] |
黄明, 李洪珍, 李金山, 等. 高氮含能化合物的合成及反应性[J].
含能材料, 2006, 14(6): 457-462. HUANG Ming, LI Hong-zhen, LI Jin-shan, et al. Review on synthesis of high-nitrogen energetic Compounds[J]. Chinese Journal of Energetic Material(Hanneng Cailiao), 2006, 14(6): 457-462. |
| [3] |
Hiskey M, Chavez D. Insensitive high-nitrogen compounds. NTIS No: DE220012776133[R], 2001.
|
| [4] |
Son S F, Berghout H L, Bolme C A, et al. Burn rate measurements of HMX, TATB, DHT, DAAF and BTATz[J].
Proceedings of the Combustion Institute, 2000, 28(1): 919-924. DOI:10.1016/S0082-0784(00)80298-2 |
| [5] |
Ali A N, Son S F, Hiskey M, et al. Novel high-nitrogen propellant use in solid fuel micropropulsion[J].
Journal of Propulsion and Power, 2004, 20(1): 120 DOI:10.2514/1.9238 |
| [6] |
Chavez D, Hiskey M, Naud D L. High-nitrogen fuels for low-smoke pyrotechnics[J].
J Pyrotech, 1999, 10: 17-36. |
| [7] |
Hiskey M, Chavez D, Naud D L, et al. Low smoke pyrotechnic compositions: US 6312537[P]. 2001.
|
| [8] |
Khandhadia P S, Burns S P, Williams G K. High gas yield nonazide gas generants: US 6201505[P]. 2001.
|
| [9] |
Khandhadia P S, Burns S P. Thermally stable nonazide auto motive airbag propellants: US 6306232[P]. 2001.
|
| [10] |
Holl G, Klatopke T M, Weigand J. Preparation of dihydrazinium compounds of 5, 5'-azotetrazolate type, used in propellant, pyrotechnic formulation, rocket fuel or gas-generating composition, involves reacting alkali metal azotetrazole and hydrazinium salt in aqueous medium: DE102005011563-A1[P]. 2005.
|
| [11] |
张兴高, 朱慧, 张炜, 等. 呋咱类含能化合物及其在推进剂中的应用[J].
化学推进剂与高分子材料, 2006, 4(3): 1-5. ZHANG Xing-gao, ZHU Hui, ZHANG Wei, et al. Furazan energetic compounds and its application in propellant[J]. Chemical Propellant and Polymer Material, 2006, 4(3): 1-5. |
| [12] |
Novikova T S, Melnikova T M, Kharitonova O V, et al. An effective method for the oxidation of aminofurazans to nitrofurazans[J].
Mendeleev Communication, 1994, 4(4): 138-140. DOI:10.1070/MC1994v004n04ABEH000386 |
| [13] |
葛忠学, 王锡杰, 姜俊, 等. 3, 4-二硝基呋咱的合成[J].
合成化学, 2008, 16(3): 260-263. GE Zhong-xue, WANG Xi-jie, JIANG Jun, et al. Synthesis of 3, 4-dinitrifurazan[J]. Chinese Journal of Synthesis Chemistry, 2008, 16(3): 260-263. |
| [14] |
Sheremetev A B, Mantseva E V. Hydroxyfurazans: Outlook to using[C]//Proc 32th International Annual ICT-Conference, 2001.
|
| [15] |
Sheremetev A B, Aleksandrova N S. An efficient synthesis of Hydroxyfurazans[J].
Mendeleeve Communication, 1998(6): 238-239. |
| [16] |
Sheremetev A B, Aleksandrova N S. Synthesis of chlorofuranans from nitrofurazans[J].
Mendeleeve Communication, 2000(2): 67-68. |
| [17] |
Godovikova T I, Rakitin O A, Golova S P, et al. 3, 4-dinitrofuroxan-the 1st example of a pernitro heterocycle[J].
Mendeleev Communication, 1993, 3(5): 209-210. DOI:10.1070/MC1993v003n05ABEH000296 |
| [18] |
Godovikova T I, Golova S P, Strelenko Y A, et al. Synthesis and properties of unsubstituted furoxan[J].
Mendeleev Communications, 1994, 4(1): 7-9. DOI:10.1070/MC1994v004n01ABEH000324 |
| [19] |
黄明, 李洪珍, 黄奕刚, 等. 呋咱类含能材料合成进展[J].
含能材料, 2004, 12(A01): 73-78. HUANG Ming, LI Hong-zhen, LI Jin-shan, et al. Development of furazan energetic materials[J]. Chinese Journal of Energetic Material(Hanneng Cailiao), 2004, 12(A01): 73-78. |
| [20] |
Churakov A M, Loffe S L, Tartakovsky VA. Synthesis of[1, 2, 5] oxadiazolo[3, 4-e][1, 2, 3, 4]tetrazine4, 6-di-N-oxid[J].
Mendeleev Communication, 1995, 5(6): 227-228. DOI:10.1070/MC1995v005n06ABEH000539 |
| [21] |
Lempert D B, Nechipo renko G N. Specific momentum of rock propellants containing oxidizers based on C, N, and O atoms versus the enthalpy of formation and elementary com position of the oxidizer[J].
Khimicheskaya Fizika, 2004, 23(5): 75-81. |
| [22] |
WANG Bo-zhou, LI Xiang-zhi, LI Hui. A novel synthesis route of[1, 2, 5-oxadiazolo[3, 4-e][1, 2, 3, 41tetrazine-4, 6-Di-N-oxide[J].
Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(1): 131-132. |
| [23] |
胡焕性. 3, 4 -二硝基呋咱基氧化呋咱炸药: 中国, 02101092. 7[P]. 2002.
HU Huan-xing. 3, 4-dinitrofurazanofuroxan explosive: China, CN02101092. 7[P]. 2002. |
| [24] |
王军, 周小清, 张晓玉, 等. 一种高能量密度材料DNTF的低成本制备技术[J].
含能材料, 2011, 19(6): 747-748. WANG Jun, ZHOU Xiao-qing, ZHANG Xiao-yu., et al. Low-cost preparation technology of DNTF of a kind of high energy density material[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(6): 747-748. |
| [25] |
胡焕性, 张志忠, 赵凤起, 等. 高能量密度材料3, 4-二硝基呋咱基氧化呋咱性能及其应用研究[J].
兵工学报, 2004, 25(2): 155-158. HU Huan-xing, ZHANG Zhi-zhong, ZHAO Feng-qi, et al. A study on the properties and app-lication of high energy density material DNTF[J]. Acta Armamentarii, 2004, 25(2): 155-158. |
| [26] |
阳世清, 徐松林, 雷永鹏. 氮杂环含能化合物的研究进展[J].
含能材料, 2006, 14(6): 475-484. YANG Shi-qing, XU Song-lin, LEI Yong-peng. Development on nitrogen heterocyclic energetic copmpouds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 475-484. |
| [27] |
欧育湘, 刘进全.
高能量密度化合物[M]. 北京: 国防工业出版社, 2005.
OU Yu-xiang, LIU Jin-quan. High Energy Density Compounds[M]. Beijing: National Defence Industry Press, 2005. |
| [28] |
高莉, 杨红伟, 汤永兴. 偶氮及氧化偶氮呋咱化合物的合成与表征[J].
火炸药学报, 2013, 36(1): 47-51. GAO Li, YANG Hong-wei, TANG Yong-xing, et al. The synthesis and characterization of azofurzazn and oxidation azofurazan[J]. Chinese Journal of Explosives & Propellants, 2013, 36(1): 47-51. |
| [29] |
ZHANG Xiao-wen, ZHU Wei-hua, XIAO He-ming. Comparative theoretical studies of energetic substituted carbon-and nitrogen-bridged difurazans[J].
The Journal of Physical Chemistry A, 2010, 114(1): 603-612. DOI:10.1021/jp909024u |
| [30] |
高莉. 呋咱类含能化合物的合成研究[D]. 南京: 南京理工大学, 2013.
http://cdmd.cnki.com.cn/Article/CDMD-10288-1013165967.htm |
| [31] |
Chavez D, Hiskey M, Hill L, et al. Preparation and explosive properities of azo-and azoxy-furazans[J].
Journal of Energetic Materials, 2000, 18: 19-236. |
| [32] |
张德雄, 张衍, 王琦. 呋咱系列高能量密度材料的发展[J].
固体火箭技术, 2004, 27(1): 32-36. ZHANG De-xiong, ZHANG Yian, WANG Qi. Advances in high energy density matter of furazan series[J]. Journal of Soild Rocket Technology, 2004, 27(1): 32-36. |
| [33] |
Chavez D, Hill L, Hiskey M, et al. Preparation and explosive properties of azo and azoxy-furazans[J].
Taylor & Francis, 2000, 18(2-3): 219-236. |
| [34] |
Solodyuk G D, Bolydrev M D, Gidaspov B V. Oxidation of 3, 4-diaminofurazan by some peroxide reagents[J].
Zhurnal Organicheskol Khimii, 1981, 17(4): 861-865. |
| [35] |
Gao H X, Ye C F, Gupta O D, et al. 2, 4, 5-trinitroimidazole-based energetic salts[J].
Chemisity-A European Journal, 2007, 13(14): 3853-3860. DOI:10.1002/(ISSN)1521-3765 |
| [36] |
Venugopal Thottempudi, Farhad Forohor, Damon A, Parrish J. Tris(triazolo)benzene and its derivatives: high-density energetic materials[J].
Energetic Materials, 2012, 51: 9881-9885. |
| [37] |
Shastin A V, Godovikova T I, Golova S P, et al. Synthesis of 2, 4, 6-t ris(trinitromethyl) -1, 3, 5-triazine[J].
Mendeleev Communications, 1995, 5(1): 17-18. DOI:10.1070/MC1995v005n01ABEH000440 |
| [38] |
Shastin A V, Godovikova T I, Korsunskii B L. Trisubstituted 1, 3, 5-triazines. 3. Synthesis of substituted 2, 4, 6-tris(hydroxyiminomethyl)-1, 3, 5-triazines[J].
Khimiya Geterotsiklicheskikh Soedinenii, 1999, 1: 76-78. |
| [39] |
Shastin A V, Godovikova T I, Korsunskii B L. Trisubstituted-1, 3 triazines. 5. The interaction of 2, 4, 6-tris[di(tert-butoxycarbonyl)nitromethyl]-1, 3, 5-triazine with nucleophiles[J].
Khimiya Geterotsiklicheskikh Soedinenii, 2003(5): 722-729. |
| [40] |
Shastin A V, Godovikova T I, Golova S P J. ucleophilic-substitution Reaction of 2, 4, 6-Tris(Trinitromethyl)-1, 3, 5-Triazine.2. Interactionof 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine with primary amines and hexamethyldisilazane[J].
Khimiya Geterotsiklicheskikh Soedinenii, 1995(5): 679-688. |
| [41] |
Shastin A V, Godovikova T I, Golova S P J. Nucleophilic-substitution reaction of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine.1. interaction of 2, 4, 6-tris(trinitromethyl)-1, 3, 5-triazine with alcohols, diols, ammonia and secondary-amines[J].
Khimiya Geterotsiklicheskikh Soedinenii, 1995(5): 674-678. |
| [42] |
Klapötke T M, Piercey D G, Stierstorfer J. Amination of energetic anions: high-performing energetic materials[J].
Dalton Transactions, 2012, 41(31): 9451-9459. DOI:10.1039/c2dt30684k |
| [43] |
Jeffrey C B, Robert J S, Paul E P. Igniter for air bags; rocket propellant; detonators: US 5889161[P]. 1999.
|
| [44] |
Huynh M H V, Hiskey M A, Hartline E L, et al. Polyazido high-nitrogen compounds: hydrazo-and azo-1, 3, 5-triazine[J].
Angew Chem Int Ed, 2004, 43(37): 4924-4928. DOI:10.1002/(ISSN)1521-3773 |
| [45] |
Huynh M H V, Hiskey M A, Archuleta J G, et al. 3, 6-di(azido)-1, 2, 4, 5-tetrazine: A precursor for the preparation of carbon nanospheres and nitrogen-rich carbon nitrides[J].
Angew Chem Int Ed, 2004, 43(42): 5658-5661. DOI:10.1002/(ISSN)1521-3773 |
| [46] |
Huynh M H V, Hiskey M A, Chavez D E, et al. Synthesis, characterization, and energetic properties of diazido heteroaromatic high-nitrogen C-N compound[J].
Journal of the American Chemical Society, 2005, 127(36): 12537-12543. DOI:10.1021/ja0509735 |
| [47] |
Miller D R, Swenson D C, Gillan E D, et al. Synthesis and structure of 2, 5, 8-triazido-s-heptazine: An energetic and luminescent precursor to nitrogen-rich carbon nitrides[J].
Journal of the American Chemical Society, 2004, 126(17): 5372-5373. DOI:10.1021/ja048939y |
| [48] |
William W W, Ashwani V, Vandana V, et al. Polynitrogen chemistry: Preparation and characterization of (N5)2 SnF6, N5 SnF5, and N5B(CF3)4[J].
Chemistry, 2003, 9(12): 2840-2844. DOI:10.1002/chem.200304973 |
| [49] |
LI Song, QU Hong, LI Qian-shu. Quantum chemical study on N60[J].
Chemical Journal of Chinese Universities, 1997, 18(2): 297-299. |
| [50] |
黄辉, 王泽山, 黄亨建, 等. 新型含能材料的研究进展[J].
火炸药学报, 2005, 28(4): 9-13. HUANG Hui, WANG Ze-shan, HUANG Heng-jian, et al. Researches and progresses of novel energetic materials[J]. Chinese Journal of Explosive and Propellants, 2005, 28(4): 9-13. |
| [51] |
Samartizis P C, Wodtke A M. All-nitrogen chemistry: how far are we from N60[J].
International Reviews in Physical Chemistry, 2006, 25(4): 527-552. DOI:10.1080/01442350600879319 |
| [52] |
Glukhovtsev M N, Jiao H V. Besides N-2, what is the most stable molecule composed only of nitrogen atoms[J].
Inorganic Chemistry, 1996, 35(24): 7124-7133. DOI:10.1021/ic9606237 |
| [53] |
Karl O C, William W W, Jeffrey A, et al. N5+: A novel homoleptic polynitrogen ion as a high energy density material[J].
Angew Chem Int Ed, 2001, 40(16): 2947 |
| [54] |
Ashwani Vij, James G. Pavlovich, William W. Wilson, et al. Experimental detection of the pentaazacyclopentadienide(pentazolate) anion, cyclo-N5[J].
Angew Chem Int Ed, 2002, 114(16): 3177-3180. DOI:10.1002/1521-3757(20020816)114:16<3177::AID-ANGE3177>3.0.CO;2-I |
| [55] |
Cacace F, de Petris G, Troiani A. Experimental detection of tetranitrogen[J].
Science, 2002, 295(5554): 480-481. DOI:10.1126/science.1067681 |
| [56] |
Larson C, Ji Y, Samartzis P C, et al. Observation of photochemical C—N bond cleavage in CH3N3: A new photochemical route to cyclic N3[J].
Journal of Physical Chemical A, 2008, 112(6): 1105-1111. DOI:10.1021/jp076779h |
| [57] |
Quinto-Hernandez A, Lee Y Y, Huang T P, et al. Dissociative photoionization of C1N3 using high-resolution synchrotron radiation: The N-Cl bond energy in C1N3[J].
International Journal of Mass Spectrometry, 2007, 265: 261-266. DOI:10.1016/j.ijms.2007.02.028 |
| [58] |
Samartzis P C, Lin J M, Ching T T, et al. The simplest all-nitrogen ring: Photolytically filling the cyclic-N3 well[J].
Journal of Chemical Physics, 2007, 126(4): 041101-041105. DOI:10.1063/1.2433723 |
| [59] |
廉鹏, 来蔚鹏, 王伯周, 等. N5+、N5-、N8、N10结构与稳定性的密度泛函理论[J].
火炸药学报, 2007, 30(5): 28-32. LIAN Peng, LAI Wei-peng, WANG Bo-zhou, et al. Structures and stabilities of N5+、N5-、N8、N10 by density functional theory method[J]. Chinese Journal of Explosives and Propellants, 2007, 30(5): 28-32. |
| [60] |
张佳利, 庞思平, 李玉川, 等. 1-(对二甲氨基苯基)五唑的合成研究[J].
含能材料, 2006, 14(5): 355-357. ZHANG Jia-li, PANG Si-ping, LI Yu-chuan, et al. Synthesis of 1-(p-dimethylaminophenyl)pentazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(5): 355-357. |
| [61] |
Curtius T. Ueber Stickstoffwasserstoffsaure (Azoimid) N3H[J].
Berichte, 1890, 23: 3023-3033. |
| [62] |
Cacace F. From N-2 and O-2 to N-4 and O-4: Pneumatic chemistry in the 21st century[J].
Chemistry-A European Journal, 2002, 8(17): 3839-3847. |
| [63] |
Christe K O, Wilson W W, Sheehy J A. N5+: A novel homoleptic polynitrogen ion as a high energy density material[J].
Angew Chem Int Ed, 1999, 38(13-14): 2004-2009. DOI:10.1002/(ISSN)1521-3773 |
| [64] |
Christe K O, Dixon D A, McLemore, et al. On a quantitative scale for Lewis acidity and recent progress in polynitrogen chemistry[J].
Journal of Fluorine Chemistry, 2000, 101(2): 151-153. DOI:10.1016/S0022-1139(99)00151-7 |
| [65] |
Zhang M X, Eaton P E, Gilardi R J. Hepta-and octanitrocubanes[J].
Angewandte Chemie international Edition, 2000, 39(2): 401-404. DOI:10.1002/(ISSN)1521-3773 |
| [66] |
张光全, 董海山. 氮簇合物——潜在的高能密度材料候选物[J].
含能材料(增刊), 2004, 12(21): 105-113. ZHANG Guang-quan, DONG Hai-shan. Nitrogen clusters potentials candidates as high-energetic density material[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(Supplyment): 105-113. |
| [67] |
李玉川, 庞思平. 全氮型超高能含能材料研究进展[J].
火炸药学报, 2012, 35(1): 1-8. LI Yu-chuan, PANG Si-ping. Progress All-nitrogen ultrahigh-energetic materials[J]. Chinese Journal of Explosive and Propellants, 2012, 35(1): 1-8. |
| [68] |
Wang L J, Mezey P G, Zgjerskj M Z. Stability and the structures of nitrogen clusters N10[J].
Chemical Physics Letters, 2004, 391(4-6): 338-343. DOI:10.1016/j.cplett.2004.04.114 |
| [69] |
LI Yu-chuan, QI Cai, LI Sheng-Hua, et al. 1, 1'-Azobis-1, 2, 3-triazole: A high-nitrogen compound with stable N8 structure and photochromism[J].
Journal of the American Chemical Society, 2010, 132(35): 12172-12173. DOI:10.1021/ja103525v |
The synthesis, characterization, performance and research progress of nitrogen-rich compounds without hydrogen are summarized, and their developing trend in the future is analyzed.