高氮含能化合物是含碳和氮的杂环为骨架且氮含量较高(一般大于20%), 是目前新型含能材料领域研究的重点与热点[1-2]。呋咱环作为一类高氮含能结构单元被广泛应用于新型含能材料的设计合成中, 可使含能化合物具有高的生成焓和氧平衡[3]。自1968年Coburu[4]首次合成出3, 4-二氨基呋咱(DAF), 其良好的应用前景引起了研究者的关注。在呋咱化合物结构中引入偶氮桥—N=N—或氧化偶氮—N=N(O)—可获得爆轰性能优良, 标准生成焓高, 富含氮氧, 能量密度高, 氮含量高和耐热性能好的目标物[5]。几十年来, 俄罗斯科学院Zelinsky有机化学研究所Sheremetev等人[6-8]一直致力于呋咱含能化合物的研究。呋咱类高氮含能化合物作为一类新型的含能化合物受到各国的广泛重视。1981年俄罗斯科学家Solodyuk G D首次报道了3, 3′-二氨基-4, 4′-氧化偶氮呋咱(DAOAF)的合成[9]。1996年Zelinsky有机化学研究所报道了3, 4:7, 8:11, 12:15, 16-四呋咱基-1, 5, 9, 13-四偶氮环十六烷(TATF)及3, 4:7, 8:11, 12:15, 16-四呋咱-1, 5, 9, 13-四氧化偶氮环十六烷(TOATF)两种大环呋咱化合物的性质[10]。有文献对二(4-氨基呋咱基-3-氧化偶氮基)偶氮呋咱(ADAAF)爆轰性能进行了理论研究[11], 该化合物高能基团紧密排列, 分子结构对称, 有较高的密度(1.76 g·cm-3)和爆热(6.26 kJ·g-1)。硝氨基具有高能钝感性能[12], 若能通过硝化反应将氨基转化为硝氨基, 可明显提高化合物的爆轰性能。二(4-硝氨基呋咱基-3-氧化偶氮基)偶氮呋咱(ADNAAF)具有良好的应用前景, 然而国内外尚未见到此化合物的合成研究报道。
本研究选用碳酸氢钠的水溶液为反应介质, 采用过硫酸氢钾复合盐氧化体系对DAF进行了氧化研究, 获得了DAOAF。然后以DAOAF为原料, 经过氧化、硝化反应获得了ADNAAF。利用红外光谱、核磁共振和质谱等表征了各化合物的结构, 采用差示扫描量热法(DSC)和热重分析(TG)对ADAAF和ADNAAF的热性能进行了研究, 并预估了ADNAAF的爆轰性能, 为该类化合物的进一步研究和应用提供了数据支持。
2 实验部分 2.1 主要试剂与仪器盐酸羟胺、尿素、乙二醛(aq.40%)、氢氧化钠、过硫酸氢钾、碳酸氢钠、溴酸钾、冰乙酸均为分析纯, 均购于国药集团化学试剂有限公司; 100%硝酸, 自制。
Bruker Tensor 27傅里叶红外变换光谱仪, 瑞士Bruker公司; Bruker AvanceⅢ 300M数字化核磁共振仪, 瑞士Bruker公司; TSQ Quantum质谱仪, 美国Finnigan公司; LC-20AT高效液相色谱, 日本岛津公司; WRS-1B数字熔点仪, 上海精密科学仪器公司; DSC 823e差示扫描量热仪, 瑞士METTLER TOLEDO公司; TGA/ADTA 851e热重分析仪, 瑞士METTLER TOLEDO公司。
2.2 合成路线
|
Scheme 1 Synthetic routes of ADNAAF |
向250 mL三口烧瓶中, 依次加入35 mL乙二醛(aq. 40%), 105 g(1.75 mol)尿素, 133.0 g(1.91 mol)盐酸羟胺和128 mL蒸馏水。参照文献[13]的方法得到淡黄色针状晶体16.8 g, 收率35.1%。
2.3.2 DAOAF的合成[14]向500 mL三口烧瓶中, 依次加入2.0 g(20 mmol) DAF, 5.0 g (59.5 mmol) NaHCO3和200 mL蒸馏水, 分批加入12.3 g(20 mmol)过硫酸氢钾, 参照文献[14]的方法得到橙黄色固体粉末1.81 g, 收率85.4%。
2.3.3 ADAAF的合成向三口烧瓶里依次加入22.3 mL冰乙酸和1.2 g(5.7 mmol) DAOAF搅拌, 再称量1.2 g(7.2 mmol) KBrO3在加热的条件下溶于少量的蒸馏水中, 溶解完趁热加入冰乙酸的悬浮液。加料结束后将温度慢慢升高到50 ℃, 反应16 h。反应完全后倒入冰水中, 静置, 过滤, 将滤饼用水洗涤, 得到粗产品, 柱层析分离(硅胶柱200~300目, 洗脱剂二氯甲烷)得到深橘色固体0.70 g, 收率58.5%。1H NMR(DMSO-d6, 300 MHz) δ: 7.08(s, 4H, NH2); 13C NMR(DMSO-d6, 75 MHz) δ: 147.26, 151.40, 151.95, 159.31; IR(KBr, ν/cm-1): 3403, 3318(—NH2), 1637, 1507(N=O), 1480, 1426(C=N—O), 1265(C—N), 950(N—O); ESI-MS, m/z: 418.92[M-H]-。
2.3.4 ADNAAF的合成将2 mL纯硝酸加入到圆底烧瓶中, 置于冰盐浴中。分批加入0.42 g(1 mmol) ADAAF, 溶液变成浅黄色的透明溶液, 加料完毕后, 温度控制在0~5 ℃继续搅拌1 h。反应完全后倒入冰水中, 静置, 过滤, 滤饼用5% NaOH水溶夜溶解, 后用10%的稀硝酸酸化, 析出固体, 经过滤、洗涤、真空干燥得到黄色固体0.37 g, 收率72.5%。1H NMR(DMSO-d6, 300 MHz) δ: 5.03(s, 2H, NH2); 13C NMR(DMSO-d6, 75 MHz) δ: 147.66, 153.62, 155.30, 159.10; IR(KBr, ν/cm-1): 3272(—NH), 1615, 1299(NO2), 1488, 1376(C=N—O), 1250(C—N), 947(N—O), 744; ESI-MS, m/z: 508.83[M-H]-。
3 结果与讨论 3.1 KBrO3氧化DAOAF的机理推测由于配位氧对该共轭体系的影响, 使得化合物DAOAF中远离配位氧端的氨基电子密度较高, 易在KBrO3氧化作用下, 首先生成羟胺中间体1, 进一步氧化得到亚硝基中间体2, 因为氧的电负性比氮强, 化合物DAOAF中远端氨基优先进攻亚硝基中的氮原子, 形成羟胺结构, 加热脱水失去一分子的水, 最终得到化合物ADAAF, 反应机理如Scheme 2。

|
Scheme 2 Mechanism of oxidation from DAOAF to ADAAF |
设定反应时间为16 h, 冰乙酸与DAOAF摩尔比为68:1, 研究了反应温度对ADAAF收率影响, 结果见表 1。
| 表 1 反应温度对ADAAF收率的影响 Tab.1 Effect of reaction temperature on the yield of ADAAF |
由表 1可知, 在40 ℃以下, 产物的收率较低。根据液相色谱、薄层色谱(TLC)的跟踪监测, 发现反应不完全, 可能是由于反应需要一定的活化能, 在温度低的环境下分子间有效碰撞几率小, 导致反应不完全; 在60 ℃与70 ℃条件下, 反应虽然进行完全, 但产物收率有所降低, 其原因可能是温度太高, 导致副产物生成。故最佳反应温度为50 ℃。
3.2.2 反应时间设定反应温度为50 ℃, 冰乙酸与DAOAF摩尔比为68:1, 研究了反应时间对ADAAF收率影响, 结果见表 2。
| 表 2 反应时间对ADAAF收率的影响 Tab.2 Effect of reaction time on the yield of ADAAF |
从表 2可以看出, 随着反应时间的不断延长, 产物收率先增加后降低; 当反应时间为16 h时, 收率最高, 延长时间, 收率没有明显提高。因此, 最佳反应时间为16 h。
3.2.3 冰乙酸与DAOAF摩尔比设定反应温度为50 ℃, 反应时间为16 h, 研究了冰乙酸与DAOAF摩尔比对反应收率的影响, 结果见表 3。
| 表 3 试剂料比对ADAAF收率的影响 Tab.3 Effect of molar ratio of CH3COOH and DAOAF on the yield of ADAAF |
从表 3可以看出, 随着冰乙酸与DAOAF摩尔比的增加, 有利于反应的进行, 收率呈上升趋势。当n(CH3COOH):n(DAOAF)达到68:1时, 收率达58.5%, 随着两者摩尔比的继续增大, 收率下降, 这可能是因为冰乙酸用量过多会溶解部分产物。因此, 最佳冰乙酸与DAOAF摩尔比为68:1。
3.3 ADAAF与ADNAAF的热性能ADAAF和ADNAAF在10 ℃·min-1升温速率下的DSC和TG曲线如图 1和图 2所示。
|
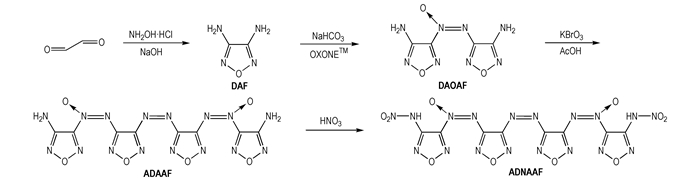
图 1 ADAAF和ADNAAF的DSC曲线 Fig.1 DSC curves of ADAAF and ADNAAF |
|
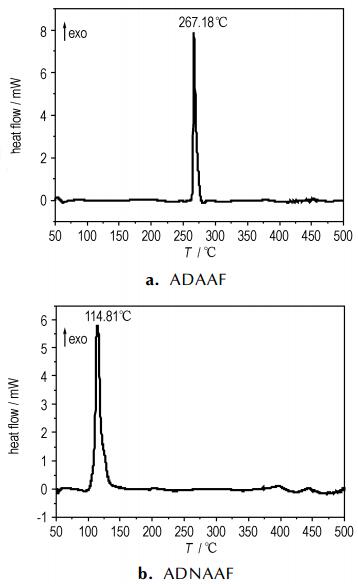
图 2 ADAAF和ADNAAF的TG曲线 Fig.2 TG curves of ADAAF and ADNAAF |
从图 1可以看出, ADAAF的DSC曲线在Tp=267.18 ℃时有一个明显的放热峰, 为该物质的热分解放热峰。ADNAAF的DSC曲线在Tp=114.81 ℃时有一个明显的放热峰, 为该物质的热分解放热峰。ADNAAF分解温度比ADAAF提前了约152 ℃, ADNAAF的热稳定性一般, 这是由于硝基是较敏感基团, 使其更容易分解。
从图 2a可知, ADAAF失重共分三个阶段。第一阶段为50~245.57 ℃, 失重约为10%;第二阶段为245.57~257.54 ℃, 失重约为47.5%;第三阶段为257.54~499.43 ℃, 失重约为33.41%, 温度最高升至499.43 ℃, 尚有9.09%未分解。从图 2b可知, 当温度为70~100.31 ℃时, ADNAAF失重45.57%;在温度100.31~480.83 ℃的过程中, 失重较平缓, 约为54.43%。
3.4 爆轰性能预估采用Gaussian03 (Revision E. 01)[15], 利用文献[16]的方法计算得到ADNAAF的分子摩尔体积V=268.41 cm3·mol-1, 理论密度为1.90 g·cm-3。
采用PM3半经验方法[17]得到目标物的气态生成焓ΔfH°298(g)=2001.35 kJ·mol-1。用Politzer分子表面静电势的方法[18]计算了升华焓ΔsubH°298=226.28 kJ·mol-1, 从而求得凝聚态ADNAAF的标准摩尔生成焓ΔfH°298(s)=1775.07 kJ·mol-1。通过Kamlet-Jacobs半经验方程[19-21]预测ADNAAF的爆速和爆压分别为9140 m·s-1和38 GPa。
4 结论(1) 以乙二醛为起始原料, 合成了ADAAF和ADNAAF, 并采用红外光谱、核磁共振、质谱等对中间体以及产物进行了结构表征。
(2) 确定了合成中间体ADAAF的最佳工艺条件:反应温度50 ℃, 反应时间16 h, 冰乙酸与DAOAF摩尔比为68:1。
(3) 初步研究了ADAAF和ADNAAF的热性能。结果表明, ADAAF的分解温度为267.18 ℃, 共失重90.91 %; ADNAAF的分解温度为114.81 ℃, 共失重100 %, ADNAAF的热稳定性一般。
(4) ADNAAF的理论密度为1.90 g·cm-3, 标准摩尔生成焓为1775.07 kJ·mol-1。其爆速和爆压分别为9140 m·s-1和38 GPa, 是一个性能优异、具有潜在应用价值的高能量密度化合物。
| [1] |
Singh R P, GAO Hai-xiang, Meshri D T, et al. Nitrogen-rich heterocycles[J].
High Energy Density Materials, Springer Berlin Heidelberg, 2007, 125: 35-83. DOI:10.1007/978-3-540-72202-1 |
| [2] |
Singh R P, Verma R D, Meshri D T, et al. Energetic nitrogen-rich salts and ionic liquids[J].
Angewandte Chemie International Edition, 2006, 45(22): 3584-3601. DOI:10.1002/(ISSN)1521-3773 |
| [3] |
李加荣. 呋咱系列含能材料的研究进展[J].
火炸药学报, 1998, 21(3): 56-59. LI Jia-rong. Research development of furazan energetic materials[J]. Chinese Journal of Explosives & Propellants, 1998, 21(3): 56-59. |
| [4] |
Pagoria P F, Lee G S, Mitchell A R, et al. A review of energy materials synthesis[J].
Thermochimica Acta, 2002, 384(1): 187-204. |
| [5] |
范艳洁, 王伯周, 周彦水, 等. 3, 3'-二氰基-4, 4'-偶氮呋咱(DCAF)合成及晶体结构[J].
含能材料, 2009, 17(4): 385-388. FAN Yan-jie, WANG Bo-zhou, ZHOU Yan-shui, et al. Synthesis and crystal structure of 3, 3'-dicyano-4, 4'-azofurazan (DCAF)[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2009, 17(4): 385-388. |
| [6] |
Sheremetev A B. Chemistry of furazans fused to fived-memebered rings[J].
Journal of Heterocyclic Chemistry, 1995, 32(2): 371-385. DOI:10.1002/jhet.v32:2 |
| [7] |
Sheremetev A B, Kulagina V O. Zero-hydrogen furazan macrocycles with oxy and azo bridges[J].
Journal of Organic Chemistry, 1996, 61(5): 1510-1511. |
| [8] |
Sheremeteev A B, Kulagina V O, Batog L V. Furazan derivatives high energetic materials from diaminofurazan[C]//Proceedings of 22nd International Pyrotechnics Seminar. Fort Collins, Colorado. 1996: 377-388.
|
| [9] |
Solodyuk G D, Boldyrev M D, Gidaspov B V, et al. Oxidation of 3, 4-diaminofurazan by some peroxide reagents[J].
Zhurnal Organicheskoi Khimii, 1981, 17(4): 756 |
| [10] |
Eman V E, Sukhanov M S, Lebedev O V, et al. Polydiazenofurazans: novel macrocyclic systems[J].
Mendeleev Communications, 1996, 2: 66-67. |
| [11] |
LI Xiao-hong, ZHANG Rui-zhou, ZHANG Xian-zhou. Computational investigation of the heat of formation, detonation properties of furazan-based energetic materials[J].
Structural Chemistry, 2013, 24(4): 1193-1200. DOI:10.1007/s11224-012-0147-3 |
| [12] |
沈华平, 卢艳华, 曹一林, 等. 亚甲基-双-(3-硝氨基-4-甲基呋咱)的合成与性能[J].
火炸药学报, 2011, 34(4): 37-40. SHEN Hua-ping, LU Yan-hua, CAO Yi-lin, et al. Synthesis and properties of methylene-bis-(3-nitramino-4-methylfurazan)[J]. Chinese Journal of Explosives & Propellants, 2011, 34(4): 37-40. |
| [13] |
黄明, 李洪珍, 李金山. 3, 4-二氨基呋咱的三种简便合成方法[J].
含能材料, 2006, 14(2): 114-115. HUANG Ming, LI Hong-zhen, LI Jin-shan. Three methods of synthesizing 3, 4-diaminofurazan[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(2): 114-115. |
| [14] |
高莉, 杨红伟, 汤永兴, 等. 偶氮及氧化偶氮呋咱化合物的合成与表征[J].
火炸药学报, 2013, 36(1): 47-51. GAO Li, YANG Hong-wei, TANG Yong-xing, et al. Synthesis and characterization of azofurazan and azoxyfurazan[J]. Chinese Journal of Explosives & Propellants, 2013, 36(1): 47-51. |
| [15] |
Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 03, Revision B. 05[CP], Gaussian: Wallingford, inc., 2004.
http://www.oalib.com/references/8806651 |
| [16] |
Kotomin A A, Kozlov A S. Calculation of densities of organic compounds from contributions of molecular fragments[J].
Russian Journal of Applied Chemistry, 2006, 79(6): 957-966. DOI:10.1134/S1070427206060176 |
| [17] |
邱玲, 居学海, 肖鹤鸣. 高能化合物生成热的半经验分子轨道研究[J].
含能材料, 2004, 12(2): 69-73. QIU Ling, JU Xue-hai, XIAO He-ming. Semi-empirical MO investigation on heats of formation for energetic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(2): 69-73. |
| [18] |
Politzer P, Murray J S, Grice M E, et al. Calculation of heats of sublimation and solid phase heats of formation[J].
Molecule Physics, 1997, 91(5): 923-928. DOI:10.1080/002689797171030 |
| [19] |
Kamlet M J, Jacobs S J. Chemistry of detonations. I. simple method for calculating detonation properties of C—H—N—O explosives[J].
The Journal of Chemical Physics, 1968, 48(1): 23-35. DOI:10.1063/1.1667908 |
| [20] |
XIAO He-ming, XU Xiao-juan, QIU Ling. Theoretical design of high energy density materials[J].
Science, Beijing, 2008 |
| [21] |
Politzer P, Murray J S. Some perspectives on estimating detonation properties of C, H, N, O compounds[J].
Central European Journal of Energetic Materials, 2011, 8(3): 209-220. |

Bis[4-nitraminofurazanyl-3-azoxy]azofurazan (ADNAAF) was synthesized from bis[4-aminofurazanyl-3-azoxy]azofurazan (ADAAF) using glyoxal as starting material. The thermal properties of ANDAAF and ADAAF were studied by differential scanning calorimetry and thermogravimetry analysis. The detonation performances of ADNAAF were estimated by Gaussian 03.




