2. 中国工程物理研究院化工材料研究所, 四川 绵阳 621999;
3. 四川省新材料研究中心, 四川 成都 610000
2. Institute of Chemical Materials, CAEP, Mianyang 621999, China;
3. SiChuan Research Center of New Materials, Chengdu 610000, China
发展可靠、准确、快速、实时的爆炸物检测技术是国内外研究的热点, 具有强爆炸性的多硝基化合物检测成为预防恐怖犯罪和保障公共安全的重点之一。众多的检测方法中[1-2], 基于荧光光谱法的探针识别技术因其具有高灵敏度和良好的专一性而备受关注, 是近年来发展最为迅猛的一类检测方法[3-6]。
富电子化合物与缺电子化合物之间会发生给体(D)-受体(A)的相互作用, 硝基化合物作为强缺电子化合物, 与富电子荧光物质之间存在典型的D—A作用, 可发生电子转移, 使体系的荧光猝灭[7-8]。目前, 富电子三苯胺类衍生物作为荧光探针逐渐得到大家的关注, 研究者以三苯胺为荧光团, 外接特定的识别基团对三苯胺母体进行修饰, 得到了一系列具有不同功能的荧光探针分子, 当待测体系中的物质与识别基团发生作用时, 引起探针共轭程度和电荷分布发生变化, 使荧光也随之发生变化, 实现检测的目的[9-10]。研究表明荧光分子的共轭效应越强, 荧光效率越高[11]; 荧光分子结构的刚性、共平面性越强, 荧光效率越高[12]。彭海涛等[13]通过Heck反应, 合成咔唑乙烯基修饰的三苯胺化合物, 咔唑基团的加入使得三苯胺化合物共轭性增大, 荧光强度较三苯胺有所增加。炔基三键的刚性较烯基双键更强, 唐本忠等[14]的研究工作将炔基三键引入三苯胺荧光分子中, 利用乙炔基将三苯胺与六苯基取代噻咯连接起来, 得到的化合物在水溶液中荧光强度较强, 但水相体系不利于硝基化合物的检测, 并且六苯基取代噻咯的分子共平面性较差。借鉴前人的工作经验, 为了进一步增强三苯胺分子的荧光强度, 本工作尝试通过刚性三键将三苯胺分子与其他共轭分子连接起来, 达到同时增强目标化合物共轭程度和分子刚性的目的; 为了进一步增强分子的共平面性, 我们尝试将平面性较好的苯基、取代苯基、芘基与三苯胺分子相连。本研究利用sonogashira偶联反应[15]对三苯胺母体进行炔基化修饰, 通过炔烃三键将三苯胺与芳环连接, 合成了四种以三苯胺为核心构筑单元的荧光探针分子, 并研究了分子结构、溶剂极性、硝基爆炸物对炔基三苯胺探针分子溶液荧光性质的影响, 为硝基爆炸物的快速定性检测提供了依据。
2 实验部分 2.1 试剂与仪器试剂: 4-溴三苯胺(纯度>97.0%)、4-乙炔基苯甲醚(纯度>98.0%)购于梯希爱化成工业发展有限公司; 1-乙炔基芘(纯度为96%)购于阿法埃莎化学有限公司; 4-氟苯乙炔(纯度为98%)购于阿拉丁; 碘化亚铜(纯度为99.998%)、双(三苯基膦)二氯化钯(Ⅱ)(纯度为98%)、三(4-碘苯胺)(纯度为98%)、苯乙炔(纯度为98%)购于百灵威。溶剂正己烷(n-hexane), 甲苯(toluene), 四氢呋喃(THF), 丙酮(acetone), N, N-二甲基甲酰胺(DMF)等均为分析纯(AR), 购自成都市科龙化工试剂厂, 且均经蒸馏除水处理后使用。
仪器:瑞士Bruker公司AV Ⅱ-400 MHz型核磁共振波谱仪; 美国热电公司Nicolet 6700型傅立叶红外光谱仪; 美国珀金埃尔默公司Lambda35型紫外可见分光光度计; 英国爱丁堡仪器公司Flsp920型稳态/瞬态荧光光谱仪; 美国安捷伦公司6520型四极杆串联飞行时间高分辨质谱仪; 上海精科显微熔点仪。
2.2 实验过程以化合物a为例, 合成炔基取代三苯胺的反应式如Scheme 1所示。在厚壁封管中加入4-溴三苯胺(323.0 mg, 1 mmol)、苯乙炔(112.2 mg, 1.1 mmol)、二(三苯基膦)二氯化钯(14.0 mg, 0.02 mmol)、碘化亚铜(9.5 mg, 0.05 mmol)、四氢呋喃(8 mL)、三乙胺(2 mL), 氮气保护后将封管密闭, 80 ℃反应24 h。反应完毕后, 待反应物冷却至室温, 利用旋转蒸发仪蒸去大部分溶剂, 经硅胶柱色谱分离提纯, 流动相使用石油醚与乙酸乙酯的混合液(V/V=50:1)。浓缩含有产品的洗脱液, 干燥, 得到浅黄色固体产物314.3 mg, 分离产率为91%。
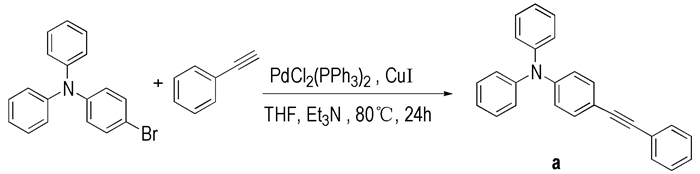
|
Scheme 1 Synthetic route of alkynyl substituted triphenylamines |
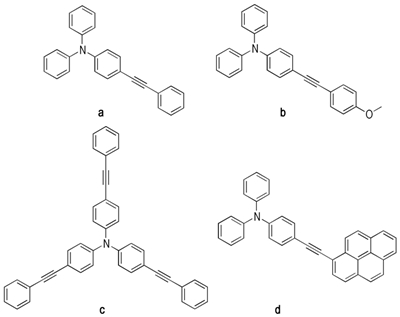
合成的四种炔基三苯胺如图 1所示。经核磁共振氢谱、核磁共振碳谱、高分辨质谱鉴定, 所得化合物结构准确无误, 具体表征数据如下:
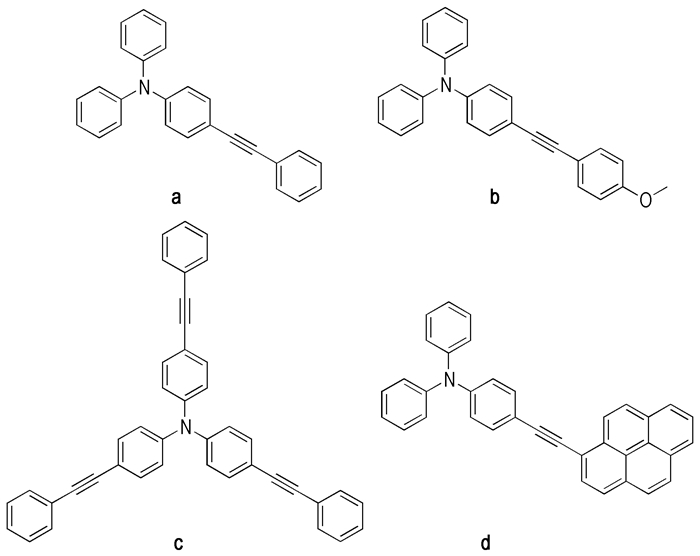
|
图 1 炔基三苯胺分子结构 Fig.1 Molecular structures of alkynyl substituted triphenylamines |
N, N-二苯基-4-(苯基乙炔基)苯胺(a), 浅黄色粉末, 分离产率91%, m.p. 93~95 ℃; UV-vis (DMF) λmax: 347 nm; 1H NMR (CDCl3, 400 MHz) δ: 6.69~7.08 (m, 4H), 7.09~7.10 (m, 4H), 7.20~7.27 (m, 7H), 7.34~7.36 (m, 2H), 7.47~7.50 (m, 2H); 13C NMR (CDCl3, 100 MHz) δ: 88.9, 90.0, 116.3, 122.6, 123.6, 124.8, 128.1, 128.3, 129.4, 131.7, 132.5, 147.2, 148.0; IR (KBr, ν/cm-1): 3055, 3034, 2918, 2849, 2203, 1590, 1515, 1491, 1333, 1318, 1282, 1177, 1136, 840, 759, 690; HRMS calcd for C26 H19 N 345.1517, found 345.150。
4-((4-甲氧基苯基)乙炔基)-N, N-二苯基苯胺(b), 浅黄色粉末, 分离产率74%, m.p. 115~117 ℃; UV-vis (DMF)λmax: 347nm; 1H NMR (CDCl3, 400 MHz) δ: 3.81 (s, 3H), 6.86 (d, J=9 Hz, 2H), 7.00 (d, J=9 Hz, 2H), 7.04~7.12 (m, 6H), 7.23~7.27 (m, 4H), 7.35 (d, J=9 Hz, 2H), 7.44 (d, J=9 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 55.4, 88.4, 88.7, 114.1, 115.9, 116.7, 122.7, 123.5, 125.0, 129.5, 132.5, 133.0, 147.4, 147.7, 159.5; IR (KBr, ν/cm-1): 3058, 3034, 2831, 1605, 1590, 1521, 1494, 1338, 1318, 1285, 1246, 1171, 1030, 828, 753, 696; HRMS calcd for C27H21NO 375.1623, found 375.1627。
三(4-(苯基乙炔基)苯基)胺(c), 黄色粉末, 分离产率88%, m.p. 159~161 ℃; UV-vis (DMF) λmax: 366 nm; 1H NMR (CDCl3, 400 MHz) δ: 7.07 (d, J=9 Hz, 6H), 7.30~7.36 (m, 9H), 7.43 (d, J=9 Hz, 6H), 7.50~7.53 (m, 9H); 13C NMR (CDCl3, 100 MHz) δ: 89.4, 89.5, 118.1, 123.5, 124.2, 128.3, 128.5, 131.7, 133.0, 146.8; IR (KBr, ν/cm-1): 3031, 2918, 2849, 2206, 1590, 1509, 1321, 1288, 1270, 1174, 1139, 1103, 1070, 834, 756, 732, 684; HRMS calcd for C42H27N 545.2143, found 545.2140。
N, N-二苯基-4-(芘基-1-乙炔基)苯胺(d), 黄色粉末, 分离产率56%, m.p. 167~169 ℃; UV-vis (DMF)λmax: 390 nm; 1H NMR (CDCl3, 400 MHz) δ: 7.05~7.09(m, 4H), 7.11~7.17(m, 4H), 7.27~7.32(m, 4H), 7.56~7.58 (m, 2H), 7.98~8.21(m, 8H), 8.64 (d, J=9 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 88.1, 95.7, 116.5, 118.4, 122.6, 123.7, 124.5, 124.7, 125.2, 125.6, 125.7, 125.8, 126.3, 127.4, 128.1, 128.3, 129.6, 131.1, 131.3, 131.4, 131.9, 132.8, 147.3, 148.2; IR (KBr, ν/cm-1): 3037, 2920, 2849, 2200, 1790, 1590, 1515, 1494, 1333, 1318, 1285, 1174, 1163, 1076, 896, 843, 756, 717, 696; HRMS calcd for C36H23N 469.1830, found 469.1824。
3.2 炔基三苯胺的光谱性质将所合成的目标化合物配制成浓度为1×10-5 mol·L-1的DMF溶液, 测其紫外吸收与荧光发射光谱, 结果见表 1。化合物a和b结构相似, 最大吸收峰一致; 化合物c、d相比于化合物a最大吸收峰分别红移了19 nm、43 nm, 说明电子受体和电子供体的结合进一步促进了π电子的分散。
| 表 1 炔基三苯胺光谱数据 Tab.1 Spectral data of alkynyl substituted triphenylamines |
荧光发射光谱如图 2所示, 化合物a、b、c、d在DMF中的浓度为1×10-5 mol·L-1, 激发波长分别为347, 347, 366, 390 nm, 结合表 1中的峰值数据可以看出, 化合物a、b、c的荧光发射峰值在418~436nm, 表现为紫色发光; 化合物d的荧光发射峰值为536 nm, 表现为黄绿色发光。化合物d的荧光最大发射峰与紫外吸收峰相同, 随着共轭程度增强发生红移, 相比于化合物a红移了100 nm。而化合物b的荧光最大发射峰相比于化合物a蓝移了18 nm, 这可能是因为荧光基团连接供电子甲氧基, 增强了分子的LUMO能级能量, 导致光谱出现蓝移; 化合物c的荧光最大发射峰相比于化合物a蓝移了6 nm, 这可能是因为三键的存在使分子变得比较舒展, 三臂化合物c比单臂化合物a更趋于平面化, 这样就使分子间紧密的面与面之间的堆积变得比较容易, 从而导致分子间作用力增大, 因此导致了荧光最大发射峰的蓝移。
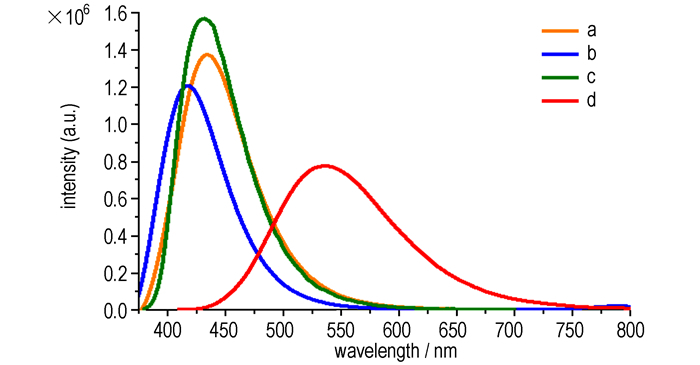
|
图 2 炔基三苯胺的荧光发射光谱 Fig.2 Fluorescence emission spectra of alkynyl substituted triphenylamines |
为了比较炔基三苯胺在不同溶剂中的发光性质, 以化合物d为例测试了它在不同极性溶剂中的荧光光谱。化合物d在各溶剂中的浓度均为1×10-5 mol·L-1, 激发波长为390 nm, 发射光谱如图 3所示, 溶剂的极性及相应的光谱数据归纳见表 2。

|
图 3 化合物d在不同溶剂中的荧光发射光谱 Fig.3 Fluorescence emission spectra of compound d in different solvent |
| 表 2 化合物d在不同溶剂中的光谱数据 Tab.2 Spectral data of compound d in different solvent |
由图 3可以看出化合物d在甲苯和环戊烷中, 荧光亮度较低; 而四氢呋喃和丙酮溶剂的荧光发射峰较DMF小, 导致斯克托位移较小, 易引起化合物d荧光自淬灭。从表 2可以看出, 化合物d在不同溶剂中最大发射波长的变化, 以及Stock′s位移的变化与溶剂的极性成正比, 即随着溶剂极性的增大, 化合物d的荧光发射峰发生红移, 这是因为随着溶剂极性的增大, 荧光物质d与溶剂的静电作用越来越显著, 从而稳定了激发态, 荧光发射波长红移。
3.4 TNT对炔基三苯胺荧光性能的影响在化合物a、b、c、d的1×10-5 mol·L-1 DMF溶液中, 加入不同浓度的TNT后体系的荧光随TNT浓度的变化呈现规律猝灭, 如图 4所示(激发波长分别为347、347、366、390 nm)。
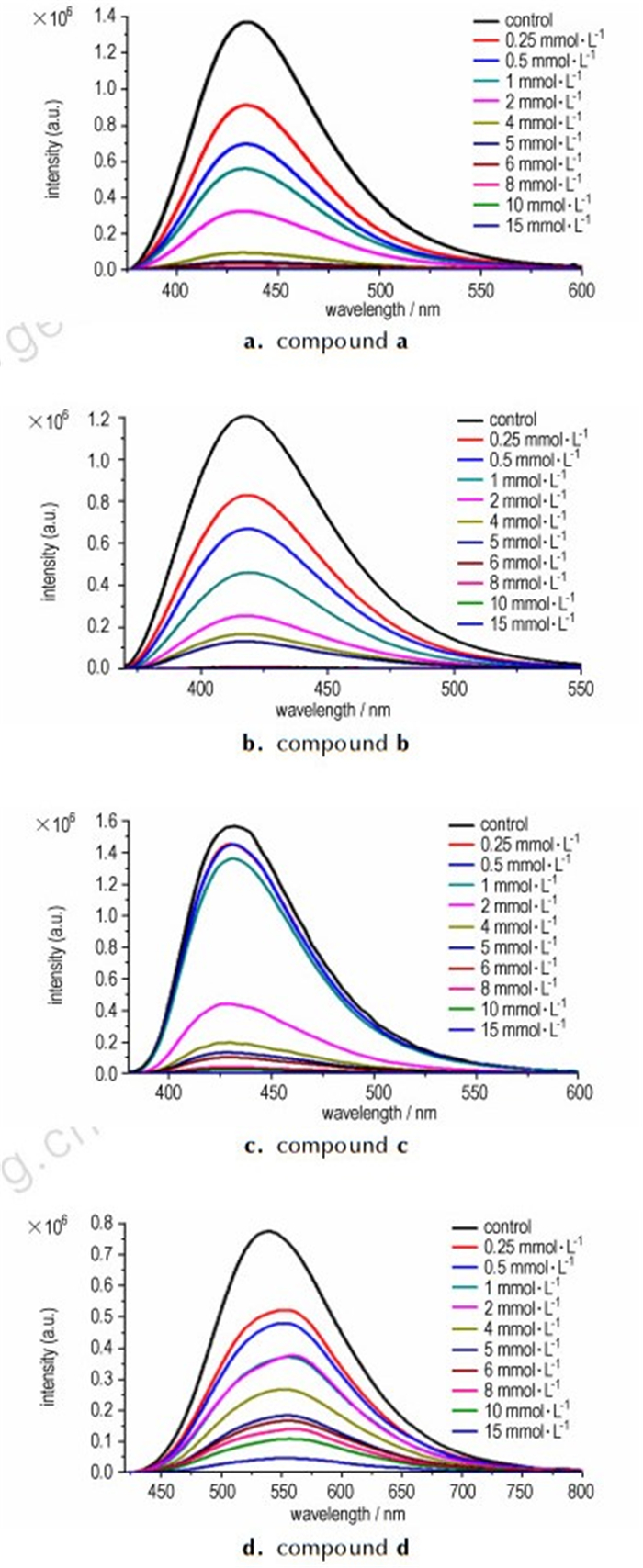
|
图 4 不同浓度TNT对炔基三苯胺荧光猝灭效应的影响 Fig.4 Effects of different concentration of TNT on the fluorescence quenching effect of alkynyl substituted triphenylamines |
从图 4可以看出:随着加入的TNT溶液浓度的增大, 炔基三苯胺溶液的荧光强度逐渐降低, 这是因为在DMF溶液中, 富电子的炔基三苯胺化合物与缺电子的硝基化合物(TNT)接触, 发生了电子转移, TNT吸引炔基三苯胺中的电子, 使电子在更大的区域内离域, 导致化合物荧光强度下降。从定量的角度, 在浓度为1×10-5 mol·L-1的炔基三苯胺溶液中, 加入浓度为2.5×10-4 mol·L-1的TNT, 发生明显的荧光猝灭效应; 当TNT的浓度增至1×10-2 mol·L-1时, 炔基三苯胺荧光几乎完全消失。
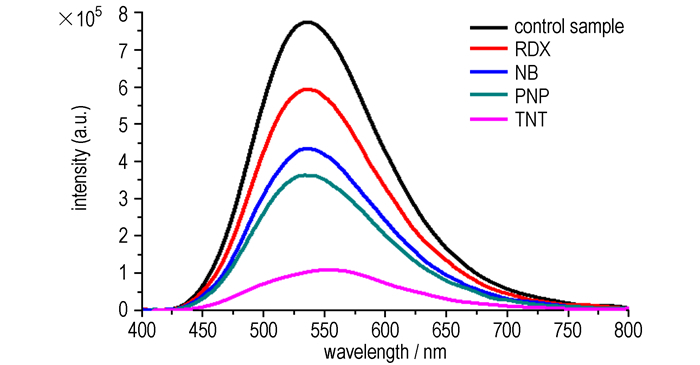
3.5 不同硝基化合物对炔基三苯胺性能的影响在化合物d的DMF溶液中分别加入黑索今(RDX)、硝基苯(NB)、对硝基苯酚(PNP)、三硝基甲苯(TNT), 使得溶液体系中化合物d浓度为1×10-5 mol·L-1, 硝基爆炸物的浓度均为1×10-2 mol·L-1, 其荧光光谱的变化所图 5所示(激发波长为390 nm)。
|
图 5 不同硝基爆炸物对化合物d荧光猝灭效应的影响 Fig.5 Effects of different nitro-explosives on the fluorescence quenching effect of compound d |
由图 5可以看出, 化合物d和硝基化合物在此浓度下, 硝基化合物对化合物d的猝灭性能表现为TNT>PNP>NB>RDX, 淬灭程度分别为88%, 56%, 47%, 25%。
与仅含一个硝基基团的硝基苯相比, TNT含有三个硝基基团, 是强缺电子化合物, 当与富电子的荧光化合物d接触时, TNT比硝基苯具有更强的猝灭能力; 对硝基苯酚中含有一个给电子的羟基基团, 它的缺电子性能不如硝基苯, 但是羟基氢能与富电子的荧光化合物d之间形成氢键并发生分子间电子转移, 使荧光猝灭效应增强; 黑索今分子中含有三个硝基, 中间为三嗪环, 当黑索今与荧光化合物d接触, 吸电子的硝基可以使富电子的d发生电子转移而导致荧光强度下降, 但黑索今分子中不含有共轭结构, 与TNT相比, 其猝灭溶液荧光的能力比较弱。
4 结论(1) 炔基三苯胺的光谱性质与化合物的分子结构紧密相关, 一般来说, 共轭体系电子离域性越大, 紫外吸收光谱与荧光发射光谱越易发生红移; 此外, 光谱性质还与分子的空间构型相关。
(2) 炔基三苯胺在不同溶剂中最大发射波长与溶剂的极性相关, 随着溶剂极性的增大, 炔基三苯胺的荧光发射峰越易发生红移, DMF、丙酮、四氢呋喃、甲苯相对于正己烷分别红移了36、23、7 nm和1 nm。
(3) 炔基三苯胺与TNT接触时, 可发生电子转移猝灭, 并且随着TNT浓度的增加, 炔基三苯胺的荧光强度逐渐减弱; 在浓度为1×10-5 mol·L-1的炔基三苯胺溶液中, 加入浓度为2.5×10-4 mol·L-1的TNT, 发生明显的荧光猝灭效应, 当TNT的浓度增至1×10-2 mol·L-1时, 炔基三苯胺荧光几乎完全消失。
(4) 不同的硝基化合物对炔基三苯胺的荧光猝灭能力不同, 与分子的骨架结构以及取代情况有关。RDX分子中间为非平面的三嗪环, 分子为非共轭结构, 猝灭性能较差; 同为单硝基的芳香烃, 由于PNP较NB多一个酚羟基, 易于与荧光化合物d通过氢键实现电荷转移淬灭, 淬灭能力稍强; TNT分子为具有三硝基的芳香烃, 淬灭能力最强。
| [1] |
Walsh M E. Determination of nitroaromatic, nitramine, and nitrate ester explosives in soil by gas chromatography and an electron capture detector[J].
Talanta, 2001, 54(3): 427-438. DOI:10.1016/S0039-9140(00)00541-5 |
| [2] |
Sylvia J M, Janni J A, Klein J, et al. Surface-enhanced Raman detection of 2, 4-dinitrotoluene impurity vapor as a marker to locate landmines[J].
Anal Chem, 2000, 72(23): 5834-5840. DOI:10.1021/ac0006573 |
| [3] |
刘勇, 舒远杰, 刘学涌, 等. 分子印迹技术和荧光分析技术在爆炸物检测中的应用[J].
化学进展, 2009, 21(12): 2712-2717. LIU Yong, SHU Yuan-jie, LIU Xue-yong, et al. Application of molecular imprinting and fluorescence analysis techniques in explosive detection[J]. Progress in Chemistry, 2009, 21(12): 2712-2717. |
| [4] |
杜海英, 丁立平, 房喻. 液相爆炸物荧光化学传感器研究进展[J].
化学通报, 2011, 74(10): 881-889. DU Hai-ying, DING Li-ping, FANG Yu. Progress in the study of fluorescent sensors for the detection of explosives in solution[J]. Chemistry, 2011, 74(10): 881-889. |
| [5] |
Xu Z, Chen X, Kim H N, et al. Sensors for the optical detection of cyanide ion[J].
Chem Soc Rev, 2010, 39(1): 127-137. DOI:10.1039/B907368J |
| [6] |
Germain M E, Knapp M J. Optical explosives detection: from color changes to fluorescence turn-on[J].
Chem Soc Rev, 2009, 38(9): 2543-2555. DOI:10.1039/b809631g |
| [7] |
Thomas S W, Joly G D, Swager T M. Chemical sensors based on amplifying fluorescent conjugated Polymers[J].
Chem Rev, 2007, 107: 1339-1386. DOI:10.1021/cr0501339 |
| [8] |
Toal S J, Trogler W C. Polymer sensors for nitroaromatic explosives detection[J].
J Mater Chem, 2006(16): 2871-2883. |
| [9] |
Yang Z, Zhao N, Sun Y, et al. Highly selective red-and green-emitting two-photon fluorescent probes for cysteine detection and their bio-imaging in living cells[J].
Chem Commun, 2012, 48(28): 3442-3444. DOI:10.1039/c2cc00093h |
| [10] |
Shi L, He C, Zhu D, et al. High performance aniline vapor detection based on multi-branched fluorescent triphenylamine-benzothiadiazole derivatives: branch effect and aggregation control of the sensing performance[J].
J Mater Chem, 2012, 22(23): 11629-11635. DOI:10.1039/c2jm30933e |
| [11] |
Badjic J D, Roneoni C M, Stoddart J F, et al. Operating molecular elevators[J].
J Am Chem Soc, 2006, 128: 1489-1499. DOI:10.1021/ja0543954 |
| [12] |
Beer P D. Transition-metal receptor systems for the selective recognition and sensing of anionic guest species[J].
Acc Chem Res, 1998, 31: 71-80. DOI:10.1021/ar9601555 |
| [13] |
彭海涛. 检测硝基芳烃用咔唑衍生物的合成及性能研究[D]. 济南: 山东轻工业学院, 2011年.
PENG Hai-tao. Studies on the Synthesis and Sensing ProPerties of Carbazole Derivatives for Nitroaromatic compounds[D]. Jinan: Shandong Polytechnic of University, 2011. |
| [14] |
Zhao Z J, Liu J Z, Jacky W Y, et al. Luminescent aggregates of a starburst silole-triphenylamine adduct for sensitive explosive detection[J].
Dyes and Pigments, 2011, 91: 258-263. DOI:10.1016/j.dyepig.2011.03.006 |
| [15] |
Chinchilla R, Najera C. The sonogashira reaction: a booming methodology in synthetic organic chemistry[J].
Chem Rev, 2007, 107(3): 874-922. DOI:10.1021/cr050992x |
Alkynylsubstituted triphenylamines were synthesized via sonogashira coupling reaction using alkynes and halogenated triphenylamines as raw materials. The effects of molecular structure, solvent polarity, and addition of nitro-explosives on the fluorescent properties were researched.




