高氮含能化合物具有高密度、高生成焓等优良性能[1-2]。目前, 已经报道的高氮含能化合物主要以氮杂环类为主, 例如嘧啶、四嗪、四唑等。其中, 四嗪类化合物[3-5]因其具有高的生成热、高氮含量、高氧平衡、燃烧成气量大、燃烧产物清洁等优点, 成为近年来高氮含能化合物的研究热点之一。
随着苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(BTDO)的合成[6-13]技术越来越成熟, 关于BTDO硝化的报道也相继出现。目前, 研究最多的硝化产物是5-硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(5-NBTDO)[14], 7-硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(7-NBTDO)[14], 5, 7-二硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(DNBTDO)[15]。其中DNBTDO是以BTDO为原料经100%HNO3 /20%的发烟硫酸硝化合成, 此工艺反应条件苛刻, 操作较繁琐, 100%HNO3制取工艺复杂, 且合成产率不高; NBTDO(包括5-NBTDO和7-NBTDO)是以BTDO为原料经发烟硝酸/硫酸合成, 此工艺硝化体系单一、废酸过多且产率不高。
本研究以BTDO为原料, 在硝硫混酸体系、发烟硫酸/硝酸体系、浓硫酸/硝酸钾体系、发烟硫酸/硝酸钾4种硝化体系下进行反应, 探索出合成5-NBTDO, 7-NBTDO, DNBTDO的最佳工艺条件。并用红外光谱测试、核磁共振分析等检测方法确定物质结构。同时, 通过理论计算, 预测出可能的硝化产物。
2 实验部分 2.1 试剂与仪器试剂:BTDO(自制), 纯度99%;20%发烟硫酸, 发烟硝酸, AR, 上海振欣试剂有限公司; 98%浓硫酸, AR, 国药集团化学试剂有限公司; 硝酸钾, AR, 南京宁试化学试剂有限公司; 乙酸乙酯, AR, 南京化学试剂有限公司。
仪器:Bruker Tensor 27傅里叶红外变换光谱仪, 瑞士Bruker公司; Bruker AvanceⅢ 300M数字化核磁共振仪, 瑞士Bruker公司; TSQ Quantum质谱仪, 美国Finnigan公司; DFY-5/30 ℃低温恒温反应浴, 南京科尔仪器设备有限公司; LC-20AT高效液相色谱, 日本岛津公司。
2.2 实验过程BTDO硝化路线见Scheme 1。
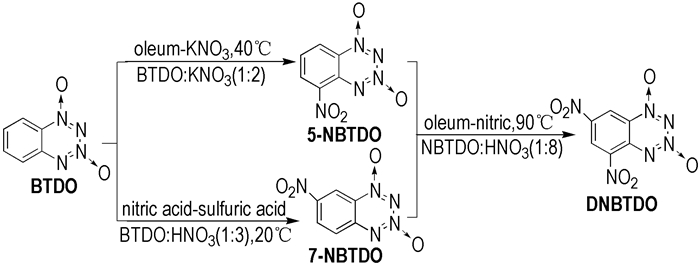
|
Scheme 1 The nitration route of BTDO |
将50 mg(0.305 mmol)的BTDO缓慢加入到0.5 mL发烟硫酸溶液中, 冰浴下搅拌至溶解; 缓慢加入62 mg(0.610 mmol)的硝酸钾固体, 温度控制在0 ℃反应1 h。再升温至40 ℃继续反应, 至薄层色谱法检测无原料点结束反应。待反应液冷却后, 用饱和的碳酸氢钠溶液中和, 再用30 mL乙酸乙酯萃取。无水硫酸镁干燥, 减压蒸馏除去溶剂得到黄色固体22.2 mg, 产率为34.9%。
2.3.2 7-硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(7-NBTDO)的制备[15]将50 mg(0.305 mmol)的BTDO缓慢加入到0.5 mL浓硫酸溶液中, 冰浴下搅拌至溶解; 缓慢滴加0.5 mL硝酸和1 mL浓硫酸混酸溶液, 温度控制在0 ℃反应1 h。再升温至20 ℃继续反应, 至薄层色谱法检测无原料点结束反应。待反应液冷却后, 用饱和的碳酸氢钠溶液中和, 再用30 mL乙酸乙酯萃取。无水硫酸镁干燥, 减压蒸馏除去溶剂得到黄色固体49.1 mg, 产率为77.1%。
2.3.3 5, 7-二硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(DNBTDO)的制备将83.6 mg(0.4 mmol)的NBTDO缓慢加入到1 mL发烟硫酸溶液中, 冰浴下搅拌至溶解; 缓慢滴加2 mL发烟硝酸和2 mL发烟硫酸的混合溶液, 温度控制在0 ℃反应1 h。再升温至95 ℃继续反应, 至薄层色谱法检测无原料点结束反应。待反应液冷却后, 用饱和的碳酸氢钠溶液中和, 再用30 mL乙酸乙酯萃取。无水硫酸镁干燥, 减压蒸馏除去溶剂得到黄色固体91.44 mg, 产率为90%。
2.4 产品质量分数的分析及相关数据高效液相色谱法HPLC条件:C18柱, 检测波长254 nm, 柱温25 ℃, 流动相配比为V(甲醇):V(水)=10:90, 流速1.0 mL·min-1, 进样量10 μL。
5-硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(5-NBTDO):黄色固体, 熔点193~195 ℃[3]。1H NMR(DMSO-d6, 300 MHz) δ: 8.74(dd, J=7.8, ArH, 1H), 8.60(dd, ArH, 1H), 7.98(t, ArH, 1H); 13C NMR(DMSO-d6, 75 MHz) δ:141.22, 136.83, 133.21, 130.94, 129.43, 124.07;IR(ν/cm-1):1505, 1416(N4O2), 1538, 1344(—NO2); ESI-MS, m/z:208 [M-H]-。
7-硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(7-NBTDO):黄色固体, 熔点166~168 ℃[3]。1H NMR(DMSO-d6, 300 MHz) δ:8.91(d, ArH, 1H), 8.79(dd, ArH, 1H), 8.20(d, ArH, 1H); 13C NMR(DMSO-d6, 126 MHz) δ:148.06, 146.40, 132.23, 128.52, 126.74, 115.75;IR(ν/cm-1):1503, 1423(N4O2), 1533, 1367(—NO2 ); ESI-MS, m/z:208 [M-H]-。
5, 7-二硝基苯并1, 2, 3, 4-四嗪-1, 3-二氧化物(DNBTDO):黄色固体, 熔点209~211 ℃[3]。1H NMR(DMSO-d6, 300 MHz) δ: 9.45(d, ArH, 1H), 9.12(d, ArH, 1H); 13C NMR(DMSO-d6, 75MHz) δ:146.14, 141.22, 139.40, 128.99, 127.70, 118.93;IR(ν/cm-1):1512, 1438(N4O2), 1537, 1368(—NO2 )。
3 结果与讨论 3.1 正交实验运用正交实验[16]方法, 选取硝化体系(A)、反应温度(B)、物料比(C)3种因素作为正交实验因素, 确定合成3种物质的最佳工艺条件。因素水平表见表 1。正交实验结果见表 2。
| 表 1 因素水平表 Tab.1 Factors and levels |
| 表 2 正交试验结果和分析 Tab.2 Results and analysis of orthogonal experiment |
由表 2可得, 影响5-NBTDO产率的主要因素是硝化体系, 其影响顺序A>C>B; 选择最佳的工艺条件是A4B2C3, 即发烟硫酸/硝酸钾体系、n(BTDO):n(KNO3)=1:2、温度为40 ℃; 影响7-NBTDO产率的主要因素是硝化体系, 其影响顺序A>B>C; 选择最佳的工艺条件是A1B1C3, 即硝硫混酸体系、温度为20 ℃、n(BTDO):n(HNO3)=1:3;影响DNBTDO产率的主要因素是物料比, 其影响顺序C>B>A; 选择最佳的工艺条件是C4B4A1, 即n(BTDO):n(HNO3)=1:4、温度为80 ℃、硝硫混酸体系。
3.2 验证试验以合成每种物质的最佳水平组合进行实验, 得出每种物质在最佳工艺条件下的产率, 分别为5-NBTDO 34.9%, 7-NBTDO 77.1%, DNBTDO 19.7%。
可见, 在发烟硫酸/硝酸钾体系下, n(BTDO):n(KNO3)=1:2、温度为40 ℃, 5-NBTDO产率为34.9%;在硝硫混酸体系下, 温度为20 ℃、n(BTDO) :n(HNO3)=1:3, 7-NBTDO产率为77.1%。在硝硫混酸体系下, n(BTDO):n(HNO3)=1:4、温度为80 ℃, DNBTDO产率仅有19.7%。实验结果发现, 7-NBTDO的产率明显高于5-NBTDO, 这是因为硝化反应为亲电反应, 且7位电子云比5位电子云密集, 为此7-NBTDO更容易生成。
3.3 DNBTDO合成工艺探究以BTDO为原料合成DNBTDO的产率仅为19.7%。为此对DNBTDO的合成工艺进行探索, 发现以NBTDO为原料, 在发烟硫酸/发烟硝酸体系, 物料比为1:8, 反应温度为95 ℃的条件下, 产率较高。具体结果见表 3。
| 表 3 原料对DNBTDO产率的影响 Tab.3 Effect of material on the yield of DNBTDO |
由表 3知, 以BTDO为原料合成DNBTDO时产率比较低, 而5-NBTDO或7-NBTDO为原料合成DNBTDO时, 产率高达90%。为此, 确定了合成DNBTDO的最佳工艺条件是n(NBTDO):n(发烟硝酸)=1:8、温度95 ℃、发烟硫酸/发烟硝酸体系。此工艺产率高, 操作简单。
4 BTDO硝化选择性的理论预测本研究使用Multiwfn 3.1[17], 利用双描述符(Dual Descriptor)和基于Hirshfeld原子电荷计算得到的简缩双描述符(Condensed Dual Descriptor)[18-19]预测了BTDO不同位点的亲电活性(表 4)。双描述符是在概念密度泛函理论框架下定义的一种实空间函数, 具体计算公式为:
| $ \begin{array}{l} {f^2}\left( r \right) = {f^ + }\left( r \right) - {f^ - }\left( r \right) = {\rho _{{\rm{N + 1}}}}\left( r \right) - 2{\rho _{\rm{N}}}\left( r \right) + {\rho _{{\rm{N}} - 1}}\left( r \right)\\ \;\;\;\;\;\;\;\;\;\;\; \approx {\rho ^{{\rm{LUMO}}}}\left( r \right) - {\rho ^{{\rm{HOMO}}}}\left( r \right) \end{array} $ |
| 表 4 BTDO苯环上的简缩双描述符数值 Tab.4 The calculated condensed dual descriptor on benzene ring of BTDO |
式中, ρN、ρN+1、ρN-1和f分别代表体系在原始状态(N电子)、结合一个电子状态(N+1电子)、电离掉一个电子状态(N-1电子)下的电子密度和旋转电子的空间分布密度。简缩双描述符是将双描述符收缩到原子上, 使每个原子具有一个确切的数值, 以便于在定量层面上比较不同位点上双描述符的大小, 计算公式为:
| $ {f^2} = {f_{\rm{A}}}^ +-{f_{\rm{A}}}^-= 2{q_{\rm{N}}}^{\rm{A}}-{q_{{\rm{N}} + 1}}^{\rm{A}} - {q_{{\rm{N}} - 1}}^{\rm{A}} $ |
式中, qNA、qN+1A、qN-1A、f+和f-分别表示A原子在原始状态(N电子)、结合一个电子状态(N+1电子)、电离掉一个电子状态(N-1电子)下的电荷量、电子N+1体系和N-1体系中的电子分布密度。通过双描述符计算活性位点时, 通常认为双描述符数值越负的区域越可能是亲电位点, 数值越正越有可能遭受亲核进攻。
根据图 1所示, BTDO的苯环上负值(蓝色)区域最大的地方为7位碳原子, 其次是5位碳原子, 6、8位周围为正值(绿色)区域。可见, BTDO的7位碳上的亲电活性最高, 5位碳其次, 6、8位碳则相对更容易被亲核进攻。从表 5中, 我们可以从简缩双描述符数值上得到相同的结论, 即7位碳上的数值最负, 为-0.040163, 5位碳其次, 为-0.0233。而8位碳上的负值很小, 6位碳上的简缩双描述符为正值。预测结果与实验结果相符, 拥有更高亲电活性的7位, 其硝基取代产物的产率最高, 5位硝基产物其次, 5、7位二硝基产物最难得到。

|
图 1 BTDO的双描述符分布等值面图 Fig.1 Dual descriptor distribution isosurface graph of BTDO |
以BTDO为原料, 合成5-NBTDO、7-NBTDO、DNBTDO。并通过IR、1H NMR、13C NMR确定物质的结构, 并获得了以下结论:
(1) 确定了合成5-NBTDO的最佳工艺条件:发烟硫酸-硝酸钾体系、n(BTDO):n(KNO3)=1:2、温度为40 ℃, 产率为34.9%。该工艺产生的废酸少, 污染小。
(2) 确定了合成7-NBTDO的最佳工艺条件:硝硫混酸体系、n(BTDO):n(HNO3)=1:3、温度为20 ℃, 产率可达77.1%。该工艺反应温度低, 产生的废酸较少, 能耗低。
(3) 确定了合成DNBTDO的最佳工艺条件:发烟硫酸/发烟硝酸体系、n(NBTDO):n(HNO3)=1:8、温度95 ℃, 产率可达90%。该工艺条件易于操作且产率高。
(4) 实验结果与理论计算相符, 即以BTDO为原料, 在相同的反应条件下, 7-NBTDO为主要硝化产物, 5-NBTDO次之, DNBTDO最少。
| [1] |
Chavez D E, Hiskey M A, Gilardi R D, et al. 3, 3'-Azobis6-amino-1, 2, 4, 5-tetrazine:A novel high-nitrogen energrtic material[J].
Angewandte Chemie International Edition, 2000, 39(10): 1791-1793. DOI:10.1002/(SICI)1521-3773(20000515)39:10<1791::AID-ANIE1791>3.0.CO;2-9 |
| [2] |
Huynh M H V, Hiskey M A, Hartline E L, et al. Polyazido high-nitrogen compounds:hydrazo-and azo-1, 3, 5-triazine[J].
Angewandte Chemie International Edition, 2004, 43(37): 4924-4928. DOI:10.1002/(ISSN)1521-3773 |
| [3] |
Churakov A M, Smirnov O Y, Ioffe S L, et al. Benzo-1, 2, 3, 4-tetrazine-1, 3-dioxides:synthesis and NMR Study[J].
European Journal of Organic Chemistry, 2002, 1(4): 2342-2349. |
| [4] |
Huynh M H V, Hiskey M A, Archuletz J G, et al. 3, 6-Diazido-1, 2, 4, 5-tetrazine:a precursor for the preparation of carbon nanospheres and nitrogen-rich carbon nitrides[J].
Angewandte Chemie International Edition, 2004, 116(42): 5776-5779. |
| [5] |
ZHANG Wei-wei, ZHAO Xiu-xiu, LIN Zhi-hui, et al. A convenient synthesis of benzo-1, 2, 3, 4-tetrazine-1, 3-dioxide[J].
Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(4): 552-553. |
| [6] |
Churakov A M, Smirnov O Y, Tartakovskii V A, et al. The first synthesis of 1, 2, 3, 4-Tetrazine-1, 3-dioxides[J].
Mendeleev Commun, 1991, 1(3): 101-103. DOI:10.1070/MC1991v001n03ABEH000062 |
| [7] |
Frumkin A E, Churakov A M, Strelenko Y A, et al. New approach to the synthesis of benzo[e][ 1, 2, 3, 4]tetrazine1, 3-dioxides[J].
Russian Chemical Bulletin, 2000, 49(3): 482-486. DOI:10.1007/BF02494779 |
| [8] |
Churakov A M, Smirnov O Y, Ioffe S L, et al. Synthesis of brominated 2-tert-butyl-NNO-azoxyanilines[J].
Russian Chemical Bulletin, 1994, 43(9): 1532-1535. DOI:10.1007/BF00697142 |
| [9] |
Tyurin A Y, Churakov A M, Strelenko Y A, et al. Benzo-1, 2, 3, 4-tetrazine 1, 3-dioxides annulated with tetraazapentalene systems[J].
Russian Chemical Bulletin, 2009, 58(1): 212-215. DOI:10.1007/s11172-009-0031-5 |
| [10] |
Frumkin A E, Churakov A M, Strelenko Y A, et al. Synthesis of 1, 2, 3, 4-tetrazino[5, 6-g]benzo-1, 2, 3, 4-tetrazine 1, 3, 7, 9-tetra-N-oxides[J].
Organic Letters, 1999, 1(5): 721-724. DOI:10.1021/ol990713q |
| [11] |
Smirnov O Y, Churakov A M, Tyurin A Y, et al. Nucleophilic substitution in benzo-1, 2, 3, 4-tetrazine 1, 3-dioxides[J].
Russian Chemical Bulletin, 2002, 51(10): 1849-1850. DOI:10.1023/A:1021396317258 |
| [12] |
Rezchikova K I, Churakov A M, Tartakovsky V A, et al. Spectroscopic study of fused 1, 2, 3, 4-tetrazine 1, 3-dioxides[J].
Russian Chemical Bulletin, 1995, 44(11): 2093-2095. DOI:10.1007/BF00696710 |
| [13] |
Klenov M S, Churakov A M, Strelenko Y A, et al. Generation of oxodiazonium ions nitramine O-alkyl derivatives in the synthesis of benzotetrazine-1, 3-dioxides[J].
Russian Chemical Bulletin, 2011, 60(10): 2051-2056. DOI:10.1007/s11172-011-0312-7 |
| [14] |
Smirnov O Y, Churakov A M, Strelenko Y A, et al. Nitration and bromination of benzo-1, 2, 3, 4-tetrazine 1, 3-dioxides[J].
Russian Chemical Bulletin, International Edition, 2002, 51(10): 1845-1846. |
| [15] |
Thomas M.Klapçtke T M, Piercey D G, Stierstorfer J, et al. The synthesis and energetic properties of 5, 7-dinitrobenzo -1, 2, 3, 4-tetrazine-1, 3-dioxide(DNBTDO)[J].
Propellants, Explosives, Pyrotechnics, 2012, 37(5): 527-535. DOI:10.1002/prep.v37.5 |
| [16] |
李云雁, 胡传荣.
试验设计与数据处理[M]. 北京: 化学工业出版社, 2008: 124-128.
LI Yun-yan, HU Chuan-rong. Experiment design and ata processing[M]. Beijing: Chemical Industry Press, 2008: 124-128. |
| [17] |
LU Tian, CHEN Fei-wu. Multiwfn:A multifunctional wavefunction analyzer[J].
Journal of Computational Chemistry, 2012, 3(3): 580-592. |
| [18] |
卢天, 陈飞武. 原子电荷计算方法的对比[J].
物理化学学报, 2012, 28(1): 1-18. LU Tian, CHEN Fei-wu. Comparison of computational methods for atomic charges[J]. Acta Physica Sinica, 2012, 28(1): 1-18. |
| [19] |
付蓉, 卢天, 陈飞武. 亲电取代反应中活性位点预测方法的比较[J].
物理化学学报, 2014, 30(4): 628-639. FU Rong, LU Tian, CHEN Fei-wu. Comparing methods for predicting the reactive site of electrophilic substitution[J]. Acta Physica Sinica, 2014, 30(4): 628-639. DOI:10.3866/PKU.WHXB201401211 |

5-Nitrobenzene-1, 2, 3, 4-tetrazine-1, 3-dioxide (5-NBTDO) and 7-nitrobenzene-1, 2, 3, 4-tetrazine-1, 3-dioxide (7-NBTDO) were synthesized using benzo-1, 2, 3, 4-tetrazine-1, 3-dioxide (BTDO) as raw material. Then the 5, 7-dinitrobenzene-1, 2, 3, 4-tetrazi ne-1, 3-dioxide (DNBTDO) was synthesized by 5-NBTDO and 7-NBTDO as raw material. HPLC was used to analyze the yields of the products. The structures of these synthesized compounds were characterized by 1H NMR, 13C NMR, IR and MS.




