2. 中国科学院过程工程研究所, 北京 100190
2. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
作为液体火箭发动机的动力源泉, 液体火箭推进剂(液体推进剂)是航空航天事业发展的重要保障, 在军工和民用领域中都起着举足轻重的作用[1]。液体推进剂是以液体状态进入火箭发动机, 经历化学反应和热力学变化, 为推进系统提供能量和工质的物质。尤其是自燃液体推进剂, 它无需额外点火环节, 可简化发动机设计, 大幅提高动力设备安全性, 在应用中具有明显的优点。自燃推进剂是指燃料与氧化剂(如浓HNO3, 浓H2O2和N2O4等)接触即可发生剧烈反应从而点火燃烧的一类推进剂, 因其优良的特性, 现已成为各国国防和装备部门研发的攻关课题, 并开展广泛研究[2]。因此, 不同燃料和氧化剂组合的自燃推进剂相继出现, 并在航空航天领域得到了广泛应用[3]。
离子液体(Ionic Liquids, ILs)是近年来材料化学领域新兴的一类环境友好功能材料, 它主要是指一类由有机阳离子和有机阴离子或无机阴离子构成的有机盐类化合物, 熔点通常低于100 ℃[4-5]。2008年, 二氰胺阴离子(—N(CN)2)和咪唑类阳离子组成的ILs被发现可与氧化剂白色发烟硝酸(WFNA)接触后发生点火燃烧[6], 现称具有这种性质的离子液体为“自燃离子液体(Hypergolic Ionic Liquids, HILs)”[3]。通过分子设计和修饰, 对阴阳离子进行功能化, 引入不同的取代基, 可调节HILs的物化性质, 使其具有低蒸汽压、低毒性、低特征信号和高热稳定性等优点, 从而弥补肼类物质在这些方面的不足[7-8]。
近年来, 很多HILs因其具有代替传统燃料应用潜能而被合成出来并受到广泛的关注[9-10]。本文对近年来文献报道的HILs的种类和相关性质进行了系统的总结和综述, 结合笔者的研究经验[11-14], 对新型HILs的设计合成和自燃机理研究进行了展望。
2 二氰胺阴离子类HILs2008年, Schneider[6]等首次报道咪唑类—N(CN)2ILs可与WFNA接触之后发生点火燃烧。—N(CN)2具有富燃料的性质, 同时可降低HILs的粘度(η), 促进HILs与氧化剂的混合, 加快燃烧。—CH2CH=CH2、—CH2C≡CH、—CH2CH2CH=CH2等不饱和烃基侧链被引入到咪唑阳离子中, 目的在于促进燃烧。所设计合成的六种咪唑类—N(CN)2类ILs都是室温离子液体(RTILs)(Scheme 1)。滴定点火实验发现这六种ILs都可与WFNA接触之后发生燃烧, 但是以上六种ILs的点火延迟时间(tid)在170~670 ms范围内[6], 与液体火箭发动机燃料的要求(tid < 5 ms)相距较远(肼tid=4.8 ms)[15]。
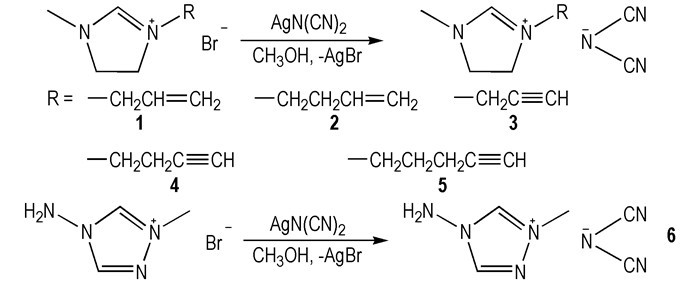
|
Scheme1 Structures of alkynyl and alkenyl-functionalized imidazolium dicyanamide hypergolic ionic liquids[6] |
从以上研究初步可知: —N(CN)2决定了ILs是否可以与氧化剂接触发生自燃, 含有不饱和键的阳离子决定了HILs的tid[16]。
考虑到N, N, N′, N′-四甲基乙二胺是一种良好的自燃燃料[17], 故N, N, N′, N′-四甲基乙二胺类阳离子的是合成新型HILs的优良选择, 且可通过阳离子的结构来调控其性能。因此, 笔者设计合成了一系列四甲基乙二胺类—N(CN)2 HILs[11](Scheme 2)。通过滴定点火测试发现, 只有7可以与WFNA接触之后发生燃烧, tid=84 ms, 分解温度(Td)为200 ℃。尽管8 ~ 10具有良好的热稳定性(Td=214~230 ℃), 但不能与WFNA接触之后发生点火燃烧。原因可能是这三种样品在室温下是固态, 相对于常温下是液体的7, 扩散速率较慢。
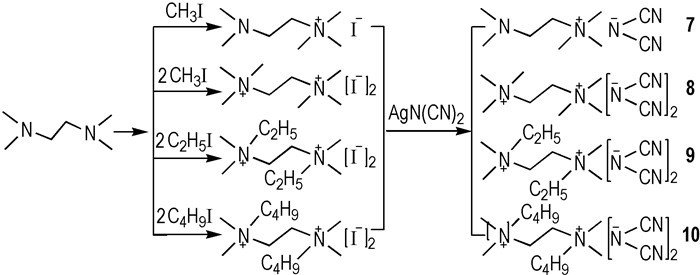
|
Scheme2 Structures of tetramethylethylenediamine-based dicyanamide hypergolic ionic liuqids[17] |
作为HILs最重要的性质之一, tid是判断HILs是否具有应用潜能的关键因素。二硝酰胺阴离子(—N(NO2)2)具有较高的氧平衡和优良的爆轰性能, 是含能盐中常见的阴离子[18-19], 选择—N(NO2)2作为HILs的阴离子可能会缩短其tid、提高比冲(Isp)和生成焓(ΔHf)等性能。但实验发现, —N(NO2)2阴离子类ILs不能与WFNA或N2O4接触发生自燃。
硝基氰胺阴离子(—N(CN)(NO2))是—N(CN)2阴离子和—N(NO)2阴离子的类似物, 它结合了—N(CN)2和—N(NO)2两类阴离子的优点, 具有零氧平衡和富燃料性质。2010年, He等[20]设计合成了一系列—N(NO2)(CN)类HILs(Scheme 3)。它们都是RTILs, 并具有良好的物化性质:低熔点(Tm < 90 ℃)、Td>250 ℃、η < 25 mPa·s等。但只有11 ~ 15可以与WFNA接触之后发生点火燃烧, 且tid=46~78 ms。
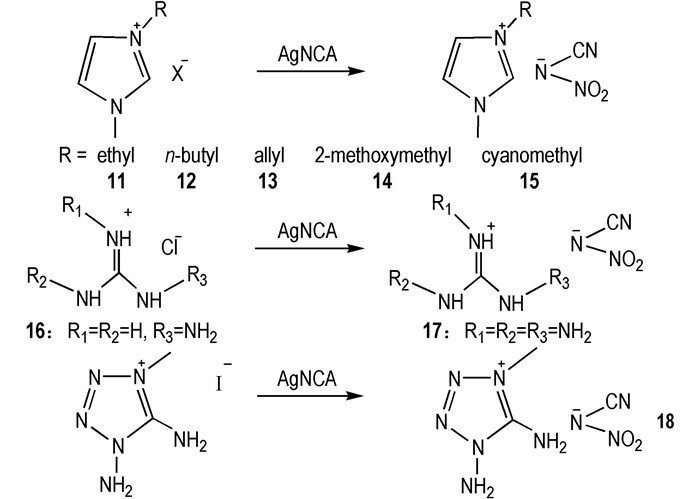
|
Scheme3 Synthesis of nitrocyanamide-based guanidinium and tetrazolium hypergolic ionic liquids[20] |
研究发现, 将含有较多氮氮键的官能团引入到HILs结构中是发展HILs的一个思路[21]。叠氮基(—N3)是一个高能基团, 化合物中每引入1 mol的—N3可提高280 kJ能量, 因此它是设计合成新型HILs过程中倍受关注的基团。2008年, Schneider等[22]设计合成了具有饱和或不饱和侧链的咪唑阳离子与—N3结合的ILs, 通过滴定点火实验验证, 它们与WFNA接触后未能点火燃烧。
2010年, Joo等[23]设计设计合成了一系列含有—N3的阳离子与—N(NO2)2、—N(CN)(NO2)、—N(CN)2和—N3四类阴离子结合的HILs(Scheme 4)。它们大多数都是RTILs, Td>200 ℃。化合物19、20、23、24与WFNA接触之后, 表现出了良好的自燃特性。对比发现, —N(CN)2类HILs 20和24的tid分别为8 ms和16 ms, 而相同阳离子的—N(CN)(NO2)类HILs 19和23的tid较长(tid>20 ms)。此研究结果说明用强吸电子基团—NO2取代—N(CN)2上的—CN能降低HILs与氧化剂之间的反应活性, 此方法可以有效地调节HILs被氧化的速度, 避免了因燃烧剧烈而发生爆炸。
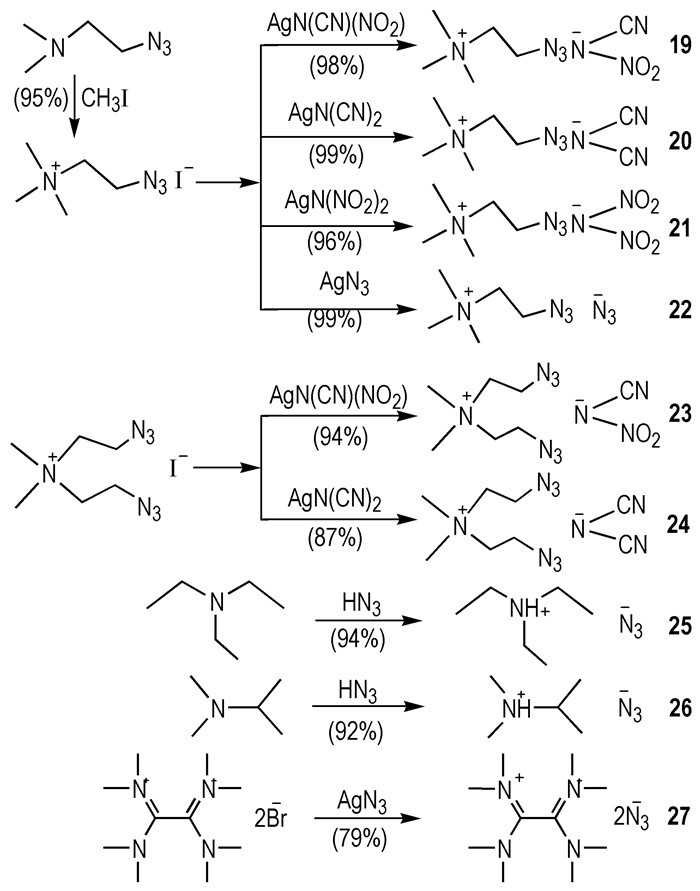
|
Scheme4 Chemical structures of some azide-functionalized hypergolic ionic liquids[23] |
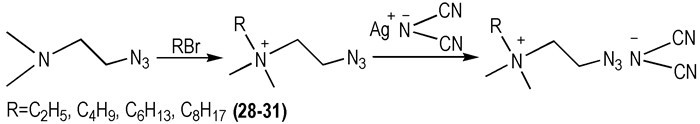
考虑到20具有较好的物化性质和较短的tid。2014年, 厉刚等[24]设计设计合成了一系列含有不同烃基侧链的叠氮铵类—N(CN)2 ILs(Scheme 5), 并探究了不同烃基侧链对其性质的影响。结果发现, 随烷基链的增长, ILs的密度(ρ)减小, 热稳定性与烷基链长基本无关。但是, 作者并没有测试它们与氧化剂接触后的tid, 需进一步实验验证。
|
Scheme5 Structure of four azidoammonium-based ionic liquids[24] |
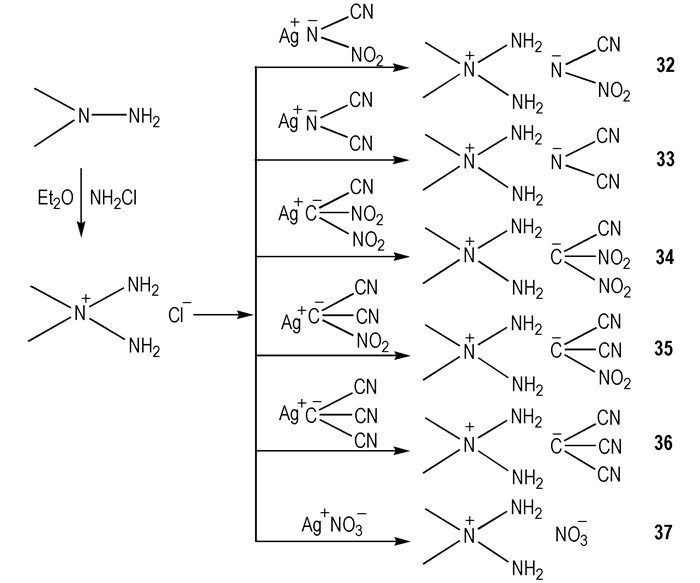
从以上的工作可知, HILs中的阴离子决定了其是否可以与氧化剂接触自燃, 而阳离子决定了燃烧的过程, 包括调控tid[25]。所以, 利用含有更多氮氮键的阳离子是设计合成具有较短tid的HILs的一个新观点。2009年, Gao等[26]设计合成了N, N′-二甲基肼类阳离子与—N(CN)(NO2)、—N(CN)2、—C(NO2)2(CN)、—C(NO2)(CN)2、—C(CN)3和—NO3六种阴离子结合的六种HILs(Scheme 6)。其中32、33和37与WFNA接触后的tid分别为16, 22, 4 ms。而选用N2O4作为氧化剂时, 32和37的tid分别为8 ms和10 ms。这三种HILs对外界刺激表现钝感, 在室温下可以稳定存在。由以上的工作可以得到结论:只含有N—CN或同时含有N—NO2和N—CN键的阴离子的ILs可以与氧化剂接触发生自燃, 而只含有C—CN或同时含有C—NO2和C—CN键的阴离子的ILs不能与氧化剂接触发生自燃。
|
Scheme6 Synthesis of 2, 2-dimethyltriazanium salts[26] |
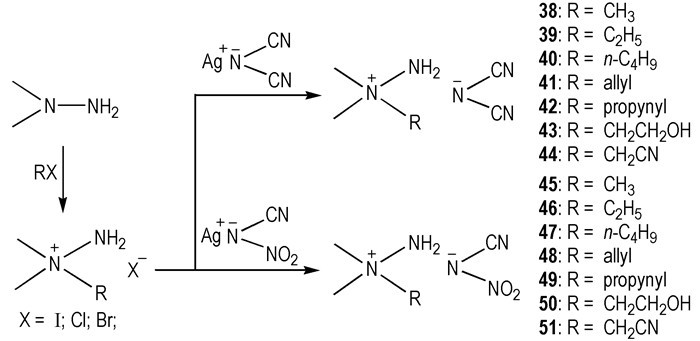
为了探究阳离子对HILs的物化性质和tid的影响。2010年, Zhang等[27]设计合成了一系列的N, N′-二甲基肼类—N(CN)2和—N(CN)(NO2) HILs(Scheme 7)。它们的Tm在65 ℃左右, 热稳定性好。尤其是阳离子中含有—CHCH=CH2和—CHC≡CH的—N(CN)2类HILs具有优良的性质(Tm < 65 ℃, Td=145~236 ℃, η=78~161 mPa·s)。阳离子中的不同取代基对HILs的密度和粘度有着显著的影响, ρ: —CH2CN>—CH2CH2OH> —CH3C≡CH> —CH3>—CH2CH=CH2>—C2H5>—C4H9; η: —CH2CN>—CH3C≡CH> —CH2CH2OH>—C4H9>—CH2CH=CH2。滴定点火实验验证38 ~ 51均可与WFNA接触发生点火燃烧, 41和48的tid分别是24 ms和30 ms。由以上的工作可以得到结论:阳离子中烃基侧链对HILs的性质有显著影响, 随着阳离子烃基侧链长度增加, tid增大; 阳离子中含有不饱和烃基侧链的HILs tid较短, 且随着不饱和度的增加, tid增加, ρ和η增大, Td降低。
|
Scheme7 Synthesis of N, N-dimethylhydrazinium dicyanamides and nitrocyanamides[27] |
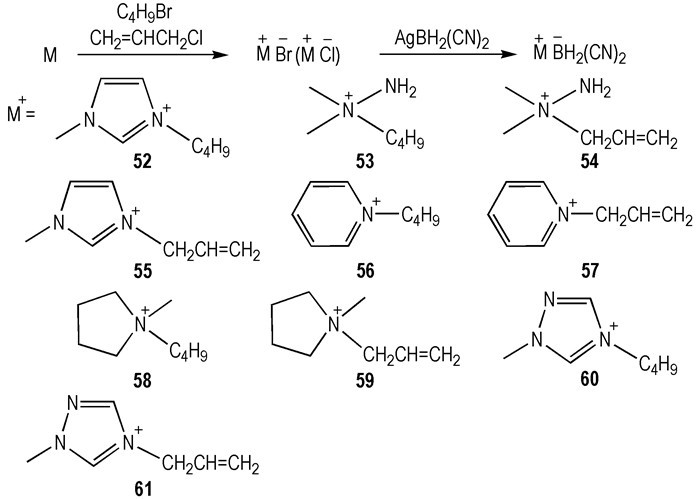
2011年, Zhang等[28]设计合成了—BH2(CN)2阴离子与含有—C4H9或—CH2CH=CH2基团的不同阳离子结合的十种HILs(Scheme 8)。作为比较, —N(CN)2和—N(CN)(NO2)阴离子分别与上述阳离子结合而成的HILs也被合成出来[6, 19, 26]。结果显示, 当采用相同的阳离子时, —BH2(CN)2类HILs与—N(CN)2和—N(CN)(NO2)类HILs具有相近的Tm(< -80 ℃)和热稳定性。此外, —BH2(CN)2类HILs的ρ(0.91~1.03 g·cm-3)要比—N(CN)2和—N(CN)(NO2)类HILs的ρ略低。η方面, —BH2(CN)2类HILs的η(12.4~39.4 mPa·s)要比—N(CN)2和—N(CN)(NO2)类HILs的η低得多。最重要的是, —BH2(CN)2类HILs的tid要比—N(CN)2和—N(CN)(NO2)类的HILs的tid短很多(例如, 54的tid=4 ms, η=35 mPa·s, ρ=0.93 g·cm-3, Td=189 ℃, ΔHf=453.14 kJ·mol-1)。
|
Scheme8 Structures of dicyanoborate-based hypergolic ionic liquids[28] |
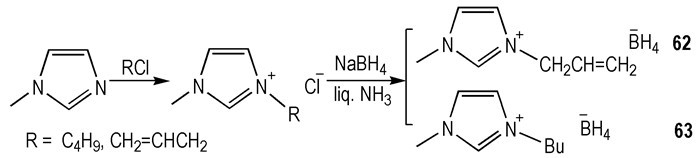
2014年, Li等[29]利用NaBH4和甲基咪唑类阳离子在液氨中合成了两种—BH4类HILs(Scheme 9)。其中62具有较好的物化性质: tid=2 ms、ρ=0.90 g·cm-3、Tm < -60 ℃、η=113.8 mPa·s、ΔHf=117.8 kJ·mol-1。但是, 这种HILs对水敏感, 并且Td=93.3 ℃。
|
Scheme9 Structures of borohydride-based ionic liquids[29] |
硼烷和三乙胺都被报道具有自燃的特性[30], 所以猜测它们的络合物硼烷三乙基胺具有提高自燃的功能[31]。将硼烷三乙基胺与[BMIm][N(CN)2]按照质量比2:1、3:1、1:1、1:2、1:4、1:6、1:9进行混合, 当三乙基胺:[BMIm][N(CN)2]=2:1时, 这种混合物与WFNA接触的tid=3 ms, η=7 mPa·s, 要比之前合成的HILs低很多。
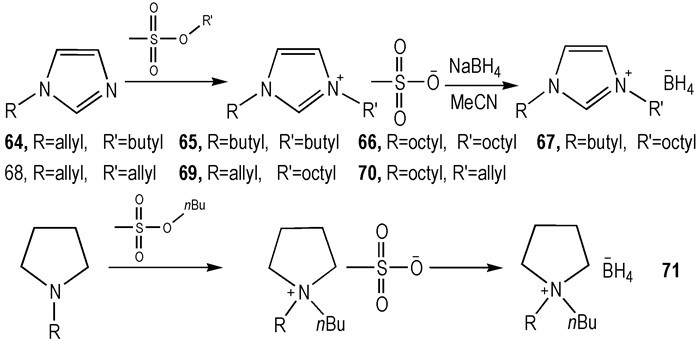
2015年, Chand等[32]利用新的方法设计合成了一系列对称或不对称的咪唑类—BH4 HILs(Scheme 10)。它们大多数具有较低的Tm(< -80 ℃), 并且都可以和WFNA接触之后发生燃烧(tid=3~342 ms)。通过增长烃基侧链的长度, 有效提高了HILs的稳定性, 使其分解温度达到了110 ℃以上。由于两个疏水基基团(—C8H15)被引入到阳离子中, 66可在水环境下稳定存在。值得注意的是, 含有两个—CH2CH=CH2的68的tid=3 ms, 结合之前的含有—CH2CH=CH2的HILs来看, —CH2CH=CH2可以有效地降低HILs的tid。相比之前的方法, 利用此方法可降低合成难度和成本, 避免了液氨、卤化物和银盐的使用, 是一种绿色合成方法。
|
Scheme10 Structures of borohydride-Based ionic liquids[32] |
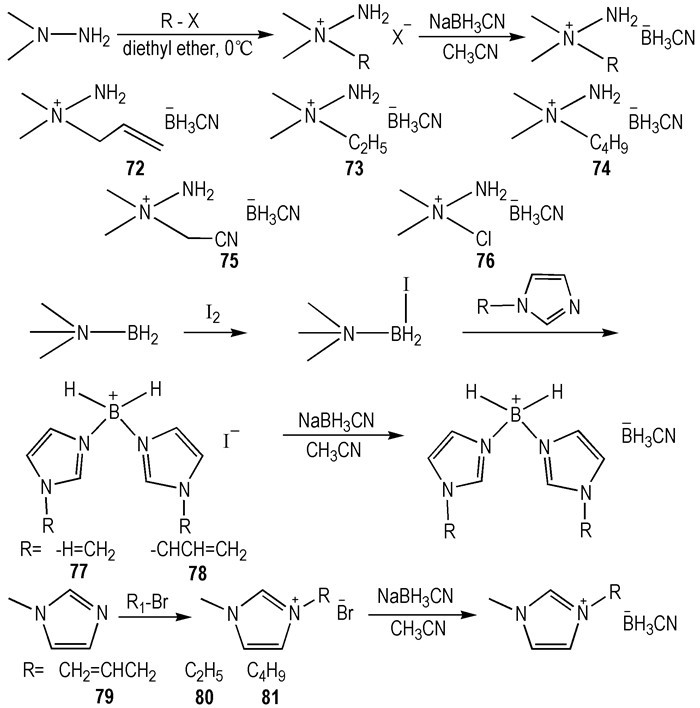
2014年, Zhang等[33]设计合成了由十种不同阳离子与—BH3CN阴离子结合而成的HILs(Scheme 11), 它们均可与WFNA发生自燃。除75和76外, 其余都是RTILs。与对水敏感的—BH4类HILs相比, —BH3CN类HILs对水具有非常好的稳定性。此外, —BH3CN类HILs的Td远高于—BH4类。在这十种HILs中, 80的综合性能最优, 包括液程宽(-71~247 ℃)、η=19 mPa·s和tid=4 ms。
|
Scheme11 Structures of cyanoborohydride-based HILs hypergolic ionic liquids[33] |
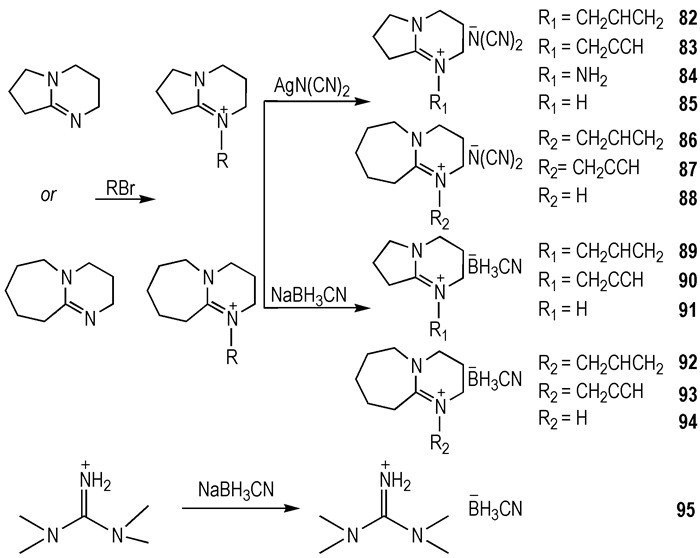
2015年, Zhang等[34]设计合成了利用强碱性的1, 5-二氮杂双环[4.3.0]壬-5-烯(DBN)类阳离子、1, 8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)类阳离子与—BH3CN阴离子结合而成的HILs 89~95, 除91和94外, 都是RTILs(Scheme 12)。它们都可以与WFNA接触之后发生点火燃烧, tid=59~576 ms。值得注意的是, 这几种-BH3CN阴离子类HILs展现出了很好的Td(205~294 ℃), 并且可以在潮湿的空气中稳定存在。作为比较, 使用相同的阳离子, —N(CN)2类HILs也被合成出来(82~87), 它们大多数都是RTILs, 并且都可与WFNA接触之后发生点火燃烧(tid=27~100 ms), 具有很好的热稳定性(Td=249~310 ℃)。其中, 82的Td=310 ℃, 在已报道的HILs中具有最高的Td。相比于相同阳离子的—BH3CN类HILs的tid较短, Td较高。根据以上的研究结果可以得知, HILs的阳离子碱性越强, 结合阴离子的能力就越强。所以利用强碱性的阳离子可提高HILs的热稳定性。
|
Scheme12 Synthesis of super-base-derived ionic liquids[34] |
2015年, Liu等[35]利用—BH3(CN)BH(CN)阴离子与一系列非对称的有机阳离子组合, 设计合成了八种—BH3(CN)BH(CN)阴离子类自燃离子96~103 (Scheme 13)。它们都是RTILs, 具有超过200 ℃的液程和较低的η(10~27 mPa·s)。所合成的八种ILs都可与WFNA接触之后点火燃烧, tid=1.7~4.3 ms。HILs 101的性质尤为突出: tid=1.7 ms, η=10 mPa·s。在已报道的HILs中具有最短的tid和最低的η。此外, 所合成的八种HILs都具有极强的憎水性。为了证明此观点, 作者计算了—BH2(CN)2, —BH4, —BH3CN和—BH3(CN)BH(CN)四种阴离子与水分子的相互作用能(Einter), 分别为-6.1、-8.6、-7.5和-5.1 kcal·mol-1。由以上计算可知, —BH3(CN)BH(CN)阴离子与水分子的相互作用最弱, 所以—BH3(CN)BH(CN)类HILs具有极强的憎水性。
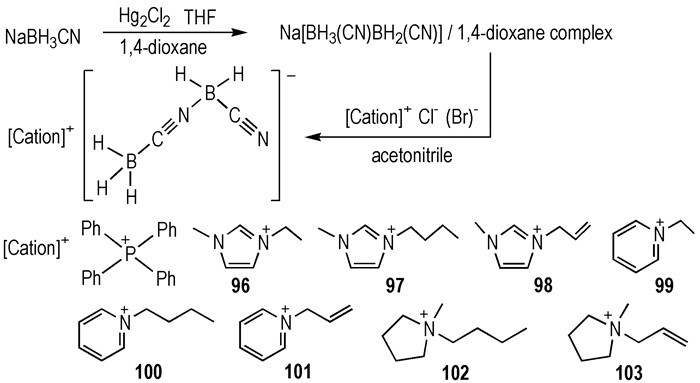
|
Scheme13 Synthesis of borohydride-rich ionic liquids based on [BH3(CN)BH2(CN)]- anion[35] |
2012年, Wang等[36]设计合成了阳离子中含有B—H键的ILs。为了比较不同阴离子对自燃性能的影响, —NO3、—N(CN)2、—N(CN)(NO2)、—BH2(CN)2分别与两类阳离子结合, 合成了八种HILs(Scheme 14)。它们大多是RTILs, 并且与WFNA接触后具有较短的tid(14~64 ms)。HILs 111的性能尤为突出(Tm < -80 ℃, η=35 mPa·s, tid=14 ms)。在这一系列的HILs中, 阳离子中存在的两个B—H键对HILs的燃烧性能起到了促进作用。
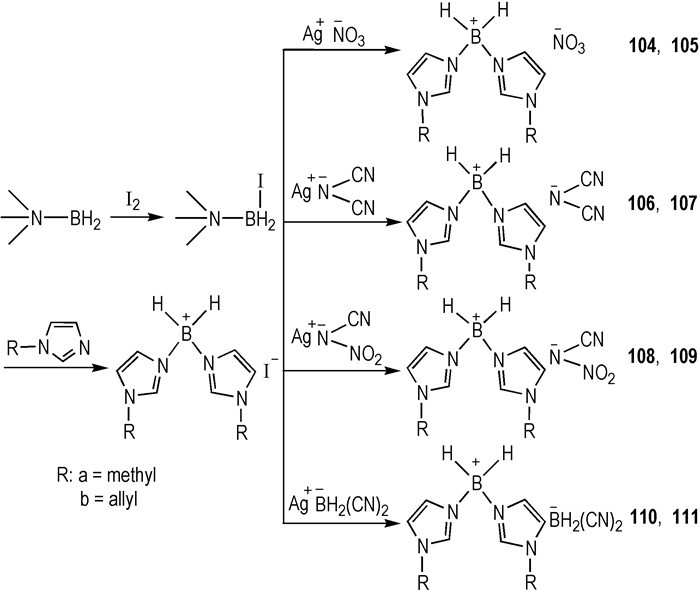
|
Scheme14 Synthesis of new boronium-based hypergolic ionic liquids[36] |
根据以上工作, 为了探究B—H阳离子中含有的不同烃基侧链对HILs性能的影响, 2015年, 笔者在此基础上进行了完善[12](Scheme 15)。合成了B—H阳离子中含有—C2H5、—C4H9、—CH=CH2三种烃基侧链的—N(CN)2和—N(CN)(NO2)类HILs, 并结合104 ~ 111, 总结了B—H阳离子中不同烃基侧链对—N(CN)2和—N(CN)(NO2)HILs性质的影响规律。在阴离子相同的情况下, 随着阳离子中烃基侧链的增长, 离子液体的ρ呈现降低的趋势(ILCH3>ILC2H5>ILC4H9和ILCH=CH2>ILCH2CH=CH2); 当阳离子中烃基侧链长度相同时, 含有不饱和烃侧链的离子液体ρ高于饱和烃侧链的离子液体(ILCH=CH2>ILC2H5), 说明不饱和键的存在可以提高离子液体的有效堆积。在热稳定性方面, 对于具有相同阳离子的HILs, —N(CN)2类HILs的热分解温度低于相应的—N(CN)(NO2)类HILs。—N(CN)2类HILs的tid小于—N(CN)(NO2)类HILs, 从tid、热稳定性和ρ等方面更进一步证明了上文的观点。
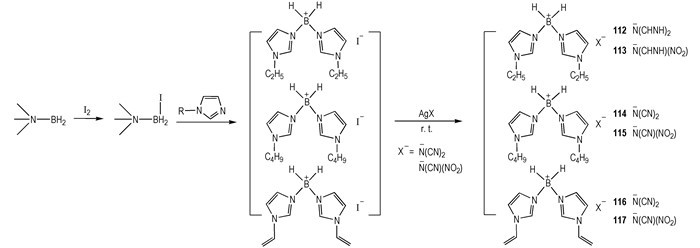
|
Scheme15 Structures of boronium-based hypergolic ionic liquids[12] |
2015年, Huang等[37]设计合成了咪唑基-胺基-BH2+阳离子类HILs。通过在阳离子结构中引入不同链长饱和或不饱和取代基, 并与AgN(CN)2和NaBH3CN通过离子交换反应, 合成了14种HILs(Scheme 16)。它们大多数是RTILs, 并与WFNA接触之后点火燃烧, tid=19~611 ms。通过滴定点火实验可以发现:在阴离子相同的情况下, 阳离子中含有不饱和键的HILs的tid要短于阳离子中只含有饱和键的HILs的tid(tid(121) < tid(119), tid(128) < tid(126)); 在阳离子相同的情况下, —N(CN)2类HILs的tid要短于—BH3CN类HILs(tid(118)<tid(125), tid(119)<tid(126))。
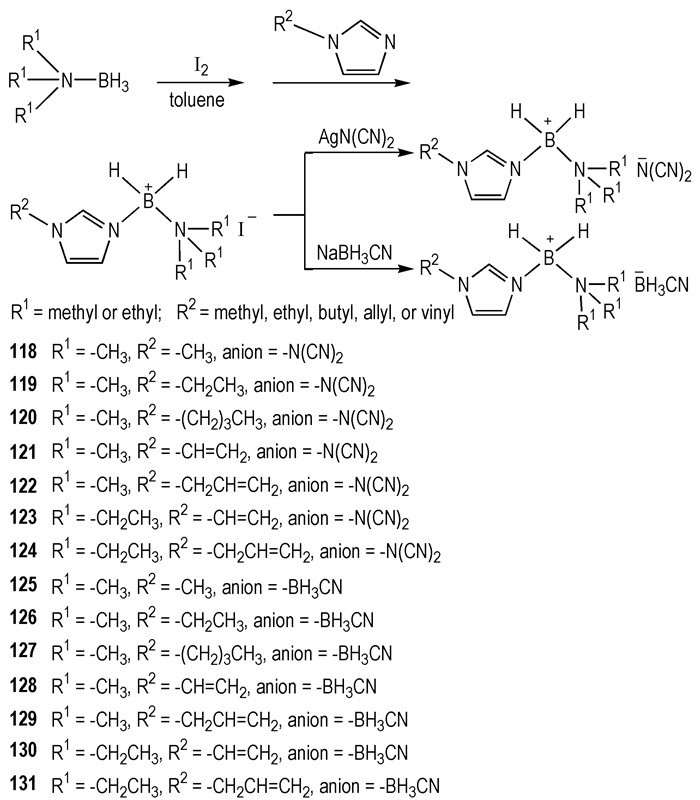
|
Scheme16 Synthesis of [imidazolyl-amine-BH2]+-cation-based ionic liquids[37] |
一些含硼化合物, 如:氨硼烷(AB)、联氨硼烷(HB)和联氨二硼烷(HBB)都是已知的储氢材料, 都可与WFNA发生自燃。2012年, Gao等[38]设计合成了一种基于硼烷-离子液体的混合自燃燃料, 这种混合自燃燃料可通过将AB、HBB溶解在HILs中获得。当溶解在—N(CN)2类HILs中, 具有非常短的tid。(例如: AB与[BMIm][N(CN)2]按照2.7:1的摩尔比混合之后的混合物和HBB与[BMIm][N(CN)2]按照2.4:1的摩尔比混合之后的混合物的tid=3 ms; AB与[Pyrr14][N(CN)2]按照2.1:1的摩尔比混合之后的混合物的tid=4 ms)。根据自然键轨道理论分析, AB、HB和HBB与WFNA的自燃反应机理被推出(Scheme 17):在自燃反应过程中, 首先质子与AB中的氮原子反应, 形成硝酸盐; 而HB和HBB中的双质子化作用可能导致反应大量放热, 然后形成硝酸盐, 此过程中会产生局部高温, 导致联HB和HBB与WFNA的tid比AB与WFNA的tid要短。
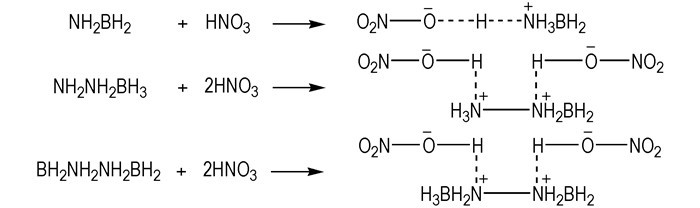
|
Scheme17 Possible mechanisms of the reactions between AB, HB, or HBB and WFNA[37] |
因为将硼烷添加到HILs中, 可有效降低tid[31, 39], 所以使用硼烷簇作为自燃添加剂或阴离子也引起了研究人员的关注。2014年, Rogers等[40]研究了硼烷簇(B10H14)作为HILs燃料添加剂的可行性:当把巢型硼烷簇B10H14分别加入到HILs [BMIm][N(CN)2]和[AMIm][N(CN)2]中, 溶液颜色发生变化, 有黑色沉淀物生成。分析表明B10H14与—N(CN)2发生反应, 生成了新的硼烷簇阴离子(—B9H14)和三聚氰胺(Scheme 18)。滴定点火实验证实了所合成的含—B9H14的ILs溶液都可与WFNA发生自燃。按照摩尔比为1:10的[—B9H14]-[AMIm][N(CN)2]和[—B9H14]-[BMIm][N(CN)2]混合溶液的tid分别是4 ms和5 ms, 比任何的—N(CN)2类HILs的tid都要短。为了探究硼烷簇阴离子在点火性能, 合成出了四种硼烷簇阴离子([—B9H14]和[—B10H13])类的ILs(Scheme 19)[40], 滴定点火测试表明, 四种硼烷ILs与不同的氧化剂(WFNA、IRFNA、70% HNO3)都可发生自燃, tid < 3 ms。
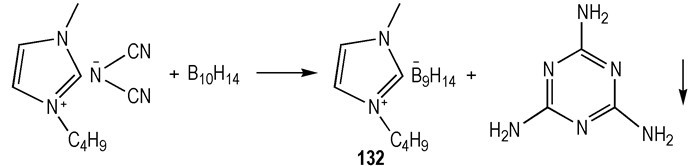
|
Scheme18 Proposed reaction pathway for the in situ generation of [B9H14]- between B10H14 and [BMIm][N(CN)2][40] |
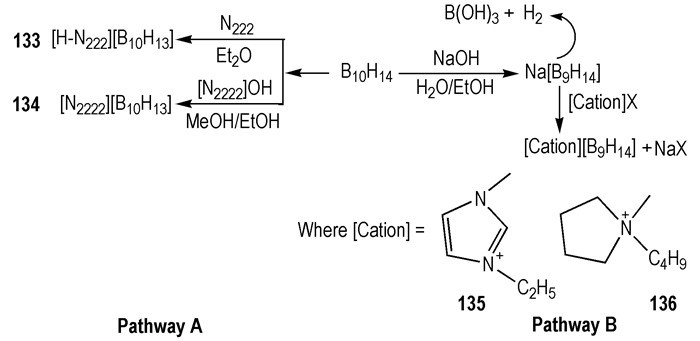
|
Scheme19 Proposed reaction pathway for the in situ generation of [B9H14] between B10H14 and [Bmim][N(CN)2][40] |
与硼烷类似, 微米级或纳米级硼材料同样可以作为自燃添加剂[41], 然而这类材料由于表面的氧化层使得燃烧需要1500 ℃以上的高温。2012年, 为提高HILs的燃烧性能, Rogers等[42]将纳米硼分散到—N(CN)2类的HILs中作为含能添加剂, 发现纳米硼可以很好的分散在—N(CN)2类HILs中, 稳定性良好。纳米硼的表面被—N(CN)2类HILs分子覆盖, —N(CN)2类HILs的阳离子和阴离子与硼表面相互作用, 在硼纳米粒子的表面形成一个强有力的保护层, 使纳米硼不会被空气氧化[43]。将质量分数为0.33%的纳米硼加到HILs中, 滴定点火实验表明燃烧程度加大, 但是tid并无明显变化。此研究说明HILs与WFNA接触后点火燃烧的火焰大小程度可通过向其中加入纳米硼来调控。
6 铝基类HILs已证实LiAlH4和NaBH4的乙醚溶液可与H2O2发生自燃, 若将这种盐与铝或硼结合, 设计成液体燃料, 则能量就会有大幅度提高。一些—BH4和—BH3CN作为阴离子, 阳离子中含有铝的室温离子液体已有报道[44]。Schneider等不仅关注新型HILs的合成, 在氧化剂的选择上也尝试创新。与WFNA和N2O4相比, H2O2因其低腐蚀性, 分解产物无毒等性质被称为绿色氧化剂[45]。基于此背景, 2011年, 两类ILs被设计与合成出来(Scheme 20)。[THTDP][Al(BH4)4]在室温下是一种无色的液体, 其与90%或98% H2O2都可以发生点火燃烧(tid < 30 ms); 与WFNA接触之后, 不发生燃烧, 而是爆炸。相同条件下, 具有相同阳离子的[THTDP][BH4]与H2O2的tid要长的多(< 3 s)。
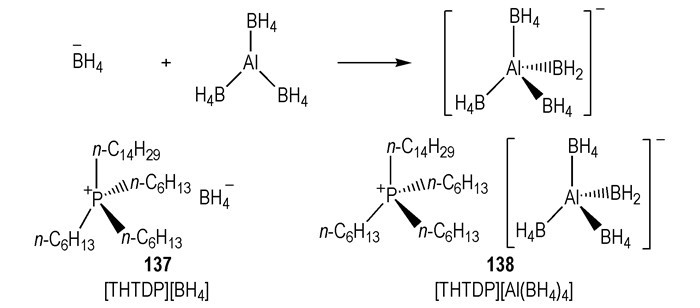
|
Scheme20 Structures of —Al(BH4)4-based hypergolic ionic liquids[45] |
同样, 铝基富氧阴离子的离子液体也可作为火箭推进系统中的氧化剂。早在1966年, 首次报道使用—Al(NO3)4作为阴离子的化合物([Et4N][Al(NO3)4])[46], 但其能量性能并没有被研究。这种化合物在室温下是白色固体且易吸潮, 但是在干燥的气氛下非常的稳定。2006年, Jones等[47]设计合成了另一种零氧平衡的含能化合物:利用稳定的高氧载体—Al(NO3)4作为阴离子、利用高能的1-乙基-4, 5-二甲基四唑为阳离子(Scheme 21)。这是一种RTILs, tid为数毫秒。
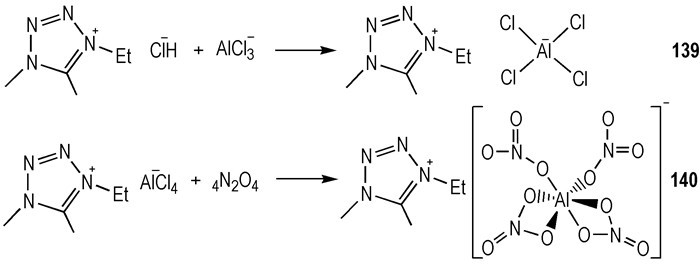
|
Scheme21 Synthesis of 1-ethyl-4, 5-dimethyltetrazolium tetranitratoaluminate room temperature ionic liquids[47] |
2013年, Maciejewski等[48]设计合成了次磷酸阴离子(HP)、N, N′-二氰甲脒阴离子(v-DCA)和插乙烯二氰胺(DCF)类HILs(Scheme 22)。选择HP作为阴离子是因为它的强还原性, 而选择v-DCA和DCF作为阴离子是因为其结构与—N(CN)2阴离子相似。如预期一样, 肼类和咪唑类阳离子与HP、v-DCA和DCF结合而合成出的化合物在室温下呈液体, 并且Tm < -80 ℃。使用相同的阳离子, 大多数的HP、v-DCA和DCF类ILs具有较高的η(56~275 mPa·s), 比—N(CN)2类HILs相比要高得多。滴定点火实验说明所有的HP类ILs可以与WFNA接触后点火燃烧(tid=171~219 ms), 而v-DCA和DCF类ILs与WFNA接触后不能点火燃烧。
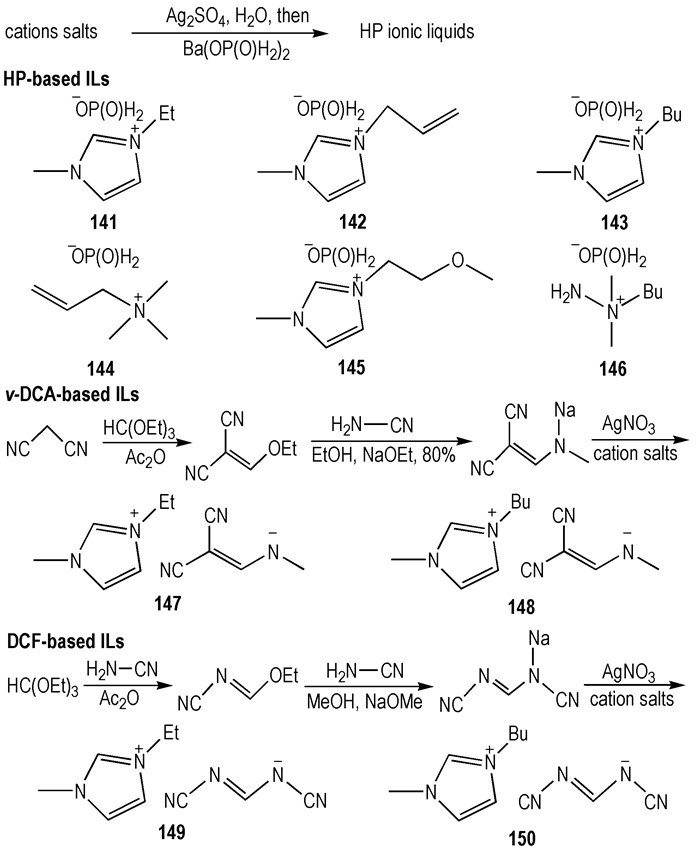
|
Scheme22 Some ILs that contain HP, v-DCA, or DCF anions[48] |
在推进系统中, 肼和其衍生物是众所周知的推进剂燃料。在过去的几十年中, 很多的肼及其衍生物被研究[49]。Rogers等[50]研究了肼类离子液体的催化点火行为, 羟乙基肼单硝酸盐和羟乙基肼二硝酸盐(Scheme 23)在没有外接火源的情况下, 与加热表面接触之后就发生了点火。点火测试可以观察到肼类离子液体具有催化点火性质, 火焰温度在150 ℃以上, 然而中性的羟乙基肼没有发生点火现象。
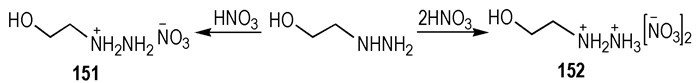
|
Scheme23 Synthetic route of two hydrazinium-based salts from HEH[50] |
研究HILs与氧化剂接触时的点火燃烧机理、反应路径对设计合成性质优良的HILs尤为重要。从实验的角度看, 自燃机理研究的困难在于反应中生成的高活性中间体难于捕捉或检测。因此, 如果通过实验手段捕捉或检测生成的高活性中间体便可充分解释HILs与氧化剂接触之后的燃烧机理、反应路径。
当前研究普遍认为HILs与氧化剂的点火燃烧过程涉及两个阶段:低温提前点火阶段和高温燃烧阶段。在低温提前点火阶段, HILs和氧化剂接触之后, 立即发生放热的氧化还原反应和其发复杂反应。同时, 生成高活性的气态中间体, 并且整个反应体系温度急剧上升。瞬间的高温导致HILs和氧化剂的进一步分解, 并伴有其它的反应发生。一旦反应温度达到高活性的气态中间体的着火点后, 气态中间产物便开始点火, 从而整个体系开始燃烧。
2008年, Edwards空军实验室提出了—N(CN)2类HILs与WFNA接触之后的自燃机理[51]。此实验中, 使用稀硝酸(34 %)代替WFNA作为氧化剂, 目的在于降低氧化反应的速率, 并及时淬火捕获反应中间体。通过原位红外得知在低温提前点火阶段产生了CO2, N2O和HNCO, 但是没有检测到HCN。根据原位红外光谱的结果和相关推导, HILs和WFNA的反应的燃烧机理被提出(Scheme 24), 此机理涉及五个步骤:首先一个质子被引入到—N(CN)2的终端氮原子上, 同时—NO3与亲电碳原子相结合(step 1), 随后化学键的断裂并发生重排(step 2);之后, 质子被引入到—CN基团的终端氮原子上(step 3), 并与—NO3进行反应(step 4);之后通过重排形成二硝基双缩脲离子(step 5)。在这项实验中, 原位红外和双缩脲实验证实了在点火过程中产生了HNCO和双缩脲离子, 且双缩脲离子通过热分解可产生CO2, N2O和HNCO, 而HNCO的进一步的反应可以导致HILs的点火燃烧。此外, 也有动力学模型很好的证实了高活性的气态中间产物点火的过程[52]。根据这个燃烧机理, 作者认为—N(CN)2类HILs中—N(CN)2起到启动点火的作用, 而有机骨架咪唑类阳离子起到持续燃烧的作用。
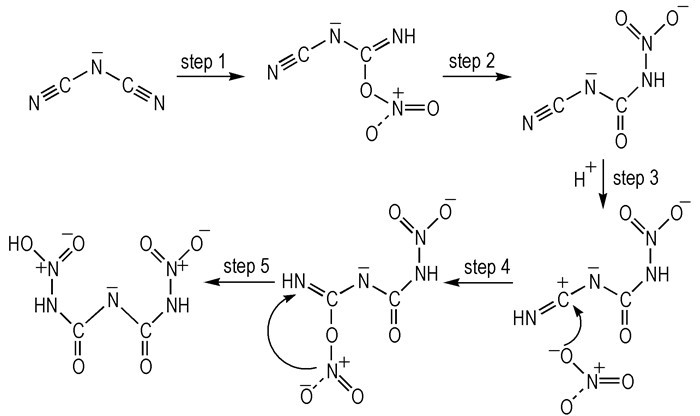
|
Scheme24 Possible ignition reaction mechanism[51] |
在上述自燃机理的研究基础上, Litzinger等[53]试图用另一种方法研究HILs自燃机理(Scheme 25)。根据测试的结果, 作者认为硝基取代中间体还有另外一种分解反应(Scheme 24, step 3)。随着反应温度的上升, 硝基取代中间体首先分解产生硝酰胺, 随后是点火之前的一系列的质子化反应, 硝化反应和重排反应等。在这种反应路径中, 一些额外的产物, 如二异氰酸可通过异氰酸二聚化作用形成。
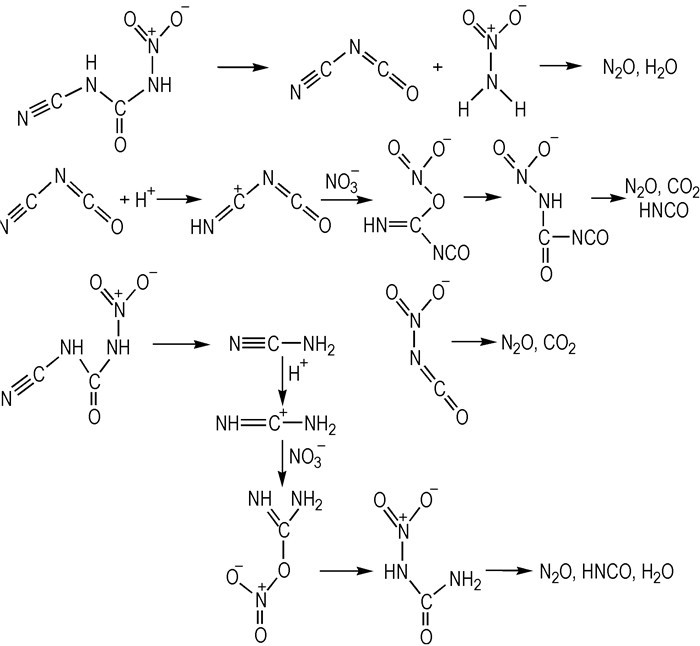
|
Scheme25 Possible decomposition reactions for the nitro-substituted intermediate[53] |
此外, 电喷雾质谱(ESI-MS)也被用来研究—N(CN)2类HILs与WFNA的自燃反应机理[54]。离子液体[Emim][N(CN)2]与WFNA接触点火之后, 有沉淀生成。通过ESI-MS分析, 沉淀由三嗪及其衍生物组成, 包括三聚氰胺及其低聚物。在点火过程中, 各种的三嗪类化合物的产生可能是由于HNO3对—N(CN)2离子液体的催化分解产生。聚合反应通常发生在在点火燃烧前低浓度的溶液中。此外, 硝酸和离子液体的阳离子可能发生一个离子交换反应, 从而产生具有高活性的中间体HN(CN)2, 之后迅速发生自聚合反应产生三聚氰胺和其低聚物。
9 结论与展望本文系统综述了近年来所合成的—N(CN)2类等七类HILs国内外所报道的研究成果。HILs因具有蒸汽压低、热稳定性好、物化性质可调、毒性小等优点, 可弥补肼类等物质在这些方面的缺陷, 且HILs的特征信号低, 是一种应用潜能极好的绿色推进剂燃料[55]。
但是, 目前已报道的HILs很难满足液体推进剂的所有性能要求。因此, 为了提高HILs作为自燃推进剂的应用性, 需进一步对HILs进行结构设计和优化, 建议今后可从以下几方面开展研究工作:
(1) 降低HILs的合成成本并降低污染。HILs合成过程中普遍需利用重金属化合物和卤化物, 使合成成本提高, 对环境造成污染。应探索更加绿色合成方法, 避免或减少重金属化合物和卤化物的使用, 合理降低成本, 降低对环境的污染。
(2) 解决目前HILs燃烧不充分的问题。目前HILs与WFNA接触燃烧之后, 普遍有不溶于WFNA的黑色沉淀物生成, 多为三聚氰胺或其聚合物。应分析固体产物的来源, 以便从HILs的结构中进行调节, 使其与氧化剂接触后燃烧充分。
(3) 进一步探究HILs的自燃机理。HILs燃烧机理研究仍不充分。应从反应热力学和动力学两方面探究HILs燃烧过程, 揭示离子液体结构对自燃反应热效应的影响。同时用原位技术捕获自燃反应的过渡态中间产物, 并且结合量子化学计算, 从分子层面解释HILs的自燃反应机理。
(4) 进一步提高HILs的能量水平。大多数HILs阳离子源自咪唑、季铵等有机骨架, 烃基比重大、碳含量高; 阴离子源自—N(CN)2、—N(CN)(NO2)、硼烷类等, 作为引起自燃的主导因素, 种类较少[7-8]。应加快对未知HILs分子结构的探索。
(5) 探索新型绿色氧化剂。HILs作为还原剂已经初步符合绿色化学的要求, 但是与其反应的氧化剂(如浓HNO3, 浓H2O2和N2O4等)仍属于高蒸汽压, 高毒, 高腐蚀性的化学物质, 不易储存和操作, 对人和环境危害较大。应探索新型绿色氧化剂配合HILs的使用。
| [1] |
李亚裕.
液体推进剂[M]. 北京: 中国宇航出版社, 2011: 1-2.
LI Ya-yu. Liquid propellant[M]. Beijing: China Astromautic Pubishing House, 2011: 1-2. |
| [2] |
Jain S R. Self-igniting fuel-oxidizer systems and hybrid rockets[J].
J Sci Ind Res, 2003, 62(4): 293-310. |
| [3] |
Zhang Y, Gao H, Joo Y H, et al. Ionic liquids as hypergolic fuels[J].
Angew Chem Int Ed, 2011, 50(41): 9554-9562. DOI:10.1002/anie.201101954 |
| [4] |
张锁江, 刘晓敏, 姚晓倩, 等. 离子液体的前沿、进展及应用[J].
中国科学, 2009, 39(40): 1134-1144. ZHANG Suo-jiang, LIU Xiao-min, YAO Xiao-qian, et al. Frontiers, progresses and applications of ionic liquids[J]. Scientia Sinica Chimica, 2009, 39(40): 1134-1144. |
| [5] |
Rogers R D, Seddon K R. Ionic liquids-solvents of the future[J].
Science, 2003, 32(10): 792-793. |
| [6] |
Schneider S, Hawkins T, Rosander M, et al. Ionic liquids as hypergolic fuels[J].
Energy & Fuels, 2008, 22(4): 2871-2872. |
| [7] |
田均均, 张庆华. 含能离子液体—新型离子炸药和绿色推进剂燃料[J].
含能材料, 2014, 22(5): 580-581. TIAN Jun-jun, ZHANG Qing-hua. Energetic ionic liquids—new explosives and green propellant fuels[J]. Chinese Journal of Energetic Materals (Hanneng Cailiao), 2014, 22(5): 580-581. |
| [8] |
张光全. 离子液体在含能材料领域的应用进展[J].
含能材料, 2012, 20(2): 240-247. ZHANG Guang-quan. Application progress of ionic liquids in energetic materials[J]. Chinese Journal of Energetic Materals (Hanneng Cailiao), 2012, 20(2): 240-247. |
| [9] |
黄海丰, 孟子晖, 周智明, 等. 含能盐和含能离子液体[J].
化学进展, 2009, 21(1): 152-163. HUANG Hai-feng, MENG Zi-hui, ZHOU Zhi-ming, et al. Energetic salts and energetic ionic liquids[J]. Progress in Chemistry, 2009, 21(1): 152-163. |
| [10] |
Zhang Q, Shreeve J M. Energetic ionic liquids as explosives and propellant fuels: a new journey of ionic liquid chemistry[J].
Chem Rev, 2014, 114(20): 10527-10574. DOI:10.1021/cr500364t |
| [11] |
Fei T, Cai H, Zhang Y, et al. Synthesis and characterization of tetramethylethylenediamine-based hypergolic ionic liquids[J].
J Energ Mater, 2016, 34(2): 138-151. DOI:10.1080/07370652.2015.1017669 |
| [12] |
费腾, 蔡会武, 李志敏, 等. 双(咪唑)硼烷类HILs的合成、表征及性质[J].
含能材料, 2015, 23(10): 952-958. FEI Teng, CAI Hui-wu, LI Zhi-min, et al. Synthesis, characterization and properties of bis(imidazole)dihydroboronium hypergolic ionic liquids[J]. Chinese Journal of Energetic Materals (Hanneng Cailiao), 2015, 23(10): 952-958. DOI:10.11943/j.issn.1006-9941.2015.10.007 |
| [13] |
Liu L, Zhang Y, Zhang S, et al. Heterocyclic energetic salts of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazole[J].
J Energ Mater, 2015, 33(3): 202-214. DOI:10.1080/07370652.2014.970246 |
| [14] |
Li Y, Qi C, Li S, et al. 1, 1'-azobis-1, 2, 3-triazole: a high-nitrogen compound with stable N8 structure and photochromism[J].
J Am Chem Soc, 2010, 132(33): 12172-12173. |
| [15] |
Durgapal U C, Venugopal V K. Hypergolic ignition of rocket propellants with nitric acid containing dissolved nitrogen tetroxide[J].
AIAA J, 1974, 12(11): 1611-1612. DOI:10.2514/3.49561 |
| [16] |
Joo Y H, Shreeve J M. High-density energetic mono-or bis(oxy)-5-nitroiminotetrazoles[J].
Angew Chem Int Ed, 2010, 49(40): 7320-7323. DOI:10.1002/anie.v49:40 |
| [17] |
Wang S, Thynell S T, Arindrajit C. Experimental study on hypergolic interaction between N, N, N', N'-tetramethylethylenediamine and nitric acid[J].
Energy & Fuels, 2010, 24(10): 5320-5330. |
| [18] |
Bottaro J C, Penwell P E, Schmitt R J. 1, 1, 3, 3-tetraoxo-1, 2, 3-triazapropene anion, a new oxy anion[J].
J Am Chem Soc, 1997, 119(40): 9405-9410. DOI:10.1021/ja9709278 |
| [19] |
Zhao J, Jin B, Peng R, et al. Synthesis and characterization of a new energetic salt based on dinitramide[J].
Z Anorg Allg Chem, 2015, 641(15): 2630-2636. DOI:10.1002/zaac.201500634 |
| [20] |
He L, Tao G, Parrish D A, et al. Nitrocyanamide-based ionic liquids and their potential applications as hypergolic fuels[J].
Chem Eur J, 2010, 16(19): 5736-5743. DOI:10.1002/chem.200902651 |
| [21] |
McCrary P D, Chatel G, Alaniz S A, et al. Evaluating ionic liquids as hypergolic fuels: exploring reactivity from molecular structure[J].
Energy & Fuels, 2014, 28(5): 3460-3473. |
| [22] |
Schneider S, Hawkins T, Rosander M, et al. Liquid azide salts and their reactions with common oxidizers irfna and N2O4[J].
Inorg Chem, 2008, 47(13): 6082-6089. DOI:10.1021/ic8004739 |
| [23] |
Joo Y H, Gao H, Zhang Y, et al. Inorganic or organic azide-containing hypergolic ionic liquids[J].
Inorg Chem, 2010, 49(7): 3282-3288. DOI:10.1021/ic902224t |
| [24] |
厉刚, 孙甜甜. 四种叠氮铵类离子液体的合成及其物性研究[J].
含能材料, 2014, 22(2): 136-140. LI Gang, SUN Tian-tian. Synthesis and physicocheical properties of four azidoamoinium-based ionic liquid[J]. Chinese Journal of Energetic Materals (Hanneng Cailiao), 2014, 22(2): 136-140. |
| [25] |
Ye C, Shreeve J M. Rapid and accurate estimation of densities of room-temperature ionic liquids and salts[J].
J Phys Chem A, 2007, 111(8): 1456-1461. DOI:10.1021/jp066202k |
| [26] |
Gao H, Joo Y H, Twamley B, et al. Hypergolic ionic liquids with the 2, 2-dialkyltriazanium cation[J].
Angew Chem Int Ed, 2009, 48(15): 2792-2795. DOI:10.1002/anie.200900094 |
| [27] |
Zhang Y, Gao H, Guo Y, et al. Hypergolic N, N-dimethylhydrazinium ionic liquids[J].
Chem Eur J, 2010, 16(10): 3114-3120. DOI:10.1002/chem.v16:10 |
| [28] |
Zhang Y, Shreeve J M. Dicyanoborate-based ionic liquids as hypergolic fluids[J].
Angew Chem Int Ed, 2011, 50(4): 935-937. DOI:10.1002/anie.201005748 |
| [29] |
Li S, Gao H, Shreeve J M. Borohydride ionic liquids and borane/ionic-liquid solutions as hypergolic fuels with superior low ignition-delay times[J].
Angew Chem Int Ed, 2014, 53(11): 2969-2972. DOI:10.1002/anie.v53.11 |
| [30] |
Staubitz A, Robertson A P M, Manners I. Ammonia-borane and related compounds as dihydrogen sources[J].
Chem Rev, 2010, 110(7): 4079-4124. DOI:10.1021/cr100088b |
| [31] |
Martin D.R. The development of borane fuels[J].
J Chem Educ, 1959, 36(5): 207-260. DOI:10.1021/ed036p207 |
| [32] |
Chand D, Zhang J, Shreeve J M. Borohydride ionic liquids as hypergolic fuels: a quest for improved stability[J].
Chem Eur J, 2015, 21(38): 13297-13301. DOI:10.1002/chem.v21.38 |
| [33] |
Zhang Q, Yin P, Zhang J, et al. Cyanoborohydride-based ionic liquids as green aerospace bipropellant fuels[J].
Chem Eur J, 2014, 20(23): 6909-6914. DOI:10.1002/chem.201402704 |
| [34] |
Zhang W, Qi X, Huang S, et al. Super-base-derived hypergolic ionic fuels with remarkably improved thermal stability[J].
J Mater Chem A, 2015, 3(41): 20664-20672. DOI:10.1039/C5TA05559H |
| [35] |
Liu T, Qi X, Huang S, et al. Exploiting hydrophobic borohydride-rich ionic liquids as faster-igniting rocket fuels[J].
Chem Commun, 2016, 52(10): 2031-2034. DOI:10.1039/C5CC09737A |
| [36] |
Wang K, Zhang Y, Chand D, et al. Boronium-cation-based ionic liquids as hypergolic fluids[J].
Chem Eur J, 2012, 18(38): 16931-16937. |
| [37] |
Huang S, Qi X, Zhang W, et al. Exploring sustainable rocket fuels:[imidazolyl-amine-BH2]+-cation-based ionic liquids as replacements for toxic hydrazine derivatives[J].
Chem Asian J, 2015, 10(12): 2725-2732. DOI:10.1002/asia.201500711 |
| [38] |
Gao H, Shreeve J M. Ionic liquid solubilized boranes as hypergolic fluids[J].
J Mater Chem, 2012, 22(22): 11022-11024. DOI:10.1039/c2jm31627g |
| [39] |
Rastogi R P, Baijal S K. Boron containing polymers as potential rocket propellants[J].
AIAA J, 1968, 6(9): 1815-1816. DOI:10.2514/3.4884 |
| [40] |
McCrary P D, Barber P S, Kelley S P, et al. Nonaborane and decaborane cluster anions can enhance the ignition delay in hypergolic ionic liquids and induce hypergolicity in molecular solvents[J].
Inorg Chem, 2014, 53(9): 4770-4776. DOI:10.1021/ic500622f |
| [41] |
Perez J P L, McMahon B W, Yu J, et al. Boron nanoparticles with high hydrogen loading: mechanism for B-H binding and potential for improved combustibility and specific impulse[J].
ACS Appl Mater & Interfaces, 2014, 6(11): 8513-8525. |
| [42] |
McCrary P D, Beasley P A, Cojocaru O A. Hypergolic ionic liquids to mill, suspend, and ignite boron nanoparticles[J].
Chem Commun, 2012, 48(36): 4311-4313. DOI:10.1039/c2cc30957b |
| [43] |
Yusupov M, Bogaerts A, Huygh S, et al. Plasma-induced destruction of bacterial cell wall components: a reactive molecular dynamics simulation[J].
J Phys Chem C, 2013, 117(11): 5993-5998. DOI:10.1021/jp3128516 |
| [44] |
Nöth H, Ehemann M. Triple hydrides of aluminium and beryllium[J].
J Chem Soc, Chem Commun, 1967, 14: 685-686. |
| [45] |
Schneider S, Hawkins T, Ahmed Y, et al. Green bipropellants hydrogen-rich ionic liquids that are hypergolic with hydrogen peroxide[J].
Angew Chem Int Ed, 2011, 50(26): 5886-5888. DOI:10.1002/anie.v50.26 |
| [46] |
Addison C C, Boorman P M, Logan N. Anhydrous aluminium nitrate, and the nitronium and alkylammonium tetranitratoaluminates[J].
J Chem Soc (A), 1966, 10(2): 1434-1437. |
| [47] |
Jones C B, Haiges R, Schroer T, et al. Oxygen-balanced energetic ionic liquid[J].
Angew Chem Int Ed, 2006, 45(30): 4981-4984. DOI:10.1002/(ISSN)1521-3773 |
| [48] |
Maciejewski J P, Gao H, Shreeve J M. Synthetic methods for preparing ionic liquids containing hypophosphite and carbon-extended dicyanamide anions[J].
Chem Eur J, 2013, 19(9): 2947-2950. DOI:10.1002/chem.201203740 |
| [49] |
Zarko V E, Simonenko V N, Anisiforov G I, et al. Combustion characterization of hydrazinium nitrate/energetic binder/Alex based model propellants[J].
Aerosp Sci Technol, 2007, 11(1): 13-17. DOI:10.1016/j.ast.2006.07.004 |
| [50] |
Shamshina J L, Smiglak M, Drab D M, et al. Catalytic ignition of ionic liquids for propellant applications[J].
Chem Commun, 2010, 46(47): 8965-8967. DOI:10.1039/c0cc02162h |
| [51] |
Chambreau S D, Schneider S, Rosander M, et al. Fourier transform infrared studies in hypergolic ignition of ionic liquids[J].
J Phys Chem A, 2008, 112(34): 7816-7824. DOI:10.1021/jp8038175 |
| [52] |
Catoire L, Chambreau S D, Vaghjiani G L. Chemical kinetics interpretation of hypergolicity of dicyanamide ionic liquid-based systems[J].
Combust Flame, 2012, 159(4): 1759-1768. DOI:10.1016/j.combustflame.2011.12.007 |
| [53] |
Litzinger T, Iyer S. Hypergolic reaction of dicyanamide-based fuels with nitric acid[J].
Energy & Fuels, 2011, 25(1): 72-76. |
| [54] |
Chingin K, Perry R H. Generation of melamine polymer condensates upon hypergolic ignition of dicyanamide ionic liquids[J].
Angew Chem Int Ed, 2011, 50(37): 8634-8637. DOI:10.1002/anie.201101247 |
| [55] |
Zhang Q, Shreeve J M. Ionic liquid propellants: future fuels for space propulsion[J].
Chem Eur J, 2013, 19(46): 15446-5451. DOI:10.1002/chem.v19.46 |
Seven kinds of hypergolic ionic liquids with excellent performances were summarized. The key studies of hypergolic ionic liquids on next step are to synthesize new hypergolic ionic liquids with better performances, and to further calculate and deduce the combustion mechanism of hypergolic ionic liquids.




