2. 中国工程物理研究院化工材料研究所, 四川 绵阳 621999
2. Institute of Chemical Materials, CAEP, Mianyang 621999, China
3, 3′-二氨基-4, 4′-氧化偶氮呋咱(DAOAF)是一种标准生成焓高、感度低、耐热性好的富氮含能材料[1-2],其晶体密度、爆速和爆压分别为1.747 g·cm-3、7930 m·s-1、30.6 GPa[3]。综合性能优于六硝基芪(HNS)[4],可作为炸药配方,也可以作为含能添加剂,在推进剂中具有广阔的应用前景[5]。
自1981年由俄国科学家[6]合成以来,对DAOAF的研究主要集中在合成方法上[7-9]。王文涛[10]利用密度泛函理论对DAOAF的晶体、分子和电子结构、光吸收性质进行了理论研究。李洪珍等[11]研究了DAOAF的爆轰性能。Chellappa RS等[12]利用红外、拉曼和同步加速X射线衍射仪研究了DAOAF分子间的稳定性。Wang LX等[13]利用飞行时间分辨光谱和完全活性空间自洽场法研究了DAOAF的激发态电子分解机理。Sinditskh V等[14]利用快速升温跃迁原位池与快速扫描傅里叶变换红外联用技术研究了DAOAF的快速热裂解过程。Depiero S等[15]对DAOAF的热安全性和热分解性能进行了研究。但DAOAF热力学性质的研究尚未见报道。含能材料的热力学性质(如比热容、焓、熵、吉布斯自由能),是评价含能材料性能进而掌握含能材料在不同生产、储存、运输和操作条件下反应速率的必要条件,对于物质的理论研究和工程技术应用都有很重要的意义[16]。基于此,本研究利用TG-DTG和DSC研究了DAOAF的热分解行为,利用Kissinger法和Flynn-Wall-Ozawa法计算了热分解的表观活化能和指前因子。用DSC测定了DAOAF在253~373 K时的比热容,根据比热容与热力学函数的关系,计算了以298.15 K为基准的热力学函数值。对于DAOAF的热物性、热危险性评估技术的研究具有重要意义。
2 实验部分 2.1 试剂与仪器试剂: 3, 3′-二氨基-4, 4′-氧化偶氮呋咱(DAOAF,按照文献[17]合成,精制后纯度大于99%); 比热容基准物蓝宝石(直径3 mm,厚度1 mm,质量23.25 mg,美国TA公司提供)。
仪器: DSC Q2000型差示扫描量热仪(量热精确度: ±0.05%,温度精确度: ± 0.01 ℃,Tzero基线重现性: ±10 μW,灵敏度: 0.2 μW,美国TA仪器公司); SDT Q600同步热分析仪(美国TA仪器公司); 铝坩埚(两个坩埚的质量差小于0.1 mg,美国TA仪器公司); XS105 DualRange分析天平(北京捷德凯科技有限公司,d=0.01 mg)。
2.2 实验方法热分析:利用SDT Q 600同步热分析仪,样品量约1.5 mg; N2气氛,纯度>99.999%,流量100 mL·min-1; 升温速率分别为5,10,15,20,25 ℃·min-1。
比热容:按照DSC Q2000的连续比热容测定模式(空白、比热容基准物蓝宝石、样品)进行测定,温度范围-20~100 ℃; N2气氛,纯度>99.999%,流速50 mL·min-1; 样品量13.43 mg; 测定程序: -20 ℃恒温5 min,以升温速率10 ℃·min-1升至100 ℃,100 ℃恒温5 min,比热容计算方程如式(1)所示:
| $ {c_{{\rm{ps}}}} = {c_{{\rm{pst}}}}\frac{{{D_{\rm{s}}}{m_{{\rm{st}}}}}}{{{D_{{\rm{st}}}}{m_{\rm{s}}}}} $ | (1) |
式中, cps、cpst为样品、蓝宝石的比热容,J·g-1·K-1; Ds、Dst为样品与基线、参比与基线之间的热流差值,mW; ms、mst为样品、蓝宝石的质量,mg。
3 结果与讨论 3.1 DAOAF的热行为DAOAF在不同升温速率下的DSC曲线如图 1所示。从图 1可以看出,当升温速率为5 ℃·min-1时,固体分解与熔融呈大致相同的趋势,随着升温速率的升高,熔融趋势增大,DSC曲线出现熔融峰和热分解峰两个峰,且两峰相距很近。DAOAF的放热分解峰逐渐向高温方向偏移,且分解放热峰形变宽,峰温262.68~287.34 ℃。可见,DAOAF的热分解是先熔化吸热后放热分解的过程。

|
图 1 DAOAF在不同升温速率下的DSC曲线 Fig.1 DSC curves of DAOAF at different heating rates |
升温速率为5 ℃·min-1时的TG-DTG曲线如图 2所示。从图 2可以看出,TG-DTG曲线显示热分解过程为一个急剧失重过程。当温度达到222.5 ℃时,其失重率显著增加,温度为258.51℃,失重率为56.13%,当温度达到267.02℃时,质量损失率达82.27%。
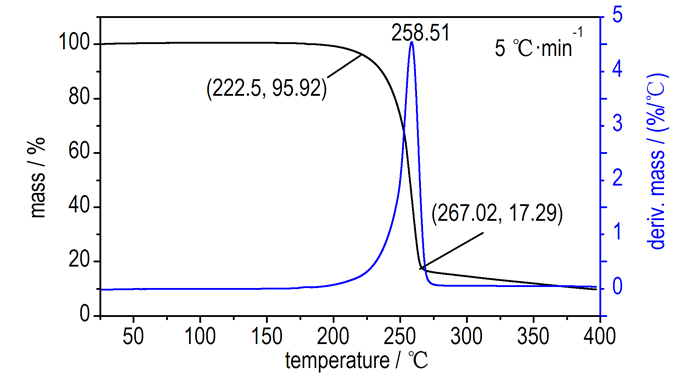
|
图 2 DAOAF的TG-DTG曲线 Fig.2 TG-DTG curves of DAOAF at a heating rate of 5 ℃·min-1 |
根据图 1,通过Kissinger[18]法(式2)和Flynn-Wall-Ozawa[19]法(式3)计算了DAOAF热分解的动力学参数,获得的表观活化能(E)、指前因子(A)和线性相关系数(r)列于表 1。
| $ {\rm{ln}}\frac{\beta }{{T_{\rm{p}}^2}} = {\rm{ln}}\frac{{AR}}{E}-\frac{E}{{R{T_{\rm{p}}}}} $ | (2) |
| $ {\rm{lg}}\beta = {\rm{lg}}\left( {\frac{{AE}}{{R{G_{(\alpha )}}}}} \right)-2.315-0.4567\frac{E}{{R{T_{\rm{p}}}}} $ | (3) |
| 表 1 不同加热速率下DAOAF放热峰温得到的动力学参数 Tab.1 Kinetic parameter of DAOAF obtained by exothermic peaks at different heating rates |
式中,β为升温速率,℃·min-1; Tp为DSC曲线峰值温度,K; R为理想气体常数,8.314J·mol-1·K-1; A为指前因子,s-1; E为表观活化能,kJ·mol-1。
由表 1可知,Kissinger法和Flynn-Wall-Ozawa法计算的活化能E分别为151.62 kJ·mol-1和152.84 kJ·mol-1,两种方法计算的活化能非常接近,且r值均大于0.99,说明计算结果比较准确。
3.3 DAOAF比热容的测定按照2.2节比热容测定方法中的程序测定DAOAF的比热容,得到热流曲线如图 3所示。
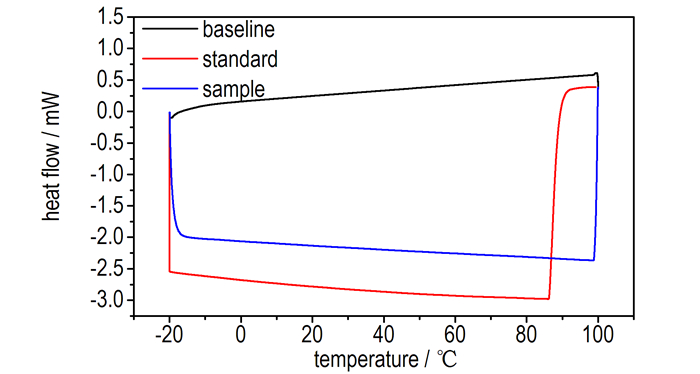
|
图 1 DAOAF和蓝宝石的连续比热容曲线 Fig.1 Curves of continuous specific heat capacity for DAOAF and sapphire |
在253~373 K,选取间隔10 K时的空白基线、参比蓝宝石和DAOAF的热流值,根据比热容公式(1)计算得到DAOAF的比热容、热流数值与比热容列于表 2。
| 表 2 DAOAF和蓝宝石的连续比热测试数据 Tab.2 Test values of continuous specific heat capacities of DAOAF and sapphire |
从表 2可以看出,在260~370 K,随着温度升高,DAOAF比热容不断增大。比热容是材料最重要的热物性参数,从晶体结构考虑,比热容与晶体的无序-有序转变和晶界缺陷的堙灭有关。物体的温度决定于物体内质点热运动的强度,温度高则质点运动的振幅大,晶体趋于有序的减少,DAOAF的比热容呈增大的趋势。
对比热容进行拟合,结果如图 4所示。从图 4可以看出,比热容随温度呈稳定的线性变化,拟合的比热容方程为: cp(J·g-1·K-1)=0.00303T+0.17235(253 K<T<373 K),R2= 0.9997,在298.15 K时,DAOAF的标准摩尔热容为228.05 J·mol-1·K-1。
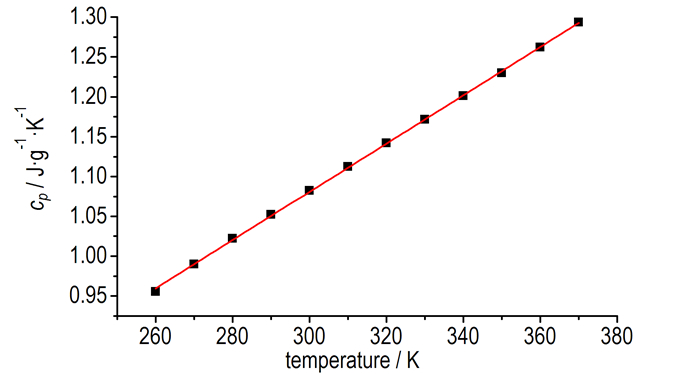
|
图 4 DAOAF的比热容与温度关系 Fig.4 The relationship of cp vs temperature for DAOAF |
利用DAOAF比热容随温度变化的方程式,根据比热容与热力学函数关系式(4)~(6)[20],计算得到了DAOAF以标准状态298.15 K为基准的热力学函数在253~373 K温区的焓、熵和吉布斯自由能函数值,结果见表 3。
| $ {H_{\rm{T}}}-{H_{298.15}} = \int_{298.15}^T {{c_p}{\rm{d}}T} $ | (4) |
| $ {S_{\rm{T}}}-{S_{298.15}} = \int_{298.15}^T {{c_p}{\rm{d}}T} $ | (5) |
| $ {G_{\rm{T}}}-{G_{298.15}} = \int_{298.15}^T {{c_p}{\rm{d}}T}-T\int_{298.15}^T {\frac{{{c_p}}}{T}{\rm{d}}T} $ | (6) |
| 表 3 DAOAF的热力学函数 Tab.3 Themodynamic functions of DAOAF |
(1) DAOAF是一种熔融分解型含能材料。利用Kissinger法和Flynn-Wall-Ozawa法获得DAOAF热分解反应的平均活化能和指前因子分别为152.23 KJ·mol-1、1012.53 s-1。
(2) 应用DSC Q2000的连续比热容模式对DAOAF比热容进行了测定,得到了比热容与温度的线性方程cp(J·g-1·K-1)=0.00303T+0.17235(253 K<T<373 K),298.15 K时DAOAF的标准摩尔热容为228.05 J·mol-1·K-1。
(3) 根据比热容与热力学函数关系,计算了以298.15 K为基准的热力学函数在253~373 K温区的焓、熵和吉布斯自由能函数值。
| [1] |
Talawar M B, Sivabalan R, Senthilkumar N, et al. Synthesis, characterization and thermal studies on furazan-and tetrazine-based high energy materials[J].
Journal of Hazardous Materials, 2004, 113(1-3): 11-25. DOI:10.1016/j.jhazmat.2004.05.016 |
| [2] |
Hiskey M A, Chavez D E, Bishop R L, et al. Use of 3, 3′-diamino-4, 4′-azoxyfurazan and 3, 3′-diamino-4, 4′-azofurazan as insensitive high explosive materials: US, US6358339[P]. 2002.
|
| [3] |
Sivabalan R, Talawar M B, Santhosh P, et al. Electro-analysis of energetic materials[J].
Journal of Hazardous Materials, 2007, 14: 8573-8582. |
| [4] |
Chavez D E, Hill L, Hiskey M A, et al. Preparation and explosive properties of azo and azoxyfurazans[J].
Journal of Energetic Materials, 2000, 18(2): 219-236. |
| [5] |
Wang Luo-xin, Tuo Xin-lin, Yi Chang-hai, et al. Theoretical study on the trans-cis isomerization and initial decomposition of energetic azofurazan and azoxyfurazan[J].
Journal of Molecular Graphics and Modelling, 2009, 28: 81-87. DOI:10.1016/j.jmgm.2009.04.007 |
| [6] |
Solodyuk G D, Boldyrev M D, Gidaspov B V, et al. Oxidation of 3, 4-diaminofurazan by peroxide reagents[J].
Zhurnal Organicheskoi Khimii, 1981, 17: 861-865. |
| [7] |
Makhova N N, Ovchinnikov I V, Kulikov A S, et al. Diaminofuroxan: synthetic approaches and computer-aided study of thermodynamic stability[J].
Propellants, Explosives, Pyrotechnics, 2012, 37(5): 549-557. DOI:10.1002/prep.v37.5 |
| [8] |
高莉, 杨红伟, 汤永兴, 等. 偶氮及氧化偶氮呋咱化合物的合成与表征[J].
火炸药学报, 2013, 36(1): 47-51. GAO Li, YANG Hong-wei, TANG Yong-xing, et al. Synthesis and characterization of azofurazan and azoxyfurazan[J]. Chinese Journal of Explosives and Propellants, 2013, 36(1): 47-51. |
| [9] |
吴敏杰, 陈树森, 金韶华, 等. 一种合成3, 3′-二氨基-4, 4′-氧化偶氮呋咱的新方法[J].
含能材料, 2013, 21(2): 273-275. WU Min-jie, CHEN Shu-sen, JIN Shao-hua, et al. A new method to synthesize 3, 3′-diamino-4, 4′-azoxyfurazan[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(2): 273-275. |
| [10] |
王文涛. 高能呋咱衍生物晶体的高压行为的周期性密度泛函理论研究[D]. 南京: 南京理工大学, 2013.
WANG Wen-tao. Periodic DFT studies of high-pressure behavior of energetic furazan derivatives crystals[D]. Nanjing: Nanjing University of Science and Technology, 2013. |
| [11] |
李洪珍, 黄明, 周建华, 等. 3, 3′-二氨基-4, 4′-偶氮呋咱及其氧化偶氮呋咱的性能研究[J].
含能材料, 2006, 14(5): 381-384. LI Hong-zhen, HUANG Ming, ZHOU Jian-hua, et al. Synthesis of diaminoazofurazan and diaminoazoxyfurazan[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(5): 381-384. |
| [12] |
Chellappa R S, Dattelbaum D M, Coe J D, et al. Intermolecular stabilization of 3, 3′-diamino-4, 4′-azoxyfurazan (DAOAF) compressed to 20 GPa[J].
Journal of Physical Chemistry A, 2014, 118(31): 5969-5982. DOI:10.1021/jp504935g |
| [13] |
Wang Luo-xin, Tuo Xin-lin, Zou Han-tao, et al. Ab initio study of the molecular structure and thermal cis-trans isomerization of 3, 3′-diamino-4, 4′-azofurazan and 3, 3′-diamino4, 4′-azoxyfurazan[J].
Journal of Theoretical and Computational Chemistry, 2009, 8: 507-517. DOI:10.1142/S0219633609004885 |
| [14] |
Sinditskh V, Manh V U, Shelaputina V, et al. Study on thermal decomposition and combustion of insensitive explosives 3, 3′-diamino-4, 4′-azofurazan and 3, 3′-diamino-4, 4′-azoxyfurazan[C]//Proceedings-2007 International Autumn Seminar on Propellants, Explosives and Pyrotechnics. Xian, 2007, 422-428.
|
| [15] |
Depiero S, Koerner J, Maienschein J, et al. Small-Scale Safety and Thermal Characterization of 3, 3′-diamino-4, 4′-azoxyfurazan (DAOAF)[R]. UCRL-TR-231649: 2007.
|
| [16] |
Smirnov L P. Chemical physics of decomposition of energetic materials[J].
Russian Chemical Reviews, 2004, 73(11): 1121-1141. DOI:10.1070/RC2004v073n11ABEH000869 |
| [17] |
Francois E G, Chavez D E, Sandstrom M M. The development of a new synthesis process for 3, 3′-diamino-4, 4′-azoxyfurazan[J].
Propellants, Explosives, Pyrotechnics, 2010, 35(6): 529-534. DOI:10.1002/prep.v35.6 |
| [18] |
Kissinger H E. Reaction kinetics in differential thermal analysis[J].
Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
| [19] |
Ozawa T. A new method of analying thermogravimetric data[J].
Bulletin of the Chemical Society of Japan, 1965, 38: 1881-1886. DOI:10.1246/bcsj.38.1881 |
| [20] |
Pan Lu, Gao Xiao-han, LV Xue-chuan, et al. Low-temperature molar heat capacity and thermodynamic properties of rare earth complex[J].
Journal of Thermal Analysis and Calorimetry, 2016, 124: 429-435. DOI:10.1007/s10973-015-5133-8 |
Thermal decomposition behavior of DAOAF was studied by TG-DTG/DSC and the activation energy and pre-exponential factor of DAOAF were calculated. The specific heat capacity was determined by differential scanning calorimetry. According to the relationship between specific heat capacity and thermodynamic functions, its enthalpy, entropy, Gibbs free energy increments from 253 K to 373 K, relative to the standard temperature 298.15 K, were calculated.




