全氮化合物分子结构中含有大量的N—N和N=N键, 储存着较高的能量, 同时又具有高密度、低感度、高产气量以及爆轰产物清洁等优点, 受到了含能材料领域研究者的广泛关注[1-3]。自1956年Huisgen和Ugi报道了苯基五唑的合成以来[4], 国内外的学者进行了大量的研究工作。2002年, Vij等[5]通过质谱首次检测到了N5-, 这一发现给研究者们从芳基五唑中分离得到N5-带来了极大的希望。但由于其较差的稳定性, 芳基五唑极易释放氮气变成相应的叠氮化合物, 导致其合成与表征陷入了极大的困境[6-8]。因此, 芳基五唑的稳定化技术是目前亟需解决的难点。
目前大多数实验研究都集中在单取代芳基五唑上, 庞思平等[9]研究了对二甲氨基苯基五唑的合成, 葛忠学等[10]研究了对叔丁基苯基五唑的合成及分解动力学, 毕福强等[11]研究了氮标记的对甲氧基苯基五唑的合成及分解机理, Ek等[12]合成并表征了八种对位取代的苯基五唑。通过这些研究, 不同单取代芳基五唑的性质被了解。但对于多取代的芳基五唑, 仅有一些理论计算, 很少有关于它的合成报道。有研究发现芳基五唑中五唑环的对位和间位的供电子基有助于芳基五唑稳定性的提高[13]。
基于此, 本研究参照文献报道了一系列多供电基取代的芳基五唑的合成, 运用质谱仪对储存在不同温度下的五唑化合物进行检测, 研究了取代基的位置及数目对芳基五唑化合物稳定性的影响, 同时通过二级质谱碎片分析了不同裂解能量下芳基五唑的裂解途径, 并讨论了芳基五唑的稳定性与产生的N5-之间的关系。
2 实验部分 2.1 试剂与仪器主要试剂:盐酸(36%)、甲醇、正己烷, 分析纯, 成都市科龙化工试剂厂; 对氨基苯酚、3-甲基-4-氨基苯酚, 亚硝酸钠, 分析纯, 阿拉丁试剂有限公司; 2, 6-二甲基-4-氨基苯酚, 2-甲基-4-氨基苯酚, 3, 4-二甲基-4-氨基苯酚, 自制。
仪器: EYELA PSL-1810型磁力搅拌低温恒温水槽, 日本东京理化器械株式会社; Finnigan TSQ Quantumultra AM型质谱仪, 美国Thermal公司; 500 MHz核磁共振仪, 瑞士Bruker公司。
2.2 合成路线
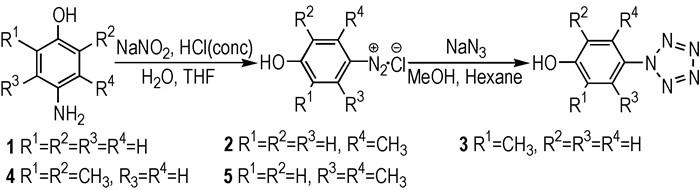
|
Scheme1 Synthetic route of arylpentazoles |
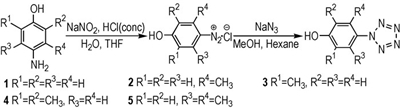
在圆底烧瓶中加入原料氨基苯酚(5 mmol)、水(3 mL)、四氢呋喃(3 mL)和浓盐酸(36%, 10 mmol), 控制温度在-5~ 0 ℃, 滴加亚硝酸钠(0.379 g, 5.5 mmol)的水溶液, 反应40 min后, 加入甲醇(10 mL)和正己烷(6 mL)至反应液中, 待低温反应槽冷却至-45 ℃后, 滴加叠氮化钠(0.358 g, 5.5 mmol)的水溶液, 反应50 min。经低温过滤, 冷冻干燥得到目标产物。
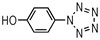
4-羟基苯基五唑(1): 1H NMR (CD3OD): 7.88 (2H, d, J=9.5), 7.77 (2H, d, J=9.5); ESI-MS/MS (m/z, 10 eV), 162.024 [M-H]-, 134.01, 106.03, 78.16;
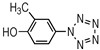
2-甲基-4-羟基苯基五唑(2): 1H NMR (CD3OD): 7.84 (2H, d, J=8.0), 7.06 (2H, d, J=8.0), 2.34 (3H, s); ESI-MS/MS (m/z, 10 eV), 176.06 [M-H]-, 148.02, 120.07, 92.01;
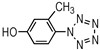
3-甲基-4-羟基苯基五唑(3): 1H NMR (CD3OD): 7.87 (1H, s), 7.79 (1H, s), 7.03 (1H, s), 2.33 (3H, s); ESI-MS/MS (m/z, 10 eV), 175.97 [M-H]-, 147.96, 120.04, 92.08;
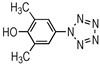
3, 5-二甲基-4-羟基苯基五唑(4): 1H NMR (CD3OD): 7.67 (2H, s), 2.24 (6H, s); ESI-MS/MS (m/z, 10 eV), 190.08 [M-H]-, 162.01, 134.05, 106.04;
2, 6-二甲基-4-羟基苯基五唑(5): ESI-MS/MS (m/z, 10 eV), 190.03 [M-H]-, 163.06, 134.07, 106.35。
3 结果与讨论 3.1 芳基五唑的合成芳基五唑化合物的合成包括重氮化反应和与叠氮化钠的成环反应, 芳基重氮盐的制备可以通过有机溶剂体系中的亚硝酸异戊酯重氮化反应得到, 也可以通过无机重氮化的苯胺与亚硝酸钠反应制得。和有机重氮化[14]相比, 无机重氮化具有反应体系简单, 处理容易, 有助于芳基五唑的合成等优点, 因而被广泛采用。化合物1-4的反应现象与文献[10]类似, 质谱跟踪检测显示重氮化反应能够完全进行, 随后加入叠氮化钠的水溶液, 反应液中有固体浑浊出现, 最后抽滤得到灰白色的目标化合物。在合成化合物5时却发现, 质谱检测显示重氮化反应能够完全进行, 但加入叠氮化钠之后却未得到目标化合物。考虑到五唑化合物的不稳定性, 将反应温度降低到-65 ℃, 缩短反应时间至25 min, 质谱检测显示只生成了痕量的化合物5, 绝大部分都是对应的芳基叠氮, 因而很难分离得到纯净的化合物5。
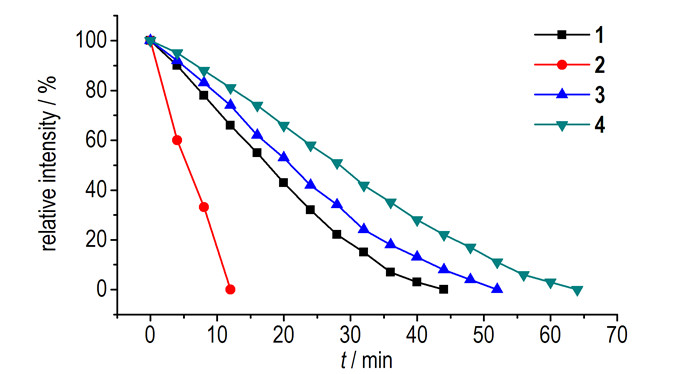
3.2 芳基五唑的稳定性研究利用质谱仪检测储存在-45, -18, 0 ℃和室温(25 ℃)的芳基五唑完全分解所需要的时间, 结果见表 1。由表 1可知, 除了化合物5, 所有的化合物在低温冰箱中(-45 ℃)都能长期保存。在冰箱下层(-18 ℃)储存时, 化合物4稳定性最好, 化合物2的稳定性最差。在0 ℃下, 芳基五唑的稳定性都大大降低, 最稳定的芳基五唑也仅能存在数小时。分析以上实验数据发现低于-18 ℃, 芳基五唑能够存在数天之久, 甚至于长期保存而不发生分解, 但是当温度到0 ℃时, 芳基五唑的稳定性大大降低, 仅能够存在数小时。在0 ℃以下, 将化合物3和4与化合物1、2和5对比发现, 化合物3和4的稳定性明显强于其他化合物, 且化合物4的稳定性要好于化合物3。当温度到达25 ℃时, 化合物2在数分钟就完全发生分解, 稳定性最好的化合物4也仅能存在1 h左右。由于现有的仪器设备大多都是在室温下进行分析检测, 因此精确测定芳基五唑在室温下的存在时间对于能否采用常规的仪器进行表征具有重要意义。取0.01 mmol的四种芳基五唑溶解在10 mL的甲醇中配成1 mmol·L-1的芳基五唑甲醇溶液, 置于室温下的恒温箱中, 在室温下每隔4 min进行质谱测试, 观察芳基五唑母离子峰的强度变化, 以此来分析芳基五唑在室温下的稳定性, 由图 1可知, 化合物2的相对强度随时间变化很大, 其他化合物的相对强度随时间的变化较小。这表明, 邻位取代的芳基五唑稳定性不如间位取代, 甚至于不如没有供电子基取代的芳基五唑, 但间位取代的供电基却能够提高芳基五唑的稳定性, 且供电基越多化合物的稳定性越好。说明邻位取代的供电基不能够提高芳基五唑的稳定性, 相反却会导致芳基五唑更不稳定, 这与Butler等[14]提出的芳基五唑的成环机理相吻合:由于邻位甲基的空间位阻效应导致经异构化形成的(E, Z)五氮烯很难发生氮氮协同的闭环反应或者成环之后马上开环分解, 导致邻位取代的芳基五唑很难合成。
| 表 1 芳基五唑在不同温度下的存在时间 Tab.1 Existent time of arylpentazoles at different temperatures |
|
图 1 芳基五唑在室温下的存在时间 Fig.1 Existent time of arylpentazoles at room temperature |
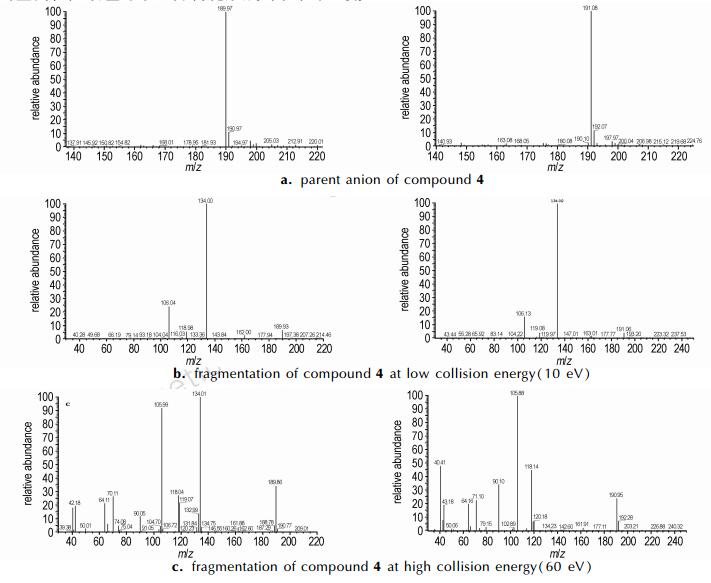
为了详细了解芳基五唑的分解过程, 选取最稳定的化合物4作为底物, 运用电喷雾离子化串联质谱(ESI-MS-MS)对其进行二级裂解, 通过观察不同裂解能量下化合物4的质谱碎片, 来分析芳基五唑在质谱中的裂解规律, 结果如图 2所示, 由图 2可知, 在不同的裂解能量下, 化合物4有两种不同的裂解途径。在低裂解能量轰击(10 eV)下(图 2b), 化合物的质量数190, 逐渐失去28、28和28, 得到质量数162, 134和106。第一个28为五唑开环分解变成叠氮; 第二个28是叠氮分解失去一分子氮气; 第三个28为苯环开环裂解失去CO。在高裂解能量轰击(60 eV)下(图 2c), 除了以上的碎片质量数以外, 还能够得到其他的裂解碎片, 比较显著的碎片质量数为70和42, 质量数70推断为N5-, 由于质谱碎片162裂解时不会产生叠氮碎片, 因此质量数42归因于N5-开环失去氮气变成N3-。以上实验现象说明高裂解能量能够切断芳基五唑中的C—N键得到N5-, 这与Nguyen等[15]理论预测的N5-的分解路径一致。
|
图 2 化合物4的质谱图 Fig.2 The mass spectrum of compound 4 |
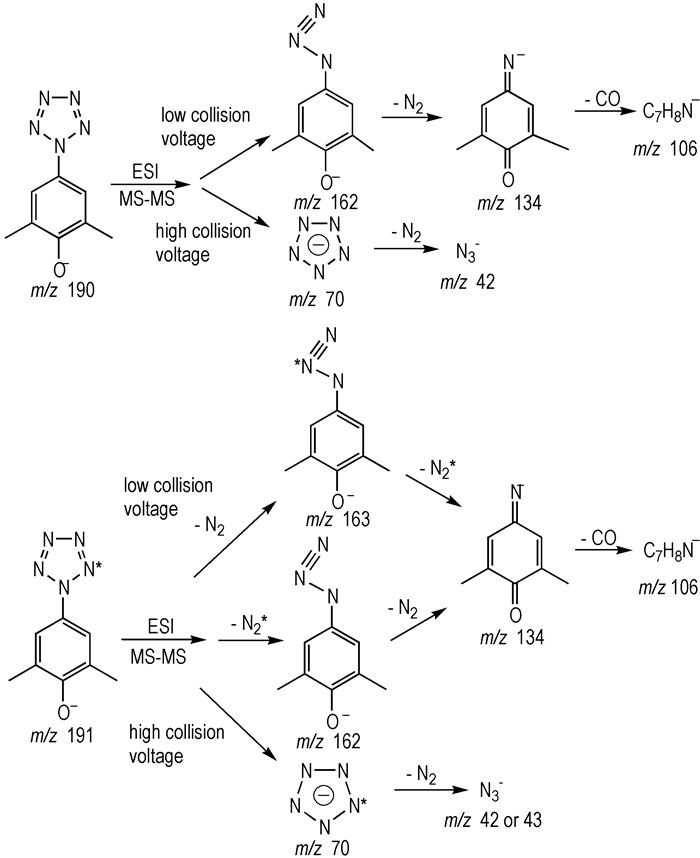
|
图 3 不同能量下化合物4的分解路径 Fig.3 Decomposition pathway of compound 4 at different collision energy |
为了证实二级质谱得到的质量数70为N5-, 采用2, 6-二甲基-4-氨基苯酚与15N标记的亚硝酸钠为原料合成了带有15N标记的化合物4。采用相同的裂解能量进行分析, 在10 eV能量轰击下(图 2b), 得到的主要碎片质量数是163, 162, 134和106;在60 eV能量轰击下(图 2c), 除了以上主要碎片外, 还能够得到质量数为71和43的碎片。这充分证实了二级质谱裂解芳基五唑所得到的质量数70就是N5-。
3.4 质谱裂解产生N5-的能力比较根据Vij等[4]的报道, 在不同的裂解能量下芳基五唑的裂解途径有明显的区别。在样品浓度(1 mmol·L-1)、裂解能量(60 eV)和进样流速(10 μL·min-1)等其他条件相同的情况下, 运用ESI-MS-MS来对其进行裂解分析。由图 4可知, 化合物4释放的N5-强度最大, 化合物3产生的N5-强度最小, 有一个间位甲基的化合物3释放的N5-强度大于没有甲基取代的化合物1。说明产生N5-强度的大小规律与芳基五唑的稳定性规律一致, 因为芳基五唑中五唑环的对位和间位取代的供电基会增加五唑环的芳香性和稳定性, 同时也会弱化芳基五五唑环相连的C—N键, 有助于选择性的断裂C—N键而能够使五唑环不发生分解。基于芳基五唑稳定性和二级质谱释放N5-的能力而言, 在这一系列化合物中, 化合物4的稳定性最好, 同时切断C—N键释放得到N5-的能力也最强, 最有可能用来去芳基化得到N5-及其离子盐。
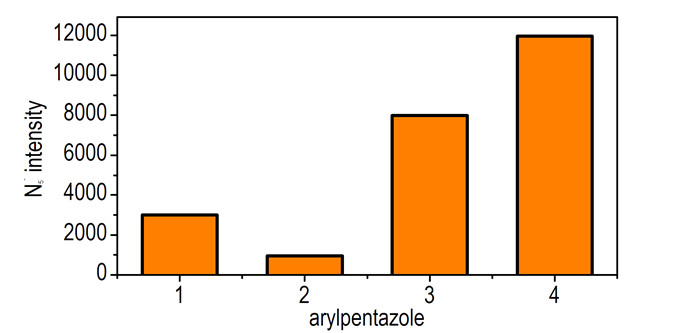
|
图 4 ESI-MS-MS检测到的N5-强度图 Fig.4 N5- intensity detected by ESI-MS-MS |
(1) 以对氨基苯酚及其衍生物为原料, 通过与亚硝酸钠的无机重氮化和与叠氮化钠在低温下的[3+2]成环反应, 合成了一系列多甲基取代的芳基五唑化合物, 并表征了其结构。
(2) 间位取代的供电基能够提高芳基五唑的稳定性, 且供电基越多化合物的稳定性越好。邻位取代的供电基不能够提高芳基五唑的稳定性, 还会因为空间位阻效应明显减弱芳基五唑的稳定性。
(3) 在合成的一系列芳基五唑中, 化合物4的稳定性最好, 同时在60 eV裂解能量下切断C—N键释放得到N5-的能力也最强, 最有可能用来去芳基化得到N5-及其离子盐。
| [1] |
Butler R N, Stephens J C, Hanniffy J M. First reversible protonation of the all-nitrogen 1-arylpentazole ring[J].
Tetrahedron Lett, 2004, 45(9): 1977-1979. DOI:10.1016/j.tetlet.2003.12.147 |
| [2] |
Geiger U, Haas Y, Grinstein D. The photochemistry of an arylpentazole in liquid solutions: The anionic 4-oxidophenylpentazole (OPP)[J].
J Photochem Photobiol A, 2014, 277: 53-61. DOI:10.1016/j.jphotochem.2013.12.008 |
| [3] |
Nguyen M T. Polynitrogen compounds 1.Structure and stability of N4 and N5 systems[J].
Coord Chem Rev, 2003, 244: 93-113. DOI:10.1016/S0010-8545(03)00101-2 |
| [4] |
Huisgen R, Ugi I. Zur löesung eines klassischem problems der organischen stickstoff-chemie[J].
Angew Chem Int Ed, 1956, 68(22): 705-706. |
| [5] |
Vij A, Pavlovich J G, Wilson W W, et al. Experimental detection of the pentaazacyclopentadienide (Pentazolate) anion, cyclo-N5-[J].
Angew Chem Int Ed, 2002, 41(16): 3051-3054. DOI:10.1002/1521-3773(20020816)41:16<3051::AID-ANIE3051>3.0.CO;2-T |
| [6] |
Carlqvist P, Östmark H, Brinck T. The stability of arylpentazoles[J].
J Phys Chem A, 2004, 108: 7463-7467. DOI:10.1021/jp0484480 |
| [7] |
Yang Y Z, Li Y C, Pang S P, et al. Thermal stability ofp-dimethylaminophenylpentazole[J].
RSC Advances, 2014, 4: 57629-57634. DOI:10.1039/C4RA08454C |
| [8] |
Hammerl A, Klapötke T M. Tetrazolylpentazoles: nitrogen-rich compounds[J].
Inorganic Chemistry, 2002, 41: 906-912. DOI:10.1021/ic0108134 |
| [9] |
张佳利, 庞思平, 李玉川, 等. 1-(对二甲氨基苯基)五唑的合成研究[J].
含能材料, 2006, 14(5): 355-357. ZHANG Jia-li, PANG Si-ping, LI Yu-chuan, et al. Synthesis of 1-(p-dimethylaminophenyl) pentazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(5): 355-357. |
| [10] |
毕福强, 许诚, 樊学忠, 等. 对叔丁基苯基五唑的合成及分解动力学[J].
火炸药学报, 2012, 35(2): 15-18. BI Fu-qiang, XU Cheng, FAN Xue-zhong, et al. Synthesis and decomposition kinetics of p-tert-butylphenylpentazole[J]. Chinese Journal of Explosives and Propellants, 2012, 35(2): 15-18. |
| [11] |
王民昌, 毕福强, 葛忠学, 等. 15N标记的苯基五唑的合成、表征及分解反应机理[J].
火炸药学报, 2012, 35(3): 56-60. WANG Min-chang, BI Fu-qiang, ZHANG Gao, et al. Synthesis, characterization and decomposition reaction mechanism of 15N-labelled phenylpentazoles[J]. Chinese Journal of Explosives and Propellants, 2012, 35(3): 56-60. |
| [12] |
Ek S, Rehn S, Wahlström L Y, et al. Synthesis andcharacterization of eight arylpentazoles[J].
J Heterocycl Chem, 2013, 50: 261-267. DOI:10.1002/jhet.v50.2 |
| [13] |
Zhang X L, Yang J Q, Lu M, et al. Theoretical studies on the stability of phenylpentazole and its substituted derivatives of —OH, —OCH3, —OC2H5 and —N(CH3)2[J].
RSC Advances, 2014, 4: 56095-56101. DOI:10.1039/C4RA10669E |
| [14] |
舒畅, 廖立华, 张晓梅. 芳基偶氮染料的高效合成[J].
合成化学, 2014, 22(6): 832-834. SHU Chang, LIAO Li-hua, ZHANG Xiao-mei. Efficient synthesis of aryl azo dye[J]. Chinese journal of synthetic chemistry, 2014, 22(6): 832-834. |
| [15] |
Butler R N, Stephensa J C, Burke L A. First generation of pentazole (HN5, pentazolic acid), the final azole, and a zinc pentazolate salt in solution: A new N-dearylation of 1-(p-methoxyphenyl) pyrazoles, a 2-(p-methoxyphenyl) tetrazole and application of the methodology to 1-(p-methoxyphenyl) pentazole[J].
Chem Commun, 2003, 8: 1016-1017. |
| [16] |
Nguyen M T, Ha T K. Decomposition mechanism of the polynitrogen N5 and N6 clusters and their ions[J].
Chem Phy Lett, 2001, 335: 311-320. DOI:10.1016/S0009-2614(01)00037-9 |
A series of arylpentazoles were synthesized fromp-aminophenol and its derivatives at -45 ℃ and their structures were characterized. The effects of the number and position of the substituents on the stability of arylpentazoles were investigated. The decomposition pathway of arylpentazoles at different collision energy was infered by electrospray tandem mass spectrometry, and then, the relationship between the arylpentazole stability and the relative intensity of the generation of N5- was also discussed.