由于全氮类物质分解产物为稳定无污染的N2, 因此有希望作为新一代超高能含能材料[1]。人们在多氮材料方向进行了长时间的探索, 五元唑环系只有五氮唑[2-6](HN5, 五唑) 尚未合成。它的负离子N5-与环戊二烯负离子结构高度相似, 极有可能具有芳香性[7]。因此, 合成五氮唑引起了人们极大的关注。
1956年, Rolf Huisgen和Ivar Ugi[8-10]首次在低温条件下合成出能稳定存在的芳基五唑化合物, 这些化合物升温迅速分解成芳基叠氮和N2。随后, 大量含不同取代基的芳基五唑化合物及其衍生物被相继合成[11-15]。2004年, Peter Carlqvist等[16]发现芳环上对位的供电子基, 以及甲醇溶剂可以增加芳基五唑的稳定性, 至此芳基五唑化合物的合成方法日趋成熟。2001年, Matthias Lein等[17-18]提出五唑可以和亚铁离子形成Fe (N5)2, 类似于二茂铁构型的猜想。2002年, Ashwani Vij等[19]首次通过高能粒子轰击芳基五唑, 在二级质谱中检测到N5-, 并通过理论计算证明N5-在制备过程中的可控性。2008年, Richard N. Butler等[20]提出了芳基五唑的分解路径。2016年, Boris Bazanov等[21]使用金属Na在四氢呋喃 (THF) 溶液中与苯基五唑反应, 可以在质谱中检测到五唑负离子 (m/z=70);使用15N同位素标记标记单个N原子后, 也可以检测到相应的峰 (m/z=71)[21]。该反应条件苛刻, 需要严格无水, 且芳基五唑与碱金属稳定性较差, 危险性较大。但该反应指出了一条途径, 即用强还原剂去切断芳基五唑中的C—N键。
基于此, 本研究以3, 5-二甲基-4-羟基苯基五唑为原料, 采用“先还原后氧化”的方法, 在保持N—N键稳定的情况下, 切断C—N键。该方法反应条件温和, 危险性较小。运用质谱仪监测反应的进行程度, 并通过同位素标记来研究五唑负离子的性质。
2 实验部分 2.1 仪器和试剂仪器: EYELA公司PSL-1810型磁力搅拌低温恒温槽, Coolingway公司-86 ℃超低温冰箱, Bruker公司Avance Ⅲ 500 MHz核磁共振仪, Finnigan公司TSQ Quantum Ultra AM高分辨液质联用仪。
试剂:对氨基苯磺酸、2, 6-二甲基苯酚、叠氮化钠、亚硝酸钠、连二亚硫酸钠、七水合硫酸亚铁、四水合氯化亚铁、四水合氯化铁、四水合氯化锰、氯化亚铜、30%过氧化氢水溶液、过氧叔丁醇, 阿拉丁试剂有限公司, 分析纯; 氢氧化钠、无水碳酸钠、无水硫酸钠, 成都市科龙化工试剂厂, 分析纯; 36.5%浓盐酸、四氢呋喃、甲醇, 上海凌峰化学试剂有限公司, 分析纯; 85%间氯过氧苯甲酸, 上海萨恩化学技术有限公司, 分析纯。
2.2 3, 5-二甲基-4-羟基苯胺盐酸盐的合成在250 mL三口瓶中依次加入12 g对氨基苯磺酸 (69 mmol, 1.0 e.q.), 3.7 g碳酸钠 (35 mmol, 0.5 e.q.), 50 mL水。磁力搅拌下降温至0 ℃, 加入20 mL NaNO2水溶液 (7.2 g, 104 mmol, 1.5 e.q.), 滴加过程中保持温度稳定, 反应30 min。加入14.6 mL 36.5%浓盐酸 (175 mmol, 2.5 e.q.), 反应30 min后置于冰箱中低温保存。
在另一个500 mL三口瓶中加入7.8 g 2, 6-二甲基苯酚 (64 mmol, 0.93 e.q.), 0 ℃下加入50 mL NaOH水溶液 (14 g, 350 mmol, 5.0 e.q.), 反应10 min后加入之前制备好的重氮盐溶液, 加入过程中保持温度恒定在0 ℃, 反应1 h。
将反应液升温至80 ℃, 加入30.5 g Na2S2O4(175 mmol, 2.5e.q.), 反应1 h。冷却至室温后抽滤, 滤饼水洗两次后用50 mL THF溶解, 滤去不溶物, 在所得澄清THF溶液中加入浓盐酸至强酸性 (pH < 2), 搅拌析出大量固体, 抽滤并用THF洗涤滤饼一次, 晾干后得9 g粉色固体, 产率75%。m.p. 230~235 ℃。1H NMR (CD3OD-d4, 500 MHz) δ: 6.95(s, 2H), 2.25(s, 6H)。ESI-MS/MS (m/z, 10 eV): 138.01 [M+H]+。
合成路线见Scheme 1。
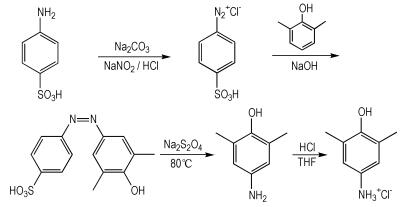
|
Scheme1 Synthetic route of 3, 5-dimethyl-4-hydroxy aniline hydrochloride |
3, 5-二甲基-4-羟基苯基五唑为含能化合物, 室温易分解, 具有一定危险性, 注意采取必要防护措施, 保存在-50 ℃低温冰箱中[22]。
在250 mL单口瓶中加入3 g 3, 5-二甲基-4-羟基苯胺盐酸盐 (17.3 mmol, 1.0 e.q.), 加入30 mL水溶解, 磁力搅拌下降温至0 ℃, 加入1.52 mL 36.5%浓盐酸 (18.2 mmol, 1.05 e.q.)。充分搅拌后加入15 mL NaNO2水溶液 (1.25 g, 18.2 mmol, 1.05 e.q.), 反应30 min。
重氮化完成后加入80 mL甲醇, 降温至-50 ℃后, 加入20 mL预先冷冻至-50 ℃的NaN3的甲醇水混合溶液 (1.22 g, 18.2 mmol, 1.05 e.q.), 反应2 h。
低温抽滤, 滤饼低温真空干燥, 得2 g粉色固体, 产率66.7%。1H NMR (CD3OD-d4, 500 MHz)δ: 6.95 (s, 2H), 2.25 (s, 6H)。ESI-MS/MS (m/z, 10 eV): 190.07 -, 225.99 -。
合成路线见Scheme 2。

|
Scheme2 Synthetic route of 3, 5-dimethyl-4-hydroxy phenyl-pentazole |
R1在-50 ℃下合成并保持稳定, 故以R1为底物的反应也在-50 ℃下进行。鉴于五唑溶液的稳定性尚不明确,故所得产品也保存于-50 ℃低温冰箱中。
在250 mL单口瓶中加入30 mL甲醇, 降温至-50 ℃。迅速称取1 g R1(5.2 mmol, 1.0 e.q.) 并加入反应瓶中溶解。先加入40 mL预冷至-50 ℃的FeSO4的甲醇溶液 (1.58 g, 10.4 mmol, 2.0 e.q.), 反应30 min。再加入40 mL预冷至-50 ℃的间氯过氧苯甲酸 (m-CPBA) 的甲醇溶液 (2.25 g, 13.0 mmol, 2.5 e.q.), 反应4 h, 得到含有N5-的甲醇溶液。1H NMR (CD3OD-d4, DMSO-d6, D2O, CDCl3, 500 MHz) 均未能检测到五唑的氢原子峰。ESI-MS/MS (m/z, 10 eV):70.10 -, 141.06 -。
合成路线见Scheme 3。
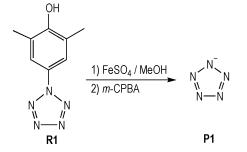
|
Scheme3 Synthetic route of pentazole anion |
由于五唑负离子结构与环戊二烯负离子高度相似, 极有可能与过渡金属离子结合, 得到类似于二茂铁的夹心结构。故以常见低价过渡金属离子盐作为还原剂 (2.0 e.q.), 过氧化物为氧化剂 (2.5 e.q.), 与R1(1.0 e.q.) 反应。过渡金属盐使用常见的FeSO4、MnCl2、CuCl, 氧化剂选用H2O2(a1)、(CH3)3COOH (a2, 过氧叔丁醇)、NaClO (a3)、m-CPBA (a4), 结果见表 1。由表 1可知, MnCl2和CuCl无论与哪一种氧化剂反应, 都无法得到N5-(序号3, 4); FeSO4与a1、a2、a3反应也无法得到N5-(序号1);以m-CPBA为氧化剂, 在反应体系中可以检测到N5- (m/z=70, 10 eV, 序号2), 其质谱图见图 1。
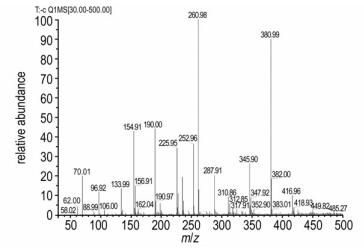
|
图 1 五唑溶液的质谱图 Fig.1 Mass spectrum of pentazole solution |
| 表 1 不同还原剂和氧化剂的反应结果 Tab.1 Results of using different reductants react with oxidants |
图 1中主要峰的归属如下: m/z=155为m-CPBA的还原产物间氯苯甲酸 (m-CBA); m/z=190为R1离去H+得到的负离子[R1-H]-; m/z=226为[R1+Cl]-; m/z=261为[R1+N5]-; m/z=311为m-CBA的二聚; m/z=381为R1的二聚。
为进一步研究Fe2+在反应中的作用, 设计正交实验, 使用另一种亚铁盐FeCl2作为还原剂; 使用Fe3+代替Fe2+, 实验结果见表 2。FeCl2与a1、a2、a3不发生反应, 但和m-CPBA反应能检测到N5-, 说明Fe在反应过程中是以离子形式存在的, 反应不受亚铁盐中的负离子的影响 (序号1, 2)。使用FeCl3则得不到N5-, 说明m-CPBA在反应中的作用不仅仅是将Fe2+氧化成Fe3+(序号3, 4)。R1, m-CPBA, Fe2+三者可能会形成N—Fe—O—O—Bz的过渡态[23], a1、a2中尽管存在过氧键, 但是过氧键不与苯环相连, 无法形成这一过渡态, 故无法解离得到N5-。
| 表 2 氯化亚铁和氯化铁的测试 Tab.2 Test of ferrous chloride and ferric chloride |
将五唑的甲醇溶液在-50 ℃下真空浓缩, 滤去大部分析出杂质, 可以得到黄色的油状液滴。取该液滴做质谱测试, 对比原始的反应溶液, 多出一个丰度较大的峰 (m/z=141, 10 eV)。对其进行二级裂解,离子碎片表明其为五唑的二聚形态 (m/z=42, 70; 50 eV), 这与Ashwani Vij的二级质谱数据相符[19], 该峰对应的离子应为[HN5+N5]-, 如图 2所示,根据这一数据, 猜测与N5-结合的阳离子为H+, 分子式为HN5, 其为活泼氢, 故在1H NMR中没有对应峰。
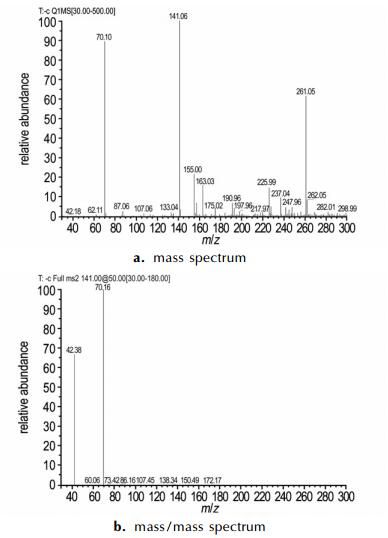
|
图 2 五唑浓缩溶液的质谱图 Fig.2 Mass spectrum of the concentrated solution of pentazole |
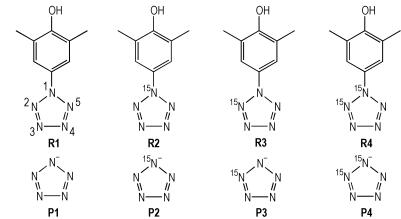
假如五唑负离子具有芳香性, 那么其N原子的化学环境应完全相同。由于尚未得到五唑的晶体, 其N—N键键长键角无法测定, 故设计同位素标记实验。以普通NaNO2为原料, 可以得到R1, P1, 为方便分析, 将5个N原子分别编号为N (1), N (2), N (3), N (4), N (5), 后续的分析均使用此编号; 使用15N标记的NaNO2作为原料, 则可以得到三种15N标记的3, 5-二甲基-4-羟基苯基五唑, 分别为R2, R3, R4;分别以R2, R3, R4为原料, 制备对应的五唑, 编号为P2, P3, P4, 如图 3所示。
|
图 3 不同位置15N标记的3, 5-二甲基-4-羟基苯基五唑和五唑负离子 Fig.3 3, 5-dimethyl-4-hydroxy phenyl-pentazole and pentazole anion with 15N in different position |
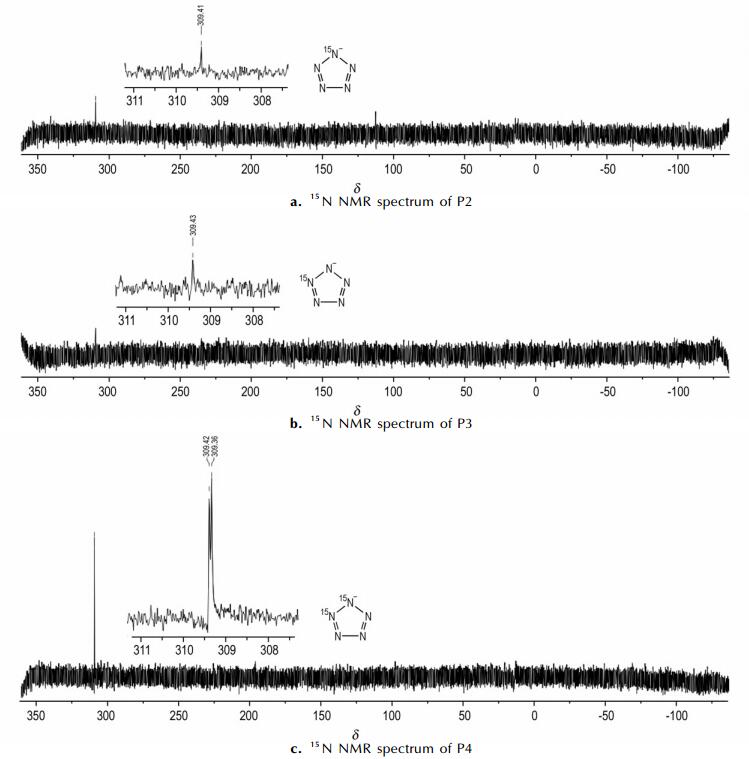
以氘代甲醇 (MeOH-d4) 为溶剂, 对P2, P3, P4进行15N NMR测试, 结果见图 4。P2, P3上都只有一个15N原子, 其谱图均是单峰, 化学位移基本相同, 都处于309.4; P4的图谱为二重峰, 化学位移为309.4, 证明N (1), N (2) 化学环境相同。芳基五唑上有3种环境的N原子, 其化学位移分别在5, -27和-80附近, 芳基五唑的副反应分解产物芳基叠氮上的2号位N原子化学位移在-150附近[24], 故排除干扰。由于3, 5-二甲基-4-羟基苯基五唑分子对称轴经过N (1), N (2) 和N (5) 应该具有相同的化学环境。所以在N5-中, N (1), N (2), N (5) 这3个原子等价, N5-中至少含有2个C5轴, 所以N (3), N (4) 与N (5), N (2) 均等价。这证明五唑环上5个N原子具有相同的化学环境, 分子高度对称, 从数学角度分析, 应呈平面构型, 是其具有芳香性的有力证据。
|
图 4 不同位置15N标记五唑的15N NMR图谱 Fig.4 15N NMR spectrum of pentazole with 15N in different position |
(1) 以对氨基苯磺酸和2, 6-二甲基苯酚为起始原料, 依次合成3, 5-二甲基-4-羟基苯胺盐酸盐 (收率75%), 3, 5-二甲基-4-羟基苯基五唑 (收率66.7%), 操作简单, 危险性较低。
(2) 以亚铁盐为还原剂, 间氯过氧苯甲酸为氧化剂, 可以切断3, 5-二甲基-4-羟基苯基五唑中的C—N键, 得到五唑负离子 (m/z=70, 141; 10 eV)。五唑负离子在甲醇溶液中稳定, 但由于提纯难度较大, 尚未得到其固体, 未能测定其热稳定性等性质。
(3) 五唑负离子的15N NMR图谱证明, 其环上5个N原子的化学环境相同 (δN=309.4), 并且在同一平面上, 认为五唑负离子极有可能具有芳香性。
| [1] |
李玉川, 庞思平. 全氮型超高能含能材料研究进展[J].
火炸药药学报, 2012, 35(1): 1-7. LI Yu-chuan, PANG Si-ping. Progress of all-nitrogen ultrahigh-energetic macterials[J]. Chinese Journal of Explosives & Propellants, 2012, 35(1): 1-7. |
| [2] | Kim F Ferris, Rodney J Bartlett. Hydrogen pentazole: does it exist?[J]. Journal of the American Chemical Society, 1992, 114(21): 8302-8303. DOI:10.1021/ja00047a058 |
| [3] | Burke L A, Butler R N, Stephens J C. Theoretical characterization of pentazole anion with metal counter ions. Calculated and experimental 15N shifts of aryldiazonium, -azide and-pentazole systems[J]. Journal of the Chemical Society, 2001, 9: 1679-1684. |
| [4] | Nguyen M T, McGinn M A, Hegarty A F, et al. Can the pentazole anion (N5-) be isolated and/or trapped in metal complexes?[J]. Polyhedron, 1985, 4(10): 1721-1726. DOI:10.1016/S0277-5387(00)84166-2 |
| [5] | Straka M, PyykköP. One metal and forty nitrogens. Ab initio predictions for possible new high-energy pentazolides[J]. Inorganic Chemistry, 2003, 42(25): 8241-8249. DOI:10.1021/ic034702b |
| [6] | Müller R, Wallis J D, von Philipsborn W. Direct structural proof for the pentazole ring system in solution by 15N NMR spectroscopy[J]. Angewandte Chemie International Edition in English, 1985, 24(6): 513-515. |
| [7] | Wallis J D, Dunitz J D. An all-nitrogen aromatic ring system: structural study of 4-dimethyl-aminophenylpentazole[J]. Journal of the Chemical Society, Chemical Communications, 1983(16): 910-911. DOI:10.1039/c39830000910 |
| [8] | Ugi I, Huisgen R., Pentazole Ⅱ. Die zerfallsgeschwindigkeit der aryl-pentazole[J]. Chemische Berichte, 1958, 91(3): 531-537. DOI:10.1002/(ISSN)1099-0682 |
| [9] | Ugi I, Perlinger H, Behringer L., Pentazole Ⅲ. Kristallisierte aryl-pentazole[J]. Chemische Berichte, 1958, 91(11): 2324-2329. DOI:10.1002/(ISSN)1099-0682 |
| [10] | Huisgen R, Ugi I., Mittlere Ringe Ⅺ. Polycyclische systeme mit heteroatomen[J]. European Journal of Organic Chemistry, 1957, 610(1): 57-66. |
| [11] | Benin V, Kaszynski P, Radziszewski G. Arylpentazoles revisited: experimental and theoretical studies of 4-hydroxyphenylpentazole and 4-oxophenylpentazole anion[J]. The Journal of organic Chemistry, 2002, 67(4): 1354-1358. DOI:10.1021/jo0110754 |
| [12] | Östmark H, Wallin S, Brinck T, et al. Detection of pentazolate anion (cyclo-N5-) fromlaser ionization and decomposition of solidp-dimethylaminophenylpentazole[J]. Chemical Physics Letters, 2003, 379(6): 539-546. |
| [13] | Butler R N, Hanniffy J M, Stephens J C, et al. A ceric ammonium nitrate N-dearylation of N-p-anisylazoles applied to pyrazole, triazole, tetrazole, and pentazole rings: release of parent azoles. Generation of unstable pentazole, HN5/N5-, in solution[J]. The Journal of Organic Chemistry, 2008, 73(4): 1354-1364. DOI:10.1021/jo702423z |
| [14] |
毕福强, 许诚, 樊学忠, 等. 对叔丁基苯基五唑的合成及分解动力学[J].
火炸药学报, 2012(2): 002 BI Fu-qiang, XU Cheng, FAN Xue-zhong, et al. Synthesis and decomposition kinetics of p-tert-butylphenylpentazole[J]. Chinese Journal of Explosives & Propellants, 2012(2): 002 |
| [15] |
沈梦楠, 申程, 王鹏程, 等. 多供电子基苯胺类化合物的合成及其芳基五唑衍生物稳定性[J].
精细化工, 2014, 31(12): 1531-1536. SHEN Meng-nan, SHEN Cheng, WANG Peng-cheng, et al. Synthesis of anilines with multi-electron-donating groups and the stability of arylpentazole derivatives[J]. Fine Chemicals, 2014, 31(12): 1531-1536. |
| [16] | Carlqvist P, Östmark H, Brinck T. The stability of arylpentazoles[J]. The Journal of Physical Chemistry A, 2004, 108(36): 7463-7467. DOI:10.1021/jp0484480 |
| [17] | Lein M, Frunzke J, Timoshkin A, et al. Iron Bispentazole Fe (η5-N5)2, a theoretically predicted high-energy compound: Structure, bonding analysis, metal-ligand bond strength and a comparison with the isoelectronic ferrocene[J]. Chemistry-A European Journal, 2001, 7(19): 4155-4163. DOI:10.1002/(ISSN)1521-3765 |
| [18] | Frunzke J, Lein M, Frenking G. Structures, metal-ligand bond strength, and bonding analysis of ferrocene derivatives with group-15 heteroligands Fe (η5-E5)2 and FeCp (η5-E5)(E=N, P, As, Sb). A theoretical study[J]. Organometallics, 2002, 21(16): 3351-3359. DOI:10.1021/om020397a |
| [19] | Vij A, Pavlovich J G, Wilson W W, et al. Experimental detection of the pentaazacyclopentadienide (pentazolate) anion, cyclo-N5[J]. Angewandte Chemie, 2002, 114(16): 3177-3180. DOI:10.1002/1521-3757(20020816)114:16<3177::AID-ANGE3177>3.0.CO;2-I |
| [20] | Butler R N, Stephens J C, Burke L A. First generation of pentazole (HN5, pentazolic acid), the final azole, and a zinc pentazolate salt in solution: a new N-dearylation of 1-(p-methoxyphenyl) pyrazoles, a 2-(p-methoxyphenyl) tetrazole and application of the methodology to 1-(p-methoxyphenyl) pentazole[J]. Chemical Communications, 2003(8): 1016-1017. DOI:10.1039/b301491f |
| [21] | Bazanov B, Geiger U, Carmieli R, et al. Detection of cyclo-N5- in THF solution[J]. Angewandte Chemie, 2016, 128: 1-4. DOI:10.1002/ange.201510990 |
| [22] |
章冲, 胡炳成, 刘成, 等. 对羟基苯基五唑及其衍生物的合成与稳定性[J].
含能材料, 2016, 24(8): 769-773. ZHANG Chong, HU Bing-cheng, LIU Cheng, et al. Synthesis and stability of p-hydroxylphenylpentazole and its derivatives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2016, 24(8): 769-773. |
| [23] | Guisado-Barrios G, Zhang Y, Harkins A M, et al. Low temperature reaction of[Fe (TPA)(CH3CN)2]2+ with excess 3-chloroperoxybenzoic acid in semi-frozen acetonitrile; EPR detection of an acylperoxo iron (Ⅲ) adduct[J]. Inorganic Chemistry Communications, 2012, 20: 81-85. DOI:10.1016/j.inoche.2012.02.022 |
| [24] |
徐敏, 毕福强, 张皋, 等. 对二甲氨基苯基五唑和对羟基苯基五唑的低温合成与NMR表征[J].
含能材料, 2012, 20(5): 596-600. XU Min, BI Fu-qiang, ZHANG Gao, et al. Synthesis and NMR characterization of p-dimethylaminophenylpentazole and p-hydroxyphenylpentazole at low temperature[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2012, 20(5): 596-600. |

3, 5-Dimethyl-4-hydroxy phenyl-pentazolewas synthesized from 3, 5-dimethyl-4-hydroxy aniline hydrochloride. Transition metal salts and peroxides were used to break C—N bond in 3, 5-dimethyl-4-hydroxy phenyl-pentazole. The degree of reaction was detected by mass spectrometry. The aromaticity of the target product was studied by isotope labeling experiments.




