2. 氟氮化工资源高效开发与利用重点实验室, 陕西 西安 710065
2. State Key Laboratory of Fluorine & Nitrogen Chemicals, Xi′an 710065, China
唑类化合物由于其结构的致密性、电子高度离域的大π键以及共轭芳香性[1]等特点, 使其在医药[2-7]、农药[8-13]光电材料[14-15]以及含能材料领域具有广泛的应用。尤其是三唑和四唑类化合物, 由于具有含氮量高, 结构稳定性好, 具有较高的热分解温度、高焓值等特性, 使其在含能材料领域备受关注[16-29]。2008年, Mircea Dinca等[30]报道了一种综合了三唑和四唑结构的化合物4, 5-二 (1H-四唑-5-基)-1H-咪唑 (H3BTI), 氮含量为68.61%, 预测其在低特征信号推进剂或气体发生剂等领域具有潜在的应用前景。2009年, Min Guo[31]报道了H3BTI的晶体, 发现其晶体结构中具有丰富的氢键作用, 预示着该化合物具有较好的热稳定性。2012年, 毕福强[32]等实验研究了4, 5-二 (1H-四唑-5-基)-1H-咪唑的热分解行为, 证实该化合物具有较高的热稳定性 (热分解温度324.6 ℃), 表明该化合物具有较好的结构稳定性, 具有潜在研究价值。
在此基础上, 本课题组将三氟甲基引入4, 5-二 (1H-四唑-5-基)-1H-咪唑化合物, 自主设计了新型含能化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑), 以期得到一种新的密度更高, 氧平衡得到改善, 且可增加化合物比冲等性能含能材料。通过设计以二氨基马来腈为初始原料, 经过与三氟乙酸酐缩合、环化, 与叠氮化纳再次缩合的两步法合成路线, 首次合成了具有咪唑、四唑与三氟甲基结构的新型含能化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑)。并且利用该化合物的酸性, 设计、合成了2种含能离子盐5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的羟胺盐与胍盐, 采用红外光谱、核磁共振和元素分析等进行了结构表征。
2 实验部分 2.1 主要仪器与试剂二氨基马来腈, 济南泛诺化工有限公司; 三氟乙酸酐, 国药集团化学试剂有限公司; 乙腈, 天津市福晨化学试剂厂; 二氧六环, 天津市福晨化学试剂厂; 无水乙醚, 西安化学试剂厂; 叠氮化纳, 西安化学试剂厂; 氯化锌, 国药集团化学试剂有限公司; 乙酸乙酯, 西安化学试剂厂; 均为分析纯。
NEXUS 870型傅里叶变换红外光谱仪, 美国THERMO NICOLET公司; AV 500型 (500 MHz) 超导核磁共振仪, 瑞士BRUKER公司; VARIO-EL-3型元素分析仪, 德国EXEMENTAR公司; TG-DSC热分析仪/FR-STA-200同步热分析仪, 上海发瑞仪器科技有限公司。
2.2 合成步骤合成路线见Scheme 1。
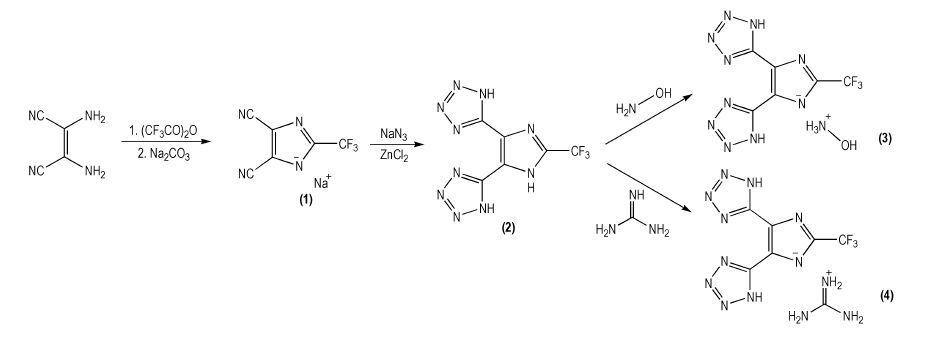
|
Scheme1 The synthesis scheme of 5, 5′-(2-(trifluoromethyl)-1H-imidazole-4, 5-diyl) bis (1H-tetrazole) and its energetic ionic salts |
搅拌下, 将5.4 g (0.05 mol) 二氨基马来腈加入52 mL二氧六环中, 充分搅拌后, 将8.4 mL (0.06 mol) 三氟乙酸酐加入, 通氮气保护, 加热回流3 h, 蒸出溶剂得褐色固体, 乙醚40 mL溶解, 加入10.84 g (0.102 mol) Na2CO3的70 mL水溶液, 充分搅拌, 分离水层, 用20 mL×2乙醚洗涤水层后, 加入活性炭于50 ℃搅拌1 h, 过滤, 减压蒸馏除去水, 将固体溶于250 mL乙腈, 过滤, 除去不溶物, 减压蒸馏除去乙腈得产物2-三氟甲基-4, 5-二氰基咪唑钠7.38 g, 收率71.0%。IR (KBr, ν/cm-1): 3557, 2243, 1678, 1639, 1501, 1463, 1425, 1317, 1307, 1189, 1137, 998, 525; 13C NMR (DMSO-d6), δ: 115.50(s, CN), 119.27(d, C=C), 117.38~123.80 (q, CF3), 147.45~148.33(q, N—C—N); 19F NMR (DMSO-d6), δ: 62.39;元素分析C6F3N4Na (%):实测值 (计算值) C 34.81(34.63), N 26.72(26.93)。
2.2.2 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑)(2) 的合成搅拌下, 将2.08 g (0.01 mol)2-三氟甲基-4, 5-二氰基咪唑钠加入到40 mL的水中, 搅拌溶解后, 加入1.56 g (0.024 mol) NaN3, 2.72 g (0.02 mol) ZnCl2加热搅拌回流4 h后, 冷却至室温, 加入30 mL乙酸乙酯, 搅拌下, 调节pH=2.0, 搅拌至溶液澄清, 分离有机层, 减压蒸馏除去溶剂得5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 2.35 g, 收率86.3%。IR (KBr, ν/ cm-1): 3452, 3057, 1678, 1588, 1454, 1392, 1349, 1264, 1183, 1071, 849; 1H NMR (DMSO-d6, 500MHz), δ: 8.29 (s, 1H, NH (imidazole)), 8.00(s, 2H, NH (tetrazole)); 13C NMR (DMSO-d6, 125MHz), δ: 172.5(s, N=C—N), 148.8(s, C—CF3), 139.4-138.5(q, C=C—N); 124.0(t, C=C—NH), 122.0-115.5(q, CF3); 19F NMR (DMSO-d6, 500 MHz), δ: 162.24(CF3); 元素分析C6H3F3N10(%):实测值 (计算值) C 26.71(26.48), H 1.13(1.11), N 51.16(51.47)。
2.2.3 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的羟胺盐 (3) 的合成将0.544 g (0.002 mol) 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 溶于乙酸乙酯, 加入0.002 mol羟胺的乙酸乙酯溶液, 搅拌10 min, 过滤, 室温干燥, 得白色固体5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的羟胺盐0.57 g, 收率92.8%。IR (KBr, ν/cm-1): 3384, 3227, 2775, 1641, 1557, 1483, 1416, 1398, 1287, 1182, 1117, 1070, 1020, 891;元素分析C6H6F3N11O (%):实测值 (计算值) C 23.74(23.61), H 2.00(1.98), N 50.26(50.49)。
2.2.4 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的胍盐 (4) 的合成将0.544 g (0.022 mol) 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 溶于乙酸乙酯, 加入0.02 mol胍的乙醇溶液, 搅拌10 min, 过滤, 室温干燥, 得白色固体5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的胍盐0.63 g, 收率95.2%。IR (KBr, ν/cm-1): 3397, 1666, 1580, 1404, 1339, 1271, 1186, 1118, 1010, 834;元素分析C7H8F3N13(%):实测值 (计算值) C 25.61(25.38), N 54.76(54.97), H 2.46(2.43)。
3 结果与讨论 3.1 2-三氟甲基-4, 5-二氰基咪唑环化的可能反应机理探讨探讨了二氨基马来腈与三氟乙酸酐缩合环化形成咪唑环结构的反应机理, 其微观反应过程如Scheme 2。
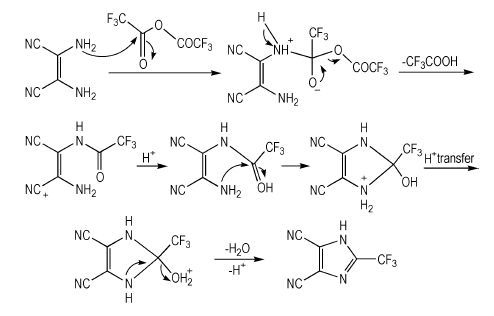
|
Scheme2 The cyclization reaction mechanism of forming 2-(trifluoromethyl)-1H-imidazole-4, 5-dicarbonitrile |
反应首先以二氨基马来腈的—NH2上的孤对电子进攻三氟乙酸酐上一个羰基C原子开始, 羰基—C=O双键的π电子向羰基O原子迁移, 从而形成N—C键和O-; 然后O-上的电子向C—O键迁移, 另外一个C—O键上的σ电子向O原子迁移, 从而在形成—C=O键的同时C—O键断裂形成CF3COO-, 与此同时, NH2+上的一个N—H键的σ电子向N迁移, 使N原子上再次形成孤对电子, 并且N—H键断裂形成H+, 与CF3COO-结合生成一分子CF3COOH, 分子母体变成2-乙酰胺基马来腈; 接着在反应体系中H+的作用下, 2-乙酰胺基马来腈C=O的O原子结合一个H+, 同时另外一个—NH2上的孤对电子进攻—C=O的C原子, —C=O的π电子向OH+转移, 在生成N—C键的同时生成—OH; 接着NH2+上一个N—H键的σ电子向N迁移, 使N原子上再次形成孤对电子, 并且N—H键断裂形成H+, H+进行迁移生成—OH2+; 最后NH上的一个孤对电子向N—C键迁移, 形成π键, C—OH2+上的σ电子向O原子上迁移, C—O键断裂, 生成一个分子H2O脱离母体结构, 母体结构最终生成2-三氟甲基-4, 5-二氰基咪唑。
3.2 四唑环化反应条件 3.2.1 溶剂的影响在合成5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 过程中, 尝试了甲醇、异丙醇、叔丁醇以及水等多种溶剂, 考察在反应条件为: 2-三氟甲基-4, 5-二氰基咪唑钠和NaN3分别为0.01 mol和0.024 mol, 催化剂为ZnCl2为0.02 mol, 反应时间为4 h, 溶剂量为40 mL时在上述各溶剂中反应的产物收率, 结果见表 1。
| 表 1 溶剂对产物收率的影响 Tab.1 Effect of solvents on the yield of product |
从表 1可看出, 在这几种溶剂中, 反应均可进行, 但在水中收率最高, 可达到86.3%, 叔丁醇和异丙醇次之, 而在甲醇中收率最低。由于反应均是在回流状态下进行, 而这些溶剂的沸点引起反应的反应温度不同, 因此反应温度高有利于反应进行。
3.2.2 反应时间的影响对合成5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 过程中反应时间进行优化, 条件为:三氟甲基-4, 5-二氰基咪唑钠和NaN3分别为0.01 mol和0.024 mol, 催化剂为ZnCl2为0.02 mol, 以水为反应溶剂, 溶剂量为40 mL, 考察不同反应时间时的产物收率, 结果见表 2。
| 表 2 反应时间对产品收率的影响 Tab.2 Effect of reaction time on the yield of product |
从表 1可以看出, 从刚开始反应1 h起, 产物收率随着反应时间的延长而增大, 到4 h时, 收率达到最大, 此后收率基本趋于稳定, 且呈缓慢下降趋势。说明反应刚开始时, 反应迅速发生, 产物快速生成, 但随着反应时间的延长, 反应物浓度降低, 体系的反应逐渐接近终了, 产物收率增加缓慢, 在4 h时, 反应已基本结束, 而后再随着反应时间的延长, 产物在反应体系里面长时间加热会有少量分解。
3.2.3 物料比的影响在反应条件为:三氟甲基-4, 5-二氰基咪唑钠为1 mol, 催化剂为ZnCl2为0.02 mol, 以水为反应溶剂, 溶剂量为40 mL反应时间为4 h时, 对物料比 (n(三氟甲基-4, 5-二氰基咪唑钠):n(NaN3)) 进行优化, 结果见表 3。
| 表 3 反应物料比对产物收率的影响 Tab.3 Effect of molar ratio of reactants on the yield of product |
从表 3可看出, 产物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的收率随着的物料比的增大而增加, 从起初反应物料比为1:2.0时收率60.8%, 物料比为1:2.4时产物收率迅速增加, 达到86.3%, 随后物料比再增加, 收率基本上已不再增加。所以n(三氟甲基-4, 5-二氰基咪唑钠):n(NaN3)=1:2.4可作为最佳物料比。
3.3 性能计算应用Gaussian 09软件在B3lyp/6-311+g (d, p) 水平下, 对化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 分子结构进行几何全优化, 得到了5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 分子的最低能垒构型。在此基础上, 采用相同方法和基组, 计算得到了化合物的密度和生成焓, 然后采用Kamlet方法计算获得了化合物的爆速和爆压, 结果见表 4。
| 表 4 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的爆轰性能 Tab.4 Detonation performances of 5, 5′-(2-(trifluoromethyl)-1H-imidazole-4, 5-diyl) bis (1H-tetrazole) |
从表 4可以看出, 化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的密度较低, 只有1.80 g·cm-3, 所以尽管其氮含量较高 (51.47%), 而且在引进三氟甲基后相对于化合物4, 5-二 (1H-四唑-5-基)-1H-咪唑氧平衡也有所改善, 但是从整体来看, 其氧平衡太低, 因此导致其生成焓较低, 进而影响到爆速和爆压, 可以说仅从单质炸药的角度来看其不是一个好的化合物, 但是由于其氮含量较高, 因此在低特征信号推进剂或气体发生剂等领域可能会有潜在的应用前景。
3.4 5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 及其盐的热分解性能采用DSC-TG方法对化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的热性质进行了研究, 结果如图 1所示。
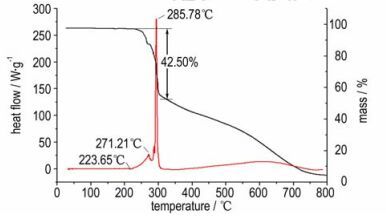
|
图 1 化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的DSC-TG曲线 Fig.1 DSC-TG curves of 5, 5′-(2-(trifluoromethyl)-1H-imidazole-4, 5-diyl) bis (1H-tetrazole) |
从图 1可以看出, 化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 结构比较稳定, 25 ℃开始加热到223.65 ℃时化合物开始分解, 其DSC曲线经历了第一个极小的热分解峰271.21 ℃, 然后紧接着快速分解形成一个较尖的峰, 在285.78 ℃时分解速率达到最大; 从TG曲线上也可看到, 从223.65 ℃开始化合物质量损失迅速, 经历一个短暂的质量损失台阶后, 紧接着进行第二个阶段的质量损失过程, 这两个阶段化合物共损失质量42.50%, 然后化合物质量损失较缓, 一直到725 ℃左右化合物质量完全损失。从DSC曲线上可以看到, 在经过第二个热分解峰后, 热分解基本结束。总体来说化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 结构较为稳定, 温度低于223.65 ℃, 化合物不发生变化。
4 结论(1) 以二氨基马来腈为原料, 经过与三氟乙酸酐缩合、环化, 与叠氮化纳再次缩合环化, 合成了新型含能化合物5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑), 并利用三唑的酸性, 制备得到了其羟胺盐和胍盐, 利用红外、核磁、元素分析等对目标化合物及中间体进行了表征。
(2) 探讨了合成5, 5′-(2-三氟甲基)-咪唑-4, 5-二 (1H-四唑) 的影响因素, 确定最佳反应条件为:以水为反应介质, 在物料比n(2-三氟甲基-4, 5-二氰基咪唑):n(NaN3)=1:2.4时, 反应温度98 ℃, 反应4 h。收率最高可达86.3%。
(3) DSC-TG热分析结果表明, 目标化合物结构比较稳定, 在加热至温度达到223.65 ℃前不发生任何变化, 分解经历两个主要的放热和热失重阶段, 最大放热峰为285.78 ℃。
| [1] |
李加荣. 唑系含能化合物的特征[J].
火炸药学报, 1998(1): 56-57. LI Jia-rong. Properties of aoles energetic cmpounds[J]. Chinese Journal of Explosives and Propellants, 1998(1): 56-57. |
| [2] |
高学军, 李庆章. 广谱抗蠕虫药物奥芬达唑研究进展[J].
动物医学进展, 2004, 25(3): 53-55. GAO Xue-jun, LI Qing-zhang. The progress of study on oxfendazole[J]. Progress in Veterinary Medicine, 2004, 25(3): 53-55. |
| [3] |
张艳, 刘东, 戴朝峰. 含有1H-1, 2, 4-三唑咪唑[2, 1-b]-1, 3, 4-噻二唑、S-三唑[3, 4-b]-1, 3, 4-噻二唑衍生物的合成及生物活性[J].
高等学校化学学报, 2002, 23(10): 1882-1886. ZHANG Yan, LIU Dong, DAI Chao-feng. Synthesis and biological of imidazolo of imidazolo[2, 1-b]-1, 3, 4-thiadiazole, S-triazole[3, 4-b]-1, 3, 4-thiadiazole derivative bearing 1H-1, 2, 4-triazole[J]. Chemical Journal of Chinese University, 2002, 23(10): 1882-1886. DOI:10.3321/j.issn:0251-0790.2002.10.010 |
| [4] |
李英俊, 刘丽军, 靳焜. 新型3, 6-二取代-1, 2, 4-三唑[3, 4-b]-1, 3, 4-噻二唑衍生物的合成、表征及生物活性[J].
化学学报, 2010, 68(16): 1577-1584. LI Ying-jun, LIU Li-jun, JIN Kun. Synthesis and biological activities of novel 3, 6-disubstituted 1, 2, 4-triazolo[3, 4-b]-1, 3, 4-thiadiazoles[J]. Acta Chimica Sinica, 2010, 68(16): 1577-1584. |
| [5] |
孙莉, 裴文. 1-β-D-呋喃核糖基-1, 2, 4-三唑-3-酰胺铂 (Ⅱ) 配合物的合成[J].
化学学报, 2002, 25(11): 1462-1464. SUN Li, PEI Wen. Synthesis of platinum complexes with 1-β-D-ribofuranosyl-1, 2, 4-triazole-3-carboxamide[J]. Chinese Journal of Organic Chemistry, 2002, 25(11): 1462-1464. |
| [6] |
杨海葵, 许万福, 段安娜. 含1, 2, 4-三唑环的亚胺及酰亚胺类化合物的合成及生物活性[J].
高等学校化学学报, 2014, 35(3): 555-563. YANG Hai-kui, XU Wan-fu, DUAN An-na. Synthesis and biological activity of novel imine and imide derivatives bearing 1, 2, 4-trazole moiety[J]. Chemical Journal of Chinese University, 2014, 35(3): 555-563. DOI:10.7503/cjcu20130543 |
| [7] |
程宇, 王辉, DineshAddla. 唑类超分子药物研究与应用[J].
有机化学, 2016, 36(1): 1-42. CHENG Yu, WANG Hui, Dinesh Addla. Current researches and applications of azole-based supermolecules as medicinal agents[J]. Chinese Journal of Organic Chemistry, 2016, 36(1): 1-42. |
| [8] |
丁明武, 宿亚丽, 刘小鹏. 1-(2-咪唑啉酮基)-1H-1, 2, 4-三唑衍生物的合成与杀菌活性[J].
化学学报, 2002, 60(10): 1893-1898. DING Ming-wu, SU Ya-li, LIU Xiao-peng. Synthesis and fungicidal activities of 1-(2-imidazolony)-1H-1, 2, 4-triazoles[J]. Acta Chimica Sinica, 2002, 60(10): 1893-1898. DOI:10.3321/j.issn:0567-7351.2002.10.028 |
| [9] |
李黔柱, 宋宝安, 蔡学建. N-(1, 2, 4-三唑) 含氟肉桂醛亚胺的合成及生物活性[J].
有机化学, 2010, 30(4): 569-575. LI Qian-zhu, SONG Bao-an, CAI Xue-jian. Synthesis and bioactivities of novel N-1, 2, 4-Triazole Moieties Imines Containing Fluorocinnamylidene[J]. Chinese Journal of Organic Chemistry, 2010, 30(4): 569-575. |
| [10] |
金云哲, 关丽萍, 赵立明. 7-取代苯氧基-4, 5-二氢-1, 2, 4-三唑并[4, 3-a]喹啉和喹啉-1(2H)-酮衍生物的合成及抗惊厥活性[J].
有机化学, 2007, 27(12): 1567-1572. JIN Yun-zhe, GUAN Li-ping, ZHAO Li-ming. Synthesis and anticonvulsant activity study of 7-substituted phenoxyl-4, 5-dihydro[1, 2, 4]triazolo[4, 3-a]quinolines and quinoline-1(2H)-one[J]. Chinese Journal of Organic Chemistry, 2007, 27(12): 1567-1572. |
| [11] |
张力学, 张安将, 熊静. 3-苄基-6-(1-氨基烃基)-1, 2, 4-三唑并[3, 4-b]-1, 3, 4-噻二唑的合成与波谱表征[J].
有机化学, 2002, 22(12): 1022-1025. ZHANG Li-xue, ZHANG An-jiang, XIONG Jing. Synthesis and spectral characterization of 3-benzyl-6-(1-aminoalkyl)-1, 2, 4-triazolo[3, 4-b]-1, 3, 4-thiadiazoles[J]. Chinese Journal of Organic Chemistry, 2002, 22(12): 1022-1025. DOI:10.3321/j.issn:0253-2786.2002.12.015 |
| [12] |
汪焱钢, 赵新筠, 龚银香. N-5-(1H-1, 2, 4-三唑基)-N′-芳甲酰基脲的合成与生物活性[J].
有机化学, 2003, 23(10): 1165-1168. WANG Yan-gang, ZHAO Xin-jun, GONG Yin-xiang. Synthesis and biological activity of N-5-(1H-1, 2, 4-triazolyl)-N′-arylformyl Urea[J]. Chinese Journal of Organic Chemistry, 2003, 23(10): 1165-1168. DOI:10.3321/j.issn:0253-2786.2003.10.024 |
| [13] |
许诚, 丁秀丽, 李宗英, 等. 杀菌剂氰霜唑的合成与表征[J].
应用化工, 2009, 38(7): 1076-1077. XU Cheng, DING Xiu-li, LI Zong-ying, et al. Synthesis and characterization of fungicide cyazofamid[J]. Applied Chemical Industry, 2009, 38(7): 1076-1077. |
| [14] |
冯猛. 吡唑基和1, 2, 4-三唑基稀土配合物的合成与表征[D]. 南京航空航天大学, 2012, 3.
FENG Meng. Snthysis and characterization of rare-earth pyrazolato and 1, 2, 4-triazolato complexes[D]. Nanjing University of Aeronautica Astronautics, 2012, 3. |
| [15] |
汪智娜. 1, 2, 4-三唑类化合物合成机理的理论研究[D]. 济南: 济南大学, 2013.
WANG Zhi-na. Theoretical study on the reaction mechanism of the synthesis of triazoles[D]. Jinan: University of Jinan, 2013. |
| [16] |
李祥志, 王伯周, 李亚南. 5H-[1, 2, 3]-三唑并[4, 5-c]呋咱及其含能衍生物的合成[J].
含能材料, 2013, 21(6): 717-720. LI Xiang-zhi, WANG Bo-zhou, LI Ya-nan. Synthesis of 5H-[1, 2, 3]-triazolo[4, 5-c][1, 2, 5]oxdiazole and its energy derivatives[J]. Chinese Journal of Energy Materials (Hanneng Cailiao), 2013, 21(6): 717-720. |
| [17] |
肖啸, 葛忠学, 汪伟. 3-叠氮基-1, 2, 4-三唑及其衍生物的研究进展[J].
含能材料, 2014, 22(1): 100-107. XIAO Xiao, GE Zhong-xue, WANG Wei. Progress of 3-azido-1, 2, 4-triazole and its derivatives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(1): 100-107. |
| [18] |
贺云, 范桂娟, 张光全. 1-氨基-3, 5-二硝基-1, 2, 4-三唑的合成工艺改进及性能[J].
含能材料, 2014, 22(2): 182-185. HE Yun, FAN Gui-juan, ZHUANG Guang-quan. Synthesis improvement and properties of 1-amino-3, 5-dinitro-1, 2, 4-triazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(2): 182-185. |
| [19] |
黄新萍, 常佩, 王伯周. 3-硝基-1, 2, 4-三唑-5-酮脒基脲盐的合成与表征[J].
含能材料, 2014, 22(2): 192-196. HUANG Xin-ping, CHANG Pei, WANG Bo-zhou. Synthesis and characterization of guanylurea salt of 3-nitro-1, 2, 4-triazol-5-one[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(2): 192-196. |
| [20] | ZHOU Cheng, WANG Bo-zhou, HUO Huan. A novel energrtic material hydrazinium 3, 5-dinitoamino-1, 2, 4-triazole: synthesis and properties[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao),, 2014, 22(4): 576-578. |
| [21] |
李永祥, 曹端林, 王建龙. 三种新型低熔点炸药的合成及表征[J].
兵工学报, 2013, 34(1): 36-40. LI Yong-xiang, CAO Duan-lin, WANG Jian-long. Synthesis and characterization studies on novel three explosives with low melting points[J]. Acta Armamentarii, 2013, 34(1): 36-40. |
| [22] |
姜冲. 四唑和三唑化合物的合成及表征[D]. 青岛: 青岛科技大学, 2012. 6.
JIANG Chong. Synthesis and characterization of tetrazole and triazole compounds[D]. Qingdao: Qingdao University of Technology and Science, 2012.6. |
| [23] |
代玲玲, 崔胜峰, GuriL V Damu. 四唑类化合物的合成及应用研究新进展[J].
有机化学, 2013, 33(2): 224-244. DAI Ling-ling, CUI Sheng-feng, Guri L V Damu. Recent advances in the synthesis and application of tetrazoles[J]. Chinese Journal of Organic Chemistry, 2013, 33(2): 224-244. |
| [24] |
石强, 唐望, 王民昌. 一种氨基四唑的硝基咪唑衍生物的合成[J].
化工新材料, 2013, 41(6): 61-63. SHI Qiang, TANG Wang, WANG Min-chang. Synthesis of a nitroimidazole-aminotetrazole derivative[J]. New Chemical Materials, 2013, 41(6): 61-63. |
| [25] |
李加荣. 3-硝基-1, 2, 4-三唑酮-5盐的研究概述[J].
含能材料, 1999, 7(1): 11-15. LI Jia-rong. A review on 3-nitro-1, 2, 4-triazole-5-one salts[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 1999, 7(1): 11-15. |
| [26] |
杨国臣, 刘慧君, 曹端林. 4, 5-二硝基咪唑的制备[J].
含能材料, 2006, 14(5): 349-351. YANG Guo-chen, LIU Hui-jun, CAO Duan-lin. Preparation of 4, 5-dinitroimidazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2006, 14(5): 349-351. |
| [27] |
杨威, 姬月萍. 多硝基咪唑及其衍生物的研究进展[J].
火炸药学报, 2008(5): 46-50. YANG Wei, JI Yue-ping. Progress in polynitroimidazoles and derivatives[J]. Chinese Joumal of Explosives and Propellants, 2008(5): 46-50. |
| [28] |
杨利, 高福磊, 凡庆涛. 咪唑类含能化合物的研究进展[J].
含能材料, 2009, 17(3): 374-379. YANG Li, GAO Fu-lei, FAN Qing-tao. Progress in imidazolium-based energetic compounds[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2009, 17(3): 374-379. |
| [29] |
杨威, 王伯周, 姬月萍. 1-甲基-2, 4, 5-三硝基咪唑 (MTNI) 的热分解动力学及机理研究[J].
含能材料, 2012, 20(2): 176-179. YANG Wei, WANG Bo-zhou, JI Yue-ping. Thermal decomposition kinetics and mechanism of 1-methyl-2, 4, 5-trinitroimidazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2012, 20(2): 176-179. |
| [30] | Dinca M, Harris T D, Iavarone A T. Synthesis andcharacterization of the cubic coordination cluster[Co6ⅢCo2Ⅱ(IBT)12] 14-(H3IBT=4, 5-bis (tetrazol-5-yl) imidazole)[J]. Journal of Molecular Structure, 2008, 890(3): 139-143. |
| [31] | Guo M. 4, 5-Bis (1H-tetrazol-5-yl)-1H-imidazole monohydrate[J]. Acta Crystallographica, Section E, 2009, 65(6): o1403 DOI:10.1107/S1600536809017899 |
| [32] |
毕福强, 李吉祯, 许诚. 4, 5-二 (1H-四唑-5-基)-1H-咪唑的合成及热性能[J].
含能材料, 2013, 21(4): 443-448. BI Fu-qiang, LI Ji-zhen, XU Cheng. Synthesis and thermal decomposition properties of 4, 5-bis (1H-tetrazol-5-yl)-1H-imidazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2013, 21(4): 443-448. |




