2. 中国航天科技集团, 陕西 西安 710025
2. Institute of Aerospace Science and Technology Corporation, Xi′an 710025, China
铝粉具有密度高、耗氧低、燃烧焓高的能量特点, 且来源广, 成本低, 产物无毒无害, 因此被作为能量添加剂广泛应用于高性能固体推进剂[1-3]、火炸药[4]等领域中。铝的活性较高, 铝粉在室温下即可发生氧化反应, 其被氧化后颗粒被一层无定型氧化铝薄层包裹[5-6], 这层氧化膜可阻碍内部Al的进一步氧化, 并影响铝粉的点火, 促进氧化膜的破裂将会缩短铝颗粒的点火延迟时间, 改善铝粉燃烧特性[7]。大量研究表明, 调节铝粉粒度, 添加纳米铝粉[8], 对铝粉颗粒进行表面处理(如包覆等)[9], 采用具有多孔介质结构的铝替代常规铝[10], 都将增加铝粉氧化反应活性。此外, 卢红霞等[11]利用同步热分析法对普通微米铝粉在不同气氛中进行了热力学分析, 结果表明在温度低于550 ℃时, 由于微米铝粉表面存在一层致密的氧化铝薄层, Al颗粒未见明显氧化现象; 直到温度达到1000 ℃时, 才出现明显的氧化现象。Trunov等[12]研究发现微米铝粉在氧气中的氧化是一个逐步氧化的过程, 并将氧化过程分为四个阶段; 通过对不同阶段氧化产物的分析, 发现在氧化过程中氧化产物会发生晶型转变。何丽蓉等[13]发现铝粉的热反应特性具有明显的尺度效应:在微米铝粉中, 平均粒径较小的铝粉其氧化反应活性更高。
从目前的研究来看, 铝热氧化反应各种因素的影响使其机理变得极为复杂, 尤其在反应微观机理方面的研究非常少, 氧化反应特性及机理未能得到彻底地理解, 使得铝粉在实际工程应用中缺少理论指导。鉴于此, 本研究采用扫描电镜(SEM)、X射线衍射(XRD)、比表面积分析等手段对铝粉样品的理化特性进行研究; 在10 K·min-1的加热速率下, 利用同步热分析仪研究铝粉的热氧化特性, 认识其氧化机理; 并通过动力学计算确定铝粉氧化反应的动力学参数, 为微米铝粉的非等温加热氧化的反应机理研究和模型建立提供参考。
2 实验部分 2.1 实验样品实验所用的3种铝粉分别标记为1#、2#、3#。1#由上海水田科技有限公司提供, 标称粒径为1 μm; 2#、3#由中国航天科技集团第四研究院第四十一所提供, 标称粒径分别为13, 25 μm。
2.2 实验方法及仪器利用美国TA Instruments公司生产的DSC Q100热分析仪对3种铝粉进行热氧化性能研究:实验每次称取10 mg铝粉, 在常压下从室温加热到1110 ℃, 升温速率为10 K·min-1, 空气流量为100 mL·min-1。将样品加热到特定的反应温度(540, 635, 925, 1110 ℃), 在氩气保护下冷却到室温后收集氧化产物。利用美国库尔特公司的LS-230 Coulter马尔文激光粒度仪测量样品的粒度分布; 利用日本日立公司的Hitachi SU-70场发射扫描电子显微镜获得样品及其氧化产物的微观形貌和元素组成; 采用美国QUANTACHROME公司的AUTOSORB-1-C气体吸附仪测定样品的比表面积; 利用荷兰PANalytical公司生产的X射线衍射仪(PANalytical X′Pert PRO)对样品和产物进行物相分析, 扫描范围5°~90°。利用Hitachi SU-70场发射扫描电子显微镜系统中的能谱仪测定了3种样品的元素种类及含量。
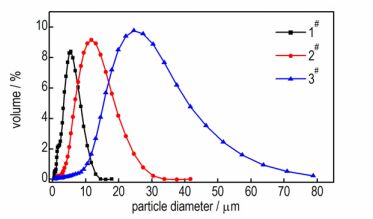
3 结果与讨论 3.1 样品理化特性图 1给出了3种样品的扫描电镜(SEM)图。由图 1可见, 3种样品的颗粒形状规则, 近似球形, 相互分散, 无团聚现象; 颗粒表面不完全光滑, 有凸起的微小颗粒附着, 推测表面的小颗粒为氧化铝。3种样品的Al颗粒大小不一, 1#粒径最小, 其次为2#, 3#的粒径最大。利用激光粒度仪测定样品粒径分布结果如图 2和表 1所示, 由图 1和表 1可知, 样品的粒度测试结果与SEM的观察结果一致。

|
图 1 三种铝粉的SEM图 Fig.1 SEM images of the three Al powders |
|
图 2 样品的粒径分布图 Fig.2 Particle size distribution of the samples |
| 表 1 样品的粒径分布 Tab.1 Particle size distribution of the samples |
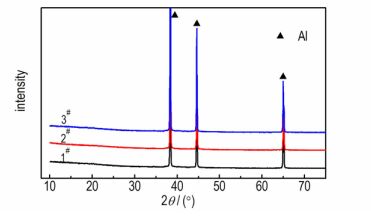
3种样品的元素种类及含量见表 2。由表 2可知, 样品中主要所含元素为Al, 有少量O, 以及极少量的Ag、C、Cu等杂质元素。利用X射线衍射仪进一步探究样品中Al和O的覆存形态。2#的衍射图谱如图 3所示, 图 3中只出现了金属Al的衍射峰, 这表明样品中的Al元素绝大部分以Al单质的形态存在。由于对非晶态的物质进行X射线衍射时, 衍射图谱中不会出现明显的衍射峰, 所以无定形氧化铝不能通过XRD明显地观测到[14]。2#的XRD衍射图(图 3)中未出现明显的氧化铝衍射峰。由此可见, 样品中的O元素是以无定形氧化铝的形式存在。1#和3#的XRD测试结果与2#的一致。此外, 对样品进行全自动比表面积及微孔分析, 得到了3种样品的比表面积: 1#的比表面积最大, 达到2.702 m2·g-1, 2#的比表面积为0.411 m2·g-1, 而3#的比表面积最小, 只有0.383 m2·g-1。
| 表 2 样品的元素种类及其质量含量 Tab.2 Element type and its quality content of the samples |
|
图 3 样品的XRD曲线 Fig.3 XRD curves of the samples |
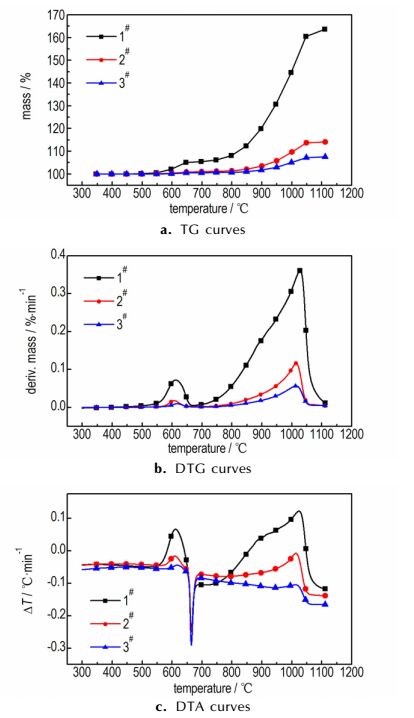
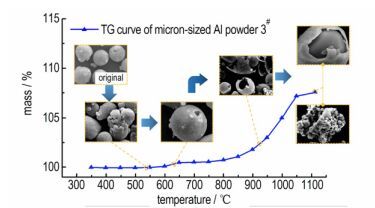
1#、2#、3#样品的热分析曲线如图 4, 由图 4可知, 随着温度的上升, TG曲线呈阶梯状上升, 3种样品的质量都有不同程度的增加; 相对应地, 在DTG曲线中, 样品的氧化反应速率随温度的上升也呈现出阶段性变化。观察图 4中TG-DTG-DTA曲线, 可将样品的氧化过程分为3个阶段, 分别为:初始氧化阶段(阶段Ⅰ), 温度低于550 ℃, 第一次剧烈氧化阶段(阶段Ⅱ), 550~670 ℃, 剧烈氧化阶段(阶段Ⅲ), 670~1110 ℃。阶段Ⅰ中, TG、DTG曲线非常平缓, DTA曲线中未出现明显的放/吸热峰。在550 ℃时, 1#增重最多, 但也仅增加了0.42%, 3#增重最少, 仅为0.05%。可见温度低于550 ℃时, 氧化反应进行得比较困难, 氧化速率极其缓慢, Al粉的氧化程度极低。在550~670 ℃, 可以明显地观察到所有的样品都出现短暂的氧化加速现象: TG曲线上升比较明显, DTA曲线出现氧化放热峰, 氧化速率迅速升高, 又在温度达到Al的熔点之前, 迅速降低到最小。图 4c显示, 在660 ℃左右, 3种样品的DTA曲线都出现明显的吸热峰, 说明在此期间固态Al吸热熔化成液态Al。这表明, 在阶段Ⅰ中, 参与氧化反应的是固相Al, 由于反应受到Al阳离子向外扩散和O阴离子向内扩散的限制, 因此反应进行得非常缓慢, 氧化产物可能是无定形氧化铝; 阶段Ⅰ结束时, 未反应的Al被一层无定形氧化铝包裹着。在阶段Ⅱ中, 随着温度的升高, 铝粉颗粒内部的固相Al开始熔化, 体积膨胀, 将使氧化壳层处于被拉伸状态; 在此温度区间内氧化反应的产物可能是γ-Al2O3[12]。由于γ-Al2O3的密度(3.6~3.67 g·cm-3)较无定形氧化铝的(3~3.1 g·cm-3)大[14], 新形成的γ-Al2O3层不能在Al颗粒表面形成连续、完整的壳层。因此, 暴露在氧化气氛中的熔融态的活性Al立即被氧化, 氧化速率迅速升高。随着反应的进行, γ-Al2O3层不断生长, 氧化层又再次完全覆盖Al颗粒, 导致了阶段Ⅱ末期氧化速率的迅速降低。之后, 氧化速率随着温度的升高不断增大。当温度升高到1010~1030 ℃左右时, 所有样品的氧化速率达到最大值, 反应非常剧烈。但随着温度进一步升高, 氧化速率再次急剧降低。在800~1030 ℃区间内, 图 4中的DTG、DTA曲线再次出现明显的肩峰, 峰值和温度区间都远大于之前(阶段Ⅱ中)的肩峰。因此推断, 在此温度区间内, 氧化过程可能也伴随着氧化铝的晶型转变, 但这一转变可能与阶段Ⅱ中氧化铝由无定形向γ-Al2O3的转变不同。从图 4a可以看出, 温度达到1110 ℃时, TG曲线仍有微弱的上升趋势, 如果继续加热, 氧化还将继续进行。因此, Al粉在1110 ℃时并未完全氧化。有研究指出Al粉在氧化过程中表面形成致密的氧化铝将阻止Al的氧化, 致使Al粉无法被完全氧化[15]。
|
图 4 10 K·min-1升温速率下铝粉在空气气氛中的TG, DTG, DTA曲线 Fig.4 TG, DTG, DTA curves of micron-sized Al powder oxidized in air at 10 K·min-1 heating rate |
通过对热分析实验数据进行分析计算, 得到1#、2#、3#样品的一系列热氧化性能参数, 见表 3。由表 3可知, 实验最后1#增重最多, 为63.7%, 2#和3#分别增重14.1%、7.5%。Ti值越小, 表明铝粉的点火温度越低, 即起始氧化反应温度越低, 也越容易被氧化。由表 3可知, 随着样品平均粒径的增大, 铝粉的点火温度有明显增加的趋势, 而其氧化增重的最大速率和平均速率都显著降低。结合3种样品的理化特性分析, 实验中所采用的3种样品, Al颗粒形状规则, 近似球形, 所含的元素种类相同, 且元素含量差别不大, 主要的不同在于样品的粒径分布、比表面积。1#样品中Al颗粒集中分布在2~10μm, 平均粒径最小, 比表面积最大。因此, 在氧化过程中Al颗粒的反应接触面积更大, 加热过程中获取到的能量更多, 有利于Al阳离子和O阴离子的扩散, 在相同的实验条件下, 有更多的活性Al参与反应, 放出更多的热量, 部分热量反馈给Al颗粒, 还能够实现对颗粒的加热。在本实验中表现为1#的起始氧化温度最低, 氧化速率最大, 样品增重量最大, 氧化程度最深; 2#次之, 3#的氧化程度最低。
| 表 3 微米铝粉的热氧化性能参数 Tab.3 The thermal oxidation performance parameters of micron-Al powders |
采用Satava-Sestak方程(公式(1))[16]计算铝粉热氧化反应的动力学参数。
| ${\rm{lg}}G\left( \alpha \right) = {\rm{lg}}\frac{{AE}}{{R\beta }} - 2.315 - 0.4567\frac{E}{{RT}}$ | (1) |
式中, α是t时刻铝粉热氧化过程中的转化率, %; f(α)为反应机理函数微分式, G(α)为机理函数的积分形式; A为指前因子, s-1; E为反应活化能, J·mol-1; β为升温速率, K·s-1; R为气体常数, 8.314 J·mol-1·K-1; T为反应温度, K。
令Y=lgG(α), a=lg(AE/βR)-2.315, b=-0.4567E/R, X=1/T。则式(1) 改写为
| $Y = a + bX$ | (2) |
针对文献[17]提出的45种机理函数, 将这些机理函数带入到Satava-Sestak方程中, 根据热分析实验数据可得到X和Y的数值, 利用线性拟合可得到式(2) 所对应的直线, 获得直线的线性相关系数r和标准平均方差Q; 由直线的斜率b、截距a可计算得到表观活化能E、频率因子A及反应速率常数k。按照文献[17]根据r值选取最可几机理函数。结果表明, 在45个机理函数中第29号函数R3是3种铝粉样品热氧化反应增重阶段的最可几机理函数。由此可知, 在10 K·min-1的升温速率下, 铝粉非等温热氧化反应符合边界控制模型函数, 反应的最可几机理函数为G(α)=1-(1-α)1/3, 其微分表达式为f(α)=3(1-α)2/3, 适用温度范围550~1110 ℃。
1#、2#、3#的热氧化反应动力学计算结果列于表 4。反应活化能表征反应进行的难易程度, 活化能越小, 反应越容易进行。1#、2#、3#的表观活化能分别为136.54×103, 153.40×103, 162.0×103 J·mol-1。可见, 粒径越小的铝粉, 在相同的条件下越容易进行氧化反应。对大量的实验总结后发现, 对于金属燃料, 其粒径尺寸对金属的氧化过程影响重大, 粒径越小, 比表面积越大, 其反应接触面积越大, 获取的能量越多, 更易于点燃。
| 表 4 微米铝粉的热氧化反应动力学参数 Tab.4 Kinetic parameters for micron-Al powders in thermal oxidation reaction |
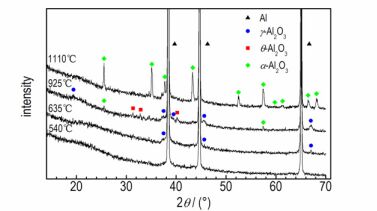
为了获悉Al在空气中氧化的反应机制和引起氧化速率阶段性变化的原因, 将3#样品以10 K·min-1的升温速率分别加热到540, 635, 925, 1110 ℃后, 在氩气保护条件下, 冷却到室温收集氧化产物。利用XRD对不同加热终温的氧化产物进行物相分析, XRD结果如图 5所示。由图 5可见, 540 ℃时氧化产物的XRD图中只有金属Al的衍射峰, 未观察到晶态氧化铝的衍射峰。说明在热重实验中初始氧化阶段TG曲线中出现极少量的增重, 是由于Al粉与氧反应生成无定形氧化铝, 但此阶段氧化速率非常小, 反应缓慢。由此可见, 在室温下Al颗粒表面包裹的氧化层是无定形氧化铝, 与文献[5-6]中的结论一致。635 ℃时在氧化产物的XRD衍射图中观察到微弱的γ-Al2O3的衍射峰, 表明此时Al颗粒表面的氧化层中出现较少量的γ-Al2O3。TG曲线在550~650 ℃温度区间内出现较为明显的增重, 氧化速率也迅速增加。此时参与氧化反应的仍是固相Al, 除了温度的升高, 与阶段Ⅰ中最主要的不同的是, Al颗粒表面氧化铝的晶型发生了转变:由无定形向γ-Al2O3转变。这一改变可能是引起氧化速率突增的主要原因。3#样品加热到925 ℃后, XRD衍射图中除了最强的金属Al衍射峰, γ-Al2O3的衍射峰增强, 并有微弱的θ-Al2O3的衍射峰出现。说明氧化铝发生了由无定形向γ或θ-Al2O3的晶型转变。同时, 剧烈氧化阶段中TG曲线大幅上升, 样品增重显著, 说明此期间Al与O的反应也直接生成了γ或θ-Al2O3。文献[18]指出γ-Al2O3从800 ℃时开始发生相变, 同时向θ、α-Al2O3转变, 随着温度的升高最终将全部转变为α-Al2O3。同样地, 在本实验中, 加热到1110 ℃时收集到的氧化产物, 其XRD衍射图显示的氧化铝衍射峰仅有α-Al2O3一种。这说明此时γ-Al2O3已经直接或间接地全部转变成α-Al2O3。由于α-Al2O3氧化壳层更加稳定、致密, 因此在阶段Ⅲ末, 氧化速率急剧降低。同时, 阶段Ⅲ中TG曲线有明显增重, 表明Al与O的反应也直接生成γ或α-Al2O3。TG曲线在阶段Ⅲ末仍有增长趋势, 继续升高温度(>1110 ℃), 氧化将继续进行, α-Al2O3层生长。
|
图 5 不同加热终温的氧化产物的XRD图 Fig.5 XRD patterns for oxidation products after heating to different temperatures |
为了能更清楚、更直观地观察样品中Al颗粒及其氧化产物随温度的变化, 深入了解Al在空气中的氧化反应机制, 实验中利用扫描电镜(SEM)对3.3.1中不同加热终温收集到的氧化产物进行观察分析, 如图 6所示, 随着温度的升高, Al颗粒及其氧化产物的形貌变化非常明显。从图 6a中可以看到, 在加热前, 3#样品的颗粒表面附着有许多零散分布的颗粒状物质, 根据EDS和XRD的测试结果, 推断是样品在室温时颗粒表面氧化生成的无定形氧化铝。当样品被加热到540 ℃时, 颗粒表面的氧化铝壳层变得更加均匀、连续, 部分Al颗粒的形状稍有改变。当温度达到635 ℃时, 如图 6f和图 6g所示, 样品中粒径较大的Al颗粒, 其形状由最初的球形变得非常不规则, 而粒径较小的颗粒表面出现孔洞, 部分小粒径的Al颗粒表面的氧化层开始出现破裂。此时的温度接近Al的熔点, 继续升高温度, 颗粒内部的Al不断吸热熔化, 而液相Al的密度(2.4 g·m-3)低于固相Al的密度(2.7 g·m-3), 导致内部Al体积膨胀, 且随着温度的升高膨胀程度越大。这种膨胀会使氧化铝壳层处于拉伸状态, 而内部的液相Al处于压缩状态, 于是在氧化铝壳层内存在压力梯度。研究表明, 该压力梯度可以促进氧化铝壳层内的原子向压力小的方向扩散; 同时, 这一压力差的存在, 最终将会导致壳层产生裂缝[19]。此外, 在阶段Ⅱ中, 氧化壳层由无定形向γ-Al2O3转变的过程中表面积收缩, 也会使壳层产生裂缝。这一结果与文献[20]的结论一致。由于Al颗粒表面氧化层破裂, 内部的活性铝释放, 所以氧化变得剧烈, 这一过程恰当地解释了热分析曲线中600 ℃左右引起氧化速率激增的原因。

|
图 6 3#样品在不同加热终温时的氧化产物SEM图 Fig.6 SEM images of oxidation products of 3# sample heated to different temperatures |
从图 6h中可以看到, 温度升高到925 ℃时, 产物中氧化壳层破裂的颗粒非常多且破碎严重, 有许多碎片状氧化壳。图 6c显示925 ℃时Al颗粒表面非常粗糙, 颗粒状氧化物成团簇拥, 不连续的覆盖在颗粒表面, 形成不规则的缝隙。加热到1100 ℃时, 图 6d显示颗粒表面更加粗糙, 氧化层更加致密, 氧化铝呈针刺状均匀、连续的覆盖在颗粒表面。如图 6i和图 6j所示, 在SEM中观察到两种不同特征的氧化产物: Al2O3形成一个整体外壳, 与内部铝核分离, 未反应的Al被新生成的氧化铝壳层包裹着; 许多小球状颗粒成团簇拥, 大部分颗粒的粒径都只有几微米, 而粒度分布测试结果表明, 样品C中铝颗粒的粒径都大于12 μm。分析上述两种现象产生的原因: (1) 高温时铝粉的氧化为异质Al-O反应[21], 液相的Al与气相的O2(或溶解在熔融态Al中的O2)反应, 生成固相的Al2O3, 随着反应的进行固液分离, 导致生成的Al2O3形成一个整体的外壳; (2) Al颗粒表面氧化壳层的晶型转变导致表面积收缩, 使壳层产生裂缝, 同时, 内部熔融态Al不断受热膨胀, 将加剧壳层的破裂, 冲破壳层束缚的液相Al, 由于表面张力和压力的改变, 迅速分散成粒径较小的铝簇, 氧化的同时又相互熔联凝聚。Rufino B等[22]通过实验证明铝粉表面氧化壳层对金属内核的热膨胀束缚性不高, 这也从侧面证明铝粉破壳氧化的驱动力可能是由于内部铝熔化产生的压力大于壳层的束缚力所致。与文献[15, 20, 23]提出铝粉在高加热速率下Al冲破氧化壳层的束缚后分散成铝簇发生剧烈氧化, 在低加热速率下逐层扩散氧化的结论有所不同的是, 本研究发现, 在较低的加热速率下, 微米级铝粉同时存在破裂-分散氧化和逐层扩散氧化两种氧化过程。
4 结论(1) 在较低的升温速率下, 微米铝粉的氧化过程可分为三个阶段:初始氧化阶段, 温度低于550 ℃; 第一次剧烈氧化阶段, 550~670 ℃; 剧烈氧化阶段, 670~1110 ℃。反应在铝粉的热分析实验中就是其TG曲线呈恒重—缓慢增重—恒重—急剧增重; 氧化过程中颗粒表面的氧化铝层生长增厚、拉伸破裂, 并伴随氧化铝由无定形→γ→θ→α-Al2O3的晶型转变。
(2) 铝粉的理化特性对其氧化过程有着非常重要的影响。微米铝粉在较低加热速率下的氧化过程存在明显的尺度效应:铝粉的平均粒径越小, 比表面积越大, 其氧化反应的起始温度就越低, 越容易被氧化, 氧化速率越高, 氧化程度越深。
(3) 通过Satava-Sestak方程确定了3种样品在热重条件下的氧化反应符合边界控制函数模型R3: G(α)=1-(1-α)1/3, 其表观活化能和指前因子按粒径由小到大分别为136.54×103, 153.4×103, 162.0 ×103 J·mol-1和3.31×104, 1.52×105, 2.55×105s-1。平均粒径越小, 比表面积越大的铝粉, 其氧化反应的表观活化能越低, 反应越容易进行。
| [1] |
顾从标, 汤庆钊, 胡刚. 精确制导武器对现代战争的影响[J].
飞航导弹, 2006(4): 12-14. GU Cong-biao, TANG Qing-zhao, HU Gang. The impact of precision guided weapons on modern warfare[J]. Aerodynamic Missile Journal, 2006(4): 12-14. |
| [2] | Geisler R. A global view of the use of aluminum fuel in solid rocket motors[C]//38th AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 2002, 3748. |
| [3] |
刘晶如, 罗运军. 固体推进剂用金属燃烧剂的研究及应用[J].
化学推进剂与高分子材料, 2007, 5(4): 6-12. LIU Jing-ru, LUO Yun-jun. Research and application of metal combustion agent for solid propellant[J]. Chemical Propellants & Polymeric Materials, 2007, 5(4): 6-12. |
| [4] |
黄辉, 黄勇, 李尚斌. 含纳米级铝粉的复合炸药研究[J].
火炸药学报, 2002, 1(2): 1-3. HUANG Hui, HUANG Yong, LI Shang-bin. Study on compound explosives containing nano-sized aluminum powder[J]. Chinese Journal of Explosives & Propellants, 2002, 1(2): 1-3. |
| [5] | Jeurgens L P H, Sloof W G, Tichelaar F D, et al. Thermodynamic stability of amorphous oxide films on metals: Application to aluminum oxide films on aluminum substrates[J]. Physical Review B, 2000, 62(7): 4707 DOI:10.1103/PhysRevB.62.4707 |
| [6] | Jeurgens L P H, Sloof W G, Tichelaar F D, et al. Structure and morphology of aluminum-oxide films formed by thermal oxidation of aluminum[J]. Thin Solid Films, 2002, 418(2): 89-101. DOI:10.1016/S0040-6090(02)00787-3 |
| [7] |
唐泉, 庞爱民, 汪越. 固体推进剂铝粉燃烧特性及机理研究进展分析[J].
固体火箭技术, 2015, 38(2): 232-238. TANG Quan, PANG Ai-min, WANG Yue. Research progress analysis of aluminum combustion property and mechanism of solid propellant[J]. Journal of Solid Rocket Technology, 2015, 38(2): 232-238. |
| [8] |
李鑫, 赵凤起, 郝海霞, 等. 不同类型微/纳米铝粉点火燃烧特性研究[J].
兵工学报, 2014, 35(5): 640-647. LI Xin, ZHAO Feng-qi, HAO Hai-xia, et al. Research on ignition and combustion properties of different micro/nano-aluminum powders[J]. Acta Armamentarii, 2014, 35(5): 640-647. |
| [9] |
李鑫, 赵凤起, 仪建华, 等. 国内外纳米铝粉表面包覆改性研究进展[J].
材料保护, 2013, 46(12): 47-52. LI Xin, ZHAO Feng-qi, YI Jian-hua, et al. Research progress of surface modification of nanometer aluminum powder at home and abroad[J]. Journal of Materials Protection, 2013, 46(12): 47-52. |
| [10] | Yavor Y, Rosenband V, Gany A. Reduced agglomeration in solid propellants containing porous aluminum[C]//Proceedings of the Institution of Mechanical Engineers, Part G: Journal of Aerospace Engineering, 2013. |
| [11] |
卢红霞, 曾昭桓, 侯铁翠, 等. 纳米Al粉热反应特性的研究[J].
人工晶体学报, 2007, 36(3): 638-641. LU Hong-xia, ZENG Zhao-huan, HOU Tie-cui, et al. Thermal reaction properties of nanometer aluminum powders[J]. Journal of Synthetic Crystals, 2007, 36(3): 638-641. |
| [12] | Trunov M A, Schoenitz M, Zhu X, et al. Effect of polymorphic phase transformations in Al2O3 film on oxidation kinetics of aluminum powders[J]. Combustion and Flame, 2005, 140(4): 310-318. DOI:10.1016/j.combustflame.2004.10.010 |
| [13] |
何丽蓉, 肖乐勤, 菅晓霞, 等. 纳米铝粉热反应特性的TG-DSC研究[J].
固体火箭技术, 2011, 34(5): 628-631. HE Li-rong, XIAO Le-qin, JIAN Xiao-xia, et al. Investigation on nano-aluminum thermal reactivity by TG-DSC[J]. Journal of Solid Rocket Technology, 2011, 34(5): 628-631. |
| [14] | Levin I, Brandon D. Metastable alumina polymorphs: crystal structures and transition sequences[J]. Journal of the American Ceramic Society, 1998, 81(8): 1995-2012. |
| [15] | Sun Y, Sun R, Zhu B, et al. Thermal reaction mechanisms ofnano-and micro-scale aluminum powders in carbon dioxide at low heating rate[J]. Journal of Thermal Analysis and Calorimetry, 2016, 124(3): 1727-1734. DOI:10.1007/s10973-016-5284-2 |
| [16] |
冯仰婕, 史永强. 固体热分解动力学的热分析法研究[J].
高分子材料科学与工程, 1997, 13(2): 30-34. FENG Yang-jie, SHI Yong-qiang. Study on thermal decomposition kinetics of solid[J]. Polymeric Materials Science and Engineering, 1997, 13(2): 30-34. |
| [17] |
胡荣祖, 史启祯.
热分析动力学[M]. 北京: 科学出版社, 2001: 127-131.
HU Rong-zu, SHI Qi-zhen. Thermal analysis kinetics[M]. Beijing: Chinese Science Publishing & Media Ltd, 2001: 127-131. |
| [18] |
方萍, 何迈, 谢云龙, 等. γ-Al2O3高温相变的XRD和Raman光谱比较研究[J].
光谱学与光谱分析, 2006, 26(11): 2039-2042. FANG Ping, HE Mai, XIE Yun-long, et al. Comparative study on high temperature phase transition of γ-Al2O3 by XRD and Raman spectroscopy[J]. Spectroscopy and Spectral Analysis, 2006, 26(11): 2039-2042. DOI:10.3321/j.issn:1000-0593.2006.11.019 |
| [19] | Campbell T J, Aral G, Ogata S, et al. Oxidation of aluminumnanoclusters[J]. Physical Review B, 2005, 71(20): 205413 DOI:10.1103/PhysRevB.71.205413 |
| [20] | Rai A, Park K, Zhou L, et al. Understanding the mechanism of aluminum nanoparticle oxidation[J]. Combustion Theory and Modelling, 2006, 10(5): 843-859. DOI:10.1080/13647830600800686 |
| [21] | Massalski T B, Murray J L, Bennett L H. Baker Binary alloy phase diagrams[M]. Metals Park, OH: American Society for Metals, 1986. |
| [22] | Rufino B, Coulet M V, Bouchet R, et al. Structural changes and thermal properties of aluminum micro-and nano-powders[J]. Acta Materialia, 2010, 58(12): 4224-4232. DOI:10.1016/j.actamat.2010.04.014 |
| [23] |
周东辉, 黄雪峰, 李盛姬, 等. 微燃烧室内纳米铝粉的激光点火及燃烧特性[J].
固体火箭技术, 2016, 39(5): 642-648. ZHOU Dong-hui, HUANG Xue-feng, LI Sheng-ji, et al. Laser-induced ignition and combustion characteristics of nano-aluminum powders in the micro-scale combustor[J]. Journal of Solid Rocket Technology, 2016, 39(5): 642-648. |
The thermal oxidation characteristics and its dynamic mechanism of micron-Al powders in air were investigated by TG/DTA. Three kinds of particle sizes of aluminum powder were heated up to 1110 ℃ at 10 K·min-1 heating rate in air. SEM and XRD were used to determine the evolution of the Al samples by observing the products collected at selected temperatures. The kinetic parameters of the oxidation reaction were calculated by Satava-Sestak integral method.




