2. 应用物理化学国家级重点实验室, 陕西 西安 710061
2. National Key Laboratory of Applied Physics and Chemistry, Xi′an 710061, China
为满足目前对炸药性能的高要求,基于超分子作用的混合炸药备受关注,因此分析和预测混合炸药中分子间作用以及炸药感度等性质非常必要[1-3]。
通常,硝基炸药中X—NO2 (X=C、N或O)键的能量最低,受到外部刺激后会首先发生断裂,进而引发炸药的爆炸反应,这些键叫做“引发键”[4]。Li[5]和Tan等[6]研究表明,引发键强度越大,感度便越低。Polizer等[7]利用引发键键长来判断键的强度,并分析了部分硝基炸药的感度与引发键强度之间的关系。引发键的强度可以通过键长、键解离能、键级等表征。近年,相对TNT具有高能量、低感度等特点的硝基吡唑类化合物引起了人们的广泛关注[8],其中3, 4-二硝基吡唑(3, 4-Dinitropyrazole, DNP)和1-甲基-3, 4, 5-三硝基吡唑(1-Methyl-3, 4, 5-Trinitropyrazole, MTNP)性能优异。DNP具有低熔点、低感度和良好爆炸性能等优点,被看作替代TNT作为镕铸载体炸药的潜在候选物[9]。Du等[10]通过量子化学计算分析了DNP与阳离子之间的相互作用并通过引发键强度的变化预测其感度变化。六硝基六氮杂异伍兹烷(Hexaazaisowurtzitane, CL-20)是目前能量密度最高的含能化合物,但是较高的撞击与摩擦感度限制了它作为单质炸药的广泛应用[11]。Gao[12]、Ding等[13]通过量子化学计算预测了CL-20与其他钝感含能材料形成共晶炸药后感度的变化。但钝感炸药DNP与CL-20共晶和分子间相互作用的研究均未见报道,本文通过量子化学计算方法分析DNP与CL-20分子间相互作用,并通过一系列引发键分析预测CL-20感度变化。
本研究利用密度泛函理论(DFT),对DNP/CL-20复合物的构型进行优化。通过优化结构和计算相互作用能,并结合自然键轨道、电子密度拓扑和约化密度梯度分析,研究了DNP/CL-20分子间相互作用的本质。对CL-20中引发键进行分析并预测其感度变化,从理论计算方面为DNP与CL-20混合炸药研究提供支持。
2 计算方法基于密度泛函理论[14],在B3LYP方法6-311++G(d, p)基组水平下,对DNP、CL-20单体及DNP/CL-20复合物构型进行几何优化与频率计算,确定结构无虚频。在此基础上,对所得结构进行键临界点处电子密度拓扑[15](Atoms in Molecular, AIM)分析、约化密度梯度[16](Reduced Density Gradient, RDG)分析和自然键轨道[17](Natural Bond Orbital, NBO)分析,研究DNP与CL-20分子间作用的类型。采用引发键长度、键解离能、键级和键临界点电子密度的分析方法描述分子间作用对CL-20感度的影响。研究表明计算BDE时使用B3LYP方法要优于MP2方法[18],所以本文采用B3LYP方法。对于反应: R—NO2→R·+·NO2,键解离能(Bond Dissociation Energy, BDE)由式(1)计算:
| $ {\rm{BDE}}=E\left( {\rm{R}}\cdot \right)+E(\cdot {\rm{N}}{{\rm{O}}_{2}})-E({\rm{R-N}}{{\rm{O}}_{2}}) $ | (1) |
体系的相互作用能通过复合物与单体之间的能量差计算,采用均衡法(Counterpoise Correction, 简称为CP)对基组叠加误差(Basis Set Superposition Error, BSSE)进行校正[19]。对于DNP/CL-20复合物的相互作用能由式(2)计算:
| $ \begin{align} &E\left( \rm{int}. \right)=~E\left( \rm{DNP/CL-20} \right)-E\left( \rm{CL-20} \right)-E\left( \rm{DNP} \right)+ \\ &E\left( \rm{BSSE} \right) \\ \end{align} $ | (2) |
式中, E(int.)为复合物相互作用能;E(DNP/CL-20)为复合物总能量;E(CL-20)为单体CL-20能量;E(DNP)为单体DNP能量;E(BSSE)为CP校正能,单位均为kJ·mol-1。
利用对电子密度差和硝基电荷变化量的分析解释分子间相互作用对引发键强度的影响。硝基电荷用式(3)计算:
| $ Q({\rm{N}}{{\rm{O}}_{2}})=Q\left( {\rm{N} }\right)+Q({{\rm{O}}_{1}})+Q({{\rm{O}}_{2}}) $ | (3) |
式中, Q(NO2)为硝基电荷;Q(N)为氮原子电荷;Q(O1)和Q(O2)分别为硝基上两个氧原子电荷。
以上所有计算与分析工作利用Gaussian 09[20]、Multiwfn 3.3.9[21]程序完成。
3 结果与讨论 3.1 几何结构分析在B3LYP/6-311++G(d, p)计算水平下,优化后单体DNP、CL-20结构中主要的键参数与文献[22]、[23]对比,结果表明实验值与计算值之间的平均偏差分别为0.34%,0.74%(见表 1)。并且研究表明,B3LYP可以描述分子间氢键相互作用[24]。因此,本研究中使用该方法和基组对DNP/CL-20复合物构型进行结构优化。
| 表 1 单体DNP和CL-20分子的主要键长 Tab.1 Main bond length for molecules of monomers DNP and CL-20 |
六种DNP/CL-20复合物全优化构型如图所示,图中标注了分子间相互作用的部分重要参数,包括键长、键角且构型中原子序号均相同。值得注意的是,优化了二十余种DNP/CL-20复合物构型,除去存在虚频的构型,挑选了较稳定的六种结构各异的构型进行讨论。由图 1可知,DNP/CL-20分子间作用主要存在于H原子和N、O原子之间,且H…O、H…N原子间距离位于2.05~2.66 Å,小于H原子与N原子或O原子范得华半径[25]之和:2.72 Å、2.75 Å,属于氢键作用原子间距离范围[26]。所有构型中的Donor-H…Acceptor键角为121.9~167.3°。H…Acceptor距离越短且Donor-H…Acceptor键角越接近180°,氢键作用就越强[27]。因此,DNP/CL-20复合物中可能存在氢键相互作用,其中结构Ⅰ,Ⅱ和Ⅳ中作用较强。
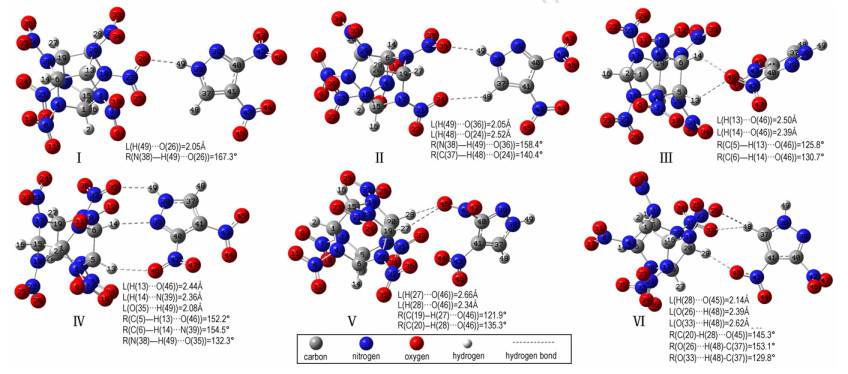
|
图 1 B3LYP/6-311++G (d, p)水平下的六种DNP/CL-20优化复合物构型 Fig.1 Six optimized configurations of DNP/CL-20 complexes at B3LYP/6-311++G (d, p) level |
分析构型Ⅰ和Ⅱ可知DNP分子N—H基团与C—H基团均可与CL-20分子硝基中O原子发生作用,但N—H…O类型的氢键键长较短且键角较接近180°,说明相对C—H基团,DNP分子中N—H基团更易作为氢键电子供体存在。构型Ⅵ中DNP分子硝基O原子与CL-20分子C—H基团之间产生氢键,存在的位阻效应使DNP分子中N—H基团无法靠近CL-20分子,因此DNP分子中C—H基团与CL-20分子中硝基O原子产生氢键作用。同样由于位阻效应的存在,构型Ⅲ和Ⅴ中DNP分子与CL-20分子间距离较大,导致这两个构型中氢键强度偏弱。
3.2 相互作用能分析在B3LYP/6-311++G(d, p)水平下计算DNP/CL-20复合物分子间相互作用能E(int.),结果使用CP进行BSSE校正。六种构型的相互作用能顺序为:构型Ⅳ(-29.88 kJ·mol-1) < 构型Ⅵ(-25.84 kJ·mol-1) < 构型Ⅴ(-24.09 kJ·mol-1) < 构型Ⅲ(-24.09 kJ·mol-1) < 构型Ⅱ(-19.52 kJ·mol-1) < 构型Ⅰ(-19.28 kJ·mol-1),相互作用能E(int.)分布在-29.88~-19.28 kJ·mol-1。通常分子间氢键的相互作用能介于-160~-16 kJ·mol-1[28],并且相互作用能越小则结构越稳定。因此,六个构型稳定性排序为:构型Ⅳ>构型Ⅵ>构型Ⅴ>构型Ⅲ>构型Ⅱ>构型Ⅰ。由此可见,DNP/CL-20复合物中的分子间作用中存在氢键作用且构型Ⅳ较其他构型更稳定。
3.3 引发键分析键级可以衡量分子中化学键的相对强弱,键级高则键强,因此计算复合物中CL-20部分引发键的拉普拉斯键级[29](Laplacian Bond Order, LBO)。DNP/CL-20复合物中引发键键长、键解离能、拉普拉斯键级和键临界点电子密度的详细数据见表 2。与单体CL-20对比,复合物中CL-20的N—N键键长减小了0.005~0.024 Å,键解离能增大了6.1~27.3 kJ·mol-1,键级上升了0.03~0.09,键临界点电子密度增加了0.004~0.0178 a.u.。说明与DNP形成分子间作用后,CL-20引发键强度增加,而感度可能降低,其中构型Ⅰ中CL-20的N(18)—N(22)键强度增加显著:键长减小0.024 Å,BDE升高了27.3 kJ·mol-1,键级升高0.09,键临界点电子密度增加0.0178 a.u.。CL-20的引发键解离能增量ΔBDE、键长减量ΔL、键级增量ΔO和键临界点电子密度变化量ΔρBCP之间呈良好的线性关系,关系式与对应的相关系数分别为:
| $ \Delta O=3.31\Delta L+0.0082, {{R}^{2}}=0.97; $ |
| $ \Delta {{\rho }_{\text{BCP}}}=0.75\Delta L-0.0006,{{R}^{2}}=0.99; $ |
| $ \Delta {{\rho }_{\text{BCP}}}=0.223\Delta O-0.0023,{{R}^{2}}=0.98;$ |
| $ \Delta BDE=312.35\Delta O-1.23, {{R}^{2}}=0.96; $ |
| $ \Delta {{\rho }_{\text{BCP}}}=0.0007\Delta BDE-0.0012,{{R}^{2}}=0.97; $ |
| $ \Delta L=0.0009\Delta BDE-0.0006, {{R}^{2}}=0.96。$ |
| 表 2 单体CL-20与其复合物中引发键的键长、键解离能、键级和键临界点电子密度 Tab.2 Bond length, BDE, bond order and electron density at the bond critical point for the trigger bond in monomer CL-20 and its complexes |
此外,各个构型中的键参数变化均发生在氢键形成的原子或基团上,说明了氢键的形成是导致CL-20引发键强度变化的原因。
3.4 硝基电荷变化量分析已有研究表明,硝基炸药的硝基电荷愈负则其撞击感度愈低,并且炸药特性落高H50与硝基所带电荷之间存在一定的关系:当硝基带有小于0.23e的负电荷时,H50将小于0.4m[30],因此本部分利用适合描述静电作用的ADCH[31](Hirshfeld Atom Charge with Atom dipole Moment corrected)电荷分析了CL-20部分硝基电荷,预测其感度变化。从表 3可知,复合物中CL-20硝基电荷小于其单体硝基的电荷,且电荷变化量较大的硝基与形成分子间作用的原子之间存在联系。例如:在单体CL-20中N(32)—O(35)—O(36)硝基电荷为-0.0410 e,而在结构Ⅱ,Ⅲ和Ⅳ中分别减小为-0.08801 e,-0.08804 e和-0.13422 e,在这些构型中N(32)—O(35)—O(36)均与DNP分子产生了分子间相互作用。经过分析可知,CL-20分子内硝基的电荷普遍存在减小的现象,得到与引发键分析相同的结论:与DNP产生分子间作用后,CL-20感度呈下降的趋势。说明与钝感炸药分子DNP发生相互作用后,CL-20可以被有效的降低感度。
| 表 3 DNP/CL-20复合物中部分硝基电荷 Tab.3 Selected the charge of nitro groups in DNP/CL-20 complexes |
使用键临界点处AIM拓扑分析讨论DNP/CL-20分子间存在的相互作用,并分析相互作用本质[32]。总电子密度ρ(r)处于0.002~0.04 a.u.之间预示了氢键作用,其值愈大代表作用愈强。电子密度拉普拉斯值▽2ρ(r)和能量密度H(r)可以反应分子间相互作用类型,其中能量密度等于势能密度V(r)与拉格朗日动能密度G(r)之和。当电子密度拉普拉斯值和能量密度为负代表共价键相互作用,为正代表闭壳型相互作用(氢键、范得华作用等)[15]。在表 4中,ρ(r)介于0.0033~0.0192 a.u., ▽ 2ρ(r)和H(r)均为正,表示DNP/CL-20复合物中存在闭壳型相互作用。六个构型中ρ(r)最大分别为0.0192 a.u.(O(26)…H(49))、0.0179 a.u.(O(36)…H(49))、0.0092 a.u.(H(14)…O(46))、0.0164 a.u.(O(35)…H(49))、0.0117 a.u.(H(16)…O(45))和0.0154 a.u.(H(28)…O(45)),说明构型Ⅰ、Ⅱ和Ⅳ中氢键作用较强。另外,DNP/CL-20复合物中还在中存在O…O和N…O作用,包括构型Ⅲ中O(35)…O(44) (0.0054 a.u.)、N(29)…O(44)(0.0044 a.u.)等,构型Ⅳ中O(10)…O(46) (0.0043 a.u.)和构型Ⅴ中O(25)…O(45) (0.0057 a.u.),其强度小于氢键。根据分析可知:DNP/CL-20复合物中存在弱氢键和范德华作用,且构型Ⅰ、Ⅱ和Ⅳ中氢键作用较强。
| 表 4 DNP/CL-20复合物键临界点处电子密度的拓扑参数 Tab.4 Topological parameters of electron density at the bond critical point for DNP/CL-20 complex a.u. |
对六种构型的RDG进行分析并绘制其散点图和填色等值面图(图 2),对弱相互作用进行可视化分析。散点图中的每个点代表单个网格,点愈密集说明电子密度愈大,作用愈强。在等值面填色图中,不同颜色的区域与散点图中存在的波峰相对应,代表不同类型的相互作用。蓝色区域代表强吸引作用(氢键、强卤键等),绿色区域代表范德华作用,红色区域代表强排斥作用(位阻效应)。图 2散点图中,在sign(λ2)ρ的值在-0.03~0 a.u.之间存在两个波峰,说明DNP/CL-20复合物中存在两种作用:弱氢键(-0.03~-0.01 a.u.)与范德华作用(-0.01~0 a.u.);当sign(λ2)ρ>0时存在着位阻效应,对应RDG填色等值图中DNP和CL-20分子中显示的红色区域。在RDG填色等值图中,硝基上氧原子与氨基上氢原子存在蓝色与绿色区域,说明DNP与CL-20之间确实存在了弱的氢键作用和范德华作用。在构型Ⅲ中,DNP的硝基与CL-20中特定硝基之间存在了明显的浅绿色盘状区域,说明该构型中除氢键外还存在N—O和O—O作用;在构型Ⅳ和Ⅴ中DNP的硝基氧原子与CL-20的硝基氧原子之间出现浅绿色区域,预示这两个构型中存在O—O作用。对于构型Ⅰ, Ⅱ和Ⅳ,波峰处的散点更加稠密,说明构型Ⅰ, Ⅱ和Ⅳ中存在了强度较大的弱氢键作用与范德华作用,且DNP/CL-20复合物中主要的分子间作用力为氢键。
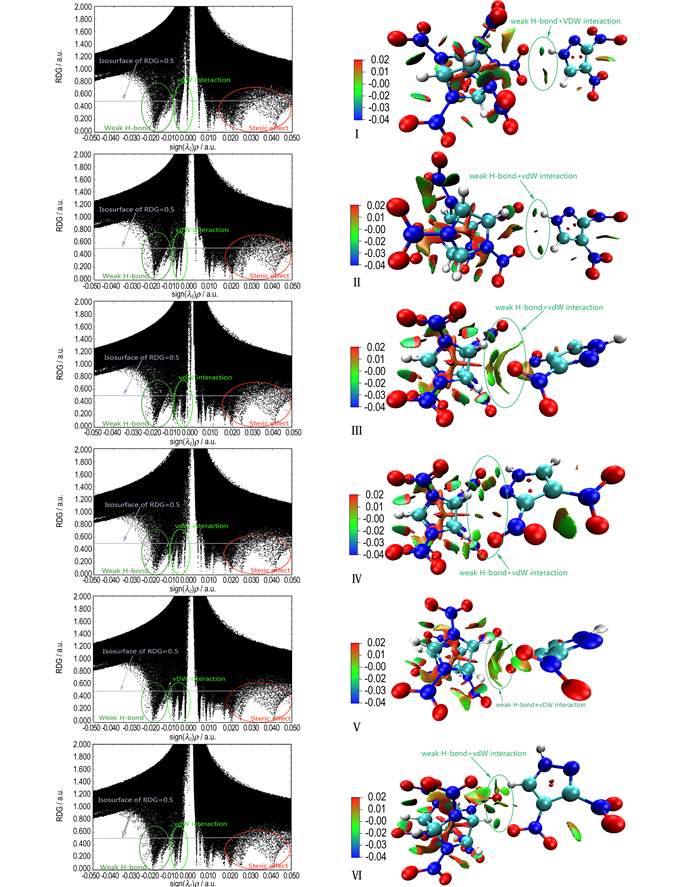
|
图 2 DNP/CL-20复合物构型的散点图和RDG填色等值面图 Fig.2 The scatter diagram and isosurface graph of RDG for configurations of DNP/CL-20 complexes |
利用自然键轨道(NBO)理论,计算二阶微扰稳定化能E2评价这些构型中分子间作用的相对稳定性[33]。从表 5可以看出,在构型Ⅰ和构型Ⅱ中主要的相互作用为C—H…O或N—H…O类型的氢键,其中LP(2) O(26)→BD*(1) N(38)—H(49)和LP(2) O(36)→BD*(1) N(38)—H(49)作用的E2分别为5.02, 1.73 kJ·mol-1,其能量高于各自构型中其他相互作用。构型Ⅲ,Ⅳ,Ⅴ和Ⅵ中除了较强的分子间氢键外还存在部分原子之间的范德华作用,包括:N—O,O—O和O—C作用。构型Ⅲ的氢键稳定化能最大为0.97 kJ·mol-1明显小于其他构型。构型Ⅳ中主要存在氢键和范德华力:LP(1) N(39)→BD*(1) C(6)—H(14)和BD*(2) N(7)—O(10)→RY*(4) O(46)。构型Ⅴ中主要的作用力为氢键和范德华作用:LP(1) O(25)→BD*(1) C(37)—H(48)、LP(1) O(45)→BD*(1) C(1)—H(2)和BD(1) N(17)—N(21)→BD*(1) N(43)—O(45)。构型Ⅵ中的分子间作用与其他构型不同,主要作用为范德华作用:BD(2) N(22)—O(26)→RY*(15) C(37),还有一些较弱氢键作用。可以证明,DNP/CL-20复合物中主要的分子间相互作用为氢键,包括部分范德华作用。
| 表 5 在B3LYP/6-311++G(d, p)水平下DNP/CL-20复合物的自然键轨道理论分析 Tab.5 NBO analysis of DNP/CL-20 complexes at the B3LYP/6-311++G(d, p) level |
电子密度差可以直观地描述DNP/CL-20复合物形成后部分原子间密度的增减,表现出相应键的削弱与增强[34]。在图 3中,紫色区域代表了电子密度增加,黄色区域代表电子密度减小。由于DNP与CL-20分子间形成氢键与范德华作用,相关硝基上氧原子所在区域呈现紫色,与之对应的氢原子呈现黄色,印证了形成氢键时氢原子电子密度减小的观点。部分硝基附近的紫色区域说明电子从氢原子转移至引发键,因此引发键的强度增加。与引发键分析得到的结论相同:由于分子间氢键的形成,CL-20中引发键强度增加,感度呈下降的趋势。
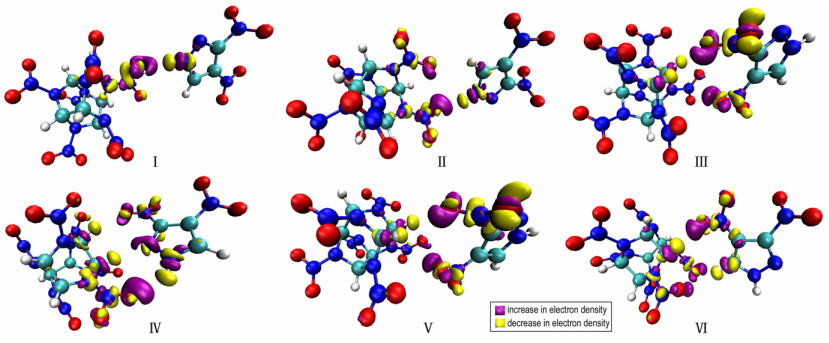
|
图 3 六种DNP/CL-20复合物中电子密度差图 Fig.3 The electron density differences of six DNP/CL-20 complexes |
对DNP/CL-20复合物分子间相互作用进行密度泛函研究,讨论DNP/CL-20复合物中分子间作用的类型,分析与DNP发生作用后CL-20感度的变化,得到了以下主要结论:
(1) DNP/CL-20分子间相互作用以C—H…O、N—H…O、C—H…N类型的分子间氢键为主,氢键键长分布在205~2.66 Å,键角分布在121.9~167.3°,说明DNP与CL-20分子间作用较强。
(2) DNP/CL-20相互作用能为-29.88~-19.28 kJ·mol-1,不同构型间作用能存在差异,构型稳定性由强至弱排序为:构型Ⅳ>构型Ⅵ>构型Ⅴ>构型Ⅲ>构型Ⅱ>构型Ⅰ,可见构型Ⅳ最稳定。
(3) 与DNP发生相互作用后,CL-20引发键键长减小、键解离能增大、键级增大,因此引发键强度增加,CL-20感度呈下降趋势。此外,与单体CL-20对比,复合物中其引发键键长、键级、BDE和键临界点电子密度的变化量呈良好的线性关系,相关指数达到0.96~0.99。
(4) 硝基电荷的变化与电子密度差分析说明由于分子间氢键的形成,CL-20引发键所在硝基上电荷减小,引发键电子密度增加,从而导致了引发键强度的增大。
| [1] |
Badgujar D M, Talawar M B, Asthana S N, et al. Advances in science and technology of modern energetic materials: an overview[J].
Journal of Hazardous Materials, 2008, 151(2): 289-305. |
| [2] |
Landenberger K B, Bolton O, Matzger A J. Two isostructural explosive cocrystals with significantly different thermodynamic stabilities[J].
Angewandte Chemie International Edition, 2013, 52(25): 6468-6471. DOI:10.1002/anie.201302814 |
| [3] |
Thottempudi V, Shreeve J M. Synthesis and promising properties of a new family of high-density energetic salts of 5-nitro-3-trinitromethyl-1H-1, 2, 4-triazole and 5, 5′-bis (trinitromethyl)-3, 3′-azo-1H-1, 2, 4-triazole[J].
Journal of the American Chemical Society, 2011, 133(49): 19982-19992. DOI:10.1021/ja208990z |
| [4] |
Owens F J. Calculation of energy barriers for bond rupture in some energetic molecules[J].
Journal of Molecular Structure: Theochem, 1996, 370(1): 11-16. DOI:10.1016/S0166-1280(96)04673-8 |
| [5] |
Li J S. A multivariate relationship for the impact sensitivities of energetic N-nitrocompounds based on bond dissociation energy[J].
Journal of Hazardous Materials, 2010, 174(1): 728-733. |
| [6] |
Tan B S, Long X P, Peng R F, et al. Two important factors influencing shock sensitivity of nitro compounds: bond dissociation energy of X—NO2 (X=C, N, O) and Mulliken charges of nitro group[J].
Journal of Hazardous Materials, 2010, 183(1): 908-912. |
| [7] |
Politzer P, Murray J S. Relationships between dissociation energies and electrostatic potentials of C—NO2 bonds: applications to impact sensitivities[J].
Journal of Molecular Structure, 1996, 376(1-3): 419-424. DOI:10.1016/0022-2860(95)09066-5 |
| [8] |
郭俊玲, 曹端林, 王建龙, 等. 硝基吡唑类化合物的合成研究进展[J].
含能材料, 2014, 22(6): 872-879. GUO Jun-ling, CAO Duan-lin, WANG Jian-long, et al. Review on synthesis nitropyrazoles[J]. Chinese Journal Energetic Materials(Hanneng Cailiao), 2014, 22(6): 872-879. DOI:10.11943/j.issn.1006-9941.2014.06.031 |
| [9] |
Ravi P, Badgujar D M, Gore G M, et al. Review on melt cast explosives[J].
Propellants, Explosives, Pyrotechnics, 2011, 36(5): 393-403. DOI:10.1002/prep.201100047 |
| [10] |
Du S, Wang Y, Chen L Z, et al. A B3LYP and MP2 (full) theoretical investigation into explosive sensitivity upon the formation of the molecule-cation interaction between the nitro group of 3, 4-dinitropyrazole and H+, Li+, Na+, Be2+ or Mg2+[J].
Journal of Molecular Modeling, 2012, 18(5): 2105-2115. DOI:10.1007/s00894-011-1229-7 |
| [11] |
Nair U R, Sivabalan R, Gore G M, et al. Hexanitrohexaazaisowurtzitane (CL-20) and CL-20-based formulations (review)[J].
Combustion Explosion and Shock Waves, 2005, 41(2): 121-132. DOI:10.1007/s10573-005-0014-2 |
| [12] |
Gao H F, Zhang S H, Ren F D, et al. Theoretical insight into the co-crystal explosive of 2, 4, 6, 8, 10, 12-hexanitrohexaazaisowurtzitane (CL-20)/1, 1-diamino-2, 2-dinitroethylene (FOX-7)[J].
Computational Materials Science, 2015, 107: 33-41. DOI:10.1016/j.commatsci.2015.05.009 |
| [13] |
Ding X, Gou R J, Ren F D, et al. Molecular dynamics simulation and density functional theory insight into the cocrystal explosive of hexaazaisowurtzitane/nitroguanidine[J].
International Journal of Quantum Chemistry, 2016, 116(2): 88-96. DOI:10.1002/qua.25027 |
| [14] |
Becke A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange[J].
The Journal of Chemical Physics, 1993, 98(7): 5648-5652. DOI:10.1063/1.464913 |
| [15] |
Bader R F W. A quantum theory of molecular structure and its applications[J].
Chemical Reviews, 1991, 91(5): 893-928. DOI:10.1021/cr00005a013 |
| [16] |
Johnson E R, Keinan S, Mori-Sanchez P, et al. Revealing noncovalent interactions[J].
Journal of the American Chemical Society, 2010, 132(18): 6498-6506. DOI:10.1021/ja100936w |
| [17] |
Reed A E, Weinstock R B, Weinhold F. Natural population analysis[J].
The Journal of Chemical Physics, 1985, 83(2): 735-746. DOI:10.1063/1.449486 |
| [18] |
Brinck T, Haeberlein M, Jonsson M. A computational analysis of substituent effects on the O—H bond dissociation energy in phenols: polar versus radical effects[J].
Journal of the American Chemical Society, 1997, 119(18): 4239-4244. DOI:10.1021/ja962931+ |
| [19] |
Boys S F, Bernardi F. The calculation of small molecular interactions by the differences of separate total energies. Some procedures with reduced errors[J].
Molecular Physics, 1970, 19(4): 553-566. DOI:10.1080/00268977000101561 |
| [20] |
Frisch M J, Trucks G W, Schlegel H B. Gaussian 09, Revision A. 01[CP]. Gaussian Inc, Wallingford CT, 2009.
|
| [21] |
Lu T, Chen F W. Multiwfn: a multifunctional wavefunction analyzer[J].
Journal of Computational Chemistry, 2012, 33(5): 580-592. DOI:10.1002/jcc.v33.5 |
| [22] |
Chen L Z, Song L, Cao D L, et al. Crystal structure of 3, 4-dinitropyrazole, C3H2N4O4[J].
Zeitschrift Für Kristallographie-New Crystal Structures, 2016, 231(4): 1099-1100. |
| [23] |
Nielson A T, Chafin A P, Christian S L, et al. Synthesis of polyazapolycyclic caged polynitramines[J].
Tetrahedron, 1998, 54(39): 11793-11812. DOI:10.1016/S0040-4020(98)83040-8 |
| [24] |
Sousa S F, Fernandes P A, Ramos M J. General performance of density functionals[J].
The Journal of Physical Chemistry A, 2007, 111(42): 10439-10452. DOI:10.1021/jp0734474 |
| [25] |
Rozas I. On the nature of hydrogen bonds: an overview on computational studies and a word about patterns[J].
Physical Chemistry Chemical Physics, 2007, 9(22): 2782-2790. DOI:10.1039/b618225a |
| [26] |
Bondi A. van der Waals volumes and radii[J].
The Journal of Physical Chemistry, 1964, 68(3): 441-451. DOI:10.1021/j100785a001 |
| [27] |
Arunan E, Desiraju G R, Klein R A, et al. Definition of the hy-drogen bond (IUPAC Recommendations 2011)[J].
Pure and Applied Chemistry, 2011, 83(8): 1637-1641. |
| [28] |
Steiner T. The hydrogen bond in the solid state[J].
Angewandte Chemie International Edition, 2002, 41(1): 48-76. DOI:10.1002/1521-3773(20020104)41:1<>1.0.CO;2-5 |
| [29] |
Lu T, Chen F W. Bond order analysis based on the Laplacian of electron density in fuzzy overlap space[J].
The Journal of Physical Chemistry A, 2013, 117(14): 3100-3108. DOI:10.1021/jp4010345 |
| [30] |
Zhang C Y, Shu Y J, Huang Y G, et al. Investigation of correlation between impact sensitivities and nitro group charges in nitro compounds[J].
The Journal of Physical Chemistry B, 2005, 109(18): 8978-8982. DOI:10.1021/jp0512309 |
| [31] |
Lu T, Chen F W. Atomic dipole moment corrected Hirshfeld population method[J].
Journal of Theoretical and Computational Chemistry, 2012, 11(1): 163-183. DOI:10.1142/S0219633612500113 |
| [32] |
Espinosa E, Molins E, Lecomte C. Hydrogen bond strengths revealed by topological analyses of experimentally observed electron densities[J].
Chemical Physics Letters, 1998, 285(3): 170-173. |
| [33] |
Weinhold F, Landis C R.
Valency and bonding: a natural bond orbital donor-acceptor perspective[M]. London: Cambridge University Press, 2005 |
| [34] |
Scheiner S, Kar T. Red-versus blue-shifting hydrogen bonds: Are there fundamental distinctions?[J].
The Journal of Physical Chemistry A, 2002, 106(9): 1784-1789. DOI:10.1021/jp013702z |
To explore the changes of CL-20 sensitivity and provide helpful insights on the preparation of DNP/CL-20 mixture explosives, DNP/CL-20 complex was investigated by quantum chemistry methods.




