2, 4-二硝基甲苯(2, 4-DNT)被广泛应用于军工生产中, 它是火箭推进剂生产中的主要成分[1]以及TNT炸药生产过程的主要副产物[2]。然而生产使用2, 4-DNT过程中的不恰当操作使得军工厂周围的环境受到严重污染。2, 4-DNT具有显著的生物毒性[3], 美国环保署已经将2, 4-DNT列为优先控制污染物名单[4]。
微生物转化2, 4-DNT一直以来被认为是最有效的途径, 国内外大多数学者已经对微生物降解2, 4-DNT进入了深入的研究。然而研究降解2, 4-DNT的微生物要么在严格的厌氧条件下, 要么在好氧条件下进行。在厌氧条件下, 2, 4-DNT一般会转化为2-氨基-4-硝基甲苯、4-氨基-2-硝基甲苯, 进而转化为2, 4-二氨基甲苯[5-6], 2, 4-DNT虽然可以转化成易降解的中间产物, 但却不能将其完全矿化, 因而厌氧转化需要借助于好氧菌后续处理; 在好氧条件下, 2, 4-DNT一般先羟化生成4-甲基-5-硝基儿茶酚、2-羟基-5甲基苯醌和2, 4, 5-三羟基甲苯[7-8], 而2, 4-DNT从化学结构特点上来看, 很难直接进行氧化反应, 且可能生成毒性更大或几乎不能降解的代谢产物; 而兼性细菌可以首先进行缺氧还原2, 4-DNT, 然后再经过好氧来开环、矿化, 可以将2, 4-DNT彻底转化为无毒无害的小分子物质。
球形红细菌(Rhodobacter sphaeroides)属于光合细菌紫色非硫菌群的红细菌属, 它是兼性细菌, 也是益生菌。它既能在厌氧条件下利用光照进行生长, 也能在好氧条件下利用有机物生长[9]。因此, 相比较其他细菌, 更具有优越性。前期研究表明, 菌株Rhodobacter sphaeroides 能以2, 4-DNT为唯一有机碳源72 h将其完全转化, 120 h彻底矿化[10]; 球形红细菌生物转化2, 4-二硝基甲苯(2, 4-DNT)过程中会生成重要的中间产物2-氨基-4-硝基甲苯(2A4NT)和4-氨基-2-硝基甲苯(4A2NT)[11], 而2, 4-DNT能否被高效还原为这两种中间产物直接影响2, 4-DNT的最终矿化, 硝基还原酶是该生物转化过程中的关键酶。为此, 本研究在文献[10]和[11]的基础上, 对不同氮源、中间产物变化过程及硝基还原酶性质进行深入研究, 进一步确定了反应条件、明确了硝基还原酶的性质, 为今后在硝基苯类化合物废水污染治理中的应用提供理论依据。
2 实验部分 2.1 试剂和仪器球形红细菌(Rhodobacter sphaeroides)H菌株系紫色非硫菌群红细菌属光合细菌, 由山西大学光合细菌研究室分离、鉴定并保存[12]; 2, 4-二硝基甲苯(2, 4-DNT, 纯度99%)、2-氨基-4-硝基甲苯(2A4NT, 纯度99%)、4-氨基-2-硝基甲苯(4A2NT, 纯度99%), 2, 4-二氨基甲苯(2, 4-DAT, 99%), 均购自阿拉丁公司。
美国Waters公司的E2695型高效液相色谱仪(HPLC); 宁波新芝科学器材研究所的JY92-Ⅱ型超声波细胞破碎仪; 上海安亭科学仪器厂的LXJ-ⅡB型低速大容量多管离心机和TGL-16G高速冷冻离心机; 北京六一生物科技有限公司的DYCZ-24A型电泳仪; 上海嘉鹏科技有限公司的ZF-368型凝胶成像系统; 上海龙尼柯仪器有限公司的WFZ UV-200型紫外可见分光光度计。
2.2 培养基的配制基础培养基参照文献[12]进行配置:苹果酸2.5 g、酵母膏1.0 g、(NH4)2SO4 1.25 g、MgSO4 0.2 g、CaCl2 0.07 g、KH2PO4 0.6 g、K2HPO4 0.9 g、蒸馏水1000 mL, pH值为7.0。
液体驯化培养基:将2, 4-DNT作为唯一有机碳源配制培养基, 使2, 4-DNT溶于甲醇溶液中, 待甲醇挥发后直接加入除苹果酸以外基础培养基。
2.3 不同氮源对球形红细菌生长及转化2, 4-DNT的影响试验实验考察了不同有机氮源(酵母膏、牛肉膏、蛋白胨、尿素), 不同无机氮源(NH4NO3、(NH4)2SO2、KNO4), 复合氮源: (NH4NO3/酵母膏、(NH4)2SO2/酵母膏)对球形红细菌转化2, 4-DNT的影响。按照文献[10]实验方法, 在最适条件下接种球形红细菌, 培养36 h后取样, 用高效液相色谱仪(HPLC)测定溶液中残留的2, 4-DNT浓度, 并用紫外可见分光光度计在590 nm处测定细菌的吸光度, 以OD590表示, 各设3个平行样。
2.4 球形红细菌转化2, 4-DNT及其中间产物试验参照文献[10]方法, 在最适条件下接种球形红细菌, 在0,24,48,72,96,120 h各取10 mL样品, 用高速离心机在8000 r·min-1离心10 min。上清液中残留的2, 4-DNT、生成的2A4NT、4A2NT和2, 4-DAT浓度用HPLC测定, 各设3个平行样。
2.5 分析方法2, 4-DNT、2A4NT、4A2NT和2, 4-DAT通过高效液相色谱仪(HPLC)测定, 选用的色谱柱为C18反相柱(250 mm×4.6 mm×5 μm), 20 ℃下测量, 流速为0.9 mL·min-1, 流动相为0~6 min为50%(V/V)甲醇, 7~10 min为70%(V/V)甲醇。探测波长设定为254 nm, 进样体积为20 μL。
2, 4-DAT的流动相为乙晴:磷酸盐缓冲液(20 mmol·L-1, pH 7.0)(30:70, V/V), 流速为0.9 mL·min-1, 检测波长为224 nm, 进样体积为20 μL。
2.6 粗酶液的制备参照文献[13]的方法。取培养好的菌液, 用8000 r·min-1高速离心10 min, 收集菌体, 用33 μmol·L-1 pH 7.5的Tris-HCl缓冲液洗涤2次, 悬浮于1 mL的缓冲液中。将其在冰水浴条件下用超声波细胞粉碎仪破碎细胞, 破碎20 min(每次间隔3 s破碎1 s)。然后, 在10000 r·min-1的高速冷冻离心机中离心10 min, 弃沉淀, 上清液即细胞粗酶液, 于-20 ℃保存备用。
2.7 SDS-聚丙烯酰胺凝胶电泳考察了在培养条件下, 2, 4-DNT的初始浓度分别为0,20,40,60,80 mg·L-1和初始pH值分别为5,6,7,8,9, 对全细胞进行SDS-聚丙烯凝胶电泳的影响。参照文献[14]的方法, 对制备的粗酶液进行聚丙烯酰胺凝胶电(PAGE), 电泳在垂直电泳装置中进行, 分离胶质量浓度为12%, 浓缩胶质量浓度, 4%, 每点样孔加样量30 μL(取15 μL的样品, 加入等体积的SDS上样缓冲液, 煮沸2 min)。先恒压100 V, 样品通过浓缩胶后恒压120 V。电泳结束后进行考马斯亮蓝G-250染色, 染色1 h后, 进行脱色, 直到背景变清晰后进行拍照。
2.8 Native-聚丙烯酰胺凝胶电泳Native-PAGE是在变性的SDS-PAGE基础上, 将蛋白变性剂SDS和巯基乙醇去除, 使得蛋白在电泳中依旧可以保持其天然的活性。考察了在培养基中2, 4-DNT的初始浓度为0,20,40,60,80 mg·L-1和初始pH值为5,6,7,8,9条件下, 对硝基还原酶同工酶的影响。电泳在垂直电泳装置中进行[15], 分离胶为10%, 浓缩胶为4%, 加样量为30 μL, 电泳开始时先恒定电压为90 V, 样品通过浓缩胶后, 恒定电压为120 V。电泳结束后, 进行活性染色。活性染色液体系为: 20 mmol·L -1Tris-HCl缓冲液(pH值为7.5), 50 μmol·L -1NADH, 50 μmol·L -1 2, 4-DNT, 30 μmol·L -1氮蓝四唑, 总体积为500 mL。在30 ℃下温育30 min, 直到紫色条带出现, 用凝胶成像系统进行拍照。
2.9 硝基还原酶的动力学参数采用米氏方程[15]来确定硝基还原酶的米氏常数Km和最大反应速率vmax。取0.02~0.32 mmol·L-1的2, 4-DNT作为底物, 加入20 mmol·L-1 Tri-HCl缓冲液(pH 7.0), 60 μmol·L-1 NADPH, 0.2 mL的粗酶液, 在30 ℃下进行反应, 在波长为340 nm条件下, 采用紫外可见分光光度计测定NADH的消耗量。以酶的反应速度对不同底物的浓度作图, 并按Lineweaver-Burk作图法[15]计算动力学表征参数vmax和Km。
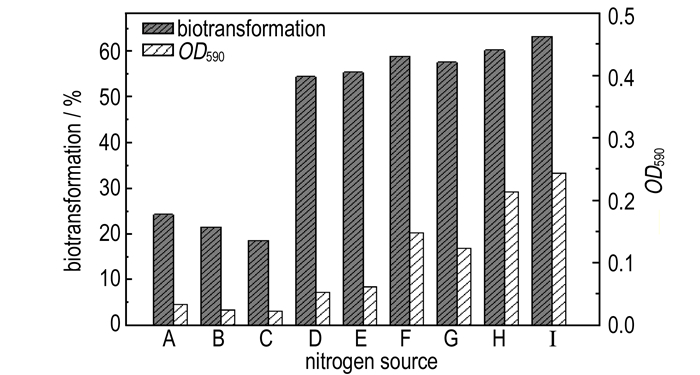
3 结果与分析 3.1 不同氮源对球形红细菌的生长及转化2, 4-DNT的影响实验考察了有机氮源、无机氮源、复合氮源对球形红细菌的生长及转化2, 4-DNT效果的影响, 如图 1所示。
|
图 1 降解36 h内不同氮源对球形红细菌生长及转化2, 4-DNT的影响 A—(NH4)2SO4, B—NH4NO3, C—KNO3, D—尿素, E—蛋白胨, F—酵母膏, G—牛肉膏, H—酵母膏/NH4NO4, I —酵母膏/(NH4)2SO4 Fig.1 Effect of different nitrogen sources on 2, 4-DNT biotransformation and Rhodobacter sphaeroides growth during 36 h of degradation A—(NH4)2SO4, B—NH4NO3, C—KNO3, D—urea, E—peptone, F—yeast extract, G—beef extract, H—yeast extract/NH4NO4, I —yeast extract/(NH4)2SO4 |
由图 1可看出, 有机氮源包括尿素、蛋白胨、牛肉膏、酵母膏对2, 4-DNT的转化率分别为54.4%、55.4%、57.6%和58.9%, OD590值分别为0.05、0.06、0.13和0.15, 其效果表现为酵母膏>牛肉膏>蛋白胨>尿素。比较无机氮源(NH4)2SO4、NH4NO3和KNO3, 其转化率分别为24.3%、21.4%和18.6%, OD590值分别为0.033、0.025和0.018。复合氮源组合以酵母膏为有机氮源时, 添加无机氮源(NH4)2SO2时效果最佳, 36 h转化率为63.3%; OD590最大, 为0.24;而添加无机氮源NH4NO3时, 转化效果为60.2%, OD590值为0.22。结果显示, 添加复合氮源36 h的转化率在60%以上; 添加有机氮源时转化率均达到50%左右; 而添加无机氮源时, 转化率仅有20%左右。因此, 有机氮源比无机氮源更有利于2, 4-DNT的生物转化和球形红细菌的生长, 但低于复合氮源对2, 4-DNT的转化和球形红细菌的生长。
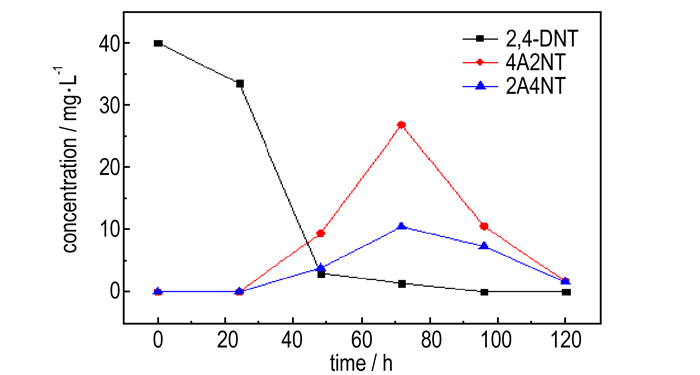
3.2 球形红细菌生物转化2, 4-DNT的中间产物及其分析之前的研究[11]表明球形红细菌转化2, 4-DNT过程中产生两种中间产物2-氨基-4-硝基甲苯(2A4NT)和4-氨基-2-硝基甲苯(4A2NT), 不同时间点的浓度如图 2所示。
|
图 2 2, 4-DNT及生物转化产物在不同采样时间点的浓度 Fig.2 The concentrations of 2, 4-DNT and biotransformation products at different sampling time |
由图 2可知, 这两种中间产物开始出现的时间为降解24 h之后, 72 h浓度达到最大, 120 h内被完全转化。值得注意的是, 24 h后4A2NT和2A4NT两种中间产物出现时, 4A2NT的总量远大于2A4NT, 这与之前的一些研究结果一致[16-17]。
在研究中可以发现, 4A2NT的转化速率比2A4NT的速率快, 因此, 相比较邻位硝基比对位硝基位置更开阔, 溶剂化程度相对更高, 所以更容易接受电子进行下一步的还原。但在转化过程中, 并未检测到2, 4-DAT, 表明两种中间产物4A2NT和2A4NT均没有进一步还原为2, 4-DAT。
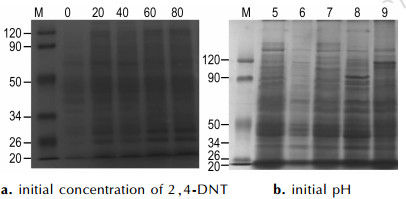
3.3 SDS-聚丙烯酰胺凝胶电泳分析不同培养条件下, 球形红细菌降解2, 4-DNT的细菌全细胞蛋白电泳如图 3, 左侧数据为标准蛋白的分子质量。图 3a和图 3b分别表示不同浓度2, 4-DNT和不同初始pH对全细胞蛋白的影响。图 3a中各个泳道分别为2, 4-DNT的初始浓度为0, 20, 40, 60, 80 mg·L-1, 图 3b中各个泳道分别为初始培养pH为5, 6, 7, 8, 9下球形红细菌在降解2, 4-DNT过程中的全细胞蛋白的变化, 这5个泳道共有14条主蛋白带, 其分子质量主要密集在26~120 kD。
|
图 3 不同培养条件下球形红细菌全细胞蛋白电泳 Fig.3 Whole cell protein electrophoresis of Rhodobacter sphaeroides under various culture conditions |
图 3a可看出泳道1的蛋白条带颜色较浅, 说明其蛋白含量较低; 泳道5的蛋白条带颜色较深, 但其条带较密, 分辨率较差; 而在泳道2、泳道3、泳道4, 其蛋白含量较高, 且条带清晰。分子质量主要分布在26~120 kD。从图 3b中可看出, pH值为6时, 其泳道的颜色较浅, 蛋白含量较低; 在pH为5和9时, 泳道1和泳道5的条带出现了拖尾现象, 分辨率较差; 而泳道3和泳道4的蛋白含量高, 且分辨率较好。
从以上结果上可以看出, 不同反应条件下条带数量并无差异, 但是条带颜色深浅、蛋白条带强度明显有所不同, 所以2, 4-DNT初始浓度和初始pH的变化会影响全细胞蛋白含量。这是由于当2, 4-DNT的浓度和pH值发生变化时, 会影响球形红细菌的生长, 从而影响蛋白酶量变化[18]。
3.4 硝基还原酶的同工酶谱分析硝基还原酶的同工酶谱如图 4所示。图 4a和图 4b分别表示不同浓度2, 4-DNT和不同初始pH对硝基还原酶的影响。采用Genetool软件分析各个泳道的条带, 使用峰高来表示各个条带的表达量, 结果如表 1和表 2所示。

|
图 4 不同培养条件下球形红细菌中硝基还原酶的同工酶谱 Fig.4 The patterns of isoenzymes of nitroreductase in Rhodobacter sphaeroides under various culture conditions |
| 表 1 不同初始浓度下球形红细菌中硝基还原酶的同工酶表达量 Tab.1 Expressive value of the pattern of isoenzyme of nitroreductase in Rhodobacter sphaeroides under different initial concentration |
| 表 2 不同初始pH下球形红细菌中硝基还酶原的的同工酶表达量 Tab.2 Expressive value of the pattern of isoenzyme of nitroreductase in Rhodobacter sphaeroides under different initial pH |
由图 4可知, 球形红细菌中的硝基还原酶在不同条件处理组都表达出4种同工酶, 可以看出在变化初始2, 4-DNT的浓度和初始pH条件下, 不会诱导其他酶, 且对第一种同工酶和第二种同工酶的影响不大。在pH=7, 不同初始2, 4-DNT浓度条件下, 将图 4a中的A (0 mg·L-1)设为对照组, 从表 1可知, 2, 4-DNT的初始浓度对第三和第四种同工酶明显有所差别, B(20 mg·L-1)、C(40 mg·L-1)、D(60 mg·L-1)的表达明显高于对照组, 随着2, 4-DNT初始浓度的变化至80 mg·L-1(E)时, 表达明显变弱, 且第三种和第四种同工酶影响较大; 在初始浓度为40 mg·L-1, 不同pH条件下, 将图 4b中的H(pH=7)设为对照组, 表 2结果可知, 初始pH变化对第三种和第四种同工酶影响较大, 且F(pH=5)、G(pH=6)、I (pH=8)、J(pH=9)的表达明显低于对照组H, 初始pH=7时, 其第三种和第四中同工酶表达量达到最大, 分别为60489、62511。
结果表明, 当2, 4-DNT的初始浓度和初始pH发生变化时, 硝基还原酶的活性发生了变化, 这说明硝基还原酶的活性与2, 4-DNT的初始浓度、pH存在的一定的相关性。2, 4-DNT初始浓度发生变化时, 硝基还原酶的酶活变化是由于没有2, 4-DNT存在时, 碳源的缺乏会影响体系中硝基还原酶酶量的产生, 从而影响硝基还原酶活力, 而2, 4-DNT浓度过高会导致细胞产生毒性, 阻碍降解菌的生长, 从而影响硝基还原酶活力[18]; pH值会影响酶活性催化集团的解离状态, 因此pH的改变会使得酶活性中心的基团解离, 从而影响酶的活性[19]。另外, 降解2, 4-DNT以及菌株生长的最适条件为中性[10], 此时产生的硝基还原酶酶量较多, 相应的硝基还原酶的活性较高[20]。这种结果变化趋势与之前研究[11]的硝基还原酶酶活性变化趋势一致。
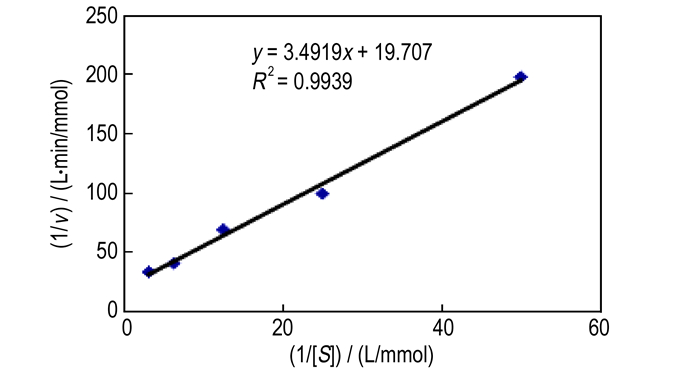
3.5 硝基还原酶的动力学参数硝基还原酶的动力学参数符合米氏方程, 按照Lineweaver-Burk的双倒数法(图 5)求出, 结果如表 3所示。由图 5可得出其方程为y=3.4919 x+19.707(R2=0.9939), 由该方程的截距和斜率很容易得出硝基还原酶的动力学参数 vmax和Km分别为0.0507 mmol·(L·min) -1和0.1772 mmol·L-1。越低的Km说明酶与底物反应更加完全。
|
图 5 硝基还原酶反应速率的倒数(1/v)与底物浓度倒数(1/[S])之间的关系 Fig.5 The relationship between 1/v and 1/[S] of nitroreductase (v is reaction rate, [S] is concentration of substrate) |
| 表 3 硝基还原酶的动力学参数 Tab.3 Kinetic parameters of the nitroreductase |
(1) 在球形红细菌生物转化2, 4-DNT的过程中, 有机氮源比无机氮源转化2, 4-DNT的效果好, 复合氮源比有机氮源更有利于细菌生长和对2, 4-DNT的生物转化。因此, 确定了最佳氮源为复合氮源(酵母膏/(NH4)2SO2)。
(2) 进一步研究发现, 在降解24 h后, 4-氨基-2-硝基甲苯的含量比2-氨基-4硝基甲苯的含量高, 但均没有进一步还原为2, 4-二氨基甲苯(2, 4-DAT)。
(3) 硝基还原酶是球形红细菌生物转化2, 4-DNT生成4A2NT和2A4NT两种中间产物的关键酶。2, 4-DNT的初始浓度为20、40和60 mg·L-1时, 对球形红细菌产生硝基还原酶活力有明显的促进作用, 而当2, 4-DNT浓度为80 mg·L-1时, 会对硝基还原酶的活力起到抑制作用; 当pH值为7时, 硝基还原酶活力最高。硝基还原酶为球形红细菌生物转化2, 4-DNT中的关键酶, 其动力学参数最大反应速率vmax和米氏常数Km分别为0.0507 mmol/(L·min)-1和0.1772 mmol·L-1。
后续研究拟将分离纯化一种天然的球形红细菌硝基还原酶,并克隆得到一种球形红细菌硝基还原酶基因及其重组蛋白。这些研究将为芳香硝基化合物还原提供一种新的生物催化剂和酶源, 为其在化学工业及环境修复中的应用提供理论指导和技术支持。
| [1] |
Christopher H J, Boardman G D, Freedman D L. Aerobic biological treatment of 2, 4-dinitrotoluene in munitions plant wastewater[J].
Water Research, 2000, 34(5): 595-1603. |
| [2] |
Hughes J B, Wang C Y, Zhang C L. Anaerobic biotransformation of 2, 4-dinitrotoluene and 2, 6-dinitrotoluene by Clostridium acetobutylicum: A pathway through dihydroxylamino intermediates[J].
Envrionmental Science and Technology, 1999, 33(7): 1065-1070. |
| [3] |
Smock L A, Stoneburner D L, Clark J R. The toxic effects of trinitrotoluene (TNT) and its primary degradation products on two species of algae and the fathead minnow[J].
Water Research, 1976, 10(6): 537-543. DOI:10.1016/0043-1354(76)90191-3 |
| [4] |
Keith L, Telliard W. Priority Pollutants: I-a Perspective View[J].
Environmental Science and Technology, 1979, 13(4): 416-423. |
| [5] |
Cheng J, Suidan M T, Venosa A D. Anaerobic biotransformation of 2, 4-dinitrotoluene with ethanol, methanol, acetic acid and hydrogen as primary substrates[J].
Water Research, 1998, 32(10): 2921-2930. DOI:10.1016/S0043-1354(98)00089-X |
| [6] |
黄杰勋, 陈星, 李非里, 等. 厌氧条件下Shewanella oneidensis MR-1对2, 4-二硝基甲苯的还原转化[J].
微生物学通报, 2013, 40(9): 1734-1741. HUANG Jie-xun, CHEN Xing, LI Fei-li, et al. Reductive biotransformation of 2, 4-dinitrotoluene by Shewanella oneidensis MR-1 under anaerobic conditions[J]. Microbiology China, 2013, 40(9): 1734-1741. |
| [7] |
Snellinx Z, Taghavi S, Vangronsveld J, et al. Microbial consortia that degrade 2, 4-DNT by interspecies metabolism: isolation and characterisation[J].
Biodegradation, 2003, 14(1): 19-29. DOI:10.1023/A:1023539104747 |
| [8] |
Nishino S F, Paoli G C, Spain J C. Aerobic Degradation of Dinitrotoluenes and Pathway for Bacterial Degradation of 2, 6-Dinitrotoluene[J].
Appilied and Environmental Microbiology, 2000, 66(5): 2139-2147. DOI:10.1128/AEM.66.5.2139-2147.2000 |
| [9] |
龙思思, 谢数涛, 段舜山, 等. 光合细菌及其应用现状[J].
生态科学, 2002, 21(1): 91-94. LONG Si-si, XIE Shu-tao, DUAN Shun-shan, et al. Photosynthetic bacteria and their applied actualities[J]. Ecological Science, 2002, 21(1): 91-94. |
| [10] |
梁芳楠, 白红娟, 柴春镜, 等. 球形红细菌厌氧降解2, 4-二硝基甲苯(英文)[J].
微生物学通报, 2016, 42(2): 279-284. LIANG Fang-nan, BAI Hong-juan, CHAI Chun-jing, et al. Anaerobic biodegradation of 2, 4-dinitrotoluene by Rhodobacter sphaeroides[J]. Microbiology China, 2016, 42(2): 279-284. |
| [11] |
白红娟, 王寿艳, 梁芳楠, 等. 球形红细菌降解2, 4-二硝基甲苯的途径及酶学性质[J].
火炸药学报, 2017, 40(5): 82-87. BAI Hong-juan, WANG Shou-yan, LIANG Fan-nan, et al. Degradation pathway and properties of enzyme of 2, 4-dinitroluene by Rhodobacer sphaeroides[J]. Chinese Journal of Explosives and Propellants, 2017, 40(5): 82-87. |
| [12] |
姚竹云, 张肇铭. 几株光合细菌的表型特征及DNA-DNA同源性分析[J].
应用与环境生物学报, 1996, 2(1): 84-89. YAO Zhu-yun, ZHANG Zhao-ming. Phenotypic features and DNA-DNA homologyanalyses of some photosynthetic bacteria[J]. Chinese Journal of Applied and Environmental Biology, 1996, 2(1): 84-89. |
| [13] |
Oh B T, Sarath G, Shea P J. TNT nitroreductase from a Pseudomonas aeruginosa strain isolated from TNT-contaminated soil[J].
Soil Biology & Biochemistry, 2001, 33(7): 875-881. |
| [14] |
Simpson R J. Proteins and proteomics :a laboratory manual[J].
Journal of Proteome Research, 2003, 3(4): 694-694. |
| [15] |
谢波. 链霉菌催化芳香硝基还原及其关键酶的分离与克隆表达[D]. 大连: 大连理工大学, 2010.
XIE Bo. Streptomyces-catalyzed nitroaromatic reduction and the purification, cloning and expression of its nitroreductase[D]. Dalian : Dalian University of Technology, 2010. |
| [16] |
Bradley P M, Chapelle F H, Landmeyer J E, et al. Microbial transformation of nitroaromatics in surface soils and aquifer materials[J].
Applied & Environmental Microbiology, 1994, 60(6): 2170-2175. |
| [17] |
Noguera D R, Freedman D L. Reduction and Acetylation of 2, 4-Dinitrotoluene by a Pseudomonas aeruginosa Strain[J].
Applied & Environmental Microbiology, 1996, 62(7): 2257-63. |
| [18] |
刘波, 熊健, 吕浩, 何冰芳, 等. 生物质对红球菌属菌株lawq生长和脱硫酶活力的影响[J].
化学工程, 2005, 33(6): 35-39. LIU Bo, XIONG Jiang, HE Bing-fang, , et al. Effect of biomaterials on the growth of Rhodococcus sp. strain lawp and the activities of desulfurization enzymes[J]. Chemical Engineering, 2005, 33(6): 35-39. |
| [19] |
曾庆梅, 潘见, 谢慧明, 等. 超高压处理对砀山梨汁中过氧化物酶活性的影响[J].
农业工程学报, 2004, 20(4): 199-202. ZENG Qing-mei, PAN Jian, XIE Hui-ming, et al. Effect of high pressure treatment on peroxidase activity in pear juice[J]. Transactions of the Chinese Society of Agricultural Engineering, 2004, 20(4): 199-202. |
| [20] |
高璇, 王亮亮, 李响, 等. 金针菇产漆酶发酵条件的优化[J].
资源开发与市场, 2013, 29(7): 683-685. GAO Xuan, WANG Liang-liang, LI Xiang, et al. Optimization of Flammulia velutipes fermentation for laccase production[J]. Resource Development & Market, 2013, 29(7): 683-685. |

The important intermedimates, 2-amino-4-nitrotoluene and 4-amino-2-nitrotoluene, produced during the biotransformation of 2, 4-dinitrotoluene by Rhodobacter sphaeroides were studied. Nitroreductase is a key enzyme in the biotransformation of 2, 4-dinitrotoluene. The pattern of isoenzymes of nitroreductase was analyzed using native-PAGE method.




