硝基氮杂环化合物[1-2]作为新型氮杂环化合物的重要代表, 具有爆炸性能高、感度低、热安定性好的特点。1-甲基-3, 4, 5-三硝基吡唑(MTNP)作为一种新型高能钝感低熔点单质炸药, 具有良好的爆炸性能和对冲击或点火具有较低的敏感性[3]。其熔点91.5 ℃, 氧平衡-25.81%, 密度1.83 g·cm-3, 爆炸热5.25 kJ·g-1, 爆速8.65 km·s-1, 爆压33.65 GPa[4]。爆轰性能与环三亚甲基硝胺(RDX)相当, 感度接近B炸药[4-6](TNT与RDX的混合炸药)。所有这些特征表明, MTNP可以作为替代TNT和RDX熔铸炸药载体的潜在含能材料。
目前, 许多研究都集中在MTNP的合成上, 只有少数研究者试图建立纯化的方法来获得高纯度产物[7]。但通过合成反应获得MTNP纯度低、晶体形状不规则、晶体缺陷多、流散性差等, 导致其直接使用时, 综合性能不能完全体现出来, 制约了其在炸药以及武器上的应用。而结晶对改善MTNP的综合性能变得尤为关键。在结晶过程中, 溶剂的选择、结晶温度、过饱和度、搅拌强度等外部因素都会影响晶体的生长, 因此需要对MTNP的结晶过程进行研究。
本研究采用重力法测定了MTNP在不同溶剂中的溶解度, 通过Apelblat方程和vant′t Hoff方程拟合了溶解度数据, 讨论了温度对溶解度的影响, 并且研究其热力学行为, 对产品的晶体形貌和安全性能进行了表征, 筛选出结晶的最佳溶剂, 为MTNP结晶提供了基础数据。
2 实验部分 2.1 药品及仪器试剂: MTNP, 结晶后纯度大于99.0%(如图 1所示), 实验室自制[8];苯, 甲醇, 无水乙醇, 分析纯, 正丙醇, 异丙醇, 正丁醇, 异丁醇, 正戊醇, 异戊醇, 均为分析纯, 天津市福辰化学试剂厂; 蒸馏水, 实验室自制。

|
图 1 MTNP高效液相谱图 Fig.1 High performance liquid chromatogram of MTNP |
仪器:恒温水浴槽, 精度±0.01 ℃, 巩义市予华仪器有限责任公司; 磁力搅拌器, 巩义市予华仪器有限责任有限公司; 水浴锅, SYD-100型, 杭州仪表电机有限公司; 搅拌器, JJ-1型, 北京市永光明仪器有限公司; 抽滤机, SHZ-CA型, 巩义市予华仪器有限责任有限公司; 分析天平, 精度±0.0001 g, 梅特勒-托利多仪器有限公司; 真空干燥箱, 上海博讯实业有限公司; BT-2002激光粒度分布仪, 丹东市百特仪器有限公司; WL-1型立式落锤仪, 中北大学; 电子显微镜, XSP-10A型, 上海光学仪器厂。
2.2 溶解度测定方法重力法的原理是在恒定温度下, 将过量的溶质(固体)加入到溶剂中, 对体系充分搅拌直至固液相平衡, 静置并待液相中未溶解的固相溶质彻底沉降到底部后, 吸取上层清液, 分析测定被测溶解组分含量, 从而由溶剂中溶解的固体质量确定所测温度的溶解度[9-10]。
在一定温度下, 将过量的MTNP溶于100 mL的被测溶剂中, 在搅拌状态下保温8 h, 静置5 h; 用移液管抽取上层清液约15 mL移入到3个已知重量的10 mL玻璃瓶中, 并立即称取其总重量, 将溶剂完全蒸发, 干燥并称量溶质MTNP的重量, 计算得到该温度点MTNP的溶解度; 重复上述步骤测定下一温度点的溶解度。
2.3 结晶实验步骤在四口烧瓶中加入约50 mL的溶剂, 根据所测溶解度数据加入相应的MTNP; 起始温度50 ℃, 搅拌速率300~400 r·min-1下恒温搅拌30 min; 降温速率为0.1 ℃·min-1降温至10 ℃, 确保更多的MTNP析出; 抽滤、干燥; 对产品进行表征。
3 结果与讨论 3.1 溶解度的计算MTNP的溶解度由摩尔分数表示, 如式(1)所示:
| $ {x_1} = \frac{{{m_1}/{M_1}}}{{{m_1}/{M_1} + {m_2}/{M_2}}} $ | (1) |
式中, x1表示MTNP的摩尔分数; m1、m2分别为MTNP和溶剂的质量, g; M1、M2分别为MTNP和溶剂的相对分子质量。
3.2 溶解度模型 3.2.1 Apelblat方程Apelblat方程[11]是由Clausius-Clapeyron方程[12]推导出的半经验公式, 关联了溶解度与温度之间的关系,见式(2):
| $ {\rm{ln}}{x_1} = A + \frac{B}{T} + C{\rm{ln}}T $ | (2) |
式中, A、B、C为常数, T为开尔文温度, K。
3.2.2 vant′t Hoff方程根据固-液平衡的热力学原理, vant′t Hoff方程[13]可用于描述溶解度摩尔分数的对数与温度之间的关系, 见式(3):
| $ {\rm{ln}}{x_1} = a + \frac{b}{T} $ | (3) |
式中, a、b为常数, T为开尔文温度, K。
3.3 拟合结果准确性评价方程本研究采用平均绝对百分比偏差(MAPD)对实验数据准确性进行评价, 见式(4):
| $ {\rm{MAPD}} = \frac{{100}}{n} \times \sum\limits_{i = 1}^n {|\frac{{{x^{\rm{e}}} - {x^{\rm{c}}}}}{{{x^{\rm{e}}}}}|} $ | (4) |
式中, xe和xc分别代表MTNP的实验值和计算值, n表示每种溶剂组成实验数据的个数。
3.4 溶解度拟合图用Apelblat方程对不同温度下的溶解度数据拟合, 拟合结果如图 2所示。

|
图 2 不同温度下Apelblat模型关联MTNP溶解度的曲线 Fig.2 Curves of solubility data correlated by the Apelblat equation for MTNP at different temperature |
图 2显示MTNP在溶剂中的溶解度都是随着温度的升高而增加, 且与Apelblat方程关联溶解度曲线较吻合。MTNP在苯、甲醇和无水乙醇中的溶解度值随温度的升高而变化明显。
3.5 模型参数Apelplat方程和vant′t Hoff方程拟合实验值的模型参数见表 1和表 2。
| 表 1 不同溶剂中Apelplat方程关联的模型参数 Tab.1 Model parameters, MAPD and R2, correlated by the Apelblat equation in different solvents |
| 表 2 不同溶剂中vant′t Hoff方程关联的模型参数 Tab.2 Model parameters, MAPD and R2, correlated by the vant′t Hoff equation in different solvents |
表 1和表 2显示, 各溶剂中R2接近于1, 且MAPD均小于5.18%说明两个方程能较好地拟合溶解度数据。
3.6 标准溶解焓、标准溶解熵和标准吉布斯自由能的估算MTNP的溶解度和绝对温度之间的关系[14-15]见公式(5):
| $ {\rm{ln}}{x_1} = - \frac{{{\Delta _{{\rm{dis}}}}{H^\mathit{\Theta} }}}{{RT}}{\rm{ }} + \frac{{{\Delta _{{\rm{dis}}}}{S^\mathit{\Theta} }}}{R} $ | (5) |
式中, R代表气体常数, 8.3145 J·mol-1·K-1; ΔdisHΘ和ΔdisSΘ分别表示标准溶解焓和标准溶解熵。ΔdisHΘ和ΔdisSΘ分别从vant′t Hoff方程的截距和斜率对应算出[16]。在溶剂中MTNP的标准吉布斯自由能为[17]:
| $ {\Delta _{{\rm{dis}}}}{G^\mathit{\Theta} } = {\Delta _{{\rm{dis}}}}{H^\mathit{\Theta} } - {T_{{\rm{mean}}}}\cdot{\Delta _{{\rm{dis}}}}{S^\mathit{\Theta} } $ | (6) |
其中, 平均温度[18]的定义式如下:
| $ {T_{{\rm{mean}}}} = \frac{{n}}{{\sum\nolimits_n^{i = 1} {\frac{1}{{{T_i}}}} }} $ | (7) |
式中, n代表测定溶解度的温度点个数; Ti为实验温度, K。
通过式(7)计算得到Tmean=303.15 K。
溶解过程中焓变和熵变对标准吉布斯自由能的相对贡献值[19-20]由以下两式计算:
| $ \% {\zeta _H} = \frac{{{\Delta _{{\rm{dis}}}}{H^\mathit{\Theta} }}}{{|{\Delta _{{\rm{dis}}}}{H^\mathit{\Theta} }| + |{\rm{ }}{T_{{\rm{mean}}}}{\Delta _{{\rm{dis}}}}{S^\mathit{\Theta} }|}} \times 100 $ | (8) |
| $ \% {\zeta _S} = \frac{{|{\rm{ }}{T_{{\rm{mean}}}}{\Delta _{{\rm{dis}}}}{S^\mathit{\Theta} }|}}{{|{\Delta _{{\rm{dis}}}}{H^\mathit{\Theta} }| + |{\rm{ }}{T_{{\rm{mean}}}}{\Delta _{{\rm{dis}}}}{S^\mathit{\Theta} }|}} \times 100 $ | (9) |
根据以上公式计算得到的ΔdisHΘ、ΔdisSΘ、ΔdisGΘ、%ζH和%ζS见表 3。
| 表 3 MTNP在不同溶剂中的热力学函数值 Tab.3 Thermodynamic function values of MTNP in different solvents |
由表 3可以看出:在溶剂中, 标准吉布斯自由能由小到大的顺序为:苯 < 甲醇 < 乙醇 < 正丙醇 < 正戊醇 < 正丁醇 < 异戊醇 < 异丙醇 < 异丁醇 < 水, 并且ΔdisGΘ在所有溶剂中为正值, 表明MTNP的溶解是一个非自发过程, 此外ΔdisHΘ在所有溶剂中也为正值, 表明MTNP的溶解是一个吸热过程。另外, 在每一种溶剂中, %ζH始终大于%ζS, 对于混合吉布斯自由能来说, 关键是焓而不是熵起作用。
3.7 固液表面张力及表面熵因子表面张力(γ)是晶体物理性质的主要物理量, 决定晶体的生长机理。式(10)由Meresmann[21]推导得出, 如下:
| $ \gamma = 0.414kT{({\rho _{\rm{c}}}{N_{\rm{A}}})^{\frac{2}{3}}}{\rm{ln}}\left( {\frac{{{\rho _{\rm{c}}}}}{{{C_{{\rm{eq}}}}}}} \right) $ | (10) |
式中, NA表示Avogadro常数, 6.02×1023 mol-1; k为玻尔兹曼常数, 1.3806×10-23 J·K-1; γ为晶体密度, g·cm-3; Ceq为晶体溶解度, g·100 g-1。
表面熵因子(f)是用于表征晶体表面在原子水平上光滑程度的参数。Barata等[22]利用晶体的固液表面张力, 分子体积和温度来近似估算表面熵因子:
| $ f = {\rm{ }}\frac{{4{V^{2/3}}\gamma }}{{kT}}{\rm{ }} $ | (11) |
式中, V为分子体积, m3。
| $ V = \frac{M}{{\rho {N_{\rm{A}}}}} \times {10^{ - 6}} $ | (12) |
式中, M为物质的摩尔分数; ρ为密度, g·cm-3; NA为Avogadro常数, 6.02×1023 mol-1。
根据实验测定的溶解度数据, 计算了MTNP在不同溶剂中不同温度下的表面张力和表面熵因子, 见图 3。
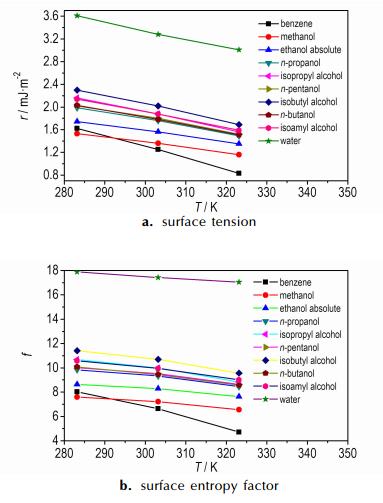
|
图 3 MTNP在不同溶剂中不同温度下的晶体表面张力和晶体表面熵因子 Fig.3 Surface tension and surface entropy factor of the crystal for MTNP at different temperatures in different solvents |
由图 3可以看出:随着温度的升高, 表面张力和表面熵因子都减小。另外, 表面张力和表面熵因子的曲线图随温度变化趋势大致相同。
3.8 溶剂对结晶晶体性能的影响根据以上研究, 选取溶解度较高的苯、甲醇和无水乙醇作为MTNP的结晶溶剂, 研究溶剂对晶体性能的影响。
3.8.1 晶体形貌表征采用显微镜100倍放大后得到四种产品晶型, 如图 4所示。
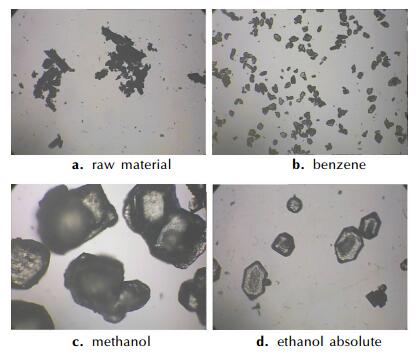
|
图 4 不同溶剂中MTNP的晶体显微照片(×100) Fig.4 The crystal micrographs of MTNP (×100) in different solvents |
由图 4发现粗品(图 4a)的晶体形状最不规则, 棱角最多; 经无水乙醇(图 4d)降温结晶的晶体结构最规整, 呈类球形, 棱角少, 没有团聚现象, 表面光滑且透明; 经苯(图 4b)降温结晶和经甲醇(图 4c)降温结晶的晶型规整程度居中。
3.8.2 撞击感度参照GJB772A-1997的方法测试前述4种样品的撞击感度。测试条件为:锤重(10±0.01) kg, 落高(25±0.1) cm, MTNP试样量(20±1) mg。25发实验为一组, 取平均值,用爆炸百分数表示感度大小。
粗品、苯降温结晶、甲醇降温结晶和无水乙醇降温结晶的撞击感度分别为92%、80%、76%、68%。与图 4对照, 可以得出:晶体结构越规整, 其撞击感度越低。
3.8.3 粒度分析为考察粒度对撞击感度的影响, 利用百特激光粒度仪, 测试前述4种样品的粒度,其中位径分别为112.37, 37.78, 120.85 μm和330.19 μm。可见,无水乙醇结晶的产品中位径最大, 苯结晶的产品中位径最小, 这与结晶时的搅拌速率和降温快慢有关。随炸药粒度的增大, 撞击感度增加。将各粒度值与撞击感度比对发现此规律并不明显, 说明晶形对MTNP撞击感度的影响要比粒度的影响更显著。
4 结论(1) 采用重力法测定了MTNP在不同温度下不同溶剂中的溶解度。结果表明, MTNP的溶解度随温度的升高而增加, 溶解度值由大到小顺序为:苯>甲醇>无水乙醇>正丙醇>正丁醇>正戊醇>异丙醇>异戊醇>异丁醇>水。
(2) 用Apelblat方程和vant′t Hoff方程拟合溶解度数据, 并且建立了溶解度模型, 拟合值与实验值的平均绝对百分比偏差小于5.18%, 但Apelblat方程对溶解度数据的关联结果优于vant′t Hoff方程。
(3) 估算了MTNP在不同溶剂中的标准溶解焓、标准溶解熵、标准吉布斯自由能、固液表面张力及表面熵因子。结果表明, MTNP的溶解是一个吸热、非自发的过程, 表面张力越大, 表面能越高, 表面熵因子越小, 即生长能垒越低, 晶体生长越快。
(4) 用无水乙醇结晶得到的晶体规整且棱角少, 撞击感度较粗品降低了24%;产品粒度分布窄。无水乙醇毒性较小且廉价可作为MTNP结晶的最佳溶剂。
| [1] |
Lebedev V R, Matyushim Y N, Inolemtcev Y D, et al. Thermochemical and explosive properties of nitropyrazoles[C]//Int. ICT Conference on Energetic Materials. Russia, 1998: 180.
|
| [2] |
阳世清, 徐松林, 雷永鹏, 等. 氮杂环含能化合物的研究进展[J].
含能材料, 2006, 14(6): 475-480. YANG Shi-qing, XU Song-lin, LEI Yong-peng, et al. Development on nitrogen heterocyclic energetic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 475-480. |
| [3] |
ZHANG Yan-qiang, GUO Yong, Joo J, et al. 3, 4, 5-trinitropyrazole based salts[J].
Chemistry A European Journal, 2010, 16(35): 10778-10784. DOI:10.1002/chem.201001243 |
| [4] |
Ravi P, Koti R C, Saikia A K, et al. Nitrodeiodination of Polyiodopyrazoles[J].
Propellants, Explosives, Pyrotechnics, 2012, 37(2): 167-171. DOI:10.1002/prep.v37.2 |
| [5] |
Ravi P, Grish G M, Sikder A K, et al. Thermal decomposition kinetics of 1-methyl -3, 4, 5-trinitropyrazole[J].
Thermochimica Acta, 2012, 528(2): 53-57. |
| [6] |
Ravi P, Tewari S P. Facile and environmentally friendly synthesis of nitropyrazoles using montmorillonite K-10 impregnated with bismuth nitrate[J].
Catalysis Communications, 2012, 19(19): 37-41. |
| [7] |
薛梅. 1-甲基-3, 4, 5-三硝基吡唑的合成工艺研究及性能测定[D]. 太原: 中北大学, 2016.
XUE Mei. Study on synthetic process and properties of 1-Methyl-3, 4, 5-trinitropyrazole[D]. Taiyuan: North University of China, 2016. |
| [8] |
郭俊玲, 李永祥, 王建龙, 等. 1-甲基-3, 4, 5-三硝基吡唑的一步法合成及热性能研究[J].
含能材料, 2015, 23(7): 304-306. GUO Jun-lin, LI Yong-xiang, WANG Jian-long, et al. One-step synthesis and thermal behavior of 1-methyl-3, 4, 5-trinitropyazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), , 2015, 23(7): 304-306. |
| [9] |
Wei Zou, Qing Xia, Wen Zhao, et al. Solubility of disodium 4, 4' -dinitrostilbene- 2, 2' -disulfonate and sodium 4-nitrotoluene-2-sulfonate in aqueous organic solutions and its application feasibility in oxidation stage of DSD acid synthesis[J].
The Journal of Chemical Thermodynamics, 2014, 70(2): 239-244. |
| [10] |
Shakeel F, Haq N, Siddiqui N A, et al. Thermodynamics of the solubility of reserpine in {{2-(2-ethoxyethoxy)ethanol + water}} mixed solvent systems at different temperatures[J].
The Journal of Chemical Thermodynamics, 2015, 85(3): 57-60. |
| [11] |
Apelblat A, Manzurola E. Solubility of manganese, cadmium, mercury and lead acetates in water from T=278.15 K to T=340.15 K[J].
The Journal of Chemical Thermodynamics, 2001, 33(2): 147-153. DOI:10.1006/jcht.2000.0735 |
| [12] |
Zhao Yan, Wang Yong-li. Measurement and correlation of solubility of tetracycline hydrochloride in six organic solvents[J].
The Journal of Chemical Thermodynamics, 2013, 57(2): 9-13. |
| [13] |
Schröder B, Santos L M N B F, Marrucho I M, et al. Prediction of aqueous solubilities of solid carboxylic acids with COSMO-RS[J].
Fluid Phase Equilibria, 2010, 289(2): 140-147. DOI:10.1016/j.fluid.2009.11.018 |
| [14] |
ZHOU Li, ZHANG Pei-pei, YANG Guang-de, et al. Solubility of chrysin in ethanol and water mixtures[J].
Journal of Chemical & Engineering Data, 2014, 59(7): 2215-2220. |
| [15] |
WANG Na, FU Qiang, YANG Guang-de, et al. Determination of the solubility, dissolution enthalpy and entropy of icariin in water, ethanol, and methanol[J].
Fluid Phase Equilibria, 2012, 324(324): 41-43. |
| [16] |
LAN Guan-chao, WANG Jian-long, CHEN Li-zhen, et al. Determination and correlation of the solubility of 3, 4-bis(3-nitrofurazan-4-yl)furoxan (DNTF) in different solvents[J].
The Journal of Chemical Thermodynamics, 2015, 89(9): 264-269. |
| [17] |
Ksiazczak A, Moorthi K, Nagata I, et al. Solid-solid transition and solubility of even n-alkanes[J].
Fluid Phase Equilibria, 1994, 95(389): 15-29. |
| [18] |
ZHANG Fang, TANG Yao-cun, WANG Long, et al. Solubility measurement and correlation for 2-naphthaldehyde in pure organic solvents and methanol + ethanol mixtures[J].
Journal of Chemical&Engineering Data, 2015, 60(8): 2502-2509. |
| [19] |
Perlovich G L, Kurkov S V, Bauer-Brandl A, et al. Thermodynamics of solutions Ⅱ. Flurbiprofen and diflunisal as models for studying solvation of drug substances[J].
European Journal of Pharmaceutical Sciences, 2003, 19(5): 423-432. DOI:10.1016/S0928-0987(03)00145-3 |
| [20] |
Perlovich G L, Kurkov S V, Kinchin A N, et al. Thermodynamics of solutions Ⅲ: Comparison of the solvation of (+)-naproxen with other NSAIDs[J].
European Journal of Pharmaceutical & Biopharmaceutics, 2004, 57(2): 411-420. |
| [21] |
Mersmann A. Calculation of interfacial tensions[J].
Journal of Crystal Growth, 1990, 102(4): 841-847. DOI:10.1016/0022-0248(90)90850-K |
| [22] |
Barata P A, Serrano M L. Salting-out precipitation of potassium dihydrogen phosphate (KPD). Ⅰ. Precipitation mechanism[J].
Journal of Crystal Growth, 1996, 160(3-4): 361-369. DOI:10.1016/0022-0248(95)00740-7 |
The solubility of 1-methyl-3, 4, 5-trinitropyrazole (MTNP) in different solvents was determined by the gravimetric method. The Apelblat equation and vant′t Hoff equation were used to correlate the solubility data. The standard enthalpy of dissolution, standard entropy of dissolution, standard Gibbs free energy of dissolution, solid-liquid surface tension and surface entropy factor of MTNP were estimated by the experimental data.The product was characterized.The optimum solvent was selected.




