耐热炸药具有较高的熔点和较低的蒸汽压, 经长期加热和冷却后仍能可靠地起爆, 同时具有适当的撞击感度和较高能量[1-3]。从目前情况看, 耐热硝基芳烃是耐热炸药的主体[4], 如现已大规模生产的耐热炸药1, 3, 5-三氨基-2, 4, 6-三硝基苯(TATB)[5-6], 2, 2′, 4, 4′, 6, 6′-六硝基菧(HNS)[7], 以及性能优良的耐热炸药如二苦氨基二硝基吡啶(PYX)[8]、3-(2, 4, 6-三硝基苯氮基)-1, 2, 4-三唑(PATO)[9], 都是硝基芳烃及其衍生物。
TATB是一种能量较高、感度较低的钝感炸药, 但由于其分子结构对称, 且具有强的氢键, 使得它在常规有机溶剂中的溶解度小, 要想得到高纯度的TATB相当困难, 这大大限制了TATB的应用。本实验合成的2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺, 也是硝基芳烃的衍生物, 其结构相对于TATB对称性降低, 分子内与分子间氢键减弱, 其溶解性较TATB得到一定的改善, 有利于精制和纯化。此外, 在三唑环上引入含能基团可以进一步提高目标分子的能量。因此, 该化合物有望成为一种有应用前景的含能材料中间体。
2 实验部分 2.1 试剂与仪器甲醇钠、无水乙醇、4-氨基-1, 2, 4-三氮唑(ATA)、二甲亚砜(DMSO)、盐酸、发烟硝酸以及浓硫酸均为分析纯, 甲胺醇溶液为化学纯, 原料2, 4, 6-三硝基氯苯为实验室自制。
ISHIMADZU红外光谱仪(KBr压片)、Bruker DRX 500(500 MHz)核磁共振光谱仪、Finnigan TSQ Quantum ultra AM型质谱仪(Thermal, USA)、Mel-Temp熔点仪(德国METTLEDO)、TGA/SDTA851e热分析仪(瑞士METTLER TOLED公司)、DSC823e差热扫描量热仪(瑞士METTLER TOLED公司)。
2.2 合成路线以2, 4, 6-三硝基氯苯为原料, 经亲核取代, 硝化, 取代得到2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺, 合成路线见Scheme 1。
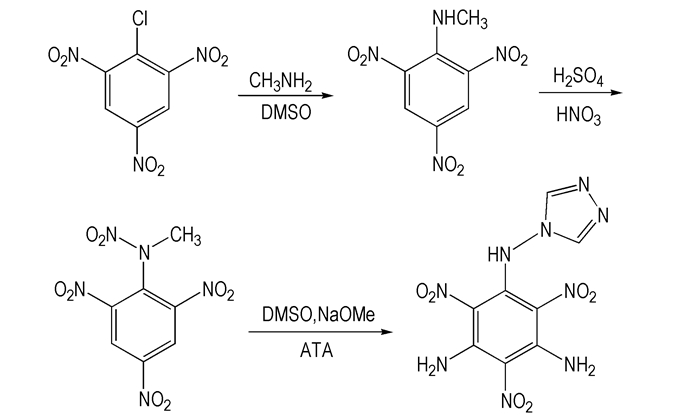
|
Scheme1 |
向装有搅拌、温度计的100 mL三口烧瓶中依次加入2, 4, 6-三硝基氯苯12 g(0.048 mol)、DMSO 50 mL, 控制反应体系温度在25 ℃以下, 缓慢滴加甲胺醇溶液(25%~30%, 25.5 mL), 室温下搅拌4 h, 倒入碎冰中, 使用稀盐酸调节pH值至中性, 抽滤得黄色1-甲氨基-2, 4, 6-三硝基苯10.8 g, 产率92.6%, m. p. 111~112 ℃(113~114 ℃[11])。1H NMR(DMSO-d6)δ: 9.1305(dd, 1H, NH), 9.0694(s, 2H, Ar-H), 3.028(d, 3H, CH); IR(KBr压片, cm-1)ν: 3235(—NH); 1615, 724(—Ar); 1538, 1346(—NO2); 2926, 1455, 1369(—CH3); MS(ESI)m/z: 240.88(M-H)-, 213.07(M-H-NCH2)-。
2.3.2 2, 4, 6-三硝基苯甲硝胺的合成向装有搅拌、温度计的100 mL三口烧瓶中加入1-甲氨基-2, 4, 6-三硝基苯12.1 g(0.05 mol), 冰盐浴下缓慢加入浓硫酸20 mL, 控制反应体系在0 ℃以下, 缓慢滴加硝酸15 mL。常温反应5 h, 倒入碎冰中搅拌, 静置抽滤得浅黄色晶体2, 4, 6-三硝基苯甲硝铵13.3 g, 产率93.2%, m. p. 128~129 ℃(129~130 ℃[12])。1H NMR(CDCl3)δ: 9.1821(s, 2H, Ar—H), 3.7620(s, 3H, CH3); IR(KBr压片, cm-1) ν: 1610, 713(—Ar); 1541, 1340(—NO2); 2953, 1456, 1352(—CH3); MS(ESI)m/z: 288.21(M+H)+, 106.04(M+H-3NO2-NO-CH2)+。
2.3.3 2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的合成向装有搅拌、温度计和回流设备的250 mL三口烧瓶中依次加入2, 4, 6-三硝基苯甲硝胺5.74 g(0.02 mol)、ATA16.80 g(0.20 mol)、DMSO 100 mL, 搅拌下分批次缓慢加入甲醇钠21.6 g(0.40 mol), 常温下搅拌6 h。反应结束后将反应液倒入碎冰中, 稀盐酸调节pH值至中性, 抽滤水洗得黄色固体2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺6.04 g, 产率92.9%, m.p.183~184 ℃。1H NMR(DMSO-d6)δ: 9.6788(s, 4H, NH), 9.1188(s, 1H, NH), 8.7916(s, 2H, CH); IR(KBr压片, cm-1)ν: 3342, 3246, 1625(—NH2); 3246(—NH); 1591, 696(—Ar); 1552, 1342(—NO2); 1625, 1473, 13633(triazole); MS(ESI)m/z: 323.91(M-H)-, 238.87(M-H-N3C2H2-NH-2H)-。
3 结果与讨论 3.1 甲胺化试剂的选择由2, 4, 6-三硝基氯苯经甲胺化合成1-甲氨基-2, 4, 6-三硝基苯, 采用不同的甲胺化试剂, 结果见表 1。从表 1中可以看出, 选用甲胺水溶液[12]为甲胺化试剂时, 收率和纯度偏低, 原因可能是因为2, 4, 6-三硝基氯苯受三个硝基吸电子作用的影响, 在碱性条件下, 会导致水解副反应; 选用甲胺气体时, 收率和纯度均较高, 但其成本昂贵且反应不易控制; 选用甲胺的醇溶液时, 收率及纯度也比较高, 但反应易控制且价格低廉。因此, 综合考虑经济和安全, 该反应的较优甲胺化试剂为甲胺的醇溶液。
| 表 1 不同甲胺化试剂对收率的影响 Tab.1 Influence of different methylamine reagents on yield of 1-methylamino-2, 4, 6-trinitrobenzene |
本实验的初始目标是以2, 4, 6-三硝基苯甲硝胺为原料经亲核取代氢胺化(VNS)反应合成3, 5-二氨基-2, 4, 6-三硝基苯甲硝胺, 实际得到的主要产物是2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺。
机理(Scheme 2)可能是氮上的硝基吸电子作用使正电性增加, 且在硝甲氨基的邻位及对位均有硝基, 强大的硝基吸电子作用, 导致其易于发生亲核反应。当使用强亲核试剂4-氨基-1, 2, 4-三唑反应时, 在硝甲氨基位置发生4-氨基-1, 2, 4-三唑直接取代反应[13]。另外两个位置发生氢的亲核取代反应, 将带有离去基团的氮负离子加到亲电芳环上, 然后通过消除1, 2, 4-三唑去掉离去基团实现重芳构化[14-15]。
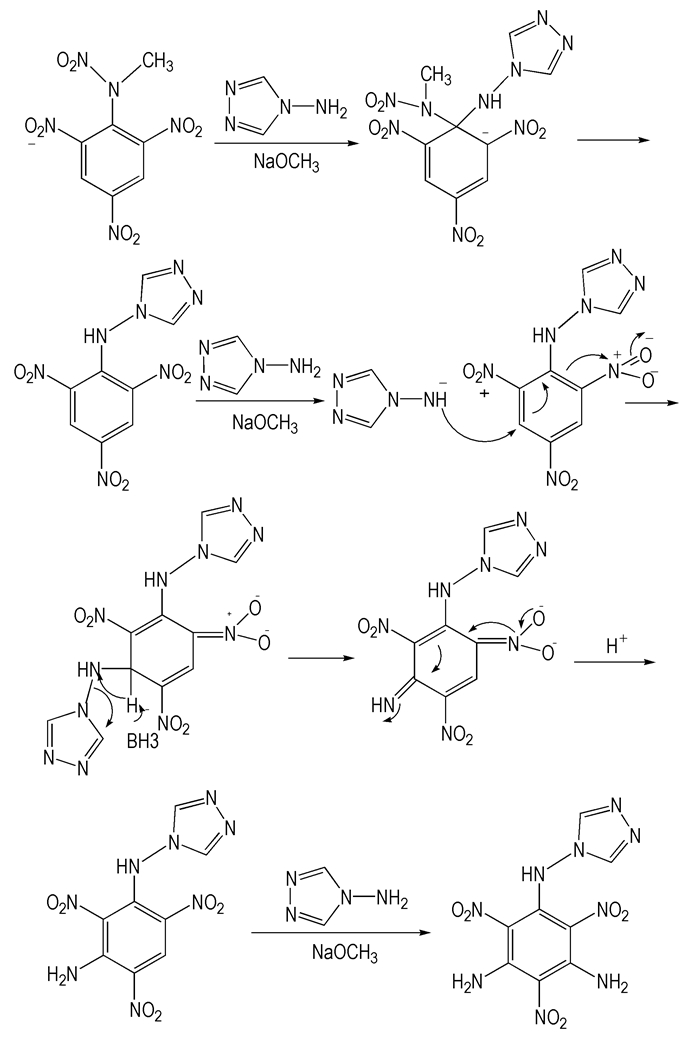
|
Scheme2 Reaction mechanism of 2, 4, 6-trinitro-3, 5-diamino-N-(1, 2, 4-triazole-4)-aniline |
从Scheme 2的反应机理中可以看出,反应需在强碱性条件下进行, 采用甲醇钠作为活化剂, 研究了其添加量对2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺收率的影响(图 1)。从图 1可看出:随着甲醇钠加入量的增加, 产物收率也随之增加, 但当n(2, 4, 6-三硝基苯甲硝胺):n(甲醇钠)≥1/20时, 产物收率基本不再变化, 当n(2, 4, 6-三硝基苯甲硝胺):n(甲醇钠)≥1:26时, 由于大量的甲醇钠致使反应体系黏度增大, 产率开始下降。因此, 甲醇钠最佳用量为n(2, 4, 6-三硝基苯甲硝胺):n(甲醇钠)=1:20。
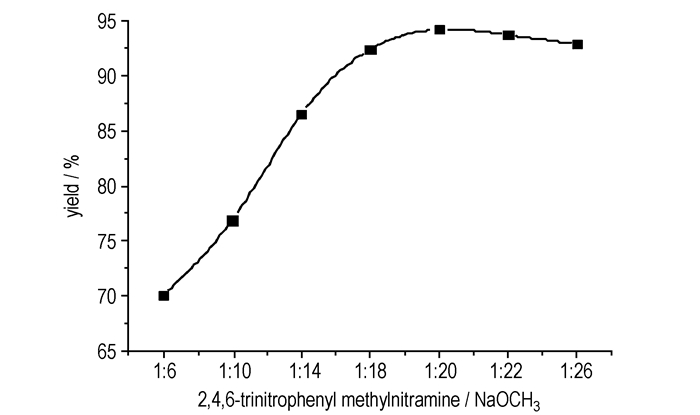
|
图 1 甲醇钠用量对2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺收率的影响 Fig.1 Effects of different NaOCH3 contents on yield of 2, 4, 6-trinitro-3, 5-diamino-N-(1, 2, 4-triazole-4)-aniline |
在该反应中, 首先发生芳香环的亲核取代反应, 然后是氢的亲核取代反应, 氨基的引入进一步降低了苯的活性, 致使下一个氨基取代很困难, 所以反应需加入过量的ATA, 使反应正向进行。因此, 给定n(2, 4, 6-三硝基苯甲硝胺)/n(甲醇钠)=1/20, 研究了2, 4, 6-三硝基苯甲硝胺和ATA的投料比对产物收率的影响, 其结果见图 2。从图 2可以看出, n(2, 4, 6-三硝基苯甲硝胺)/n(ATA)=1/14时得到92.9%的收率。ATA易与空气中的二氧化碳反应生成碳酸铵从而失去氨化能力, 且ATA极易吸潮, 不仅降低了其真实添加量而且水本身就是该反应的钝化剂, 所以在使用ATA前需使用无水乙醇进行重结晶[16]。
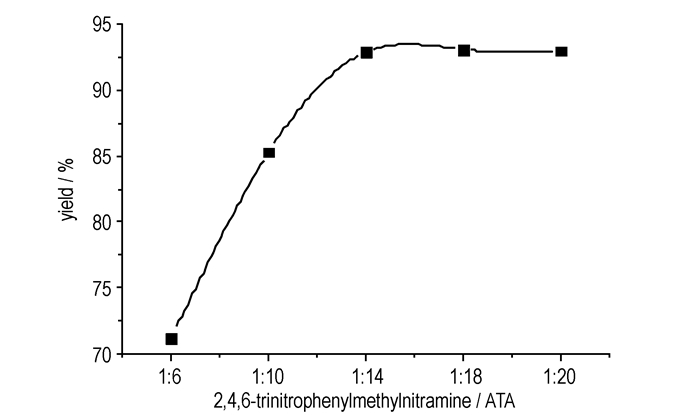
|
图 2 ATA用量对2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺收率的影响 Fig.2 Effects of different ATA contents on yield of 2, 4, 6-trinitro-3, 5-diamino-N-(1, 2, 4-triazole-4)-aniline |
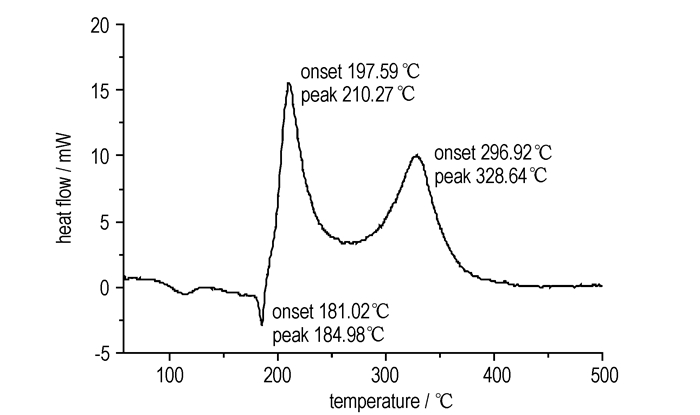
DSC测试条件:试样量为1.5 mg, 升温速率为10.00 ℃·min-1, 氮气保护, 流速30.0 mL·min-1, 样品池为陶瓷坩埚, 扫描范围50~500 ℃。DSC曲线如图 3所示。
|
图 3 2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的DSC曲线 Fig.3 DSC curve of 2, 4, 6-trinitro-3, 5-diamino-N-(1, 2, 4-triazole-4)-aniline |
由图 3可见, 向下的吸热峰为2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的熔化峰, 熔点为184.98 ℃(与使用熔点仪所测的熔点吻合)。两个向上的放热峰。推测为:第一个放热峰210 ℃, 为氮氮键的断裂后1, 2, 4-三氮唑的放热峰; 第二个放热峰328 ℃, 为苯环的放热峰。原因可能是:氮氮键比碳氮键更易断裂。热分解焓分别为552.83 J·g-1和470.92 J·g-1, 放热量较大。
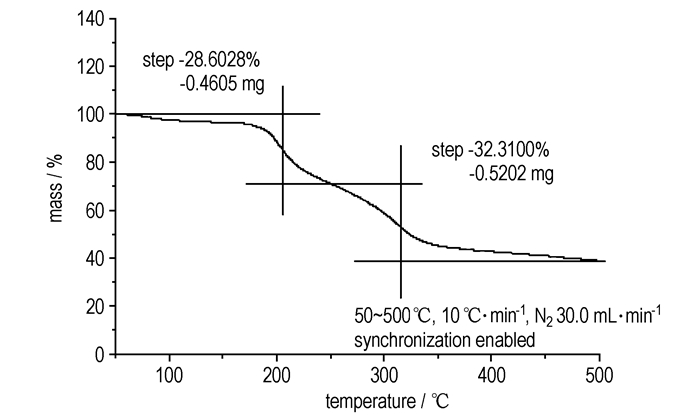
3.3.2 TG分析热失重测试:试样量为1.58 mg, 升温速率为10.00 ℃·min-1, 氮气保护, 流速20.0 mL·min-1, 样品池为带盖铝坩埚, 扫描范围50~500 ℃。
2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的TG曲线(图 4)显示, 2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的分解可能分为两步, 第一步有28.6028%的失重, 第二步有32.3100%的失重。在500 ℃的条件下, 2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺尚未分解完全, 这能进一步说明其热安定性较好。
|
图 4 2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的TG曲线 Fig.4 TG curve of 2, 4, 6-trinitro-3, 5-diamino-N-(1, 2, 4-triazole-4)-aniline |
(1) 以2, 4, 6-三硝基氯苯为原料, 经甲胺化、硝化、胺化反应合成产物2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺。收率为80.18%。
(2) 比较不同甲胺化试剂, 发现甲胺醇溶液是1-甲氨基-2, 4, 6-三硝基苯合成的较优甲胺化试剂。在2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的合成中, 当2, 4, 6-三硝基苯甲硝胺、甲醇钠和ATA的摩尔比为12014, 收率达92.9%。
(3) DSC测试2, 4, 6-三硝基-3, 5-二氨基-N-(1, 2, 4-三唑-4)-苯胺的两个热分解峰温分别为210 ℃和328 ℃, TG测试表明, 在200 ℃以下未出现明显的质量损失过程, 升温至500 ℃分解残渣为38.89%, 说明它具有良好的热稳定性, 有望成为一种有应用前景的含能中间体。
| [1] |
Agrawal J P. Recent trends in high-energy materials[J].
Progress in Energy and Combustion Science, 1998, 24(1): 1-30. DOI:10.1016/S0360-1285(97)00015-4 |
| [2] |
吕春绪. 耐热炸药分子结构分析与合成研究[J].
含能材料, 1993, 1(4): 13-18. Lü Chun-xu. Structure analysis of heat-resistant explosive molecule and its synthesis research[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 1993, 1(4): 13-18. |
| [3] |
高大元, 董海山, 李波涛, 等. 炸药热分解动力学研究及其应用[J].
含能材料, 2012(增刊): 307-310. GAO Da-yuan, DONG Hai-shan, LI Bo-tao, et al. Research and application of thermal decomposition kinetics for explosives[J]. Chinese Journal of Energetic Materials, 2012(suppl.): 307-310. |
| [4] |
吕春绪.
耐热硝基芳烃化学[M]. 北京: 兵器工业出版社, 2000: 25-67.
Lü Chun-xu. Nitroaromatic of heat-resistant chemical[M]. Beijing: Weapon Industry Press, 2000: 25-67. |
| [5] |
王友兵, 王伯周, 叶志虎, 等. VNS法合成TATB[J].
含能材料, 2011, 19(2): 142-146. WANG You-bing, WANG Bo-zhou, YE Zhi-hu, et al. Synthesis of TATB by VNS method[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(2): 142-146. |
| [6] |
马晓明, 李斌栋, 吕春绪, 等. 无氯TATB的合成及其热分解动力学[J].
火炸药学报, 2009, 32(6): 24-27. MA Xiao-ming, LI Bin-dong, Lü Chun-xu, et al. Synthesis and thermal decomposition kinetics of TATB without chloride[J]. Chinese Journal of Explosives & Propellants, 2009, 32(6): 24-27. |
| [7] |
Singh B, Malhotra R K. Hexanitrostilbene and its properties[J].
Defence Science, 1983, 33: 165-176. DOI:10.14429/dsj.33.6170 |
| [8] |
Coburn M D. 2, 6-Bis(picrylamino)-3, 5-dinitropyridine and a method for its preparation: US 3678061[P], 1972.
|
| [9] |
易景缎, 王洪珍. 3-苦氮基-1, 2, 4-三唑[J].
火炸药, 1992(4): 1-5. YI Jing-duan, WANG Hong-zhen. 3-(2, 4, 6-Trinitrobenzeneamino)-1, 2, 4-triazole[J]. Chinese Journal of Explosives & Propellants, 1992(4): 1-5. |
| [10] |
ZHANG Xue-mei, DONG Hai-shan, ZHOU Zhi-ming, et al. A new synthetic route to 1, 3-diamino-5-methylamino-2, 4, 6-trinitro-benzene[J].
Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(5): 523-526. |
| [11] |
Sekiguchi S, Miyazaki C, Motegi M. Aromatic mucleo-philic substitution, Part 22: Kinetics of the reactions of nitro-substituedted N-alkylacetanilides with sodium methoxide in methanol[J].
Journal of the Chemical Society, Perkin Transactions 2: Physical Organic Chemistry, 1988(7): 1333-1337. |
| [12] |
Ritter H, Licht H H. Synthesis and characterization of methylnitramino-substituted pyridines and triazines[J].
Propellants, Explosives, Pyrotechnics, 1993, 18(2): 81-88. DOI:10.1002/(ISSN)1521-4087 |
| [13] |
Barbara Szpakiewicz, Maria Grzegozek. Vicarious nucleophilic amination of nitroquinolines with 4-amino-1, 2, 4-triazole[J].
Canadian Journal of Chemistry, 2008, 86(7): 682-685. DOI:10.1139/v08-051 |
| [14] |
Makosza M, Kwast A. Vicarious nucleophilic substitution of hydrogen mechanism and orientation[J].
Journal of Physical Organic Chemistry, 1998, 11(5): 341-349. DOI:10.1002/(ISSN)1099-1395 |
| [15] |
Makosza M, Winiarski J. Vicarious nucleophilic substitution of hydrogen[J].
Accounts of Chemical Research, 1987, 20(8): 282-289. DOI:10.1021/ar00140a003 |
| [16] |
李海波, 李波涛, 郁卫飞, 等. VNS胺化合成炸药研究进展[J].
含能材料, 2005, 13(2): 132-136. LI Hai-bo, LI Bo-tao, YU Wei-fei, et al. Progress in explosives synthesis by VNS amination[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2005, 13(2): 132-136. |





