自1965年首次合成以来[1],到21世纪六、七十年代,ClF3O在载人航天和火箭技术方面已得到广泛研究,包括合成方法、结构与性质以及光谱特性等[2-6]。
ClF3O是一种极强的氟化剂和氧化剂,其化学活性要比已知的强氧化剂ClF3、ClF5还要活泼,极易与水和有机物发生爆炸性反应。文献[7-9]研究了ClF3与H2O、C3H6O的反应机理,但是关于ClF3O与H2O以及有机物等物质反应的微观反应机理并未见报道,ClF3O由反应物变成产物的过程有待研究。为此,本研究运用量子化学密度泛函理论研究了ClF3O与水反应的微观机理,对ClF3O与水反应的复杂过程进行描述,找到了反应通道和主要产物。本研究结果对于ClF3O的使用和贮存具有一定的理论指导意义。
2 计算方法研究表明[7-9, 10],对于含Cl和O等原子的体系,B3PW91[11]具有更好的适用性,因此,本研究采用了B3PW91方法。此外,考虑到研究体系中既含有易极化的自由基,又有易形成氢键的水,故采用了含弥散与极化函数的6-31++G(d, p)基组,以提高计算精度。在B3PW91/6-31++G(d, p)水平上对ClF3O和H2O反应势能面上的各驻点物的几何构型进行了全优化计算,并经振动频率分析确定了过渡态和中间体(稳定的中间体的虚频数为0,而过渡态的虚频数为1);通过内禀反应坐标(IRC)分析,确认了反应物、中间体、过渡态和产物的相关性。所有计算均采用Gaussian 09程序,在YH-V计算机上完成。
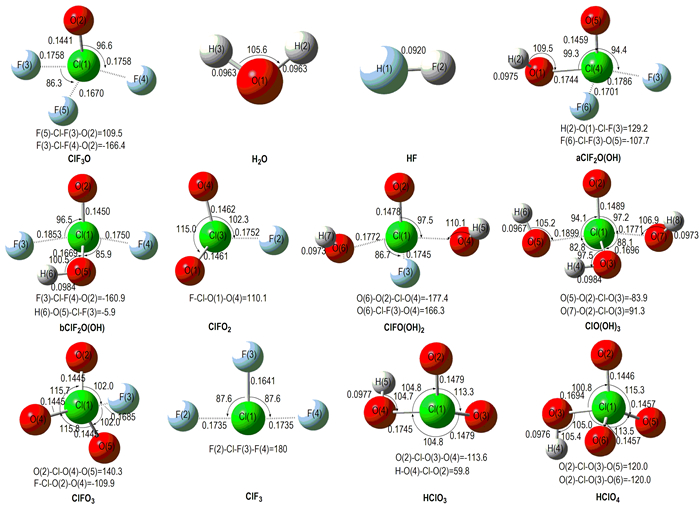
3 结果与讨论图 1为B3PW91/6-31++G(d, p)水平上优化的反应物和产物结构示意图,图 2为各过渡态的几何构型。表 1给出了产物、生成物和过渡态等驻点物在B3PW91/6-31++G(d, p)水平下的能量。
|
图 1 B3PW91/6-31++G(d, p)水平下反应物和产物的几何构型(键长/nm; 键角/(°)) Fig.1 Geometries of reactants and products optimized by B3PW91/6-31 ++ G (d, p) (Bond distances in nm, angles in degree) |

|
图 2 B3PW91/6-31++G (d, p)水平下过渡态的几何构型(键长/nm; 键角/(°)) Fig.2 Geometries of transition states optimized by B3PW91/6-31++G (d, p) (bond distances in nm, angles in degrees) |
| 表 1 反应物、中间体、产物和过渡态的振动频率、能量、零点能和总能量 Tab.1 Theoretical predicted vibration frequencies, energy, zero point energy and the total energy of the reactants, isomers, products, and transition states |
ClF3O与H2O反应可能有两种方式(1)和(2)。a、b代表同分异构体。方式(1)活化能为37.21 kJ·mol-1,方式(2)活化能为152.55 kJ·mol-1。方式(2)能垒较高,反应不易进行。因此,ClF3O与H2O的反应主要为方式(1)。
| $ \rm{CI}{{\rm{F}}_{3}}\rm{O+}{{\rm{H}}_{2}}\rm{O}\xrightarrow{\rm{TS1}}\rm{aCI}{{\rm{F}}_{\rm{2}}}\rm{O}\left( \rm{OH} \right)\rm{+HF} $ | (1) |
| $ \rm{CI}{{\rm{F}}_{3}}\rm{O+}{{\rm{H}}_{2}}\rm{O}\xrightarrow{\rm{TS2}}\rm{bCI}{{\rm{F}}_{\rm{2}}}\rm{O}\left( \rm{OH} \right)\rm{+HF} $ | (2) |
aClF2O(OH)由(3)易分解成ClFO2和HF。aClF2O(OH)也会继续与H2O反应由(4)生成ClFO(OH)2和HF。
| $ \rm{aCI}{{\rm{F}}_{2}}\rm{O}\left( \rm{OH} \right)\xrightarrow{\rm{TS3}}\rm{CI}{{\rm{F}}_{\rm{2}}}\rm{O+HF} $ | (3) |
| $ \rm{aCI}{{\rm{F}}_{2}}\left( \rm{OH} \right)\rm{+}{{\rm{H}}_{2}}\xrightarrow{\rm{TS4}}\rm{CIFO}{{\left( \rm{OH} \right)}_{2}}\rm{+HF} $ | (4) |
ClFO(OH)2不稳定,易分解生成HClO3和HF,如(5)所示。
| $ \rm{CIFO}{{\left( \rm{OH} \right)}_{2}}\xrightarrow{\rm{TS5}}\rm{HCI}{{\rm{O}}_{3}}+\rm{HF} $ | (5) |
ClFO(OH)2还会与H2O反应按(6)生成ClO(OH)3和HF,生成的ClO(OH)3不稳定,由(7)易分解生成HClO3和H2O。
| $ \rm{CIFO}{{\left( \rm{OH} \right)}_{2}}+{{\rm{H}}_{2}}\rm{O}\xrightarrow{\rm{TS6}}\rm{CIO}{{\left( \rm{OH} \right)}_{3}}+\rm{HF} $ | (6) |
| $ \rm{CIO}{{\left( \rm{OH} \right)}_{\rm{3}}}\xrightarrow{\rm{TS7}}\rm{HCI}{{\rm{O}}_{\rm{3}}}\rm{+}{{\rm{H}}_{2}}\rm{O} $ | (7) |
ClF3O与H2O反应的过程中还可能发生以下反应(8)、(9)、(10)和(11):
| $ \rm{CI}{{\rm{F}}_{\rm{2}}}\rm{O+}{{\rm{H}}_{2}}\rm{O}\xrightarrow{\rm{TS8}}\rm{HCI}{{\rm{O}}_{3}}+\rm{HF} $ | (8) |
| $ \rm{CI}{{\rm{F}}_{\rm{2}}}\rm{O}+\rm{CI}{{\rm{F}}_{3}}\rm{O}\xrightarrow{\rm{TS9}}\rm{CIF}{{\rm{O}}_{3}}+\rm{CI}{{\rm{F}}_{3}} $ | (9) |
| $ \rm{CIF}{{\rm{O}}_{3}}+{{\rm{H}}_{2}}\rm{O}\xrightarrow{\rm{TS10}}\rm{HCI}{{\rm{O}}_{4}}+\rm{HF} $ | (10) |
| $ \rm{CI}{{\rm{F}}_{3}}\rm{O}+\rm{HCI}{{\rm{O}}_{3}}\to \rm{CI}{{\rm{F}}_{3}}+\rm{HCI}{{\rm{O}}_{4}} $ | (11) |
从以上反应可以发现,ClF3O与H2O的反应产物除氟化氢外,还有亚氯酸、三氟化氯和氯酸等。生成的ClF3还会继续与H2O反应,水足量时主要产物为HClO2,如(12)所示; 水少量时主要产物为ClOF,如(13)所示,其反应过程详见文献[7]。
| $ \rm{CI}{{\rm{F}}_{3}}+2{{\rm{H}}_{2}}\rm{O=HCI}{{\rm{O}}_{2}}+3\rm{HF} $ | (12) |
| $ \rm{CI}{{\rm{F}}_{3}}+{{\rm{H}}_{2}}\rm{O=2HF+CIOF} $ | (13) |
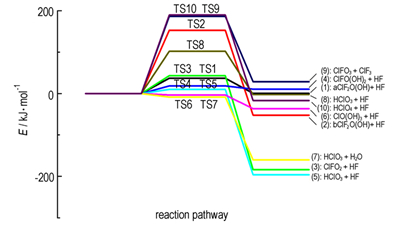
各反应的势能面如图 3所示。表 2列出了上述各反应的活化能和焓变。可以看出,反应(2)、(8)、(9)和(10)的活化能比较高,而(1)、(3)、(4)、(5)、(6)和(7)的活化能相对较小(小于50 kJ·mol-1)。据此可计算出反应(11)的ΔrG<0,因此,该反应为自发进行。

|
图 3 反应(1)~(10)的势能面图(以各反应物为能量零点) Fig.3 Potential energy profile of reactions (1)~(10) (The corresponding reaction energy is zero) |
| 表 2 各反应路径的活化能和焓变 Tab.2 The active energy(Ea) and enthalpy change(ΔrHm) of reactions (1)~(11) |
当H2O足量时,ClF3O与H2O反应的中间产物ClF2O(OH)、ClFO(OH)2、ClO(OH)3、ClFO2、ClFO3和ClF3易于继续反应生成稳定的HF、HClO2和HClO4。反应式为
| $ 2\rm{CI}{{\rm{F}}_{3}}\rm{O}+4{{\rm{H}}_{2}}\rm{O=HCI}{{\rm{O}}_{4}}+6\rm{HF+HCI}{{\rm{O}}_{2}} $ | (14) |
由反应物(ClF3O+ H2O)可能经如下路径形成产物(HClO4+6HF+ HClO2):
(Ⅰ) R→TS1→aClF2O(OH)+HF→TS3→ ClFO2+2HF+H2O→TS8→HClO3+3HF+ClF3O→ ClF3+HClO4+3HF+2H2O→P
(Ⅱ) R→TS1→aClF2O(OH)+HF→TS3→ ClFO2+2HF+ClF3O→ClFO3+ClF3+2HF+H2O→ HClO4+3HF+ ClF3+2H2O→P
(Ⅲ) R→TS1→aClF2O(OH)+HF+H2O→TS4→ ClFO(OH)2+2HF→TS5→HClO3+3HF+ClF3O→ ClF3+ HClO4+3HF+2H2O→P
(Ⅳ) R→TS1→aClF2O(OH)+HF+H2O→TS4→ ClFO(OH)2+2HF+H2O→TS6→ClFO(OH)3+3HF→ TS7→HClO3+H2O+3HF+ClF3O→ ClF3+ HClO4+3HF+2H2O→P
路径(Ⅰ)和(Ⅱ)的前两步反应相同,即都是先经过反应(1)和(3)(活化能分别为37.21 kJ·mol-1和43.51 kJ·mol-1),然后经不同的反应生成相应产物。路径(Ⅰ)通过(8)和(11)得到产物,活化能分别为102.07 kJ·mol-1和0;路径(Ⅱ)通过(9)和(10)得到产物,活化能分别为186.60 kJ·mol-1和189.80 kJ·mol-1。其中,反应(8)、(9)和(10)活化能较高,故这两条路径不占优势。路径(Ⅲ)和(Ⅳ)的前两步反应都是先经过反应(1)和(4)(活化能分别为37.21 kJ·mol-1和18.50 kJ·mol-1),然后经不同的反应生成相应产物。路径(Ⅲ)经过(5)和(11)形成产物,活化能分别为10.28 kJ·mol-1和0;路径(Ⅳ)经过的反应(6)、(7)和(11)的活化能分别为-3.13 kJ·mol-1、-8.29 kJ·mol-1和0,均为无能垒过程。可以看出,路径(Ⅳ)经过的各反应的最大活化能小于路径(Ⅰ)、(Ⅱ)和(Ⅲ),因此,路径(Ⅳ)为主要反应路径,其次为(Ⅲ)。
3.2.2 水少量时的反应当存放的ClF3O遇到少量水蒸气时,由于H2O相对ClF3O含量较少,aClF2O(OH)继续和H2O发生反应(4)和(6)或ClFO2继续和H2O发生反应(8)以及ClFO3继续和H2O发生反应(10)的机会较少,因此,在这种H2O相对ClF3O含量较少的情况下,生成HClO3可能性较小,反应(11)不占主导地位,因而生成HClO4的可能性较小。反应(12)和(13)也不占主导地位; 占主导地位的是反应(1)、(3)和(9)。其中,反应(9)的活化能为186.60 kJ·mol-1,该反应活化能太高,故反应进行的可能性也较小。因此,反应主要经过反应(1)和(3)生成产物ClFO2,其可能通道为:
(Ⅴ) R→TS1→aClF2O(OH)+HF→TS3→ClFO2+2HF
(Ⅵ) R→TS1→aClF2O(OH)+HF→TS3→ ClFO2+2HF+ClF3O→TS9→ClFO3+ClF3+2HF
水少量时,路径(Ⅴ)为主要反应路径,反应式为ClF3O+H2O=ClFO2+2HF, 即水少量时,ClF3O与水反应的主要产物为ClFO2; 当水足量时,ClF3O与水反应的主要产物为HClO4。
4 结论ClF3O和H2O的反应活化能较低,反应(1)、(3)、(4)、(5)、(6)和(7)的活化能均在50 kJ·mol-1以下, 故C1F3O和H2O的反应极易发生。反应产物除氟化氢外,还有亚氯酸和氯酸等。当水足量时, 产物主要为HF、HClO2和HClO4,反应路径为:
(Ⅳ) R→TS1→aClF2O(OH)+HF+H2O→TS4→ ClFO(OH)2+2HF+H2O→TS6→ClFO(OH)3+3HF→ TS7→HClO3+H2O+3HF+ClF3O→ ClF3+HClO4+3HF+2H2O→P
当水少量时,产物主要为ClFO2和HF,反应路径为:
(Ⅴ) R→TS1→aClF2O(OH)+HF→TS3→ClFO2+2HF
因此,为保持ClF3O的活性,应该将其贮存在干燥密闭的环境中。本研究结果对于含氟材料的使用和贮存具有一定的参考价值。
| [1] |
Pilipovich D, Wilson R D, Bauer H F. Oxychlorine trifluoride and alkali fluoride-Cl2O complex: US Patent 3733392[P]. 1972.
|
| [2] |
Bougon R, Isabey J, Plurien P. New oxyfluorinated chlorine compounds-chlorine trifluoride monoxide ClOF3. C R Hebd Seances Acad Sci, C[J] 1970, 271: 1366.
|
| [3] |
Pilipovich D, Lindahl C B, Schack C J, et al. Chlorine trifluoride oxide. I. Preparation and properties[J].
Inorg Chem, 1972, 11: 2189-2192. DOI:10.1021/ic50115a040 |
| [4] |
Pilipovich D, Rogers H H, Wilson R D. Chlorine trifluoride oxide.Ⅱ. Photochemical synthesis[J].
Inorg Chem, 1972, 11: 2192-2195. DOI:10.1021/ic50115a041 |
| [5] |
Christe K O, Curtis E C. Chlorine trifluoride oxide. Ⅲ.Vibrational spectrum, force constants, and thermodynamic properties[J].
Inorg Chem, 1972, 11: 2196-2201. DOI:10.1021/ic50115a042 |
| [6] |
Oberhammer H, Christe K O. Gas-phase structure of chlorine trifluoride oxide, ClF3O[J].
Inorg Chem, 1982, 21: 273-275. DOI:10.1021/ic00131a050 |
| [7] |
刘海峰, 闫华, 刘志勇, 等. 三氟化氯和水反应的密度泛函理论研究[J].
物理化学学报, 2007, 23(7): 1099-1104. LIU Hai-feng, YAN Hua, LIU Zhi-yong, et al. Theoretical study on the reaction of Chlorine trifluoride with water by density functional theory[J]. Acta Phys-Chim Sin, 2007, 23(7): 1099-1104. |
| [8] |
闫华, 贡雪东, 罗永锋, 等. 三氟化氯和环氧丙烷反应的理论研究[J].
化学学报, 2009, 67(24): 2845-2850. YAN Hua, GONG Xue-dong, LUO Yong-feng, et al. Theoretical study on the reaction of chlorine trifluoride with propylene oxide by density functional theory[J]. Acta Chimica Sinica, 2009, 67(24): 2845-2850. DOI:10.3321/j.issn:0567-7351.2009.24.015 |
| [9] |
牛莉, 刘志, 王少龙, 等. 氟氯酰与丙烷反应的密度泛函理论研究[J].
化学学报, 2010, 68(18): 1787-1792. NIU Li-bo, LIU Zhi-yong, WANG Shao-long, et al. Theoretical study on the reaction of chlorine trifluoride oxide with propane by density functional theory[J]. Acta Chimica Sinica, 2010, 68(18): 1787-1792. |
| [10] |
Peter P, Pat L. Energetics of ammonium perchlorate decomposition steps[J].
J Mol Struct (Theochem), 1998, 454: 229-235. DOI:10.1016/S0166-1280(98)00293-0 |
| [11] |
Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09(Revision A. 1)[DB]. Gaussian Inc, Wallingford CT, 2009.
|
Using density functional theory (DFT), the reaction of chlorine trifluoride oxide with water was studied.



