近年来, 因四唑环类含能材料具有高密度、高生成焓、高气体生成量、低感度、热稳定性好以及爆轰产物多为洁净的N2等一系列优点, 从而使得四唑类含能材料的研究成为高能钝感含能材料研究的热点[1-2]。2001年Tselinskii等人[3]合成了一种新型的联四唑化合物1, 1′-二羟基-5, 5′-联四唑(H2DHBT), 随后毕福强等人[4]也合成了该化合物并且对该化合物的结构和热稳定性进行了表征。随着离子液体研究的深入, 含能离子盐被引入到单质炸药的设计中[5-6]。2012年德国慕尼黑大学报道了5, 5′-联四唑-1, 1′-二氧羟胺盐(TKX-50)[7], 经测试在100 K下其密度高达1.918 g·cm-3, 热分解温度为221 ℃, 撞击感度为20 J, 摩擦感度为120 N, 静电感度为0.10 J; 经计算其爆速为9698 m·s-1, 爆压为42.4 GPa。说明TKX-50是一种高性能钝感炸药, 是黑索今的理想取代物。
目前TKX-50的合成方法主要有四种: (1)直接用过硫酸钾氧化5, 5′-联四唑[7], 但是氧化过程容易发生副反应, 难分离, 收率低。(2)“一锅法”二甲基甲酰胺(DMF)路线合成TKX-50[7]:将二氯乙二肟作为起始原料溶于DMF, 加入叠氮钠发生叠氮化反应, 反应结束后直接将反应液加入到乙醚中, 通入氯化氢气体直接发生环合反应, 经处理得到二甲胺盐, 最后在热水中与盐酸羟胺发生复分解反应, 合成出TKX-50。朱周朔等人[8]优化了该工艺, 实现了73.2%的收率。但是此法需要减压蒸馏除去水与DMF, 而且操作复杂, 适用于实验室。(3)“一锅法”N-甲基吡咯烷酮(NMP)合成TKX-50[7]:将二氯乙二肟溶于NMP, 加入叠氮化钠发生叠氮化反应, 之后转移到乙醚中, 通入氯化氢发生环合反应, 反应结束后挥发乙醚, 加氢氧化钠水溶解调节pH, 回流冷却生成的1, 1′-二羟基-5, 5′-联四唑钠盐析出, 后与盐酸羟胺发生复分解反应得到TKX-50。周智明等人[9]探讨了溶剂对叠氮化反应的影响并确定了最佳工艺条件。但是该“一锅法”只有在NMP作为溶剂的时候收率比较高, 而NMP这种高沸点的有机溶剂处理成本偏高。(4)毕福强等人[10]以二氯乙二肟为起始原料, 在DMF溶剂中加入叠氮化钠发生叠氮化反应, 反应完全之后加水让二叠氮乙二肟析出后抽滤, 滤饼加入到乙醚溶剂中, 通入氯化氢气体发生环合反应生成1, 1′-二羟基-5, 5′-联四唑二水合物, 然后加入氢氧化锂生成锂盐, 最后锂盐再与盐酸羟胺发生复分解反应得到TKX-50。该方法生成的二叠氮基乙二肟需要在DMF中加水析出, 收率有所下降, 并且需要用到氢氧化锂与1, 1′-二羟基-5, 5′-联四唑二水合物生成锂盐, 成本偏高。
为了克服上述合成方法的缺点, 本课题组改进了TKX-50的合成方法:二氯乙二肟在丙酮与水的混合溶剂中先叠氮化, 后环合得到了1, 1′-二羟基-5, 5′-联四唑二水合物; 然后直接利用酸碱中和法成盐得到TKX-50。并且优化了这两步反应使得由二氯乙二肟合成TKX-50的收率上升到83%, 简化了反应流程, 提高了反应安全性。
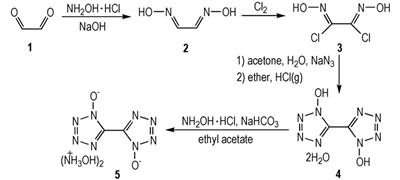
2 实验部分 2.1 合成路线
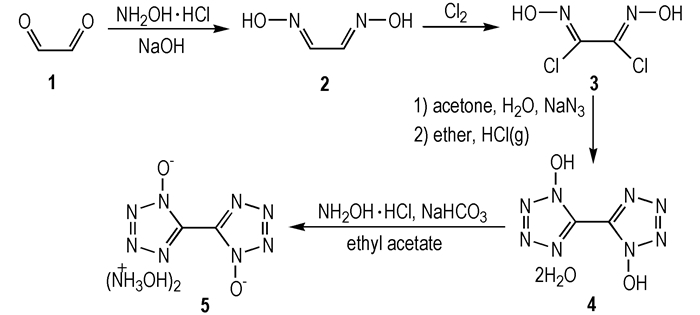
|
Scheme 1 Synthetic route of TKX-50 |
Nicolet Impact 410型傅里叶变换红外光谱仪(美国Thermofisher公司); Bruker Avance-Ⅲ DRX 500MHz核磁共振仪(德国Bruker公司); Vario EL-Ⅲ型元素分析仪(德国Elemetar公司); Finnigan TSQ Quantum ultra AM型质谱仪(美国Finnigan公司)。所有药品和试剂均为国产市售分析纯, 未经处理直接使用。
2.3 合成实验 2.3.1 乙二肟(2)的合成参考文献[7]方法以91%的收率制得乙二肟。
2.3.2 二氯乙二肟(3)的合成氯气直接氯化法[11]合成二氯乙二肟:将乙二肟17.6 g(0.2 mol)加入200 mL无水乙醇加热搅拌至溶解后, 冷却到-20 ℃, 通氯气(约0.4 mol, 由高锰酸钾与浓盐酸制得)50 min, 再反应30 min, 慢慢升温至室温, 旋转蒸发到大量微黄色固体析出后抽滤, 滤饼用二氯甲烷洗涤后得到白色粉末二氯乙二肟27 g(0.16 mol, 84%)。1H NMR(DMSO-d6, 500 MHz)δ: 13.14(s, 2H); 13C NMR(DMSO-d6, 126 MHz) δ: 130.9; Anal. Calcd for C2H2Cl2N2O2: C 15.65, H 1.25, N 17.49; found: C 15.19, H 1.31, N 17.49。
氧化氯化法[13]合成二氯乙二肟:将乙二肟4.4 g(50 mmol)、10 mL水、盐酸11.1 mL(110 mmoL)加入到100 mL烧瓶中, 通过恒压滴液漏斗缓慢滴加双氧水12. 5mL(110 mmoL), 加入氯化钙22.2 g(100 mmoL)搅拌溶解, 冰浴, 反应2 h, 抽滤, 得到少量白色粉末二氯乙二肟(1.4 g, 2%)。
2.3.3 1, 1′-二羟基-5, 5′-联四唑二水合物(4)的合成将二氯乙二肟8 g (50 mmol)溶于100 mL丙酮和100 mL水的混合溶剂中, 冷却至0 ℃后分批次加入叠氮化钠7.8 g(120 mmol), 搅拌反应1.5 h, 用无水乙醚萃取(3×100 mL), 萃取液不经过任何处理直接通入氯化氢气体(过量), 薄层色谱(乙酸乙酯:石油醚体积比为2:1)监测反应进程, 挥发无水乙醚与氯化氢气体, 抽滤后用少量冰水洗涤得到微黄色的1, 1′-二羟基-5, 5′-联四唑二水合物9.1 g (44 mmol, 88%)。1H NMR (DMSO-d6, 500 MHz) δ: 6.40 (s, 2H); 13C NMR (DMSO-d6, 126 MHz) δ:135.8; FT-IR(ν/cm-1): 3299, 1665, 1411, 1375, 1302, 1028, 1144, 995, 714, 662; m/z (ESI-): 168.99 [C2HN8O2-]; Anal. Calcd for C2H6N8O4: C 12.01, H 2.81, N 54.04; found: C 11.65, H 2.93, N 54.36。
2.3.4 1, 1′-二羟基-5, 5′-联四唑二羟胺盐(5)的合成将1, 1′-二羟基-5, 5′-联四唑二水合物10.3 g(50 mmol)溶于200 mL的乙酸乙酯中, 加入碳酸氢钠8.1 g(100 mmol)和盐酸羟胺7.0 g(100 mmol), 50 ℃条件下反应2 h后抽滤, 用(0~5 ℃)冰水30 mL分三次水洗得到白色固体1, 1′-二羟基-5, 5′-联四唑二羟胺盐11.1 g(47 mmol, 94%)。
1H NMR (DMSO-d6, 500 MHz) δ: 9.89 (brs, 2H); 13C NMR (DMSO-d6, 126 MHz) δ: 135.4; FT-IR(ν/cm-1): 3415, 3219, 3081, 3050, 2936, 2689, 2513, 1599, 1577, 1527, 1426, 1413, 1389, 1352, 1338, 1316, 1236, 1174, 1145, 1095, 1046, 1029, 1011, 997, 800, 723, 676, 612; m/z (ESI-): 168.99 [C2HN8O2-]; Anal. Calcd for C2H8N10O4: C 10.05, H 3.63, N 59.31; found: C10.17, H 3.41, N 59.31。
3 结果与讨论 3.1 二氯乙二肟的合成方法选择关于二氯乙二肟的合成, Peet等人[12]用N-氯代丁二酰亚胺氯化乙二肟得到二氯乙二肟, 收率高达91%(第一种方法); 毕福强等人[11]直接用氯气氯化乙二肟得到二氯乙二肟, 收率也高达91%(第二种方法); Innokent′evich等人[13]采用双氧水与氯化钙氧化氯化乙二肟的方法合成出了二氯乙二肟, 收率高达93%(Scheme 2)(第三种方法)。
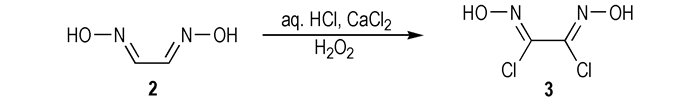
|
Scheme 2 |
第一种方法需要用到N-氯代丁二酰亚胺, 成本太高, 不适合大规模工业生产; 第三种方法本课题组尝试了多次发现, 乙二肟的氧化氯化方法收率低, 同时易生成一氯乙二肟副产物。
综合考虑选择第二种方法合成二氯乙二肟,该法具有成本低, 收率高, 适合工业化等特点。同时经过多次实验发现反应之前的预处理(加热使乙二肟完全溶于乙醇溶剂中)有利于提高该反应的收率。
3.2 叠氮化-环合反应 3.2.1 反应溶剂对叠氮化-环合反应收率的影响在0 ℃, n (二氯乙二肟):n(叠氮化钠)=1:2.4, 反应时间为1.5 h的条件下, 考察了丙酮与水、乙醚与水、乙醇与水、DMF与水(体积比均为1:1)的混合溶剂对1, 1′-二羟基-5, 5′-联四唑二水合物的收率的影响, 具体结果见表 1。
| 表 1 混合溶剂对叠氮化-环合反应收率的影响 Tab.1 Effect of mixed solvent on yield of azidation-cyclization |
由表 1可知, 当以乙醚与水作为混合溶剂时, 由于水与乙醚不能混溶, 从而使得叠氮化钠与二氯乙二肟不能完全接触, 反应很难进行, 收率仅为20%;当以乙醇和水作为混合溶剂时, 叠氮基乙二肟很难从乙醇和水的混合溶剂中萃取出来, 收率也不高, 仅为33%。当以DMF与水作为混合溶剂时, DMF沸点高, 难处理, 只能通过加水的方式让二叠氮基乙二肟析出, 最终导致收率不高。当丙酮与水作为混合溶剂时, 可以避免过滤二叠氮基乙二肟固体, 也可以避免一些高沸点的溶剂如DMF与NMP等的使用; 同时通过萃取的的处理方式也可以将1, 1′-二羟基-5, 5′-联四唑二水合物的收率提高至88%。因此, 最适宜的混合溶剂为丙酮与水。
3.2.2 反应温度对叠氮化-环合反应收率的影响在丙酮与水作为混合溶剂, n(二氯乙二肟):n(叠氮化钠)=1:2.4, 反应时间为1.5 h的条件下, 考察反应温度对1, 1′-二羟基-5, 5′-联四唑二水合物的收率的影响, 具体结果见表 2。
| 表 2 反应温度对叠氮化-环合反应收率的影响 Tab.2 Effect of reaction temperature on yield of azidation-cyclization |
由表 2可见, 反应温度低时收率较低; 随着温度的升高, 叠氮化收率逐渐提高; 继续升高温度, 产物的收率和纯度都有所降低, 这可能是因为温度较低时, 叠氮化反应速率慢, 而温度太高, 会生成副产物。因此, 适宜的反应温度为0 ℃。
3.2.3 反应时间对叠氮化-环合反应的收率的影响在0 ℃, 丙酮与水作为混合溶剂, n(二氯乙二肟): n(叠氮化钠)=1:2.4的条件下, 考察反应时间对1, 1′-二羟基-5, 5′-联四唑二水合物收率的影响, 具体结果见表 3。
| 表 3 反应时间对叠氮化-环合反应收率的影响 Tab.3 Effect of reaction time on yield of azidation-cyclization |
由表 3可见, 随着反应时间的增加, 1, 1′-二羟基-5, 5′-联四唑二水合物收率逐渐增高, 当反应时间为1.5 h时收率最高, 再延长反应时间, 收率没有明显提高。因此, 最佳反应时间为1.5 h。
3.3 酸碱中和反应 3.3.1 反应溶剂对酸碱中和收率的影响在50 ℃, n(1, 1′-二羟基-5, 5′-联四唑二水合物) :n(盐酸羟胺):n(碳酸氢钠)=1:2:2, 反应时间为2 h的条件下, 选取了水、乙酸乙酯、甲醇、二氯甲烷为反应溶剂, 考察反应溶剂对收率的影响, 具体结果见表 4。由表 4可知, 当以乙酸乙酯为溶剂时, TKX-50收率最高, 为94%, 这可能是因为当以水作为溶剂时, 由于产物TKX-50能部分溶于水, 从而导致直接过滤的处理方法收率不高, 浓缩溶剂也比较危险。同样, 当以甲醇作为反应溶剂时, 产物TKX-50能部分溶于甲醇, 从而导致收率不高。当以二氯甲烷作为溶剂时, 1, 1′-二羟基-5, 5′-联四唑二水合物不溶于二氯甲烷, 反应很难进行, 从而导致收率降低。由于原料1, 1′-二羟基-5, 5′-联四唑二水合物易溶于乙酸乙酯而产物TKX-50难溶于乙酸乙酯, 可以通过简单的过滤后冰水洗涤的方法得到产物TKX-50。因此, 酸碱中和反应的最佳溶剂是乙酸乙酯。
| 表 4 反应溶剂对酸碱中和反应的影响 Tab.4 Effect of solvent on yield of neutralization |
在乙酸乙酯作为溶剂, n(1, 1′-二羟基-5, 5′-联四唑二水合物):n(盐酸羟胺):n(碳酸氢钠)=1:2:2, 反应时间为2 h的条件下, 考察反应温度对TKX-50收率的影响, 具体结果见表 5。
| 表 5 反应温度对酸碱中和反应收率的影响 Tab.5 Effect of reaction temperature on yield of neutralization |
由表 5可见, 随着反应温度的增加, TKX-50收率增大, 当温度升至50 ℃时, 收率最高, 达94%, 之后再升高温度, 收率变化不大, 这可能是因为反应温度低时, 酸碱中和速率慢, 收率较低; 随着温度的升高, 酸碱中和反应速率变快, 收率逐渐提高。因此, 适宜的温度为50 ℃。
3.3.3 反应时间对酸碱中和反应收率的影响在50 ℃, 乙酸乙酯作为溶剂, n(1, 1′-二羟基-5, 5′-联四唑二水合物):n(盐酸羟胺):n(碳酸氢钠)= 1:2:2的条件下, 考察反应时间对TKX-50收率的影响, 具体结果见表 6。
| 表 6 反应时间对酸碱中和收率的影响 Tab.6 Effect of reaction time on yield of neutralization |
由表 6可见, 随着反应时间的增加, 收率增大, 2 h时收率最大, 达94%, 再延长反应时间收率不再增加。这可能是因为2 h时酸碱中和完全反应。因此, 适宜的反应时间为2 h。
4 结论(1) 以乙二醛原料, 经过肟化、氯化、叠氮化-环合和酸碱中和等反应合成了TKX-50。并利用核磁共振、红外、质谱、元素分析等对产物进行了表征。此法避免了敏感中间产物二叠氮基乙二肟的以固体形式存在, 使得该方法操作安全; 直接在萃取液中通氯气发生环合反应, 使得该方法操作简单; 利用酸碱中和直接合成TKX-50, 使得该方法操作简单。因此, 该方法合成TKX-50, 具有一定的工业化应用前景。
(2) 优化了叠氮化-环合反应条件:以丙酮与水作为混合溶剂, n(二氯乙二肟):n(叠氮化钠)=1:2.4, 反应温度为0 ℃, 反应时间为1.5 h, 收率为88%。
(3) 优化了酸碱中和反应条件:溶剂为乙酸乙酯, n(1, 1′-二羟基-5, 5′-联四唑二水合物):n(盐酸羟胺):n(碳酸氢钠)=1:2:2, 反应时间为2 h, 反应温度为50 ℃, 收率为94%。
| [1] |
彭蕾, 李玉川, 杨雨璋, 等. 双环和多环四唑含能化合物的合成研究进展[J].
有机化学, 2012, 32: 667-676. PENG Lei, LI Yu-chun, YANG Yu-zhang, et al. Research progress in synthesis of energetic compounds of bicycle-and multicyclo-tetrazoles[J]. Chinese Journal of Organic Chemistry, 2012, 32: 667-676. |
| [2] |
居平文, 凌亦飞, 王桂香, 等. 一种新型高氮含能化合物5-((5-硝基-2H-四唑-2-基)甲基)-1H-四唑-1-醇的合成与表征[J].
有机化学, 2015, 35: 236-240. JU Ping-wen, LING Yi-fei, WANG Gui-xiang, et al. Synthesis and characterization of a novel high nitrogen energetic compound 5-((5-Nitro-2H-tetrazol-2-yl)methyl)-1H-tetrazol-1-ol[J]. Chinese Journal of Organic Chemistry, 2015, 35: 236-240. |
| [3] |
Tselinskii I V, Mel′nikova S F, Romanova T V. Synthesis and reactivity of carbohydroximoyl azides: I. aliphatic and aromatic carbohydroximoyl azides and 5-Substituted 1-hydroxytetrazoles based thereon[J].
Russia Journal of Organic Chemistry, 2001, 37(3): 455-461. |
| [4] |
毕福强, 樊学忠, 许成, 等. 1, 1′-二羟基-5, 5′-联四唑的合成及理论研究[J].
火炸药学报, 2013, 36(4): 22-25. BI Fu-qiang, FAN Xue-zhong, XU Cheng, et al. Synthesis and theoretical study of 1, 1′-dihydroxy-5, 5′-bistetrazole[J]. Chinese Journal of Explosives & Propellants, 2013, 36(4): 22-25. |
| [5] |
Gao H, Shreeve J M. Azole-based energetic salts[J].
Chemical Reviews, 2011, 111: 7377-7436. DOI:10.1021/cr200039c |
| [6] |
黄海丰, 周智明. 基于有机阴离子的含能离子盐研究进展[J].
火炸药学报, 2012, 35(6): 1-10. HUANG Hai-feng, ZHOU Zhi-ming. Progress of study on organic anion based on energetic salts[J]. Chinese Journal of Explosives & Propellants, 2012, 35(6): 1-10. |
| [7] |
Fischer N, Fischer D, Klapotke T M, et al. Pushing the limits of energetic materials-the synthesis and characterization of dihydroxylammonium 5, 5′-bistetrazole-1, 1′-diolate[J].
Journal of Materials Chemistry, 2012, 22: 20418-20422. DOI:10.1039/c2jm33646d |
| [8] |
朱周朔, 姜振明, 王鹏程, 等. 5, 5′-联四唑-1, 1′-二氧二羟胺的合成及其性能[J].
含能材料, 2014, 22(3): 332-336. ZHU Zhou-shuo, JIANG Zheng-ming, WANG Peng-cheng, et al. Synthesis and properties of dihydroxylammonium 5, 5′-bistetrazole-1, 1′-diolate[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2014, 22(3): 332-336. |
| [9] |
周智明, 梁丽轩, 唐立伟, 等. 一种5, 5′-联四唑-1, 1′-二氧羟胺盐(TKX-50)的合成方法. CN: 103524444[P], 2014.
|
| [10] |
毕福强, 肖川, 许成, 等. 1, 1′-二羟基-5, 5′-联四唑二羟胺盐的合成与性能[J].
含能材料, 2014, 22(2): 272-273. BI Fu-qiang, XIE Chuan, XU Cheng, et al. Synthesis and properties of dihydroxylammonium 5, 5′-bistetrazole-1, 1′-diolate[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2014, 22(2): 272-273. |
| [11] |
毕福强, 王伯周, 王锡杰, 等. 1, 4-二硝基呋咱并[J].
含能材料, 2009, 17(5): 537-540. BI Fu-qiang, WANG Bo-zhou, XANG Xi-jie, et al. Synthesis of 1, 4-dinitrofurazano[3, 4-b]piperazine (DNFP)[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(5): 537-540. |
| [12] |
Peet P L, Connell T U, Gunawan G, et al. A click chemistry approach to 5, 5′-disubstituted-3, 3′-bisisoxazolesfrom dichloroglyoxime and alkynes: luminescent organometallicIridium and rhenium bisisoxazole complexes[J].
Journal of Organic Chemistry, 2013, 78: 7298-7304. DOI:10.1021/jo4008755 |
| [13] |
Innokent′evich V V, Iosifovna T S. Method for preparing dichloroglyoxime: RU. 2313517[P], 2006.
|
Dihydroxylammonium 1, 1′-diolate-5, 5′-bistetrazole (TKX-50) was synthesized via the reactions of oximation, chloration, azidation-cyclization and neutralization using glyoxal as starting material, and its structure was characterized by NMR, MS, IR. The optimum conditions for azidation-cyclization reaction and neutralization reaction were obtained.




