铜的叠氮化物存在多种形式, 都具有爆炸性, 其中常态的两种铜叠氮化物是叠氮化亚铜(CuN3)和叠氮化铜(Cu(N3)2), 都具有比叠氮化铅更大的威力, 但也异常敏感[1], 因此长期以来铜叠氮化物的应用受到了极大的限制。但随着微机电系统(MEMS)引信的发展, 以铜叠氮化物为基的微装药受到了关注。
目前, 研究者对铜与气体叠氮酸的“原位”反应进行了大量的研究工作, 并对其产物进行了表征。2008年, Gerald Laib[2]将铜沉积于基片上首先形成铜薄膜, 而后通过“原位”合成方法与气体叠氮酸反应合成了叠氮化铜薄膜装药, 经飞片换能后用于起爆下一级装药。2010年, Valarie Pelletier等人[3]将纳米铜颗粒封装于碳纳米管内, 与气体叠氮酸反应制备了叠氮化铜, 该方法大大降低了叠氮化铜的敏感性。2012年, Zhang Fang等人[4]利用阳极氧化铝(AAO)作为模板制备了铜纳米线阵列, 而后与叠氮酸反应制得了叠氮化铜纳米线阵列。2015年, 张植栋[5]、李娜[6]等人通过氢气泡模板法制备了多孔铜, 而后与气体叠氮酸反应制得了三维多孔铜叠氮化物。这为微装药技术提供了基础。本实验室[7]将块状的纳米多孔铜与气体叠氮酸反应制得了块状的铜叠氮化物装药, 提高了装药密度, 从而大大提高了装药的稳定性和起爆能力。铜颗粒尺寸和多孔铜的厚度对其叠氮化反应后的产物纯度有着重要的影响, 进而影响其爆炸性能。然而, 对于多孔铜前驱体尺度(铜颗粒尺寸和多孔铜厚度)对其叠氮化反应的影响研究未见诸报道。因此, 本文对此开展了研究。
由于铜叠氮化物易与热的稀盐酸反应[8], 因此本研究首先将铜颗粒和块状多孔铜分别与气体叠氮酸反应, 而后将其产物分别溶于热的稀盐酸溶液中, 测试溶液中铜离子浓度, 从而得到了不同尺寸的铜颗粒和不同厚度的块状多孔铜的转化率, 利于认识块状多孔铜与气体叠氮酸的反应特性以及进一步改善块状多孔铜前驱体的形貌设计。
2 实验部分 2.1 试剂与仪器仪器: S-4700型扫描电子显微镜(SEM), 日本Hitachi公司; 7000DV型电感耦合等离子体发射光谱仪(ICP), 美国PerkinElmer公司; XS105 DualRange型分析天平, 瑞士Mettler Toledo公司。
试剂:浓盐酸, 北京化工厂, 分析纯; 无水硫酸铜, 北京化工厂, 分析纯; 浓硫酸, 北京化工厂, 分析纯; 去离子水, 自制。
2.2 实验过程块状多孔铜的制备以及原位反应过程可参考文献[7], 4 g叠氮化钠与20 g硬脂酸加入至50 mL的四口烧瓶内, 缓缓通入氮气, 同时油浴升温至130℃后停止通入氮气, 装置接口处涂抹凡士林防止叠氮酸气体的泄漏。反应结束后移除油浴, 再次通入氮气吹扫整个反应装置, 待降温后小心取出产物。铜与气体叠氮酸的反应如下述方程所示。
2Cu + 3HN3→2CuN3 + NH3 + N2
2CuN3 + 3HN3→2Cu(N3)2 + NH3 +N2
铜颗粒采用电解CuSO4溶液的方法制得, 具体如下:电解液由0.5 mol·L-1 CuSO4、1.0 mol·L-1 H2SO4和1.0 mmol·L-1 HCl组成, 阴极和阳极之间的距离为2.0 cm, 电解液温度为25 ℃, 通过改变电流密度(1,0.24,0.18 A·cm-2)分别制得约0.5 μm、1 μm和2 μm的铜颗粒。原位反应结束后, 将产物溶于50 ℃、0.5 mol·L-1稀盐酸溶液, 2 h后取出溶液将其稀释10倍后定容10 mL, 采用ICP光谱仪测试虽不能区分溶液中Cu+和Cu2+浓度, 但能够确定溶液中全部铜离子的浓度。而在相同条件下, 将制备的铜颗粒或块状多孔铜放入稀盐酸溶液中与之反应, 采用ICP光谱仪测试溶液中铜离子浓度为0, 说明该条件下铜颗粒和块状多孔铜不与稀盐酸溶液发生反应。通过公式(1)即能得到铜颗粒和块状多孔铜的转化率。
| $ \alpha = \frac{{{C_{{\rm{Cu}}}}}}{{100{m_{{\rm{Cu}}}}}}100\% $ | (1) |
式中, α为转化率; CCu为ICP光谱仪测试得到的铜离子浓度, mg·L-1; mCu为反应前铜的质量, mg。
3 结果与讨论 3.1 铜颗粒与气体叠氮酸的反应转化率铜颗粒可看作是一种密实固体, 对于密实固体与气体的反应可用未反应核模型来描述, 该模型是指反应在固体产物层和未反应核之间狭窄边界上发生, 随反应的进行, 未反应核不断缩小[9]。其示意图如图 1所示。
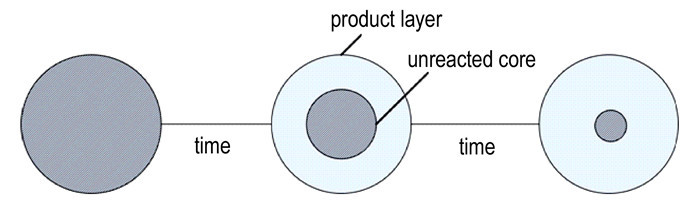
|
图 1 未反应核模型示意图 Fig.1 Schematic diagram of unreacted core model |
可以预见, 随着铜颗粒尺寸不断增大, 覆盖在铜颗粒表面的叠氮化物产物会阻碍叠氮酸气体产生, 从而导致内部的铜不发生反应。因此, 与气体叠氮酸能够完全反应的铜颗粒尺寸将存在一个临界值。实验中, 将3种尺寸(0.5, 1, 2 μm)的铜颗粒分别与气体叠氮酸反应24 h后得到其转化率, 具体结果见表 1。图 2为3种尺寸铜颗粒的SEM图, 铜颗粒近似看作球形。
| 表 1 不同尺寸铜颗粒与气体叠氮酸的反应转化率 Tab.1 Reaction conversion of copper particles with different size with gaseous HN3 |

|
图 2 不同尺寸铜颗粒的SEM图 Fig.2 SEM images of copper particles with different size |
实验表明, 将直径0.5 μm左右的铜颗粒与气体叠氮酸反应后的产物溶于热的稀盐酸2 h后, 溶液澄清, 无明显残渣; 而另外两种尺寸的铜颗粒溶液中有明显残渣。由表 3也可看出, 对于0.5 μm左右的铜颗粒, 其反应转化率超过95%。而对于1 μm和2 μm左右的铜颗粒, 其反应转化率分别仅为72%和50%左右。因此, 可以认为0.5 μm左右的铜颗粒基本能够与气体叠氮酸完全反应, 而当尺寸增大到1 μm后, 铜颗粒与气体叠氮酸不能反应完全, 再增大尺寸反应程度会进一步减弱。
| 表 3 0.3 mm厚块状多孔铜不同反应时间下的转化率 Tab.3 Conversion of monolithic porous copper with 0.3 mm thickness at different reaction time |
实验中, 将两种厚度(0.2 mm和0.3 mm)的块状多孔铜分别反应1, 2, 4, 8, 16, 24 h后计算反应转化率, 结果见表 2和表 3。图 3为块状多孔铜的SEM图。由图 3可看出, 制备的块状多孔铜基本由100~200 nm的铜颗粒构成。图 4为块状多孔铜的实物图。块状多孔铜的表观密度为1.51 g·cm-3, 通过公式(2)计算得到孔隙率约为83%。
| 表 2 0.2 mm厚块状多孔铜不同反应时间下的转化率 Tab.2 Conversion of monolithic porous copper with 0.2 mm thickness at different reaction time |

|
图 3 0.3 mm厚块状多孔铜的SEM图 Fig.3 SEM image of monolithic porous copper with 0.3 mm thickness |

|
图 4 0.3 mm厚块状多孔铜的实物图 Fig.4 Photograph of monolithic porous copper with 0.3 mm thickness |
| $ \varepsilon = 1-\frac{{{\rho _{\rm{a}}}}}{{{\rho _0}}} $ | (2) |
式中, ε为多孔铜的孔隙率; ρa为多孔铜的表观密度, g·cm-3; ρ0为铜的理论密度, g·cm-3。
铜与气体叠氮酸反应属于产生固体生成物的气固反应, 即当铜和气体叠氮酸反应时, 铜被转化为叠氮化亚铜或叠氮化铜固体。在反应初始阶段, 由于块状多孔铜的多孔性, 叠氮酸气体在多孔铜内部的扩散阻力较小, 能够快速进入到多孔铜内部与之反应。从表 2和表 3能够看出, 0.2 mm和0.3 mm多孔铜与气体叠氮酸反应1 h后的转化率都较大, 0.2 mm厚多孔铜反应1 h后的转化率甚至超过80%, 这表明, 在反应初期, 气体叠氮酸能够快速渗透至多孔铜内部, 另一方面也说明铜与气体叠氮酸易反应, 因此铜与气体叠氮酸的反应是一个快速反应。根据转化率与时间的关系, 通过公式(3)可以得出不同时间的转化速率。图 5和图 6分别为0.2 mm和0.3 mm厚块状多孔铜不同反应时间下的转化速率。
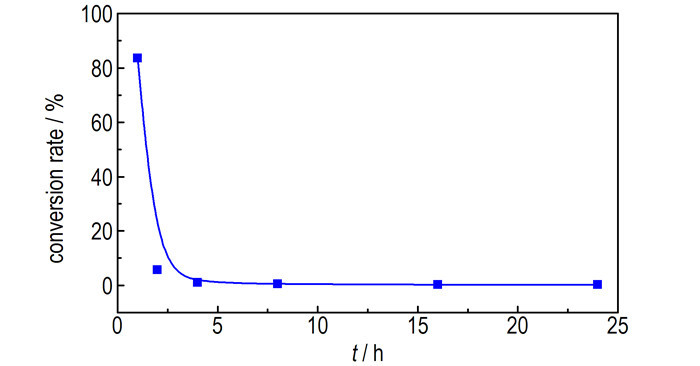
|
图 5 0.2 mm厚多孔铜不同反应时间下的转化速率 Fig.5 Conversion rate of porous copper with 0.2 mm thickness at different reaction time |

|
图 6 0.3 mm厚多孔铜不同反应时间下的转化速率 Fig.6 Conversion rate of porous copper with 0.3 mm thickness at different reaction time |
| $ v = \frac{{\Delta \alpha }}{{\Delta t}} \times 100\% $ | (3) |
式中,v表示转化速率, %; Δt表示时间间隔,h; Δα表示不同时间的转化率之差。
从图 5和图 6可以明显看出, 转化速率随反应时间的增加而不断降低。这是因为随着反应时间的增加, 块状多孔铜表表面的铜颗粒反应完全, 生成铜叠氮化物, 根据铜与铜叠氮化物的密度可计算出颗粒体积将不断增大, 使得多孔铜表面的孔隙不断缩小, 进而使得气体叠氮酸进入多孔铜内部的扩散阻力不断增加, 因此导致转化速率的不断降低。值得注意的是, 反应24 h后, 0.2 mm厚的多孔铜转化速率虽然较低, 但仍存在一定的转化速率, 增加反应时间仍能够继续与气体叠氮酸反应, 而对于0.3 mm厚的多孔铜反应速率已经趋近于0, 增加反应时间也很难继续反应。这也说明, 随着多孔铜厚度的增加, 气体叠氮酸渗透进入其内部的阻力增大, 不利于反应的进行, 多孔铜的孔隙尺寸成为影响其继续反应的主要因素。
4 结论(1) 直径0.5 μm左右的铜颗粒基本能够与气体叠氮酸完全反应, 进一步增大铜颗粒的尺寸则反应不能够完全进行, 颗粒存在未反应核, 不利于形成有效的铜叠氮化物装药, 因此为保证多孔铜完全叠氮化, 其颗粒尺寸应小于0.5 μm。
(2) 对于块状多孔铜与气体叠氮酸的反应, 在反应初期, 叠氮酸气体能够快速渗透进入多孔铜的内部。反应一段时间后, 由于反应产物膨胀, 产物层将多孔铜表面的孔隙阻塞, 使得叠氮酸气体进入多孔铜内部的阻力增大, 最终导致反应愈发难以进行。因此为使更厚的块状多孔铜能够与气体叠氮酸完全反应, 适当增大块状多孔铜的孔隙尺寸是十分有必要的。
(3) 铜与气体叠氮酸的反应是一个快速反应。因此, 块状多孔铜与气体叠氮酸的反应速率由气体叠氮酸在块状多孔铜内部的扩散速率决定。
| [1] |
Fair H D, Walker R F.
Energetic Materials: Physics and Chemistry of Inorganic Azides[M]. New York and London: Plenum Press, 1977.
|
| [2] |
Laib G. Integrated thin film explosive macro-detonator: US7322294 B1[P], 2008-1-29.
|
| [3] |
Pelletier V, Bhattacharyya S, Knoke I, et al. Copper azide confined inside template carbon nanotubes[J].
Advanced Functional Materials, 2010, 20: 3168-3174. DOI:10.1002/adfm.201000858 |
| [4] |
Zhang F, Wang Y L, Bai Y W, et al. Preparation and characterization of copper azide nanowire array[J].
Materials Letters, 2012, 89: 176-179. DOI:10.1016/j.matlet.2012.08.077 |
| [5] |
张植栋, 张方, 王燕兰, 等. 多孔铜叠氮化物的原位合成及性能表征[J].
火工品, 2015(02): 26-28. ZHANG Zhi-dong, ZHANG Fang, WANG Yan-lan, et al. In-situ preparation and characterization of porous copper azides[J]. Initiators & Pyrotechnics, 2015(02): 26-28. DOI:10.3969/j.issn.1003-1480.2015.02.008 |
| [6] |
李娜, 许建兵, 叶迎华, 等. 三维多孔微纳米结构叠氮化铜的原位合成及表征[J].
火炸药学报, 2015, 38(04): 63-66. LI Na, XU Jian-bing, YE Ying-hua, et al. In situ Synthesis and characterization of three dimensional porous micro-nano structured copper azide[J]. Chinese Journal of Explosives & Propellants, 2015, 38(04): 63-66. |
| [7] |
Li B, Li M Y, ZENG Q X, et al. In-situ fabrication of monolithic copper azide[J].
Journal of Energetic Materials, 2016, 34(2): 123-128. DOI:10.1080/07370652.2015.1015694 |
| [8] |
Matyáš R, Pachman J.
Primary Explosives[M]. Berlin: Verlag Press, 2013.
|
| [9] |
葛庆仁.
气固反应动力学[M]. 北京: 原子能出版社, 1991: 46-48.
GE Qing-ren. Gas-solid reaction kinetics[M]. Beijing: Atomic Energy Press, 1991: 46-48. |

The peculiarity for two forms of copper reacting with gaseous diazoimide was studied, consisting of copper particles and monolithic porous copper, respectively.




