全氮型超高能化合物是含能材料发展的一个新的技术领域[1]。多叠氮类化合物(Polyazides)是由中心原子和叠氮基构成的二元共价化合物,它们也可以看作是
基于以上优点,对多叠氮类化合物的合成探索研究已成为含能材料研究的热点,相关研究先后多次被Angew. Chem. Int. Ed.和Chem. Eur. J.等化学权威期刊选为封面文章。国内也开始了对多叠氮化合物爆炸性能的研究[4]。多叠氮类化合物大致可分为多叠氮化合物,多叠氮化合物可与路易斯碱形成酸-碱络合物,以及多叠氮离子化合物。这些化合物极不稳定,爆炸非常猛烈,即使1 mmol的量也能引起严重破坏,而且它们的合成对实验条件要求非常苛刻,因此多叠氮类化合物的合成是一件充满技术和挑战的工作,也是后续应用的基础。鉴于此,本文主要从合成的角度,分类介绍了多叠氮类化合物的研究进展,并对这一领域的发展方向进行了展望。
2 多叠氮化合物的合成 2.1 已报道的多叠氮化合物对多叠氮化合物的理论研究和合成探索已广泛开展,到目前为止,已经预测了30余种元素形成的多叠氮化合物的性质,这些化合物的中心原子主要集中在第三到第六主族和第三到第六副族,如图 1所示。已经被成功合成的多叠氮化合物主要包括(按报道时间先后排序):Al(

|
图 1 多叠氮化合物研究中已被作为中心原子探索过的元素(灰底:相关性能已经过计算的多叠氮化合物;黑底:经过计算并已成功合成的多叠氮化合物) Fig.1 The elements been explored as central atoms in the research of polyazides(Gray shade: polyazides been theoretically predicted; Black shade: polyazides been prepared) |
多叠氮化合物的合成也是制备多叠氮络合物和多叠氮阴离子的基础,但同时也是最艰难的一步。一般需要在隔绝氧气、水分的情况下,严格地控制反应温度。国外主要是在特制的真空管线中进行反应,操作时必须配备面罩、手套等全套的防护措施。
比较成熟的合成方法是通过中心原子的卤代物和叠氮化物在合适的溶剂中进行取代反应。氟化物和三甲基叠氮硅烷是最常用的反应原料,反应方程式如下:
| $\begin{eqnarray} \text{MF}_{n}+n\text{Me}_{3}\text{SiN}_{3}\to \text{M}(\text{N}_{3})_{n}+n\text{Me}_{3}\text{SiF}_{n} \end{eqnarray}$ | (1) |
为防止在投料过程中就迅速反应而发生爆炸,投料需要在超低温条件下进行,然后在缓慢升温(温度的快速变化也会引起目标产物的爆炸)的过程中发生反应。多叠氮化合物的不稳定性给分离提纯造成了极大的困难。一般通过保持三甲基叠氮硅烷过量,并选用易挥发性溶剂,在反应结束后通过减压除去过量的叠氮硅烷、溶剂以及副产物氟硅烷,得到纯净的多叠氮化合物。
2.3 一些特殊的合成方法不同的多叠氮化合物其合成条件略有差异,对于一些特殊的情况简要说明如下。
B(
Te(
As和Sb形成的多叠氮化合物性质极其类似,对它们的研究也比较深入。它们能形成3配位数和5配位数的多叠氮化合物[10]。其中3配位数的多叠氮化合物比较稳定,已培养得到单晶样品,As(
Nb,Ta,Mo,W等元素形成的多叠氮化合物在室温下很不稳定,因此合成反应必须严格控制在低温条件下(约-30 ℃左右)进行,升至室温即爆炸[13-14]。另外,它们对振动、温度改变(如用液氮冷却),甚至压力改变极其敏感,而且破坏力很强。Mo(
在C(
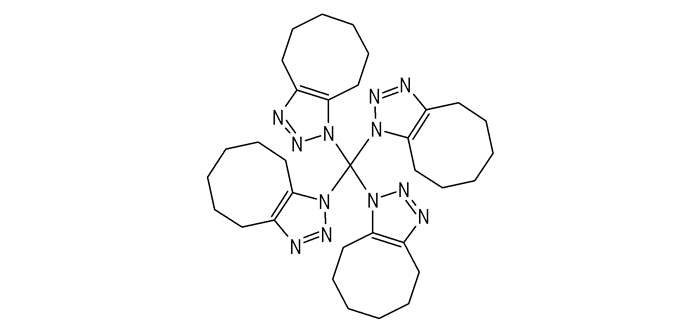
|
Scheme 1 |
表征多叠氮类化合物最常用的手段是红外光谱和核磁共振。共价型的叠氮基,有多种振动模式,但在实验谱图上能明确观察到并归属的主要有叠氮基的不对称伸缩振动、对称伸缩振动和M-N的伸缩振动,其波数分别位于2200, 1200,400
B,As,Sb,Nb,Ta,Ga,In,Tl等元素形成的多叠氮化合物具有缺电子性质,是路易斯酸,能与富电子体系形成路易斯酸-碱络合物[20-21]。因此在它们的合成过程中,常得到多叠氮化合物和溶剂(如乙腈)的络合物。
这种络合物的形成能在一定程度上稳定多叠氮化合物。前已述及As(
| $\begin{eqnarray} \text{MF}_{5}+5\text{Me}_{3}\text{SiN}_{3}+\text{L}\to \text{M}(\text{N}_{3})_{5}·\text{L}+5\text{Me}_{3}\text{SiF}_{3} \end{eqnarray}$ | (2) |
式中,M=As,Sb,L=pyridine, quinoline,
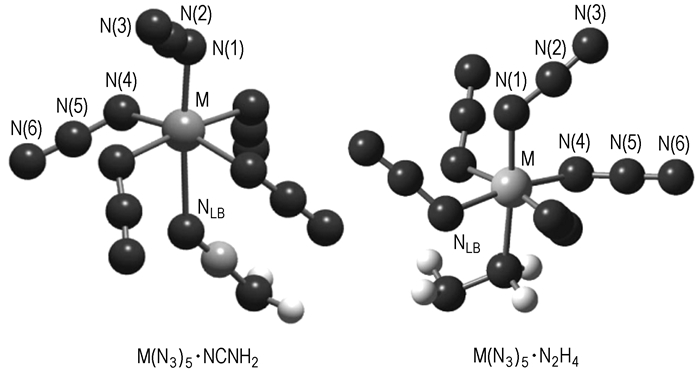
|
图 2 多叠氮络合物M( |
ⅢA族形成的多叠氮化合物也有类似性质。B(
多叠氮化合物与叠氮负离子进一步反应能生成多叠氮负离子,它可以与不含能的阳离子(如
多叠氮负离子形成的盐稳定性都有较大的提高,因此可以制得单晶样品,为结构的解析提供了极大便利。稳定性的提高一方面是由于大的对离子实质上是个惰性间隔,它的存在可以抑制爆炸传播;另一方面是由于多叠氮负离子中叠氮基的离子性有所增强。完全共价型的叠氮基极化为一个单键和一个三键的结构,如Scheme 2所示[9],极易从N—N单键处断裂而放出氮气,因此表现出极高的震动敏感性。而叠氮阴离子具有两个双键的结构,相对比较稳定。因此增加叠氮基的离子性,将提高N—N单键断裂的能垒,进而提高叠氮基的稳定性。
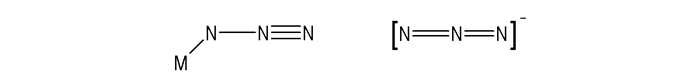
|
Scheme 2 |
合成多叠氮阴离子最常用的方法是先制备相应的多叠氮化合物,然后再使其与叠氮阴离子反应[9, 12-14, 16-18],如式(3)所示:
| $\begin{eqnarray} \text{M}(\text{N}_{3})_{n}+\text{A}^{+}\text{N}^{-}_{3}\to \text{A}^{+}[\text{M}(\text{N}_{3})_{n+1}]^{-} \end{eqnarray}$ | (3) |
式中,A=
当然也并非一定按照以上思路。如[M(
| $\begin{eqnarray} [\text{Et}_{4}\text{N}][\text{MCl}_{6}]+6\text{Me}_{3}\text{SiN}_{3}\to [\text{Et}_{4}\text{N}][\text{M}(\text{N}_{3})_{6}](\text{M}=\text{As}, \text{Sb}) \end{eqnarray}$ | (4) |
表 1对多叠氮离子的合成条件进行了总结。从表 1可知,多叠氮离子主要是阴离子,但极少数化合物也能形成阳离子。如[M(
| 表 1 文献中已报道的多叠氮离子的合成 Tab.1 The synthesis of polyazido anions reported in references |
| $\begin{eqnarray} [\text{MCl}_{4}]^{+}[\text{Sb}_{2}\text{F}_{11}]^{-}+\text{NaN}_{3}\to [\text{Sb}(\text{N}_{3})_{4}]^{+}[\text{Sb}_{2}\text{F}_{11}]^{-}+\text{NaCl} (\text{M}=\text{As}, \text{Sb}) \end{eqnarray}$ | (5) |
与多叠氮阴离子形成的盐相比,阳离子形成的盐比较容易爆炸,根据文献[21]报道,25 ℃时,[Sb(
多叠氮类化合物的合成是全氮含能材料研究领域的重要内容,近十年来,国外已就多族元素形成的多叠氮化物开展了一系列探索性研究,对它们的合成和性质有了初步了解,已逐渐成为一个独立并且活跃的研究领域。在平行地探索更多多叠氮化合物合成的同时,以这类化合物作为富氮基元,进行结构修饰和衍生,拓展出新的高氮化合物,已逐步成为一个新的发展方向。常用的方法主要有以下两种:
(1) 通过分子间作用力组装超分子。如前所述,利用配位键合成的多叠氮化合物和富氮配体的络合物[20],以及利用离子键合成的多叠氮阴离子和富氮阳离子的离子化合物[3]就是很好的体现。这些工作在提高多叠氮结构稳定性的同时,还可能提高化合物的氮含量。
(2) 通过共价键进行化学修饰。这一方法也有成功的先例,如Banert[10]等通过C(
| [1] |
Samartzis P C, Wodtke A M. All-nitrogen chemistry: How far are we from N60?[J].
International Reviews in Physical Chemistry, 2006, 25(4): 527-552. DOI:10.1080/01442350600879319 |
| [2] |
李玉川, 庞思平. 全氮型超高能含能材料研究进展[J].
火炸药学报, 2012, 35(1): 1-8. LI Yu-chuan, PANG Si-ping. Progress of all-nitrogen ultrahigh-energetic materials[J]. Chinese Journal of Explosives & Propellants, 2012, 35(1): 1-8. |
| [3] |
Haiges R, Schneider S, Schroer T, et al. High-energy-density materials: Synthesis and characterization of N5+[P(N3)6], N5+[B(N3)4], N5+[HF2]·nHF, N5+[BF4], N5+[PF6], and N5+[SO3F][J].
Angew Chem Int Ed, 2004, 43(37): 4919-4924. DOI:10.1002/(ISSN)1521-3773 |
| [4] |
周雪松, 罗琼, 焦清介, 等. 三叠氮化铝分子结构及爆炸性能理论研究[J].
含能材料, 2011, 19(6): 641-645. ZHOU Xue-song, LUO Qiong, JIAO Qing-jie, et al. Theoretical study on structure and explosion performance for aluminum triazide[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(6): 641-645. |
| [5] |
Jens Müller. Azide of the heavier group 13 elements[J].
Coordination Chemistry Reviews, 2002, 235: 105-119. DOI:10.1016/S0010-8545(02)00181-9 |
| [6] |
Linnen C J, Macks D E, Coombe R D. Synthesis of Al(N3)3 and the deposition of AlN thin films[J].
J Phys Chem B, 1997, 101(9): 1602-1608. DOI:10.1021/jp9625873 |
| [7] |
Al-Jihad I A, Liu B, Linnen C J, et al. Generation of NNBN via photolysis of B(N3)3 in low-temperature argon matrices: IR spectra and ab initio calculations[J].
J Phys Chem A, 1998, 102(31): 6220-6226. DOI:10.1021/jp9812684 |
| [8] |
Liu F Y, Zeng X Q, Zhang J P, et al. A simple method to generate B(N3)3[J].
Chem Phys Lett, 2006, 419: 213-216. DOI:10.1016/j.cplett.2005.11.082 |
| [9] |
Haiges R, Boatz J A, Vij A, et al. Polyazide chemistry: Preparation and characterization of Te(N3)4 and [P(C6H5)4]2[Te(N3)6] and evidence for[N(CH3)4][Te(N3)5][J].
Angew Chem Int Ed, 2003, 42(47): 5847-5851. DOI:10.1002/(ISSN)1521-3773 |
| [10] |
Haiges R, Vij A, Boatz J A, et al. First structural characterization of binary AsIII and SbIII azides[J].
Chem Eur J, 2004, 10: 508-517. DOI:10.1002/(ISSN)1521-3765 |
| [11] |
Haiges R, Boatz J A, Vij A, et al. Polyazide chemistry: preparation and characterization of As(N3)5, Sb(N3)5, and [P(C6H5)4][Sb(N3)6][J].
Angew Chem Int Ed, 2004, 43(48): 6676-6680. DOI:10.1002/(ISSN)1521-3773 |
| [12] |
Haiges R, Boatz J A, Schneider S, et al. The binary group 4 azides[Ti(N3)4], [P(C6H5)4][Ti(N3)5], and[P(C6H5)4]2[Ti(N3)6] and on linear Ti-N-NN coordination[J].
Angew Chem Int Ed, 2004, 43(24): 3148-3152. DOI:10.1002/(ISSN)1521-3773 |
| [13] |
Haiges R, Boatz J A, Bau R, et al. Polyazide chemistry: The first binary group 6 azides, Mo(N3)6, W(N3)6, [Mo(N3)7]-, and[W(N3)7]-, and the[NW(N3)4]- and[NMo(N3)4]- ions[J].
Angew Chem Int Ed, 2005, 44(12): 1860-1865. DOI:10.1002/(ISSN)1521-3773 |
| [14] |
Haiges R, Boatz J A, Schroer T, et al. Experimental evidence for linear metal-azido coordination: The binary Group 5 azides Nb(N3)5, Ta(N3)5, [Nb(N3)6]-, and[Ta(N3)6]- and 1:1 acetonitrile adducts[Nb(N3)5·CH3CN] and[Ta(N3)5·CH3CN],[J].
Angew Chem Int Ed, 2006, 45(29): 4830-4835. DOI:10.1002/(ISSN)1521-3773 |
| [15] |
Banert K, Joo Y H, Rffer T, et al. The exciting chemistry of tetraazidomethane[J].
Angew Chem Int Ed, 2007, 46(7): 1168-1171. DOI:10.1002/(ISSN)1521-3773 |
| [16] |
Haiges R, Boatz J A, Christe K O. The syntheses and structure of the vanadium(Ⅳ) and vanadium(Ⅴ) binary azides V(N3)4, [V(N3)6]2-, and[V(N3)6]-[J].
Angew Chem Int Ed, 2010, 49(43): 8008-8012. DOI:10.1002/anie.v49:43 |
| [17] |
Haiges R, Boatz J A, Williams J M, et al. Preparation and characterization of the binary group 13 azides M(N3)3 and M(N3)3·CH3CN (M=Ga, In, Tl), Ga(N3)5]2-, and[M(N3)6]3- (M=In, Tl)[J].
Angew Chem Int Ed, 2011, 50(38): 8828-8833. DOI:10.1002/anie.v50.38 |
| [18] |
Haiges R, Rahm M D, Dixon D A, et al. Binary group 15 polyazides. Structural characterization of[Bi(N3)4]-, [Bi(N3)5]2-, [bipy·Bi(N3)5]2-, [Bi(N3)6]3-, bipy·As(N3)3, bipy·Sb(N3)3, and[(bipy)2·Bi(N3)3]2 and on the lone pair activation of valence electrons[J].
Inorg Chem, 2012, 51: 1127-1141. DOI:10.1021/ic202307a |
| [19] |
Karaghiosoff K, Klapotke T M, Krumm B. Experimental and theoretical characterization of cationic, neutral, and anionic binary arsenic and antimony azide species[J].
Inorg Chem, 2002, 41(2): 170-179. DOI:10.1021/ic010463l |
| [20] |
Klapotke T M, Schutt T. The conversion of AsF5 and SbF5 into novel arsenic-and antimony(Ⅴ) pseudohalogen species: Preparation, characterization and hybrid DFT computation of lewis base stabilized M(N3)5 species (M=As, Sb)[J].
J Fluorine Chem, 2001, 109: 151-162. DOI:10.1016/S0022-1139(01)00387-6 |
| [21] |
Fraenk W, Habereder T, Hammerl A, et al. Highly energetic tetraazidoborate anion and boron triazide adducts[J].
Inorg Chem, 2001, 40(6): 1334-1340. DOI:10.1021/ic001119b |
| [22] |
Filippou A C, Portius P, Neumann D U, et al. The hexaazidogermanate(Ⅳ) ion: Syntheses, structures, and reactions[J].
Angew Chem Int Ed, 2000, 39(23): 4333-4336. DOI:10.1002/(ISSN)1521-3773 |
| [23] |
Filippou A C, Portius P, Schnakenburg G. The hexaazidosilicate(Ⅳ) ion: Synthesis, properties, and molecular structure[J].
J Am Chem Soc, 2002, 124(42): 12396-12397. DOI:10.1021/ja0273187 |
| [24] |
Roesky H W. Preparation of hexaazidophosphate[J].
Angew Chem Int Ed, 1967, 6(7): 637 |
| [25] |
Portius P, Fowler P W, Adams H, et al. Experimental and theoretical characterization of the hexaazidophosphate(Ⅴ) ion[J].
Inorg Chem, 2008, 47(24): 12004-12009. DOI:10.1021/ic801536z |
MFn+nMe3SiN3M(N3)n+nMe3SiFn
The developments of synthesis of polyazides,polyazido anions and acid-base complexes were reviewed with 25 references.



