三氯化氮是一种氮的卤化物,是潜在的多氮化合物制备中间体之一,许多科学家都以三氯化氮为主要原料对全氮化合物的制备进行了探索[1-3],但其性质极不稳定,在纯相或高浓度下可随时发生猛烈爆炸[4],而且在潮湿、酸、碱等条件下也容易分解,给制备和储存带来不便。实验室小量制备三氯化氮可以通过两种方法:(1)在含有铵根离子的酸性溶液里通入氯气[5]; (2)电解含有铵根离子和氯离子的酸性溶液[6]。相比之下,化学法具有反应进程不便于控制、使用氯气等缺点,而电化学合成具有反应程度便于控制、污染小、操作安全等优点。
三氯化氮的富集一般采取惰性气体通过反应液,将生成的三氯化氮带出后冷凝,该方法产生纯三氯化氮极易爆炸。为此,本研究采用在电化学反应前加入萃取剂四氯化碳,使生成的三氯化氮进入有机相中,不产生高浓度三氯化氮气体,避免气相浓度过高产生爆炸,而且也避免了产物在酸性反应液中的水解。电化学合成与原位萃取相结合,通过控制电量、酸度、温度等反应条件,可以在安全范围内获得高含量的三氯化氮溶液。
2 实验部分 2.1 试剂与仪器所用试剂均为分析纯,溶液以二次蒸馏水配制。
恒压直流电源:量程1~30 V; 217型双盐桥饱和甘汞电极:上海精密科学仪器有限公司; DH4直流电压表 2只,量程各为0~100 V,0~10 V,分别用来测量槽电压和阳极电势,电流由DH4型直流电流表测定,量程0~3 A:上海托克仪表; Nicolet傅里叶变换红外光谱仪:美国Thermo Electron公司; Renishaw invia显微共聚焦拉曼光谱仪:英国雷尼绍公司。
电解池为H型玻璃池,阴极室和阳极室容积均为150 mL,两室中间用熔沙玻璃片间隔,置于冰水浴中控制温度; 阳极和阴极均使用铂片电极(厚0.1 mm,几何表面积8 cm2),电流大小通过直流恒压电源控制,阳极电势由饱和甘汞电极测定。
2.2 实验过程 2.2.1 电解过程将53.5 g(1 mol)氯化铵溶于200 mL稀盐酸中,配成电解液。在阳极室中注入上述溶液90 mL,并加入四氯化碳20 g,使用磁力搅拌器剧烈搅拌使两相均匀分散; 剩余氯化铵电解液注入阴极室。
在电流为0.6 A恒电流下电解6 h后停止反应,将有机相从阳极液中分离,然后用无水硫酸镁干燥,过滤,得到金黄色透明溶液。
2.2.2 三氯化氮浓度测定方法三氯化氮的生成为可逆反应,当与浓盐酸作用可以生成氯气和铵盐,用间接碘量法测定氯气的量即可间接测定三氯化氮含量。具体过程为:将产物溶液取0.2~0.3 g左右置于具支试管中,加入浓盐酸5 mL,使用磁力搅拌,鼓入氮气。将混合气流经浓硫酸干燥后,依次通过两个相同的吸收瓶,吸收液组成为:2 g碘化钾溶于200 mL水,并加入10%盐酸25 mL。待具支试管内的液体变为无色后,关闭氮气。合并两个吸收瓶中液体,加入淀粉指示剂,用0.2 mol·L-1的硫代硫酸钠标准溶液滴定。
3 结果与讨论 3.1 实验原理其反应过程如下:
(1) 电极反应 阳极2Cl--2e→Cl2
阴极2H++2e →H2
(2) 化学反应 NH4++3Cl2=NCl3+4H++3Cl-
(3) 总反应 NH4++2H++3Cl-=NCl3+3H2
该反应可以迅速达到平衡,并在电化学反应过程中,阳极不断产生的氯气使反应不断向正向移动,产物浓度不断升高。反应过程经过铵的一氯取代和二氯取代过程,但在pH < 5时,该反应只生成三氯化氮[7]。
3.2 萃取剂的选择和产物表征红外光谱表征采用KBr双层窗,中间放置产物溶液,测量范围为400~4000 cm-1; 拉曼光谱测量范围100~800 cm-1,激发波长514 nm。
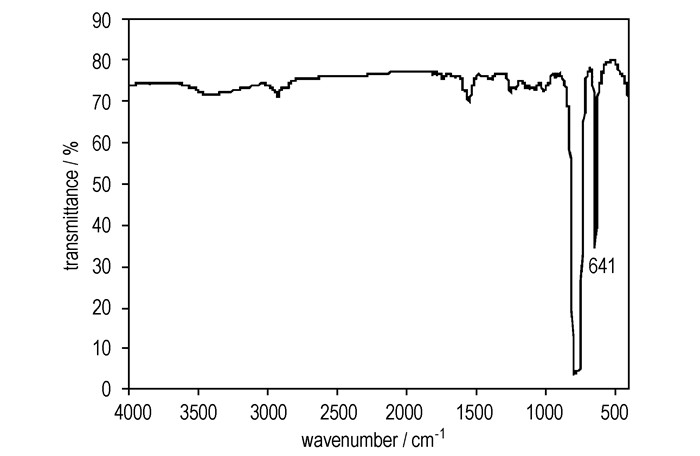
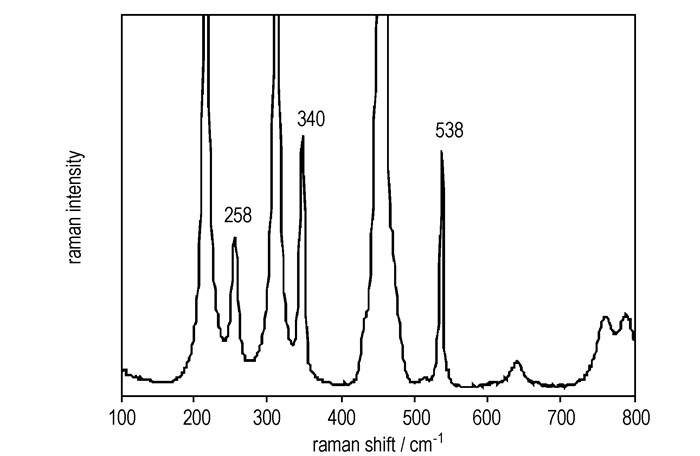
三氯化氮易溶于四氯化碳、甲苯、二硫化碳等有机溶剂,但使用甲苯或二硫化碳作为萃取剂时,间接碘量法测定结果低于1%,而且红外光谱中也没有明显的N—Cl振动; 推测甲苯或二硫化碳与水均匀分散在电极周围,不利于NH4+与Cl2反应进行。采用四氯化碳为萃取剂时,从红外光谱和拉曼光谱中可以看出有三氯化氮生成。图 1中吸收频率在641 cm-1的红外吸收峰归属为三氯化氮分子N—Cl键的伸缩振动,其它峰为四氯化碳吸收峰,未发现有N—H吸收; 图 2为产物溶液的拉曼光谱,其中频移258,340,538 cm-1为三氯化氮分子特征谱峰[8],其他强峰为四氯化碳谱峰信号。
|
图 1 三氯化氮溶液的IR谱图 Fig.1 IR spectra of nitrogen trichloride solution |
|
图 2 三氯化氮溶液的Raman谱图 Fig.2 Raman spectra of nitrogen trichloride solution |
固定反应条件:温度15 ℃,盐酸浓度0.75 mol·L-1,在600 mA下恒电流电解。每隔1 h停止搅拌,取有机层0.2~0.3 g左右,滴定分析。从表 1中可以看出,1 h后产物质量分数就达到1.95%,说明电解产生的Cl2与溶液中NH4+反应极为迅速,在之后的电解过程中三氯化氮的生成速率基本相同,说明反应过程中,已经进入有机相的三氯化氮没有发生明显的水解反应。阳极电势在反应过程中有微小下降,槽电压在11.71 ~13.43 V范围内波动,整个过程中,阳极电势和槽电压波动极小,电化学反应平稳进行。
| 表 1 阳极电势、槽电压和三氯化氮质量分数变化情况 Tab.1 Variation of anode potential, bath voltage and mass fraction of nitrogen trichloride |
三氯化氮具有很强的挥发性,因此反应适宜在较低的温度下进行,本实验选取5 ℃和15 ℃两个温度进行实验。结果如表 2所示,温度对反应影响很大,15 ℃下反应结果明显优于5 ℃。从15 ℃下不同盐酸浓度的结果可以看出,产物浓度随着溶液酸度的提高而增加,但当酸度达到1 mol·L-1以上,产物浓度基本不发生变化。同时盐酸浓度的增加导致氯化铵溶解度减小,伴随铵离子在电场作用下向阴极室移动,阴极室出现少量氯化铵结晶,继续提高酸度将导致大量氯化铵析出,因此酸度不宜超过2 mol·L-1,在6 h内电流效率可以达到75%。
| 表 2 反应温度和盐酸浓度对NCl3产率的影响 Tab.2 Effects of temperature and concentration of hydrochloric acid on yeild of NCl3 |
影响三氯化氮的分解的因素有热、光照、湿气等,本实验选取质量分数为10.1%的产物溶液,放置于封口膜密封的锥形瓶中,25 ℃室温环境下通过滴定法检测三氯化氮质量分数变化情况,结果见表 3。由表 3可见,室温下放置1周其质量浓度仍大于6%,约为初始浓度的60%,而且三氯化氮质量分数越低,其分解速度越小。
| 表 3 三氯化氮的分解情况 Tab.3 Decomposition of nitrogen trichloride |
电化学合成三氯化氮并以四氯化碳原位萃取,经萃取剂、温度、盐酸浓度等条件的选择,获得三氯化氮质量分数为10.1%,反应6 h内电流效率为75%,光谱表征并未发现有其他副产物,产物室温下保存7 d后质量分数为初始值的60%。该制备过程安全、便于控制。
| [1] |
Rasul G, Prakash S, Olah G A. DFT investigation of the tri(amino)amine N(NH2)32+ and the tri(azido)amine N(N3)32+ dications and related mixed amino(azido)ammonium ions (N3)xN(NH2)4-x+(x=0-4)[J].
Inorganic Chemistry, 2002, 41(21): 5589-5592. DOI:10.1021/ic020358r |
| [2] |
Michels H H, Montgomery J A, Christe K O. Theoretical prediction of the structures and stabilities of azidamines[J].
Journal of Physical Chemistry, 1995, 99(1): 187-194. DOI:10.1021/j100001a032 |
| [3] |
张正斌. 三叠氮胺化合物的性质及研究现状[J].
化学推进剂与高分子材料, 2011, 9(4): 45-48. ZHANG Zheng-bin. Properties and research situation of tri-azido amine compounds[J]. Chemical Propellants and Polymeric Materials, 2011, 9(4): 45-48. |
| [4] |
王正新. 三氯化氮危险性的探讨[J].
中国氯碱, 2006(7): 35-36. WANG Zheng-xin. Discussion on danger of nitrogen trichloride[J]. China Chlor-Alkali, 2006(7): 35-36. |
| [5] |
Gilbert J V, Wu X L, Stedman D H. Photolysis of nitrogen trichloride[J].
Journal of Physical Chemistry, 1987, 91(16): 4265-4269. DOI:10.1021/j100300a013 |
| [6] |
许治安, 许涛. 浅谈食盐电解副产物三氯化氮[J].
氯碱工业, 2000(10): 32-34. XU Zhi-an, XU Tao. Introduction to nitrogen trichloride byproduct from the electrolysis of brine[J]. Chlor-Alkali Industry, 2000(10): 32-34. DOI:10.3969/j.issn.1008-133X.2000.10.008 |
| [7] |
Li J, Blatchley Ⅲ E. UV Photodegradation of Inorganic Chloramines[J].
Environmental Science and Technology, 2009, 43(1): 60-65. DOI:10.1021/es8016304 |
| [8] |
Emeleus H J, Sharpe A G.
Advances in inorganic chemistry and radiochemistry[M]. New York: Academic Press Inc, 1979: 41-43. |
By electrochemical oxidation of ammonium chloride solution and hydrochloric acid, nitrogen trichloride was synthesized. Carbon tetrachloride was added to extract the product in situ prior to electrochemical procedure. The main reaction conditions were observed.



