2. 天津大学化工学院绿色合成与转化教育部重点实验室,天津 300072
2. Key Laboratory for Green Chemical Technology of State Education Ministry, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
N2O5是一种绿色硝化剂[1-3],与工业上常用的硝酸、硝硫混酸、硝酸-硝酸铵等硝化剂相比,具有温度易控制、无需废酸处理、产物分离简单、硝化选择性高等优点。因此,以N2O5为硝化剂的新型硝化技术成为国内外关注的热点。
硝酸酯是一类重要的含能材料,Millar[2-3]等以N2O5为硝化剂,硝化环氧丙烷类化合物制备了一系列相应的1, 2-二硝酸酯。相比于传统的硝硫混酸硝化多元醇法,该法原子经济性高,无高污染性副产物生成,更符合绿色化学的原则。
Millar等[3]的研究表明,取代基不同的各种环氧丙烷类化合物硝化反应的收率不同,但未对取代基的影响规律进行阐述。为进一步探索取代基对环氧丙烷类化合物开环硝化过程的影响,本研究选择环氧氯丙烷(ECH)为探针化合物,以N2O5为硝化剂,考察不同反应因素对该硝化过程的影响规律。
2 实验部分 2.1 试剂及其规格ECH,分析纯,天津市化学试剂一厂;N2O5采用与文献[4]相同的臭氧化法制备;其余原料皆为市售分析纯试剂。
2.2 硝化反应将催化剂和浓度为0.2 g·mL-1的N2O5/CH2Cl2加入到带冷却夹套的三口烧瓶中,调节反应器中的温度到15 ℃。在搅拌状态下,用恒压滴液漏斗将浓度为0.5 g·mL-1的ECH/CH2Cl2溶液滴加至反应器中,使N2O5与ECH摩尔比为1.1:1.0,并使反应在设定的温度下进行。反应结束后,加入饱和碳酸氢钠溶液除去多余的酸,水洗溶液至中性。产物经分离干燥后,用气相色谱进行分析。
其化学反应式如下:
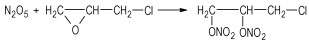
|
定性分析:产物结构确定采用6890GC-5975MSD气质联用仪进行,色谱柱采用HP-5毛细柱(30 m×0.25 mm×0.25 m),质谱采用SCAN扫描方式。
定量分析:在HP4890色谱仪上进行,采用OV101毛细柱(30 m×0.25 mm×0.25 m),FID检测器。由于主产物和副产物结构相似,相对校正因子近似为1,采用面积归一法计算选择性,以三氯甲烷为内标计算原料ECH的转化率,则收率=转化率×选择性。
3 结果与讨论 3.1 产物分析表 1是反应所得主产物的质谱结果,由表 1分析可知,该硝化反应所得主产物为目标产物3-氯-1, 2-丙二醇二硝酸酯。采用不同催化剂进行硝化时,反应的主要副产物经分析为环氧基与硝酸的开环加成产物3-氯-2-硝酸酯-1-丙醇,这是由于在N2O5的制备、储存,及后续的反应阶段都不可能做到完全干燥,而N2O5易潮解产生硝酸,从而导致开环副反应的发生。
| 表 1 N2O5硝化ECH主产物的质谱图解析结果 Tab.1 MS data of the main product in nitration of ECH with N2O5 |
表 2是无催化剂作用下,N2O5与ECH的摩尔比为1.1:1.0,以CH2Cl2作溶剂时,硝化实验的结果。在无催化剂作用下,反应4 h,原料ECH的转化率仅为20.3%,说明该条件下反应的总体速率较低。ECH是环氧丙烷环氧基邻位碳上的—H被—Cl取代后的产物,而—Cl是吸电子基团,它取代环氧基邻位碳上的氢后,使环氧基开环受到抑制;且环氧基开环反应是一个SN2反应,其反应速率随环氧基邻位碳上取代基体积的增大而降低[5],而—Cl的半径为0.099 nm,明显高于—H的半径0.032 nm。故无催化剂作用下,ECH的开环硝化反应速率较低。
| 表 2 N2O5硝化ECH的实验结果 Tab.2 Nitration results of ECH with N2O5 |
为提高反应速率,获得较高的转化率和收率,在N2O5与ECH摩尔比1.1:1.0, 温度15 ℃,反应时间4 h, 催化剂浓度为10 g·L-1, 以CH2Cl2作溶剂的条件下,考察了各种催化剂对该硝化反应的影响,结果如表 3所示。
| 表 3 不同催化剂对ECH硝化反应的影响 Tab.3 Effects of different catalysts on the nitration of ECH with N2O5 |
从实验结果看,强L酸催化剂AlCl3可明显提高原料转化率,但反应的选择性较低。酸性分子筛催化剂H-ZSM-5、H β和HY对该硝化反应都有不同程度的催化作用,而非酸性分子筛催化剂NaY的催化效果却不明显,表明分子筛催化剂对环氧基团的催化作用主要通过其活性中心的酸来实现,由于其活性中心90%以上都在分子孔道的内表面,因而分子筛的孔径和酸中心的性质对硝化结果影响较大。
H-ZSM-5、H β和HY三种分子筛的孔径分别为0.53 nm×0.56 nm、0.56 nm×0.65 nm和0.74 nm,是三种不同孔道结构类型的催化剂,其催化ECH硝化反应的选择性存在明显的差异,说明不同类型分子筛催化剂的择形催化作用对该反应具有较大的影响。TS-1催化氯丙烯环氧化制备ECH反应具有较高的选择性[6],表明ECH具有与TS-1孔道相近的分子直径。在上述三种催化剂中H-ZSM-5与TS-1属于同一拓扑结构的分子筛,其孔道大小相近,因而H-ZSM-5对该硝化反应具有较高的催化选择性。不同Y型分子筛其分子孔道大小基本相同,但经过改性后其孔道变小,故USY也有较好的催化选择性,但其孔道仍相对较大,因而选择性较H-ZSM-5低。
表 3所示的分子筛催化剂,其表面酸位以B酸为主,L酸很少。在H-ZSM-5、H β和HY三种氢型分子筛中,随着硅铝比的增加,B酸位增加并且其酸性强度依次增加,其催化作用也不断增强,H-ZSM-5在三者中的催化转化率最高;对于HY和USY这两种不同的Y型分子筛,其酸性强度HY<USY,而其催化转化率也是HY<USY。这些结果表明,分子筛催化剂中B酸位是硝化催化的活性中心,催化作用随其酸强度增加而增加,这与Kwok等人[7]的结论相一致。
综上,H-ZSM-5是最适宜的催化剂。
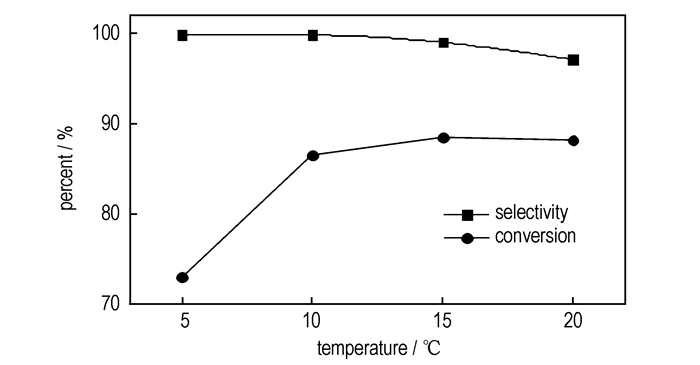
3.4 反应温度的影响硝化反应对温度比较敏感,因此,在N2O5与ECH摩尔比1.1:1.0, 反应时间4 h, H-ZSM-5浓度为10 g·L-1, 以CH2Cl2作溶剂的条件下,考察了温度对H-ZSM-5催化ECH硝化反应的影响,结果如图 1所示。随着温度的升高,ECH转化率增大,说明高温有利于反应速率的提升;3-氯-1, 2-丙二醇二硝酸酯的选择性在小于15 ℃时基本不受影响,但随着温度的进一步升高,选择性逐渐降低,表明温度过高对主反应不利。综合考虑温度对转化率和选择性的影响,确定15 ℃为最适宜的反应温度。
|
图 1 反应温度对ECH硝化反应的影响 Fig.1 Effects of reaction temperature on nitration of ECH with N2O5 |
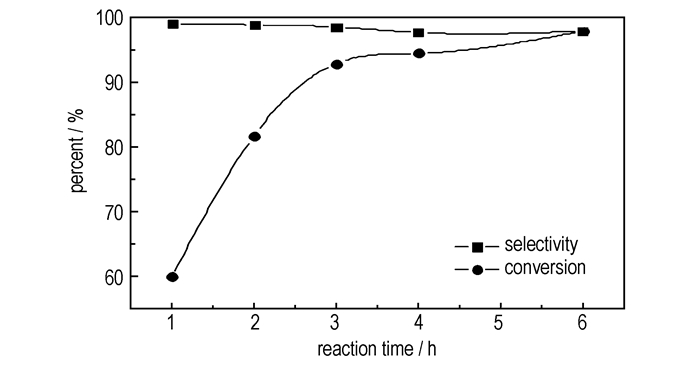
由前述可见,由于—Cl的存在,ECH的开环反应活性明显下降,有必要通过延长反应时间来获得较高的转化率和收率,故在15 ℃,N2O5与ECH摩尔比1.1:1.0, H-ZSM-5浓度为10 g·L-1, 以CH2Cl2作溶剂的条件下,考考察了该硝化反应随时间变化的规律,结果如图 2。由图 2可见,随着反应时间的增加,ECH的转化率不断增大,反应6 h时,ECH转化率接近100%,3-氯-1, 2-丙二醇二硝酸酯的转化率和选择性达98.0%;但3-氯-1, 2丙二醇二硝酸酯的选择性随时间增加呈略微降低的趋势(与表 2的结果一致),这主要是因为随着反应时间的延长,N2O5潮解产生硝酸的机率增加,从而ECH开环副反应的机率也随之增加。可见,在保证原料转化率的前提下,反应时间越短越好,故选择6 h为适宜的反应时间。
|
图 2 反应时间对ECH硝化反应的影响 Fig.2 Effects of reaction time on nitration of ECH with N2O5 |
在N2O5与ECH摩尔比1.1:1.0, 温度15 ℃,反应时间6 h,H-ZSM-5浓度为10 g·L-1的条件下,考察了ClCH2CH2Cl、CH2Cl2、CHCl3及CCl4四种溶剂对ECH硝化反应的影响,结果见表 4。由表 4可见,随着溶剂极性的增加,ECH的转化率略有增加,但3-氯-1, 2丙二醇二硝酸酯的选择性呈降低趋势,说明非极性溶剂对主反应有利。这可能是由于在反应过程中N2O5是以分子形式参与反应,而非离子形式,非极性溶剂有利于分子态N2O5的存在。虽然在CCl4中,该硝化反应具有较高的选择性和收率,但以其作溶剂,后续减压蒸馏分离产品较为困难,故综合考虑认为CH2Cl2为该反应适宜的溶剂。
| 表 4 溶剂对ECH硝化反应的影响 Tab.4 Effects of solvents on the nitration reaction of ECH by N2O5 |
(1) 考察了催化剂类型、反应温度、反应时间、溶剂等因素对ECH硝化反应的影响,获得了最优的反应条件:反应温度15 ℃,反应时间6 h,CH2Cl2为溶剂,H-ZSM-5为催化剂。在此条件下,当N2O5与ECH摩尔比为1.1:1.0时,ECH的转化率达100%,3-氯-1, 2-丙二醇二硝酸酯的选择性和收率达98.0%。
(2) 在N2O5硝化ECH的反应中,催化剂的影响较大, 不同类型催化剂因孔径或酸性的不同,对该硝化反应的影响不同。
(3) 取代基—Cl对ECH开环硝化具有明显的抑制作用,这主要是由其电子效应和立体效应决定的。
| [1] |
吴强, 谢洪涛, 袁伟, 等. 硝酸酯绿色硝化工艺研究进展[J].
化学推进剂与高分子材料, 2004, 3(3): 5-10. WU Qiang, XIE Hong-tao, YUAN Wei, et al. Research progress of green nitration in synthesis of nitric esters[J]. Chemical Propellants & Polymeric Materials, 2004, 3(3): 5-10. |
| [2] |
Millar R W, Paul N C, Richards D H. High energy nitrated materials prepared by reacting heterocyclic strained ring compounds with nitrogen oxides: EP223440[P].1987: 39-67.
|
| [3] |
Golding P, Millar R W, Paul N C, et al. Preparation of di-and polynitrates by ring-opening nitration of epoxides by dinitrogen pentoxide (N2O5)[J].
Tetrahedron, 1993, 49(22): 7037-7050. |
| [4] |
Talawar M B, Sivabalan R, Polke B G, et al. Establishment of process technology for the manufacture of dinitrogen pentoxide and its utility for the synthesis of most powerful explosive of today-CL-20[J].
Journal of Hazardous Materials, 2005, B124: 157 |
| [5] |
曹晨忠.
有机化学中的取代基效应[M]. 北京: 科学出版社, 2003: 131-132.
CAO Chen-zhong. Substituent Effects in Organic Chemistry[M]. Beijing: Science Press, 2003: 131-132. |
| [6] |
王庆法, 王莅. 氯丙烯催化环氧化钛催化剂研究进展[J].
化学工业与工程, 2004, 21(5): 351-355. WANG Qing-fa, WANG Li. Progress in titanium catalyst used for epoxidation of allyl chloride[J]. Chemical Industry and Engineering, 2004, 21(5): 351-355. |
| [7] |
Kwok T J, Jayasuriya K, Damavarapu R, et al. Application of H-ZSM-5 zeolite for regioselective mononitration of toluene[J].
Journal of Organic Chemistry, 1994, 59: 4939-4942. DOI:10.1021/jo00096a042 |
The effects of catalyst type, reaction temperature, reaction time and solvent on the nitrating process of preparing 3-chloro-1,2-propylene glycol dinitrate were investigated.




