1, 2-二硝基胍(DNG)因具有高密度(1.884 g·cm-3)和有效氧平衡(+5.37%), 而表现出良好的爆炸性能, 其使用价值受到人们的关注, 同时它的某些盐也是一些性能优异的高能炸药[1]。DNG具有类似于二硝基脲[2]的结构, 分子中含有的硝胺基团为高密度结构单元, 通常作为其它高能量密度材料的基础设计单元。例如, 4-硝基亚胺基-3, 5-二硝基四氢-1, 3, 5-噁二嗪[3]、1, 2-二硝基胍铵(ADNQ)、1, 7-二氨基-1, 7-二硝胺基-2, 4, 6-三硝基-2, 4, 6-三氮杂庚烷(APX)[4]等高能物质均含有DNG母体。
2003年, A.A.Astrat′yev等[5]采用N2O5/HNO3硝化体系硝化硝基胍, 首次合成出DNG。M. Johansson等[6]在采用100%硝酸/发烟硫酸硝化体系硝化硝基胍时发现, 发烟硫酸的浓度对产物产率影响较大。当发烟硫酸中SO3的浓度为30%时, DNG产率约为20%;当SO3的浓度为65%时, 产率达到60%;但是反应不易控制, 容易喷料, 后处理操作程序复杂、难度较大, 同时硝化成本也增加。为简化DNG合成反应条件, 降低成本, 优化工艺, 本实验采用100%硝酸/20%发烟硫酸/硝酸铵作为硝化体系, 在温和的反应条件下,探讨了硝硫混酸体积比、反应时间、反应温度及硝酸铵用量等因素对DNG产率的影响, 并通过正交实验优化得到最佳合成工艺。同时, 采用热重分析仪(TG)和差示扫描量热仪(DSC)考察DNG的热分解性能。
2 实验部分 2.1 试剂及仪器试剂:乙酸乙酯, 分析纯, 南京宁试化学试剂有限公司; 无水甲醇, 分析纯, 成都市科龙化工试剂厂; 无水硫酸镁, 分析纯, 成都市科龙化工试剂厂; 20%发烟硫酸, 分析纯, 上海振兴化工二厂有限公司; 100%硝酸, 自制; 硝基胍, 纯度99%, 吴江市东吴农化有限公司。
仪器: 500 MHz核磁共振仪, 瑞士bruker公司; Finnigan TSQ Quantum ultra AM型质谱仪, 美国Thermal公司; IR-435型红外光谱仪, 日本岛津; STA 449 C型热重分析仪, 德国NETZSCH公司; DSC823e差示扫描热仪, 瑞士METTLER TOLED公司。
2.2 合成路线以硝基胍为原料, 100%硝酸/20%发烟硫酸/硝酸铵为硝化体系, 经硝化反应合成1, 2-二硝基胍。
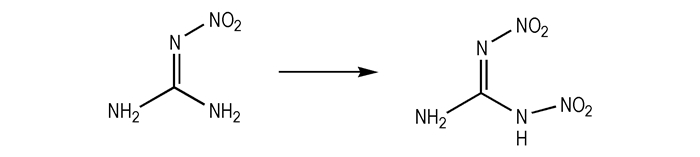
|
Scheme1 |
将3.8 mL硝酸与9.75 mL 20%发烟硫酸配成混酸于一装有搅拌器、温度计及恒压漏斗的100 mL三口烧瓶中, 向混酸中加入1 g硝酸铵, 用冰浴冷却至约10 ℃, 将2.6 g(0.025 mol)硝基胍溶于4 mL硝酸配成溶液, 然后在快速搅拌下缓慢滴加到混酸中(温度控制在10 ℃以下)。滴加完后于10 ℃反应8 h。反应完后把酸液倒入约50 g冰中, 乙酸乙酯萃取(4×50 mL), 冷水洗涤(2×10 mL), 用冷却的10%氢氧化钠溶液洗涤萃取液至pH=4左右, 后用无水硫酸镁干燥, 旋蒸出乙酸乙酯溶剂(回收再次用于萃取), 得到白色粗产物2.43 g, 用无水甲醇重结晶得到2.3 g片状晶体。
结构鉴定: 1H NMR(DMSO-d6, 500 MHz) δ: 9.61(s, 2H), 13.25(s, 1H); 13C NMR(DMSO-d6, 125 MHz) δ:156.44; IR(KBr, cm-1)ν: 3418(NH), 3318(NH2); 1649(C=N); 1621, 1292(=NNO2, —NHNO2); 1248, 1038; ESI-MS(m/z): 147.93[M-H]-。
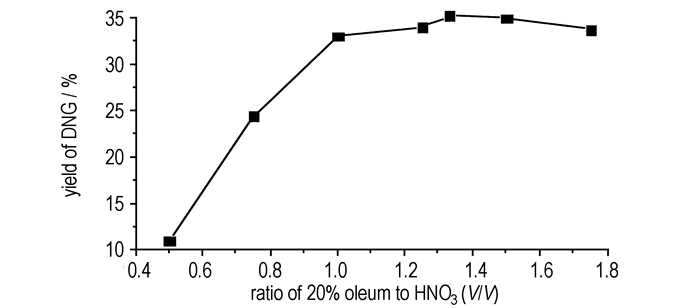
3 结果与讨论 3.1 合成工艺优化 3.1.1 100%硝酸、发烟硫酸用量的影响用硝酸溶解2.6 g(0.025 mol)硝基胍, 20%发烟硫酸用量10.4 mL, 温度10 ℃, 反应4 h, 考察所用硝酸的量对DNG产率的影响, 结果如图 1所示。从图 1可以看出, 当100%硝酸与硝基胍摩尔比为7.51时, DNG的产率达到最高35.21%。故选n(HNO3):n(NQ)为7.5:1, 此时硝酸的用量为7.8 mL, 改变发烟硫酸用量, 反应结果如图 2所示。

|
图 1 100%硝酸用量对DNG产率的影响 Fig.1 Effect of the amount of 100% HNO3 on the yield of DNG |
|
图 2 20%发烟硫酸用量对DNG产率的影响 Fig.2 Effect of the amount of 20% oleum on the yield of DNG |
从图 1可以看出, 随着硝酸的量增加, DNG的产率先增加后减少。分析原因为, 当硝酸的量相对于发烟硫酸的量增加时, 硝酰阳离子逐渐增加, 此时硝化液的硝化能力增加, 有利于DNG的生成; 但是当继续增加硝酸的量时, 难以促使硝酸转化为硝酰阳离子, 硝酰阳离子的浓度低, 则硝化能力减弱, 引起DNG的产率降低。从图 2可以看出, 随着发烟硫酸的量增加, DNG的产率先增加后略有降低, 当V(H2SO4):V(HNO3)=4:3时, 产率最高为35.21%。其原因可能是随着发烟硫酸的用量增加, 虽然有利于产生硝酰阳离子, 但是硝化液的酸度函数增大, 使得DNG易于发生脱掉硝基的水解反应[7], 造成DNG产率下降。同时随着发烟硫酸量增加, 后续分离产品中增加洗涤冷水的量, 也会造成相应产品的流失。
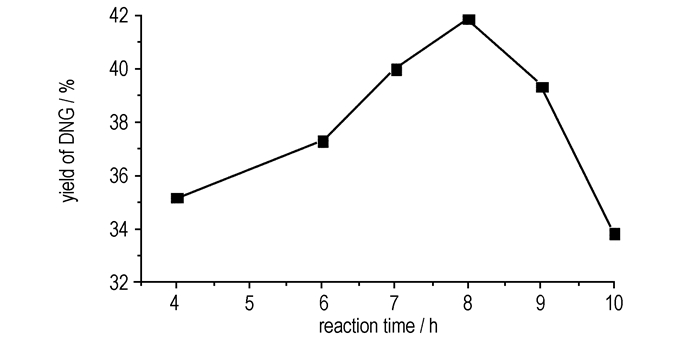
3.1.2 反应时间、反应温度的影响取2.6 g(0.025 mol)硝基胍, n(HNO3):n(NQ) =7.5:1, V(H2SO4):V(HNO3)=4:3, 反应温度为10 ℃下, 考察反应时间对DNG产率的影响, 结果如图 3所示。从图 3可知, 随着反应时间增加, DNG产率先增加后减少, 当反应时间为8 h时, 产率最高为41.93%。选反应时间为8 h, 考察反应温度对DNG产率的影响, 结果如图 4所示。
|
图 3 反应时间对DNG产率的影响 Fig.3 Effect of the reaction time on the yield of DNG |

|
图 4 反应温度对DNG产率的影响 Fig.4 Effect of the reaction temperature on the yield of DNG |
胺的硝化表现为一个可逆反应, 即可发生硝化反应, 也同时发生脱硝基的水解反应。硝基胍的两个氨基因受到硝亚胺基团的强吸电子效应和分子内氢键作用的影响, 胺的碱性明显下降, 而碱性越弱越难硝化, 因此硝基胍硝化温度比一般伯胺的硝化温度要高, 并且反应达到平衡的时间也相对较长, 为8 h。反应温度过低, 硝化剂的活性太低, 不利于硝化; 提高温度会增强硝化体系的硝化强度, 但随着反应温度升高, 杂质增多, 30 ℃时产率下降到33%, 因此反应也不利于硝基胍向DNG转化。DNG含有一个硝亚胺基和一个硝胺基, 两个强吸电子基团, 因此DNG非常难以继续硝化。
3.1.3 硝酸铵用量的影响取2.6 g(0.025 mol)硝基胍, n(HNO3):n(NQ)= 7.5:1, V(H2SO4):V(HNO3)=4:3, 反应温度为10 ℃, 反应时间为8 h下, 考察硝酸铵用量对DNG产率的影响, 结果见表 1。
| 表 1 硝酸铵用量对DNG产率的影响 Tab.1 Effect of the amount of NH4NO3 on the yield of DNG |
从表 1可以看出, 硝化剂中加入硝酸铵, DNG产率有显著的提高。分析其原因为, 一方面硝酸铵有吸水作用, 从而提高硝酸的活度, 有利于反应向正方向进行; 另一方面, 可能是因为硝酸铵的加入, 抑制了硝酸的酸式电离, 促进了硝酸的碱式电离, 利于硝酰阳离子的生成, 从而增强硝化能力[8]。但硝酸铵加入量增多时, 降低反应速率。硝酸铵在硝化液中呈悬浮状, 倒入冰水中时也是呈悬浮状, 因此用乙酸乙酯萃取前, 要抽滤掉硝酸铵, 得到的硝酸铵干燥后可继续重复利用, 利用率约为30%。
3.1.4 正交试验从以上单因素影响条件考察可以看出, 反应时间在8 h左右对DNG的产率基本变化不大。因此取表 2所示水平因素及水平取值, 做L9(34)正交实验, 结果见表 3。从表 3极差可知, 反应温度影响最大, 硝酸铵与硝基胍摩尔比次之, 硫酸与硝酸体积比次之, 硝酸与硝基胍的摩尔比最小。最佳反应条件为A2B2C2D2, 即硝酸与硝基胍的摩尔比为7.5;硝酸铵与硝基胍摩尔比为0.5,硫酸与硝酸体积比为1.25, 反应温度为10 ℃, 反应时间为8 h。最佳反应条件平行实验验证结果如表 4所示, DNG平均产率为61.76%。
| 表 2 试验因素及水平 Tab.2 Experimental factors and level of factors |
| 表 3 正交实验表L9(34) Tab.3 Orthogonal experiment table L9(34) |
| 表 4 优化条件的验证实验 Tab.4 The replication experiments of optimized conditions |
为了考察DNG的热分解性能, 采用TG和DSC对其热分解进行了测试(样品1.00 mg, 升温速率10 ℃·min-1, 温度范围80~277 ℃, 高纯氮气(30 mL·min-1)。结果如图 5所示。由图 5可知,DNG在175 ℃才开始分解, 说明DNG具有良好的热稳定性。DNG在75 ℃热气流中测试质量变化19 d其质量基本没有损失[6], 也说明DNG具有良好的热稳定性。TG曲线在175 ℃质量急剧下降, 185 ℃时, 质量损失了近55%, 说明此阶段分解反应比较剧烈, 相应地DSC曲线在此阶段出现一个很窄的放热尖峰。

|
图 5 DNG的TG和DSC曲线 Fig.5 TG and DSC curves of DNG |
从图 5可以看出, DNG有一个吸热熔融峰, 一个放热分解峰, 并且DNG融化后立刻分解, DNG起始熔化温度为175.35 ℃, 起始分解温度为178.92 ℃, 最大分解峰温Tp=182.83 ℃。DSC曲线中含有一个窄的最大放热尖峰, 曲线积分计算得其分解热为213.77 kJ·mol-1, 说明DNG在较高温度下分解, 并在很短时间内将大量热放出, 具有起爆的特点。
4 结论(1) 以100%硝酸/20%发烟硫酸/硝酸铵为硝化剂, 通过正交优化实验确定了最佳硝化工艺为n(HNO3):n(NQ):n(NH4NO3)=15:2:1, V(H2SO4):V(HNO3)=1.25:1, 反应时间为8 h, 反应温度为10 ℃, 平均产率为61.76%。
(2) 硝化剂中加入硝酸铵, 使得在发烟硫酸中SO3的浓度65%降低为20%时, DNG的产率并没有降低, 简化了反应条件, 降低了生产成本。
(3) TG和DSC测试结果表明, 175.35 ℃开始熔化, DNG有良好热稳定性。最大分解峰温182.83 ℃, 分解热为213.77 kJ·mol-1, 在较短时间内分解放出大量热。
| [1] |
Alexander D Vasiliev, Alexander M Astachov, Maxim S Molokeev, et al. 1, 2-dinitroguanidine[J].
Russian Journal of Organic Chemistry, 2003, 39(4): 550-552. |
| [2] |
杨建明, 余秦伟, 薛云娜, 等. 二硝基脲的合成、表征及热力学的理论研究[J].
含能材料, 2011, 19(2): 160-164. YANG Jian-ming, YU Qin-wei, XUE Yun-na, et al. Synthesis, characterization and theoretical research of thermodynamics on dinitrourea[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(2): 160-164. |
| [3] |
Metelkina. 2-Nitroguanidine derivatives: X. synthesis and nitration of 4-nitriminotetrahydro-1, 3, 5-oxadiazine and 2-nitriminohexahydro-1, 3, 5-triazine and their substituted derivatives[J].
Russian Journal of Organic Chemistry, 2007, 43(10): 1437-1440. DOI:10.1134/S1070428007100041 |
| [4] |
Thomas Altenburg, Thomas M Klapötke, Alexander Penger, et al. Two outstanding explosives based on 1, 2-dinitroguanidine: ammonium-dinitroguandine and 1, 7-diamino-1, 7-dinitrimino-2, 4, 6 -trinitro-2, 4, 6-triazaheptane[J].
Z Anorg Allg Chem, 2010, 636: 463-471. DOI:10.1002/zaac.v636:3/4 |
| [5] |
Astrat'yev A A, Dashko D V, Kuznetsov L L. Synthesis and some properties of 1, 2-dinitroguanidine[C]//Fraunhofer-Institut fur Chemische Technologie(ICT) International Annual Conference, 2006: 501-512.
|
| [6] |
Johansson M, Latypov N V. 1, 2-Dinitroguandidine(DNG) synthesis and optimization[C]//International Pyrotechnics Seminarb Fort Collins, CO(US), 2006: 705-710.
|
| [7] |
鲁鸣久, 刘鸿, 丁黎氮. 杂环胺类的硝化剂及硝化反应的研究[J].
火炸药学报, 1999, 22(3): 4-7. LU Ming-jiu, LIU Hong, DING Li. Heterocyclic amines nitrating agent and the study of the nitration reaction[J]. Chinese Journal of Explosives & Propellants, 1999, 22(3): 4-7. |
| [8] |
吕春绪.
硝酰阳离子理论[M]. 北京: 兵器工业出版社, 2006: 39-43.
Lü Chun-xu. The Theory of NO2+[M]. Beijing: Ordnance Industry Press, 2006: 39-43. |

1, 2-Dinitroguanidine(DNG) was synthesized via the nitration reaction using nitroguanidine(NQ) as raw material and 100% nitric acid/20% oleum/ammonium nitrate as nitrating system. The structure of DNG were identified by IR, 1H NMR, 13C NMR and MS. The thermal behavior of DNG was also studied using TG and DSC.




