2. 陕西国防工业职业技术学院, 陕西 西安 710300
2. Shan′xi Instritute of Technology, Xi′an 710300, China
含能离子化合物是近年来发展起来的非常具有潜力的一类含能材料, 因其具有高氮含量、低蒸汽压、较高的生成热、较好的热稳定性及不敏感特性而备受关注[1-4]。它们大多通过高氮含量的阳离子与含能阴离子直接中和反应或通过复分解反应合成。过去的十几年, 研究人员合成了大量的含能离子化合物, 其阴离子主要包括唑类阴离子、硝氨基类阴离子、二硝基甲烷类阴离子[5]。四唑类含能离子化合物是其中重要的一种[6-7], 氨基四唑[8]、硝基四唑[9]、硝氨基四唑[10]、偶氮四唑[11]和呋咱四唑[4]类含能离子化合物均已合成出来, 部分化合物有望作为不敏感含能材料用于混合炸药及推进剂领域。
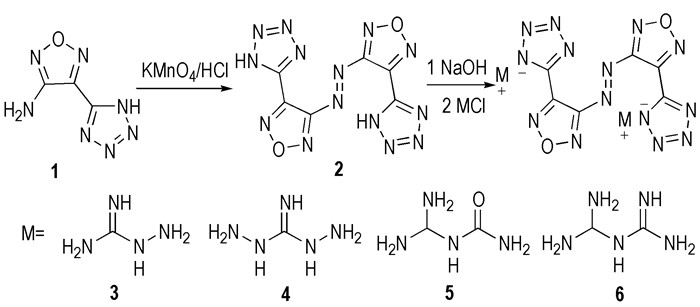
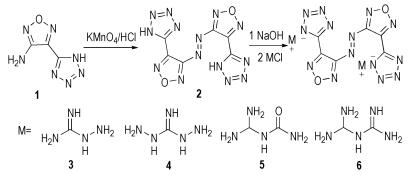
本研究报道了一类呋咱基四唑类含能离子化合物, 以3-氨基-4-(四唑-5-基)呋咱为原料经氧化反应生成3, 3′-二(四唑-5-基)-4, 4′-偶氮呋咱(DTZAF), 并通过复分解反应合成了四种未见文献报道的含能衍生物, 并用1H NMR、13C NMR、IR及元素分析对其结构进行了表征。采用差示扫描量热技术(DSC)及热重分析法(TG)研究了DTZAF及其含能离子盐的热行为, 并采用热重-差示扫描量热-红外-质谱(TG-DSC-IR-MS)联用技术对DTZAF热分解气相产物进行了研究。
2 实验部分 2.1 合成路线合成路线如Scheme 1所示:
|
Scheme 1 |
3-氨基-4-(四唑-5-基)呋咱[4], 自制; 高锰酸钾、氢氧化钠、氨基胍盐酸盐、二氨基胍盐酸盐、脒基脲盐酸盐、双胍盐酸盐, 分析纯; 浓盐酸, 工业级。
LC-2010A型高效液相色谱仪(归一化法), 日本岛津公司; NEXUS 870型傅里叶变换红外光谱仪, 美国热电尼高力公司; AV500型(500 MHz)超导核磁共振仪, 瑞士BRUKER公司; VARIO-EL-3型元素分析仪, 德国EXEMENTAR公司; 岛津DSC-60型差示扫描量热仪, 动态氮气气氛, 压力0.1 MPa, 升温速率10 ℃·min-1; 美国Nicolet公司TA2950热重仪, 动态氮气气氛, 升温速率10 ℃·min-1; TG-DSC-IR-MS联用仪(德国Netzsch公司449C型TG-DSC同步热分析仪, QMS403C质谱仪和美国Nicolet公司5700型红外仪), 样品置于TG样品盘上, 通过载气氩气将试样热分解生成的气体带入MS质量分析器和红外光谱仪中, 热分析仪与质谱和红外仪连接管温度为190 ℃, 红外原位气体池温度190 ℃。
2.3 实验过程 2.3.1 3, 3′-二(四唑-5-基)-4, 4′-偶氮呋咱(2)的合成135 mL(36 %)盐酸中加入8.0 g(0.052 mol)3-氨基-4-(四唑-5-基)呋咱, 降温至2 ℃缓慢滴加8.3 g(0.052 mol)高锰酸钾的水溶液, 加毕升温至55 ℃反应5 h, 冷却、过滤、干燥, 得黄色固体7.5 g, m.p. 251.90 ℃(DSC), 收率93.85 %, 纯度98.9%。13C NMR(DMSO-d6, 125 MHz), δ: 161.83, 146.89, 140.58; FT-IR(KBr,cm-1)ν: 3490, 2960, 2740, 1640, 1430, 1170, 1058, 997, 899, 704;元素分析(C6H2N14O2, %):计算值, C 23.84, N 64.90, H 0.662;实测值, C 23.99, N 64.76, H 0.726。
2.3.2 3, 3′-二(四唑-5-基)-4, 4′-偶氮呋咱双氨基胍盐(3)的合成反应瓶中加入0.3 g(1 mmol) DTZAF和5 mL去离子水, 滴加30%的氢氧化钠溶液调节pH至9~10, 室温下加入0.33 g(3 mmol)盐酸氨基胍, 升温至60 ℃反应3 h后结束反应。将反应液冷却至室温, 过滤干燥得白色固体0.35 g, m.p.243.1 9 ℃(DSC), 收率77.8%, 纯度98.5%。1H NMR(DMSO-d6, 500 MHz), δ: 8.62(2H), 7.30(4H), 6.79(4H), 4.73(4H); 13C NMR(DMSO-d6, 125 MHz), δ: 159.23, 157.00, 150.45, 139.61; FT-IR(KBr,cm-1)ν: 3450, 2863, 1693, 1661, 1590, 1374, 1155, 998;元素分析(C8H14N22O2, %):计算值, C 21.34, N 68.43, H 3.13;实测值, C 20.92, N 67.68, H 3.70。
2.3.3 3, 3′-二(四唑-5-基)-4, 4′-偶氮呋咱双二氨基胍盐(4)的合成步骤参考化合物3, m.p. 190.99 ℃(DSC), 收率75.0%, 纯度98.0%。1H NMR(DMSO-d6, 500 MHz), δ:8.90(4H), 8.60(4H), 7.18(8H); 13C NMR(DMSO-d6, 125 MHz), δ:160.20, 157.00, 150.43, 139.61; FT-IR(KBr,cm-1)ν: 3410, 3352, 3308, 1691, 1675, 1586, 1373, 1318, 997, 922;元素分析(C8H16N24O2, %):计算值, C 20.00, N 69.98, H 3.36;实测值, C 19.45, N 69.42, H 3.704。
2.3.4 3, 3′-二(四唑-5-基)-4, 4′-偶氮呋咱双脒基脲盐(5)的合成步骤参考化合物3, m.p. 247.96 ℃(DSC), 收率80.0%, 纯度98.8%。1H NMR(DMSO-d6, 500 MHz), δ:9.71(2H), 8.11(8H), 7.18(4H); 13C NMR(DMSO-d6, 125 MHz), δ: 162.62, 155.85, 154.84, 148.63, 145.36; FT-IR(KBr, cm-1)ν: 3393, 3321, 3136, 2914, 1732, 1701, 1613, 1412, 1354, 1157, 1005, 771;元素分析(C10H14N22O4, %):计算值, C 23.72, N 60.86, H 2.79;实测值, C 23.60, N 60.86, H 2.90。
2.3.5 3, 3′-二(四唑-5-基)-4, 4′-偶氮呋咱双胍盐(6)的合成步骤参考化合物3, m.p. 252.83 ℃(DSC), 收率81.3%, 纯度97.8%。1H NMR(DMSO-d6, 500 MHz), δ:6.82(16H); 13C NMR(DMSO-d6, 125 MHz), δ: 162.63, 160.18, 148.62, 145.38; FT-IR(KBr,cm-1)ν: 3470, 3415, 3157, 3058, 1651, 1552, 1477, 1408, 1213, 1153, 1003, 734, 600;元素分析(C10H16N24O2, %):计算值, C 23.81, N 66.65, H 3.20;实测值, C 23.71, N 66.14, H 3.12。
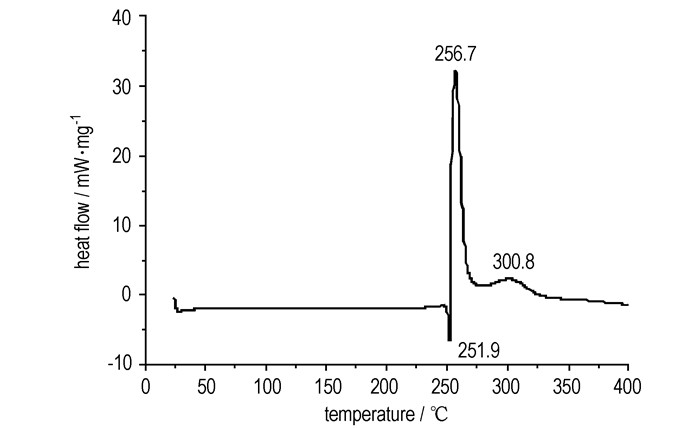
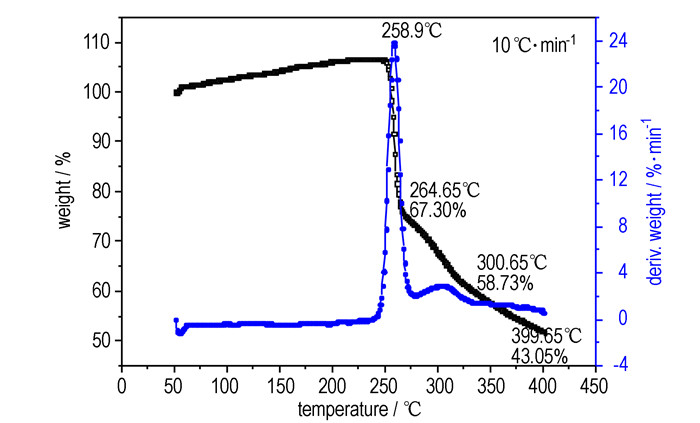
3 结果与讨论 3.1 DTZAF的热性能从图 1可以看出, DTZAF吸热峰温为251.9 ℃, 放热峰温为256.7 ℃和300.8 ℃, 说明DTZAF分两个阶段分解, 且熔化后直接开始分解。结合图 2可知, 第一个分解阶段为快速分解阶段, 当温度达到264.7 ℃时, 失重32.7 %; 第二个阶段为264.7 ~399.7 ℃时, 较第一阶段平缓, 失重约24.2 %, 温度最高升至399.7 ℃, 尚有43.1 %残渣未分解。
|
图 1 DTZAF的DSC曲线 Fig.1 DSC curve of DTZAF |
|
图 2 DTZAF的TG-DTG曲线 Fig.2 TG-DTG curves of DTZAF |
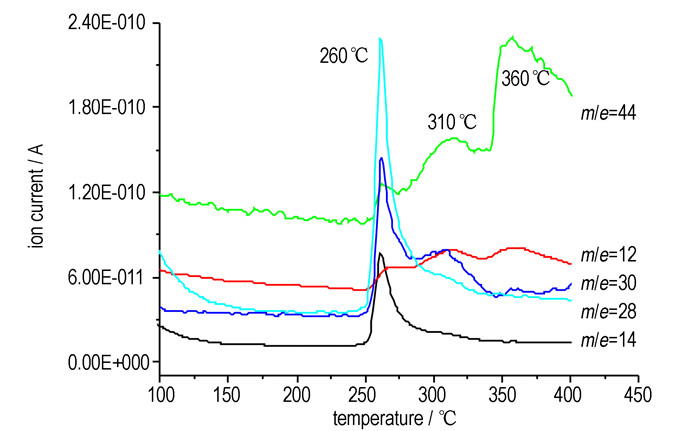
气体产物离子流强度随温度变化曲线如图 3所示, 由图 3可知,试样热分解有三阶段明显的气体释放过程, 每个阶段的离子流强度最大峰分别出现在260,310,360 ℃左右, 各温度下气相产物红外光谱如图 4所示。第一阶段, m/e为12、14、28、30、44的曲线在260 ℃时出现离子流强度最大峰, 结合红外光谱可推测出气相产物组成为CO2(2368 cm-1, 特征质量数44、28), CO(2155,2120 cm-1, 特征质量数28、12), HCN(714 cm-1, 特征质量数28,14,12), HNCO(2283,2245 cm-1, 特征质量数28)。第二阶段, m/e为12、14、28、30、44的曲线在310 ℃出现离子流强度最大峰, 结合红外光谱推测出气相产物组成为CO2(2364 cm-1, 特征质量数44、12), HCN(714 cm-1, 特征质量数28、14、12), HNCO(2283,2249 cm-1, 特征质量数28)。第三阶段, m/e为12、44的曲线于360 ℃时出现离子流强度最大峰, 结合红外光谱推测出气相产物组成为CO2(2368 -1, 特征质量数44、12)。
|
图 3 DTZAF气相产物离子流强度随温度变化曲线图 Fig.3 Ion current curves of gaseous products under different temperatures |
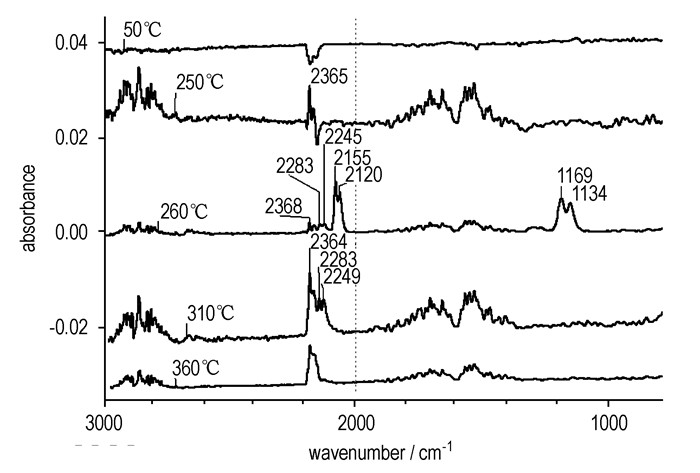
|
图 4 不同温度下试样气相产物的红外光谱 Fig.4 Infrared spectra of gaseous products under different temperatures |
从图 5可以看出, 化合物3、4、5、6的熔化吸热峰温分别为243.2, 191.0, 248.0, 252.8 ℃。分解放热峰温分别为258.2, 248.5, 257.9, 260.3 ℃。其中化合物3、5、6分解放热峰较窄, 分解迅速, 且熔化后直接进入快速分解阶段, 而化合物4熔化后继续经历一段升温后才开始分解, 起始分解温度为203.5 ℃, 分解放热峰宽, 分解速率慢。可见,低于200 ℃ DTZAF及其含能离子盐热稳定性较好。
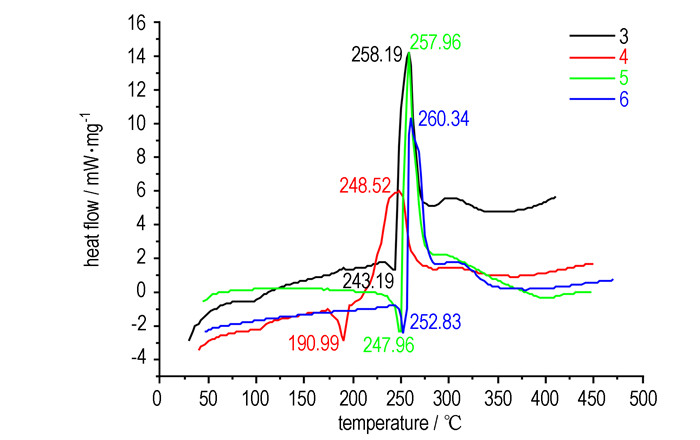
|
图 5 DTZAF含能离子盐的DSC曲线 Fig.5 DSC curves of DTZAF-based energetic salts |
(1) 以3-氨基-4-(四唑-5-基)呋咱为原料经氧化及复分解两步反应合成了四种DTZAF的含能离子盐, 总收率分别为73.0%, 70.3%, 75.0%, 76.3%。
(2) 采用TG-DSC -IR-MS联用仪分析了DTZAF热分解气相产物, 其于260, 310, 360 ℃分三个阶段分解, 三个阶段的分解产物为别为CO2、CO、HCN(第一阶段), CO2、HNCO(第二阶段), CO2(第三阶段);
(3) 初步研究了DTZAF及其含能离子盐的热行为, 结果表明,低于200 ℃ DTZAF及其含能离子盐热稳定性较好。
| [1] |
毕福强, 樊学忠, 许诚, 等. 不敏感四唑非金属含能离子化合物的研究进展[J].
含能材料, 2012, 20(6): 805-811. BI Fu-qiang, FAN Xue-zhong, XU Cheng, et al. Review on insensitive non-metallic energetic ionic compounds of tetrazolate anions[J]. Chinese Journal of Energetic Materials(Hangneng Cailiao), 2012, 20(6): 805-811. |
| [2] |
李娜, 柴春鹏, 甘志勇, 等. 含能离子化合物的分子设计与性能研究进展[J].
含能材料, 2010, 18(4): 467-475. LI Na, CHAI Chun-peng, GAN Zhi-yong, et al. Review on molecular design and performance of energetic ionic compounds[J]. Chinese Journal of Energetic Materials(Hangneng Cailiao), 2010, 18(4): 467-475. |
| [3] |
WANG Rui-hu, GUO Yong, ZENG Zhuo, et al. Furazan-functionalized tetrazolate-based salts: a new family of insensitive energetic materials[J].
Chem Eur J, 2009, 15: 2625-2634. DOI:10.1002/chem.v15:11 |
| [4] |
WANG Bo-zhou, ZHANG Guo-fang, HUO Huan, et al. Synthesis, characterization and properties of enegetic compounds derived from 3-amino 4-(tetrazol-5-yl)furazan[J].
Chin J Chem, 2011, 29(5): 919-924. DOI:10.1002/cjoc.201190189 |
| [5] |
SONG Jin-Hong, ZHOU Zhi-ming, CAO Dan, et al. 2-(Dinitromethylene)-1-nitro-1, 3-diazacyclopentane-based energetic salts[J].
Z Anorg Allg Chem, 2012, 638(5): 811-820. DOI:10.1002/zaac.v638.5 |
| [6] |
Fischer D, Klapotke T M, Stierstorfer J. Salts of tetrazolone-synthesis and properties of insensitive energetic materials[J].
Propellants Explos Pyrotech, 2012, 37: 156-166. DOI:10.1002/prep.v37.2 |
| [7] |
Joo Y H, Shreeve J M. High-density energetic mono-or bis(oxy)-5-nitroiminotetrazoles[J].
Angew Chem Int Ed, 2010, 49: 7320-7323. DOI:10.1002/anie.v49:40 |
| [8] |
Klapoetke T M, Sabate C M. 5-Aminotetrazolium 5-aminotetrazolates-new insensitive nitrogen-rich materials[J].
Z Anorg Allg Chem, 2009, 635: 1812-1822. DOI:10.1002/zaac.v635:12 |
| [9] |
Klapoetke T M, Sabate C M, Rusan M. Synthesis, characterization and explosive properities of 1, 3-dimethyl-5-amino-1H-tetrazolium 5-nitrotetrazolate[J].
Z Anorg Allg Chem, 2008, 634: 688-695. DOI:10.1002/(ISSN)1521-3749 |
| [10] |
Fendt T, Fischer N, Klapoetke T M, et al. N-rich salts of 2-methyl-5-nitraminotetrazole: secondary explosives with low sensitivities[J].
Inorg Chem, 2011, 50(4): 1447-1458. DOI:10.1021/ic1019923 |
| [11] |
Klapoetke T M, Sabate C M. Nitrogen-rich tetrazolium azotetrazolate salts: a new family of insensitive energetic materials[J].
Chem Mater, 2008, 20(5): 1750-1763. DOI:10.1021/cm703344h |
3, 3′-Bis(tetrazol-5-yl)-4, 4′-azofurazan(DTZAF) and its energetic salts were synthesized from 3-amino-4-(tetrazol-5-yl)furazan. In addition, the thermal properties of DTZAF and its energetic salts were studied.



