一硝基甲苯(MNT)的邻、间、对三种异构体均为重要的化工原料, 随着精细化工的快速发展, 一硝基甲苯被广泛用作染料、农药、医药、军用炸药的中间体[1]。制取一硝基甲苯的传统工艺主要由甲苯经硝硫混酸硝化制得[2-4], 在产物MNT分离提纯之前, 整个反应体系中仍含有大量的硝硫混酸。前人对MNT纯物质的热分解特性进行了较为广泛的研究[5-8], 但是, 硝硫混酸对其热分解特性的影响研究相对较少。为更加全面了解MNT在混酸条件下的热分解特性, 本研究用差示扫描量热仪(DSC)和绝热加速量热仪(ARC)对不同混酸含量的MNT样品进行测试, 分析硝硫混酸对MNT的热分解特性的影响, 为MNT制备工艺过程中的热稳定性、热危险性等研究提供基础数据。
2 实验部分 2.1 样品制备根据甲苯一段硝化的工艺, 利用混酸630 g(质量比:硝酸/硫酸/水=13/66/21), 甲苯100 g, 在35 ℃下进行反应[9], 将反应得到的产物分离处理, 从而得到不同混酸含量的实验样品。
样品1:硝化产物两相分离并进行碱洗后的中性油相。样品2:硝化产物两相分离后未经碱洗的油相, 通过滴定法测得样品中混酸的含量较低, 约5%。样品3:硝化产物酸油两相分离后, 称量得到酸相油相的质量比为3.7:1(即混酸的含量约为79%), 按该比例分别取酸相和油相混合所得。
2.2 实验仪器和条件热流型差示扫描量热仪(DSC1专业型)。生产厂家:METTLER TOLEDO; 实验条件:温度范围为150~480 ℃, 升温速率为10 ℃·min-1; 样品池为高压密封镀金坩埚, 最高耐压15 MPa, 氮气氛围; 样品1质量为1.63 mg, 样品2质量为1.72 mg, 样品3质量为1.80 mg。
绝热加速量热仪。生产厂家:英国THT有限公司; 实验条件:测试的操作模式为加热-等待-搜索(HWS), 加热梯度为5 ℃, 检出灵敏度为0.02 ℃·min-1, 等待时间为15 min; 样品球为哈氏合金球, 样品球的质量为14.266 g, 样品球的比热容为0.42 J·g -1·K -1; 样品1质量为0.757 g, 样品2质量为0.714 g, 样品3质量为1.196 g。
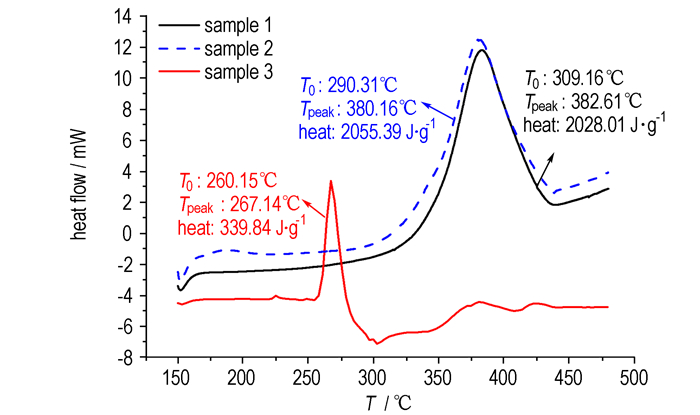
3 结果与讨论 3.1 差示扫描量热分析3种样品在升温速率10 ℃·min-1时的DSC曲线如图 1所示, 曲线上的特征值见表 2。
|
图 1 3种样品的DSC曲线 Fig.1 DSC curves of 3 samples |
| 表 2 3种样品的绝热分解参数 Tab.2 Adiabatic decomposition parameters of 3 samples |
从图 1和表 1可以看出, 样品1、2、3的起始分解温度分别为309.16, 290.31, 260.15 ℃, 混酸的含量越高, MNT的起始分解温度越低。比较样品1和2的结果发现, 5%硝硫混酸的存在使MNT的起始分解温度略有提前, 而峰值温度和比分解热没有明显的变化。但比较样品1和3的结果发现, 79%的硝硫混酸使得MNT的起始分解温度、峰值温度明显提前, 而样品3中MNT质量少、混酸质量多, 所以比分解热低是正常结果。DSC的结果表明, MNT的热稳定性随着混酸含量的增加而降低。
| 表 1 3种样品的DSC测试结果 Tab.1 DSC results of 3 samples |
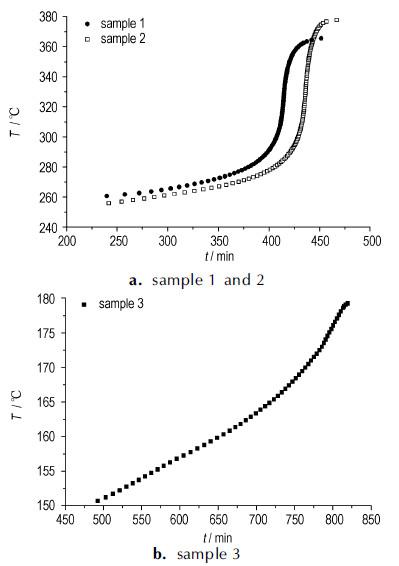
ARC实验中获得3种样品的温度-时间曲线、压力-时间曲线以及温升速率-温度曲线分别如图 2~图 4, 从曲线上获得的绝热分解参数汇总见表 2。
|
图 2 3种样品绝热分解的温度-时间曲线 Fig.2 Curves of decomposition temperature vs time for 3 samples under adiabatic decomposition condition |

|
图 3 3种样品绝热分解的压力-时间曲线 Fig.3 Curves of decomposition pressure vs time for 3 samples under adiabatic decomposition condition |

|
图 4 3种样品绝热分解的温升速率-温度曲线 Fig.4 Curves of temperature rise rate vs temperature for 3 samples under adiabatic decomposition condition |
由图 2~图 4和表 2可知, 样品1在260 ℃左右开始分解, 而含有5%混酸的样品2在256 ℃左右开始分解, 可见, 少量的混酸可使样品的起始分解温度略有提前, 这与DSC的测试结果一致。比较样品1和2的ARC测试曲线可以发现在含有少量混酸的情况下, 终止温度、最大压力、最大温升速率都明显提高, MNT热分解的危险性增大。
从图 4可以看出, 样品3的温升速率曲线有两个峰, 这表明样品3的分解至少包括两个反应, 这与样品1和2的单峰相比, 分解机理已经发生了变化, 至少存在两步反应过程。根据样品3中组成(MNT 20.4%、硝酸1.8%、硫酸57.0%、水20.8%), 推测样品3在绝热测试过程中可能存在MNT的过硝化或高温氧化, 然后过硝化产物二硝基甲苯(DNT)、TNT及氧化产物会进一步分解。通过物质的标准摩尔生成焓[12]计算硝酸分解的比放热量为1607.94 J·g-1, 大于MNT的比放热量。根据Benson基团加和法[13]先估算出MNT、DNT的标准摩尔生成焓, 再计算得到MNT硝化生成DNT的反应热为916.20 J·g-1。同时, 前人[14]研究发现无论是二段硝化产物DNT, 还是三段硝化产物TNT分解的比放热量均大于MNT。由这些热数据难以确切分析出样品3中究竟存在哪些反应, 且样品3中硝酸含量很少, 即使存在过硝化及氧化过程也只是其中的一小部分, 反应还是以MNT的分解为主, 且不论是过硝化或氧化, MNT都会参与反应。所以, 这里不详细分析过硝化或氧化在样品3反应中所占的比例, 而全部当作是样品3中MNT的分解。由表 2还可以发现, 样品3的起始分解温度比纯MNT提前了100 ℃左右, 热稳定性明显下降。虽然从最大温升速率、最大压力来看, 样品3的放热危险性反而降低了, 但考虑到样品3中只含有20.4%左右的MNT, MNT的质量是样品1和2的1/3左右, 所以, 出现这种结果也是可以预期的。
实验中样品球的质量较大, 在反应过程中的吸热量不可以忽略, 引入修正系数Φ; 由于样品3中MNT质量较少, 混酸质量较多, 混酸的吸热不能忽略, 为了能更直观地比较在不同混酸含量条件下MNT的放热特性, 引入了另一个修正系数φ。
| $ \mathit{\boldsymbol{ \boldsymbol{\varPhi} }} = 1 + \frac{{{M_{\rm{b}}}{C_{p.{\rm{b}}}}}}{{{M_{\rm{s}}}{C_{p{\rm{.s}}}}}} $ | (1) |
| $ \varphi = 1 + \frac{{{M_{\rm{b}}}{C_{p.{\rm{b}}}} + {M_{{\rm{acid}}}}{C_{p.{\rm{acid}}}}}}{{{M_{{\rm{MNT}}}}{C_{p{\rm{.MNT}}}}}} $ | (2) |
| $ \Delta {T_{{\rm{MNT}}}} = \varphi \Delta T $ | (3) |
| $ Q{\prime _{{\rm{MNT}}}} = {C_{p.{\rm{MNT}}}} \times \Delta T \times \varphi $ | (4) |
| $ Q{\prime _{\rm{s}}} = {C_{p{\rm{.s}}}} \times \Delta T \times \mathit{\boldsymbol{ \boldsymbol{\varPhi} }} $ | (5) |
式中, Φ为以样品为对象的修正系数; φ为以MNT为对象的修正系数; Mb为样品球质量, g; Cp.b为样品球的比热容, J·g-1·K-1; Ms为样品的质量, g; Cp.s为样品的比热容, J·g-1·K-1; Macid为样品中混酸的质量, g; Cp.acid为混酸的比热容, J·g-1·K-1; MMNT为样品中MNT的质量, g; Cp.MNT为MNT的比热容, J·g-1·K-1; ΔT为实测的绝热温升, ℃; ΔTMNT为以MNT为参量校准后的绝热温升, ℃; Q′MNT为单位质量MNT放热量, J·g-1; Q′s为单位质量样品放热量, J·g-1。
比较样品1和3以MNT为参量校准后的绝热温升, 大量的混酸不仅使MNT的起始分解温度明显提前, 也使得绝热温升略有增加。进一步证明混酸的存在对MNT的热稳定性和分解的热危险性都有明显的影响。
比较表 2中单位质量MNT的放热量发现, 样品2和3的值都大于MNT纯物质, 这进一步说明混酸的存在的确会使样品反应机理变得复杂, 而不仅仅是MNT的分解。正如Ballod[15]指出, 在不同温度下硝酸分解是一个复杂的反应过程, 加上MNT的多段硝化也是一个复杂的反应过程。因此, 在不同混酸含量、不同反应温度下, 样品2和3中的放热量可不同。
3.3 动力学分析为了进一步了解混酸对MNT分解特性的影响, 获取最大反应速率到达时间与温度的关系, 对ARC数据进行进一步分析。
根据文献[8, 16], 可知在绝热体系中, 温升速率与温度的关系如下:
| $ \frac{{{\rm{d}}T}}{{{\rm{d}}t}} = A{\left( {\frac{{{T_f}-T}}{{\Delta {T_{{\rm{ad}}}}}}} \right)^n}{c_0}^{n-1}\Delta {T_{{\rm{ad}}}}{\rm{exp}}(-\frac{E}{{RT}}) $ | (6) |
| $ 令{k^*} = k{c_0}^{n-1} = {c_0}^{n-1}A{\rm{exp}}\left( {-\frac{E}{{RT}}} \right) = \frac{{{\rm{d}}T}}{{{\rm{d}}t}}{\left( {\frac{{\Delta {T_{{\rm{ad}}}}}}{{{T_f} - T}}} \right)^n}\Delta {T_{{\rm{ad}}}}^{ - 1} $ | (7) |
对(7)式两边取对数得:
| $ {\rm{ln}}{k^*} = {\rm{ln}}\left( {A{c_0}^{n-1}} \right)-\frac{E}{{RT}} $ | (8) |
式中, T为温度, K; t为时间, min; A为指前因子, min-1; Tf为绝热条件下达到的最高温度, K; ΔTad为绝热温升, K; n为反应级数; c0为反应物起始浓度, mol·L-1; E为表观活化能, J·mol-1; R为普适气体常数, 8.314 J·mol-1·K-1。
利用Origin软件对式(6)进行非线性拟合, 求得参数A、E、n, 并将得到的n代入(8)式中验证lnk*对

|
图 5 样品1的实测值和拟合曲线 Fig.5 Tested results and fitting curves of sample 1 |
|
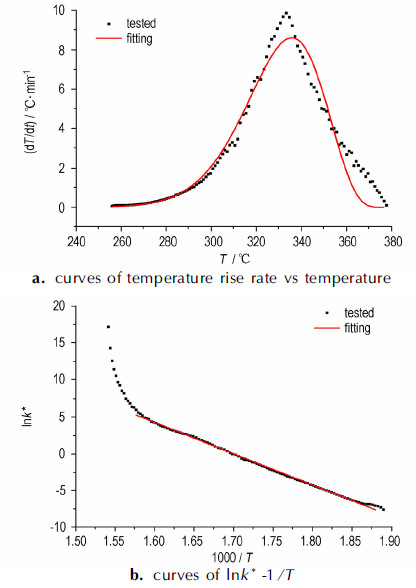
图 6 样品2的实测值和拟合曲线 Fig.6 Tested results and fitting curves of sample 2 |

|
图 7 样品3的实测值和拟合曲线 Fig.7 Tested results and fitting curves of sample 3 |
| 表 3 3种样品的动力学参数 Tab.3 Kinetic parameters of 3 samples by Eq.(6) |
由于样品3存在两步反应, 因此, 对实测曲线进行了分步拟合, 结果见图 7。图 5b、图 6b、图 7b显示lnk*-1/T曲线在分解开始和结束阶段的线性关系不是很好, 一方面可能是测试存在一定误差, 另一方面也可能样品的分解反应并非是简单的基元反应, 直接用Arrhenius公式进行拟合存在一定的偏差。图中主体部分的线性关系很好, 所以, 仍采用拟合出的结果进行下一步计算。
从表 3中可以看出, 3种样品的表观活化能均较高, 这主要是因为求取动力学参数依赖于式(6)的绝热温升速率。由于Φ值的影响, 使得实测的绝热温升曲线并非样品本身分解的曲线, 而是经过样品球“钝化”之后的曲线, 对此分析得到的动力学参数不是样品分解本身的特性, 而是综合样品分解、样品球吸热、传热等信息的综合性参数。所以, 需要通过式(9)近似计算出温度与绝热条件下最大温升速率到达时间的关系[16], 从而推算出最大温升速率达到24 h所对应的引发温度TD24。
| $ {\rm{ln}}\theta = \frac{E}{R}\left( {\frac{1}{T}} \right)-{\rm{ln}}A $ | (9) |
绝热条件下, 样品球的吸热会减缓样品的初始放热速率, 对最大温升速率到达时间产生影响, 因此, 通过Φ对其进行修正[16-17]。
| $ {\theta _s} = \theta /\mathit{\boldsymbol{ \boldsymbol{\varPhi} }} $ | (10) |
式中, Φ同式(1);θ为实测的最大温升速率到达时间, s; θs为样品的最大温升速率到达时间, s。
从表 4中看出, 校准后样品1和2分解的TD24分别为299, 279 ℃, 温度相对比较高; 样品3中由于含有大量的混酸, 存在MNT过硝化或氧化, 产物再分解的可能性, MNT的分解机理发生了变化, 样品分解的TD24(98 ℃)明显降低, 危险性增加。
| 表 4 3种样品绝热分解的TD24 Tab.4 Adiabatic decomposition(TD24) of 3 samples |
(1) DSC分析表明, 混酸含量越高, MNT物料体系的起始分解温度越低。
(2) ARC分析表明, 在大量混酸条件下, MNT物料体系的起始分解温度只有150.7 ℃, 比纯MNT提前了110 ℃左右; 与MNT纯物质相比, 大量混酸条件下MNT物料体系的最大温升速率到达时间为24 h, 所对应的引发温度TD24明显降低, 只有98 ℃。
(3) 在实际工艺生产过程中, 若发生甲苯硝化过程冷却失效, 体系温度升高至150 ℃以上, 或在98 ℃停留足够长的时间, 都会引起混酸和MNT物料体系的迅速分解, 导致反应失控, 引发严重的事故。
| [1] |
董云. 一硝基甲苯及其衍生物的开发(一)[J].
化工中间体, 2003(23): 7-12. DONG Yun. The development of mononitrotoluene and its derivatives(一)[J]. Chemical Intermediates, 2003(23): 7-12. |
| [2] |
Brennecke H M, Kobe K A. Mixed acid nitration of toluene[J].
Industrial & Engineering Chemistry, 1956, 48(8): 1298-1304. |
| [3] |
Cox P R, Strachan A N. Two phase nitration of toluene-Ⅰ[J].
Chemical Engineering Science, 1972, 21: 457-463. |
| [4] |
Chapman J W, Cox P R, Strachan A N. Two phase nitration of toluene-Ⅲ[J].
Chemical Engineering Science, 1974, 29: 1247-1251. DOI:10.1016/0009-2509(74)80124-7 |
| [5] |
Luo K M, Chang J G. The stability of toluene mononitration in reaction calorimeter reactor[J].
Journal of loss prevention in the process industries, 1998, 11(2): 81-87. DOI:10.1016/S0950-4230(97)00019-3 |
| [6] |
陈利平, 陈网桦, 李春光, 等. 混酸中甲苯半间歇硝化过程的危险性研究[J].
中国安全科学学报, 2007, 17(12): 102-106. CHEN Li-ping, CHEN Wang-hua, LI Chun-guang, et al. Study on the hazards of semi-batch nitration process of toluene in mixed acids[J]. China Safety Science Journal, 2007, 17(12): 102-106. DOI:10.3969/j.issn.1003-3033.2007.12.018 |
| [7] |
陈利平, 陈网桦, 李春光, 等. 一硝基甲苯硝化过程的热危险性[J].
火炸药学报, 2008, 31(3): 36-40. CHEN Li-ping, CHEN Wang-hua, LI Chun-guang, et al. Thermal hazard in the process of mononitrotoluene nitration[J]. Chinese Journal of Explosives & Propellants, 2008, 31(3): 36-40. |
| [8] |
陈利平. 甲苯硝化反应热危险性的实验与理论研究[D]. 南京: 南京理工大学, 2009.
CHEN Li-ping. Experiment and theoretical studies on thermal hazards of toluene nitration[D]. Nanjing: Nanjing University of Science and Technology, 2009. |
| [9] |
Cheng L P, Chen W H, Liu Y, et al. Toluene mono-nitration in a semi-batch reactor[J].
Central European Journal of Energetic Materials, 2008, 5(2): 37-47. |
| [10] |
Paul W Cooper.
Explosives Engineering[M]. New York: VCH, 1996 |
| [11] |
Dimoplon W. Estimating specific-heat of liquid mixtures[J].
Chemical Engineering, 1972, 79(22): 64-66. |
| [12] |
傅献彩, 沈文霞, 姚天扬, 等.
物理化学[M]. 第五版. 北京: 高等教育出版社, 2005.
FU Xian-cai, SHEN Wen-xia, YAO Tian-yang, et al. Physical Chemistry[M]. The fifth edition. Beijing: Higher Education Press, 2005, The fifth edition. |
| [13] |
Benson S W.
Thermochemical kinetics:methods for the estimation of thermochemical data and rate parameters[M]. New York: Wiley, 1976 |
| [14] |
陈利平, 陈网桦, 彭金华, 等. 二硝基甲苯硝化反应的热危险性分析[J].
含能材料, 2010, 18(6): 706-710. CHEN Li-ping, CHEN Wang-hua, PENG Jin-hua, et al. Thermal hazard analysis of dinitrotoluene nitration[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(6): 706-710. |
| [15] |
Ballod A P, Titarchuk T A, Ticker G S, et al. Heterogeneous-homogeneous Decomposition of HNO3[J].
Reaction Kinetics and Catalysis Letters, 1989, 40(1): 95-100. DOI:10.1007/BF02235145 |
| [16] |
Townsend D I, Tou J C. Thermal hazard evaluation by an accelerating rate calorimeter[J].
Thermochimica Acta, 1980, 37: 1-30. DOI:10.1016/0040-6031(80)85001-5 |
| [17] |
Stoessel F.
Thermal Safety of Chemical Processes[M]. New York: Wiley-VCH, 2008 |

Thermal decomposition characteristics and thermal safety of mononitrotoluene(MNT) with nitric-sulfuric mixed acid were studied by DSC and ARC.




